Азотистый обмен
В Клинико-диагностической лаборатории производится определение следующих параметров азотистого обмена:
Мочевина
Мочевина – конечный продукт метаболизма белков в организме. При патологии сдвиги в уровне мочевины крови зависят от соотношения процессов мочевинообразования и ее выведения. Пониженная концентрация мочевины не имеет диагностического значения.
Три группы причин, приводящих к увеличению содержания мочевины в крови:
1. Надпочечная азотемия:
- При потреблении очень большого количества белковой пищи.
- При различных воспалительных процессах с выраженным усилением катаболизма белков.
- При обезвоживании в результате рвоты, поноса и др.
2. Почечная азотемия (наиболее частая, при нарушении функции почек):
- При острых и хронических гломерулонефритах.
- При хронических пиелонефритах.
- При нефросклерозах, вызванных отравлениями солями ртути и другими токсическими веществами.

- При синдроме длительного сдавливания.
- При гидронефрозе.
- При острой почечной недостаточности.
3. Подпочечная азотемия:
- При задержке выделения мочи какими-либо препятствиями в мочевыводящих путях (камень, опухоль).
Креатинин
Креатинин – является конечным продуктом распада креатина, который играет важную роль в энергетическом обмене мышечной и других тканей. Определение креатинина широко используется в диагностике заболеваний почек.
Креатинин в меньшей степени зависит от уровня катаболизма, не реабсорбируется в почках, поэтому в большей мере отражает степень нарушения выделительной и фильтрационной функции почек.
Автоматический биохимический анализатор высокой мощности AU680
с ISE модулем и станцией пробоподготовки AutoMate 1200
производства Beckman Coulter Inc., США
Креатинин в моче – суточное выделение креатинина с мочой относительно постоянно, эквивалентно суточному образованию и непосредственно зависит от массы мышц и выделительной функции почек.
Проба Реберга
Проба Реберга – позволяет судить о клубочковой фильтрации и канальцевой реабсорбции в почках. Проба основана на том, что креатинин фильтруется только клубочками, практически не всасывается и не секретируется канальцами.
Порядок проведения пробы: утром пациент мочится, выпивает 200 мл воды, и затем натощак в состоянии полного покоя собирает мочу за точно определенное непродолжительное время (2 часа). Посередине этого отрезка времени берут кровь из вены. Определяют концентрацию креатинина в крови и в моче, собранной за 2 часа. Затем по формулам вычисляют величину клубочковой фильтрации (КФ) и канальцевой реабсорбции (КР).
КФ – чувствительный показатель функционального состояния почек. Снижение ее наблюдается при острых и хронических гломерулонефритах, нефросклерозах, являясь одним из ранних симптомов нарушения функции почек. Повышению способствует хронический гломерулонефрит с нефротическим синдромом, нефрозы.
Повышению способствует хронический гломерулонефрит с нефротическим синдромом, нефрозы.
КР – может значительно меняться в физиологических условиях, снижаясь до 90% при водной нагрузке. Выраженное снижение реабсорбции происходит при форсированном диурезе, вызванном мочегонными средствами. Наибольшее снижение канальцевой реабсорбции наблюдается у больных несахарным диабетом.
Стойкое снижение происходит при хронических пиелонефритах. Повышение КФ сопутствует нефриту, нефротическому синдрому.
Мочевая кислота
Мочевая кислота – продукт обмена пуриновых оснований, входящих в состав сложных белков – нуклеопротеидов. Образовавшаяся мочевая кислота выделяется почками.
Мочевая кислота во внеклеточной жидкости присутствует в виде солей натрия (ураты) в концентрации, близкой к насыщению, поэтому существует возможность кристаллизации урата натрия, если концентрация мочевой кислоты превысит максимум нормальных значений.
Повышение уровня мочевой кислоты – гиперурикемия – имеет большое значение для диагностики подагры.
Определение мочевой кислоты в моче необходимо проводить совместно с ее определением в крови. Это позволяет во многих случаях установить патологический механизм, лежащий в основе подагры у пациента (избыточная продукция мочевой кислоты в организме или нарушение ее выведения).
Материал для исследования
- Cыворотка крови;
- Моча.
Цистатин
Исследования показали, что уровень цистатина С является более точным маркером почечной функции, чем уровень креатинина.
Цистатин C (наряду с инулином) на сегодняшний день рассматривается как «золотой стандарт» определения скорости клубочковой фильтрации как интегрального показателя функции почек.
В отличие от креатинина, на темп синтеза цистатина C не влияют такие факторы, как возраст, пол, мышечная масса, характер питания, наличие воспалительных реакций.
Бета-2- микроглобулин
Уровень бета-2 микроглобулина в крови возрастает при почечной недостаточности (снижении почечного клиренса).
При повреждении клеток проксимальных канальцев вследствие заболевания почек, лекарственной интоксикации, токсического воздействия тяжёлых металлов и т. д. экскреция бета-2 микроглобулина с мочой возрастает.
Поэтому определение бета-2 микроглобулина мочи используют в качестве маркёра поражения проксимальных канальцев почек; этот тест может быть полезен при дифференциальной диагностике инфекции верхних и нижних отделов мочевого тракта.
Биохимический анализ крови
Биохимический анализ крови
Биохимический анализ крови используется для оценки состояния основных процессов обмена веществ в организме и определения показателей функционирования жизненно важных органов и систем организма, например, печени, почек, мышечной ткани и т.д. Повышение или снижение концентрации некоторых веществ может быть ранними признаками развития опасных отклонений, требующих коррекции. Для анализа используется кровь из вены Наиболее часто в клинической практике оцениваются следующие показатели биохимического анализа крови:
Креатинин – вещество, которое образуется в ходе работы мышечной ткани. В процессе сокращения мышц происходит распад особого вещества. Концентрация креатинина в плазме крови относительно постоянна и зависит от соотношения между процессами его образования в процессе работы мышц и выведения почками. Повышение концентрации креатинина, как правило, свидетельствует о нарушении функции почек, но может быть признаком ряда других заболеваний, или отражать индивидуальные особенности пациента. Снижение концентрации креатинина может наблюдаться при снижении мышечной массы или заболеваниях мышц, на фоне приема малого количества мясной пищи (например, у вегетарианцев), после приема большого количества жидкости и т.д. Для уточнения полученных результатов производят расчет клиренса креатинина – показателя, отражающего выведение данного вещества из организма.
В процессе сокращения мышц происходит распад особого вещества. Концентрация креатинина в плазме крови относительно постоянна и зависит от соотношения между процессами его образования в процессе работы мышц и выведения почками. Повышение концентрации креатинина, как правило, свидетельствует о нарушении функции почек, но может быть признаком ряда других заболеваний, или отражать индивидуальные особенности пациента. Снижение концентрации креатинина может наблюдаться при снижении мышечной массы или заболеваниях мышц, на фоне приема малого количества мясной пищи (например, у вегетарианцев), после приема большого количества жидкости и т.д. Для уточнения полученных результатов производят расчет клиренса креатинина – показателя, отражающего выведение данного вещества из организма.
Мочевина – конечный продукт белков. Играет важную роль в процессе образования мочи. Определение концентрации мочевины в плазме крови, как и креатинин, используется для оценки функционального состояния почек.
Мочевая кислота – конечный продукт обмена пуриновых оснований, которые в большом количестве содержатся в красном мясе, мясных субпродуктах и бобовых. Нарушение обмена пуринов приводит к повышению концентрации мочевой кислоты, которая может откладываться в суставах в виде кристаллов и вызывать резкие болезненные ощущение, что является причиной развития подагры. Эти же кристаллы могут образовываться при проведении химиотерапии – массивный распад опухолевых клеток на фоне лечения приводит к «выбросу» из них пуринов, что может оказывать неблагоприятное действие на разные органы и системы, в первую очередь – на почки.

АЛТ, АСТ, ГГТ («печеночные» трасаминазы) – показатели состояния функции печени. Их повышение может наблюдаться у пациентов с заболеваниями печени при повреждении её клеток, например, вследствие наличия гепатита, вовлечения печени в опухолевый процесс или токсичности проводимого лечения.
Щелочная фосфатаза (ЩФ) – фермент, участвующий во многих реакциях обмена фосфорной кислоты. Её повышение обнаруживается при многих заболеваниях печени, особенно – сопровождающихся застоем и нарушением оттока желчи, а также при наличии вторичного поражения костной ткани.
Общий билирубин и его фракции (прямой билирубин, непрямой билирубин) – продукты распада гемоглобина, которые в норме образуются в процессе «обновления» эритроцитов, а миоглобина и некоторых ферментов. Образующийся в ходе этого процесса непрямой (неконъюгированный) билирубин является токсичным для организма веществом. В печени превращается в нетоксичный прямой (конъюгированный) билирубин и выводится из организма вместе с желчью и мочой. Именно билирубин придает каловым массам в стуле их характерный цвет. При заболеваниях печени и состояниях, которые сопровождаются нарушениями оттока желчи их организма, процессы выведения билирубина из организма нарушаются. Клиническим проявлениями этого может быть внезапное потемнение мочи, светлый цвет кала и желтушность кожных покровов. Если нарушается процессы формирования прямого билирубина (при развитии печеночной недостаточности или при одновременном распаде большого количества эритроцитов) в плазме крови нарастает концентрация непрямого билирубина. При нарушении непосредственно процессов оттока желчи (например, при сдавлении желчевыводящих путей опухолью) повышается концентрация прямого билирубина. При развитии желтухи следует немедленно обратиться к врачу.
Именно билирубин придает каловым массам в стуле их характерный цвет. При заболеваниях печени и состояниях, которые сопровождаются нарушениями оттока желчи их организма, процессы выведения билирубина из организма нарушаются. Клиническим проявлениями этого может быть внезапное потемнение мочи, светлый цвет кала и желтушность кожных покровов. Если нарушается процессы формирования прямого билирубина (при развитии печеночной недостаточности или при одновременном распаде большого количества эритроцитов) в плазме крови нарастает концентрация непрямого билирубина. При нарушении непосредственно процессов оттока желчи (например, при сдавлении желчевыводящих путей опухолью) повышается концентрация прямого билирубина. При развитии желтухи следует немедленно обратиться к врачу.
Глюкоза – основное питательное вещество, которое необходимо для нормального функционирования большинства органов и систем организма. Главный источник глюкозы – питательные вещества поступающие с пищей из внешней среды. Повышенная концентрация глюкозы может наблюдаться при сахарном диабете, а также ряде других состояний.
Повышенная концентрация глюкозы может наблюдаться при сахарном диабете, а также ряде других состояний.
Натрий, калий, кальций, фосфор магний и др. – показатели водно-солевого обмена организма. Повышение или снижение их концентрации может отмечаться при обезвоживании, приеме большого количества соленой пищи, приеме лекарственных препаратов, заболеваниях костей, почек и т.д.
Помимо перечисленных выше, на усмотрение Вашего лечащего врача, могут быть назначены и другие биохимические анализы крови.
Биохимический анализ крови / «9 месяцев»
№ 3, март 2008 г.
За 9 месяцев беременности будущей маме приходится сдавать немалое количество анализов. Зачем это нужно и что означают их результаты?
Биохимический анализ крови позволяет оценить работу многих внутренних органов — почек, печени, поджелудочной железы и др. Кроме того, биохимический анализ крови показывает, каких микроэлементов не хватает в организме женщины. Поскольку во время беременности происходят различные изменения, связанные с обменными процессами, оценка биохимических показателей крови важна для своевременной диагностики патологических состояний, которые могут возникнуть в организме будущей мамы.
Поскольку во время беременности происходят различные изменения, связанные с обменными процессами, оценка биохимических показателей крови важна для своевременной диагностики патологических состояний, которые могут возникнуть в организме будущей мамы.
Перечислим основные показатели биохимического анализа крови.
Общий белок — показатель белкового обмена, отражающий общее содержание всех белков в сыворотке крови. Нормальная концентрация общего белка в крови — 63-83 г/л. Белки плазмы делят на группы с разными структурами и функциями, которые называются белко¬выми фракциями. Среди белковых фракций выделяют альбумины и альфа-, бета-, гамма-глобулины. Их определение и соотношение позволяет более точно оценить нарушения функций внутренних органов. Физиологическая гипопротеинемия (снижение уровня белка) может наблюдаться у беременных женщин (особенно в третьем триместре) и при лактации за счет уменьшения количества эритроцитов в плазме, связанного с увеличением общего объема плазмы. Небольшое снижение общего белка (55-65 г/л) во время беременности не является патологией. Повышение концентрации белка в сыворотке крови наблюдается вследствие патологии — обезвоживания и сгущения крови при потерях жидкости.
Небольшое снижение общего белка (55-65 г/л) во время беременности не является патологией. Повышение концентрации белка в сыворотке крови наблюдается вследствие патологии — обезвоживания и сгущения крови при потерях жидкости.
Липиды (жиры) — в крови присутствуют 4 основные группы липидов: холестерин (холестерол), три-глицериды, фосфолипиды, жирные кислоты. Холестерол является важнейшим показателем липидного обмена, служит структурным компонентом клеточных мембран, участвует в синтезе половых гормонов, желчных кислот, витамина D. Выделяют фракции холестерола липопротеидов низкой плотности (ЛПНП), холестерола липопротеидов высокой плотности (ЛПВП) и некоторые другие, различающиеся по составу и функциям. Содержание холестерина в крови в значительной степени зависит от возраста. Нормальный уровень холестерина в крови молодой женщины -3.15-5.8 ммоль/л. Во время беременности наблюдается физиологическое увеличение уровня общего холестерина (до 6,0-6,2), которое обусловлено повышенным формированием эндогенного (вырабатываемого в печени) холестерина, необходимого для построения сосудистого русла плаценты и плода.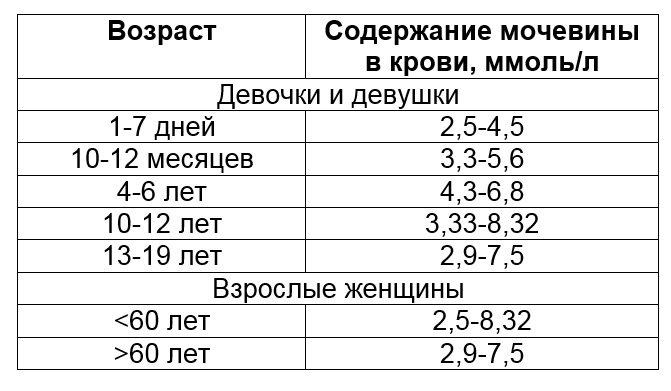 Повышение уровня холестерина в крови считается фактором, предрасполагающим к развитию атеросклероза — образованию специфических бляшек в сосудах.
Повышение уровня холестерина в крови считается фактором, предрасполагающим к развитию атеросклероза — образованию специфических бляшек в сосудах.
Углеводы являются основным источником энергии для организма.
Глюкоза — это источник энергии и компонент жизнедеятельности любой клетки организма. Нормальная концентрация глюкозы в крови у взрослых — 3.9-5.8 ммоль/л. У здоровых беременных женщин уровень глюкозы может быть немного снижен (до 3.5-4,0 ммоль/л), поскольку растущий плод потребляет все большее количество глюкозы.
Во время беременности повышенная потребность организма в инсулине (гормоне поджелудочной железы, регулирующем углеводный обмен) превышает функциональную способность клеток поджелудочной железы, вырабатывающих инсулин. Это может привести к его недостаточной секреции для поддержания нормального уровня глюкозы в крови. В этот период у некоторых беременных относительная недостаточность инсулина может вызвать развитие гестационного диабета (диабета беременных), об этом свидетельствует повышение глюкозы крови. Поэтому всем будущим мамам в сроки между 24-й и 28-й неделей рекомендуется проведение исследования глюкозы крови. Этот анализ проводится дополнительно, без исследования других показателей биохимического анализа.
Поэтому всем будущим мамам в сроки между 24-й и 28-й неделей рекомендуется проведение исследования глюкозы крови. Этот анализ проводится дополнительно, без исследования других показателей биохимического анализа.
В организме во всех биохимических реакциях в качестве катализаторов участвуют специфические белки, которые называются ферментами. В каждой реакции участвует свой специфический фермент, поэтому их количество исчисляется сотнями. При этом диагностическое значение имеют всего несколько десятков ферментов.
Аланинаминотрансфераза (АЛТ) — в норме у женщин содержится до 32 ЕД/л. Наиболее высокая активность АЛТ выявляется в печени и почках. Уровень АЛТ повышается при повреждении клеток печени, почек вирусами или химическими веществами.
Аспартатаминотрансфераза (ACT) — в норме у женщин содержится до 30 ЕД/л. ACT содержится в тканях сердца, печени, нервной ткани и почек; соответственно, определяется с целью выявления патологии этих органов. При нормальном течении беременности показатели АЛТ и ACT не меняются. Небольшое повышение трансаминаз наблюдается при гестозах легкой и средней степени тяжести. Многократное повышение активности АЛТ (до 100 МЕ/л) и ACT (до 160 МЕ/л) наблюдается при гестозах тяжелой степени. Такой результат свидетельствует о том, что печень не справляется с нагрузкой.
При нормальном течении беременности показатели АЛТ и ACT не меняются. Небольшое повышение трансаминаз наблюдается при гестозах легкой и средней степени тяжести. Многократное повышение активности АЛТ (до 100 МЕ/л) и ACT (до 160 МЕ/л) наблюдается при гестозах тяжелой степени. Такой результат свидетельствует о том, что печень не справляется с нагрузкой.
Фосфатаза щелочная присутствует практически во всех тканях организма. Самая высокая активность ЩФ обнаруживается в клетках костной ткани, печени, почек, слизистой кишечника и плаценте. Повышение активности ЩФ крови связано, в основном, с заболеваниями костей и патологией печени. У беременных, особенно в третьем триместре, также имеет место физиологическое повышение активности этого фермента, дополнительным источником щелочной фосфатазы в этом случае является плацента. Нормальные значения ЩФ у взрослых — до 150 ЕД/л. У беременных этот показатель может повышаться до 240 ЕД/л.
Амилаза панкреатическая синтезируется клетками поджелудочной железы. В норме у взрослых ее содержится до 50 ЕД/л. Уровень панкреатической амилазы крови возрастает при патологии поджелудочной железы.
В норме у взрослых ее содержится до 50 ЕД/л. Уровень панкреатической амилазы крови возрастает при патологии поджелудочной железы.
Пигменты представляют собой окрашенные органические вещества. Диагностическое значение имеют желчные пигменты (билирубин и уробилиноген) и порфирины (красные пигменты).
Билирубин — это желчный пигмент, который образуется в результате распада гемоглобина — пигмента красных кровяных клеток, к которому присоединяется кислород. При распаде гемоглобина первоначально образуется свободный билирубин, который транспортируется из селезенки в печень в комплексе с альбумином. Затем в печени свободный билирубин связывается со специальной кислотой (глюкуроновой), в результате чего образуется прямой, менее токсичный билирубин, который активно выделяется в желчные протоки и выводится с желчью. Он является одним из основных компонентов желчи. Билирубин содержится в сыворотке крови в виде двух фракций: прямого (связанного) и непрямого (свободного) билирубина, вместе составляющих общий билирубин крови. Нормальный уровень общего билирубина, в том числе и во время беременности, — 3,4-17,2 мкмоль/л. При повышении концентрации билирубина в крови (при ускоренном распаде эритроцитов, патологии печени или желчевыводящих путей) появляется желтуха. Это связано с тем, что при гипербилирубинемии билирубин накапливается в глазном яблоке и коже.
Нормальный уровень общего билирубина, в том числе и во время беременности, — 3,4-17,2 мкмоль/л. При повышении концентрации билирубина в крови (при ускоренном распаде эритроцитов, патологии печени или желчевыводящих путей) появляется желтуха. Это связано с тем, что при гипербилирубинемии билирубин накапливается в глазном яблоке и коже.
Азотистые вещества — это конечные продукты распада белков и нуклеиновых кислот — мочевина, креатинин, креатин, аммиак, мочевая кислота. Но в биохимии крови определяют в основном мочевину и креатинин.
Мочевина — определение уровня мочевины сыворотки крови, наряду с креатинином, используется для оценки выделительной функции почек. Нормальная концентрация мочевины в крови — 2,5-6,3 ммоль/л. Повышение концентрации мочевины в крови наблюдается при различных заболеваниях почек.
Креатинин — нормальные значения креатинина у женщин — 53-97 мкмоль/л. Увеличение креатинина в сыворотке крови говорит об уменьшении уровня почечной фильтрации (снижении функции почек). Концентрация креатинина крови у беременных женщин физиологически снижена (на 40%) вследствие увеличения объема крови, повышения почечного плазмотока и фильтрации, особенно во втором и третьем триместрах беременности. Для беременных нормальный уровень креатинина — 35-70 мкмоль/л.
Концентрация креатинина крови у беременных женщин физиологически снижена (на 40%) вследствие увеличения объема крови, повышения почечного плазмотока и фильтрации, особенно во втором и третьем триместрах беременности. Для беременных нормальный уровень креатинина — 35-70 мкмоль/л.
Микроэлементы — это химические вещества, содержание которых в организме колеблется от нескольких микрограммов до нескольких нанограммов. Но, несмотря на такое незначительное количество, они играют существенную роль во всех биохимических процессах организма.
Железо — жизненно важный микроэлемент, участвующий в транспорте кислорода. Нормальный уровень железа у женщин — 8,95-30,4 мкмоль/л. Железо входит в состав гемоглобина эритроцитов, миоглобина мыщц и некоторых ферментов. При дефиците железа развивается железодефицитная анемия — самая частая патология беременности, наблюдающаяся преимущественно во втором или третьем триместре вследствие недостаточного удовлетворения повышенной потребности организма матери и плода в веществах, необходимых для кроветворения. Однако при нормальном уровне гемоглобина возможно низкое содержание железа, что является показателем скрытой железодефицитной анемии — вот почему важно контролировать уровень железа в биохимическом анализе крови во время беременности. Наибольшие потери железа происходят при кровотечениях.
Однако при нормальном уровне гемоглобина возможно низкое содержание железа, что является показателем скрытой железодефицитной анемии — вот почему важно контролировать уровень железа в биохимическом анализе крови во время беременности. Наибольшие потери железа происходят при кровотечениях.
Натрий — важнейший компонент внеклеточного пространства, с которым связана регуляция распределения воды в организме. Нормальная концентрация натрия — 136-145 ммоль/л. Натрий участвует в механизмах возбуждения нервных и мышечных клеток. Снижение его уровня в плазме вызывает общую слабость, может привести к развитию различных неврологических нарушений. Увеличение концентрации натрия в крови наблюдается при ограничении приема воды, рвоте, например при токсикозе первой половины беременности или диарее (жидком стуле) без возмещения потери жидкости.
Калий — основной внутриклеточный микроэлемент. Нормальный уровень калия у взрослых — 3.5-5,5 ммоль/л. Гиперкалиемия наблюдается при почечной недостаточности, передозировке лекарственных средств. При снижении уровня калия, которое может быть при диарее, рвоте, развиваются нарушения ритма сердца, мышечная слабость, снижение тонуса мыщц.
При снижении уровня калия, которое может быть при диарее, рвоте, развиваются нарушения ритма сердца, мышечная слабость, снижение тонуса мыщц.
Кальций — основной компонент костной ткани. Нормальная концентрация кальция у молодых женщин — 2,20-2,55 ммоль/л. Кальций в организме выполняет множество функций: участвует в процессах мышечного сокращения, секреции гормонов, регуляции активности многих ферментов, процессе свертывания крови. Дефицит кальция наблюдается при беременности, что объясняется потребностью ребенка в строительном материале для костей, При снижении кальция в анализе необходимо восполнять его содержание с помощью лекарственных препаратов.
Фосфор — основная его часть находится в костной ткани в виде солей кальция, остальная часть -преимущественно в мягких тканях. Нормальная концентрация фосфора для будущей мамы — 1.0-1,40 ммоль/л. Повышение его содержания в крови наблюдается при передозировке витамина D. Снижении функции паращитовидных желез, почечной недостаточности.
Биохимический состав крови исследуется дважды за беременность: в самом начале беременности, при постановке беременной на учет и в 30 недель беременности, если не требуется чаще. Кровь на биохимический анализ берут из вены утром натощак. С момента последнего приема пищи должно пройти не менее 12 часов.
Мы привели перечень необходимых, наиболее часто проводимых исследований, но в каждом случае набор исследуемых позиций определяет врач. Исходя из необходимости, в каждом конкретном случае количество показателей может быть сокращено или увеличено.
Нона Овсепян, врач Независимой лаборатории ИНВИТРО
Клинические проявления ХБП у кошек, развитие которых возможно у пациентов с уровнем азотемии, находящимся в пределах нормы
Роман-А. Леонард,
к.в.н., практикующий ветеринарный врач, президент Российской научно-практической ассоциации ветеринарных нефрологов и урологов (НАВНУ, www.vetnefro.ru)
В статье использованы фото ветеринарного офтальмолога Веры Олейник.
Введение
Диагностика такой широко распространённой во всём мире нефропатии кошек, как ХБП1, в подавляющем числе случаев осуществляется ветеринарными специалистами лишь на основании повышения уровня креатинина и мочевины в сыворотке крови. С азотемией (или т. н. уремической интоксикацией) традиционно, хотя и необоснованно, связывают и большую часть клинических проявлений заключительных этапов почечного континуума.
Даже если отбросить в сторону то обстоятельство, что креатинин и мочевина — это в большей степени лишь биомаркеры почечного поражения2, а не факторы патогенеза и «виновники» большинства осложнений клинического этапа ХБП, необходимо учитывать и тот факт, что далеко не всегда у животного, погибающего от этой асептической нефропатии (по причине ряда тяжелейших её осложнений: гидроторакса, гидроперикарда, метаболического ацидоза, гиперпаратиреоза, гипертонии и т. д.), азотемия превышает общепринятые3 референтные значения.
Впрочем, возможна и обратная ситуация, когда у клинически здорового животного с безупречными анализами мочи и крови уровень креатинина значительно повышен и выявляется случайно, например при скрининге или при подготовке к рутинной хирургической операции (овариоэктомия и проч.).
Говоря в целом, уровень азотемии далеко не всегда позволяет оценить степень тяжести почечного поражения. Поэтому практически всегда требуется проведение совокупной оценки всех имеющихся у пациента изменений как в общем состоянии, так и отклонений, выявляемых при неинвазивных и, если требуется, инвазивных методах диагностики.
К несчастью, нередки случаи, когда на приём к врачу попадают пациенты с катастрофическими изменениями в ренальной паренхиме и, как следствие этого, набором патологических изменений в структуре/работе различных органов и систем. Но в нефрологическом диагнозе и, соответственно, в жизненно необходимом лечении таким животным необоснованно отказывают лишь на основании того, что уровень азотемии у них находится в пределах формальной нормы. Мало того, на основании некорректных диагнозов таким пациентам могут быть назначены препараты, обладающие абсолютными и относительными4 нефротоксичными свойствами.
Как же диагностировать ХБП, если азотемия в этом деле не слишком надёжный помощник?
Может возникнуть вопрос: как же определить эти самые тяжёлые структурные изменения в почечной паренхиме, если у пациента отсутствует азотемия? Ведь пункционная нефробиопсия с последующими гистоморфологическими исследованиями почечного биоптата — это сложно, опасно, дорого и долго.
Но тут далеко не всё так страшно, как кажется на первый взгляд. Прежде всего, ценность инвазивных методов диагностики нефропатий высока лишь на ранних доклинических этапах их течения. Только тогда результаты исследования могут значимо повлиять на долговременную стратегию нефропротективной терапии. На клиническом этапе ХБП (а он, как уже было сказано, далеко не всегда гиперазотемический) в почечной паренхиме обычно выявляются ярко выраженные, но весьма однотипные структурные изменения, представляющие различные этапы процессов ренальной деструкции, неминуемо ведущие к единому итогу — нефросклерозу. Результаты пункционной нефробиопсии на клиническом этапе ХБП (т. е. у пациентов, у которых не менее 75% почечной паренхимы находятся в состоянии частичной или полной деструкции) никак не способны повлиять на симптоматическую/заместительную терапию, лишь только и возможную в этом случае.
А что же расскажет врачу о тяжёлой почечной деструкции, если не инвазивные методы диагностики? Тут всё весьма банально. И при правильно поставленной работе точно не страшно, не дорого, быстро и экономически целесообразно. В 99% случаев вся необходимая информация будет в анализах мочи. Да, именно, о процессах деструкции в почечной паренхиме и даже об их выраженности может рассказать простой общеклинический анализ мочи. Поскольку протеинурия, гипостенурия, агранулоцитарная лейкоцитурия и проч. безапелляционно об этом свидетельствуют, и давно доказана прямая корреляция этих изменений и степени тяжести необратимого почечного поражения.
Из этого, с одной стороны, следует, что постановка какого угодно нефрологического диагноза на любом этапе почечного континуума невозможна без исследования мочи (исключением, пожалуй, могут быть названы только анурические состояния), а необоснованное пренебрежение этим легкодоступным, высокоинформативным и высокоприбыльным методом диагностики является врачебной ошибкой5. А с другой стороны, особенно если пациент кошка, множество различных патологических изменений, с жалобами на которые владельцы обращаются в клинику, прямо или косвенно могут быть связаны с различными нефропатиями, и прежде всего с ХБП. А следовательно, рекомендация о необходимости исследования мочи у кошек должна быть дана одной из первых, вне зависимости от наличия/отсутствия клинических проявлений и изменений в анализах крови.
Установление степени почечного поражения у пациентов является важным ещё и потому, что заключительные этапы почечного континуума накладывают как минимум существенные ограничения на использование большинства лекарственных препаратов, поскольку их фармакодинамика и фармакокинетика неразрывно связаны с почками (в т. ч. и поэтому возможно накопление нефротоксичных эффектов даже у средств, проявляющих в иных условиях нефропротективные свойства). Эти обстоятельства обязательно должен учитывать курирующий пациента врач, а узкие специалисты, к которым в случае необходимости животное может быть направлено на консультацию, должны быть проинформированы о почечном статусе пациента и об ограничениях в терапии, который он накладывает.
К примеру, ухудшение качества кожи и шерсти, говоря в общем даже без привязки к какой-либо нозологической форме, весьма распространённая причина обращения в ветеринарную клинику. (А если владельцы не обращают на эту проблему особого внимания, списывая всё, например, на возраст, сухость и жару в квартирах, хроническую линьку и т. д., то врач при первой возможности должен проинформировать их о необходимости и возможных вариантах установления причины появления у животного трихо- и/или дермопатии.) И у таких кошек наверняка будут значимые и стойкие отклонения в анализах мочи. А следовательно, есть все основания для того, чтобы предположить, что вышеназванные изменения являются осложнением ХБП (или усугубляются ей), которые автор предлагает обозначать как нефрогенный дерматит, или уремическая дерматопатия, если так проще объяснить самому себе или владельцам пациента причину развития этого осложнения — патологическое воздействие на структуры кожи разнообразных биологически активных веществ (прежде всего паратиреоидного гормона), накопление которых является прямым или косвенным следствием декомпенсированной почечной недостаточности.
Ещё одним относительно ранним, распространённым и наглядным осложнением ХБП является поражение глазного дна (снижение светочувствительности сетчатки обычно приводит к легко диагностируемому симптому — патологическому билатеральному мидриазу), а то и глазного яблока в целом (фото 1–6).
Не секрет, что системная гипертензия (в т. ч. и ренальная, тяжесть которой напрямую коррелирует с уровнем протеинурии и гипостенурии) опасна у кошек прежде всего необратимым поражением органов-мишеней, одним из которых являются глаза. Поэтому не стоит с порога отправлять пациента к окулистам, поскольку без терапии основного заболевания и попыток поставить под контроль уровень системной гипертензии заниматься лечением в т. ч. и офтальмологических осложнений ХБП, очевидно, не имеет смысла. А определиться с нефрологическим диагнозом, разъяснить владельцам причины возникших вторичных изменений6 и назначить необходимое пациенту лечение должен, по крайней мере, терапевт, если по какому-то недоразумению в клинике, в которой ведётся приём кошачьих, всё ещё нет ветеринарного нефролога-уролога. А уж потом, при большом желании владельцев, можно и направить пациента с ХБП к узкоспециализированным ветеринарным специалистам. И здесь ни в коем разе нет пренебрежения к уважаемым коллегам, а только огромное желание, чтобы умирающих от ХБП животных, которым «не повезло» с уровнем азотемии, лечили и от основного заболевания, а не только от его разнообразных осложнений, так ловко, зараза их возьми, маскирующихся под разные иные патологии.
Симптомы ХБП, возникающие на её клиническом этапе у пациентов в т. ч. с уровнем азотемии, находящимся в пределах референтных значений, и основные/наиболее вероятные причины их развития приведены в таблице 1.
Оценка степени тяжести ХБП у конкретного пациента требует, возможно, более полной оценки как различных клинических проявлений, так и результатов лабораторных и визуализирующих (т. е. неинвазивных) методов диагностики (а в случае, когда к этому есть показания, также и инвазивных). Поэтому при осмотре необходимо указать владельцам на все, даже на первый взгляд незначительные, изменения в состоянии животного. Именно такой комплексный подход (по совокупности признаков, а не основанный лишь на уровне отдельных лабораторных показателей, например креатинина) поможет и в постановке корректного нефрологического диагноза (на максимально ранних этапах почечного континуума). И при работе с владельцами, которым необходимо детально разъяснить значимость/опасность патологии и возможности (или отсутствие таковых) профилактики и лечения её на различных этапах.
Благодарности
Автор выражает признательность за предоставленные фотографии и поддержку в профессиональной деятельности замечательному офтальмологу Вере Олейник (Московский ветеринарный центр глазных болезней доктора Олейник).
Примечания
1 Хроническая болезнь почек.
2 Наряду с активно внедряемым в последнее время в клиническую практику симметричным диметиларгинином.
3 Вернее, установленные Международным обществом изучения заболевания почек (у мелких домашних животных) — IRIS (www.iris-kidney.com).
4 Степень нефротоксичности у таких препаратов во многом зависит от степени тяжести почечного поражения.
5 А в нефрологическом центре, которым руководит автор статьи, факт подобного пренебрежения расценивается как вражеский демарш и махровый коллаборационизм, направленные на подрыв экономического суверенитета лечебного учреждения (ст. 12-8а УК УЦВНиУ: расстрел на рассвете).
6 В случае с офтальмологическими осложнениями ХБП владельцев необходимо изначально проинформировать о том, что восстановления зрительной функции у пациента, скорее всего, не произойдёт. Это в последующем позволит избежать ряда претензий с их стороны.
Таблица 1
| Клинические признаки ХБП | Причина/наиболее вероятная причина возникновения |
| Ухудшение качества кожи и шерсти; хроническое выпадение шерсти (исключить стресс-обусловленное, например, на приёме в клинике), значимо превышающее физиологическую норму | 1. Компенсированная (патологически высоким уровнем фосфатурических гормонов) или декомпенсированная гиперфосфатемия и её прямое следствие — гиперпаратиреоз и неконтролируемое выделение и накопление в крови паратиреоидного гормона, воздействие которого на свои рецепторы II типа (длительное время считалось, что у паратиреоидного гормона есть только рецепторы одного, соответственно первого, типа, расположенные на клетках костной ткани), находящиеся в различных структурах кожи, и приводит к изменениям в ней, характерным для кошек с ХБП (нозологическая форма дермопатии, требует уточнения). Кроме того, высокие уровни паратиреоидного гормона обусловливают во всех тканях организма тот или иной уровень дисбаланса между внутри- и внеклеточным ионизированным кальцием, который, помимо прочего, является ключевой внутриклеточной сигнальной молекулой, необходимой для их нормальной функции. 2. Гипертиреоз. |
| Анорексия, рвота Астения, кахексия | 1. Нефрогенный (уремический1) гастрит, гастроэнтерит и связанные с ними нарушения ферментации пищи, пристеночного пищеварения и т. д. 2. Поражение паратиреоидным гормоном рвотного центра (тошнота, рвота) и структур ЦНС, отвечающих за формирование чувства голода и физиологически обусловленных вкусовых предпочтений. 3. Ятрогения. Такая, например, рекомендация врача: не давайте ничего до тех пор, пока не начнёт есть то, что нужно. Заканчивается гибелью животного от дефицита пластических и энергетических веществ в организме, психическими расстройствами у владельцев и формированием у них стойкой отрицательной позиции к определённым видам диетической продукции. |
| Нарушение аккомодации зрачка — патологический билатеральный мидриаз (исключить стрессогенный, например, связанный с посещением клиники) и снижение светочувствительности сетчатки вследствие структурных изменений на глазном дне (синдром извилистых артерий сетчатки, отёки и кровоизлияния в сетчатку, отслоение сетчатки и т. д.; это всегда патология, не имеющая отношения к стрессу, и поэтому мидриаз, с ней связанный, также всегда является значимым патологическим отклонением) | 1. Гиперактивация симпато-адреналовой (САС), а также тканевого и плазматического компонентов ренин-ангиотензин-альдостероновой системы (РААС) и формирование первоначально интраренальной, а затем и стойкой системной гипертензии. 2. Формирование порочного круга рено-кардиального и кардио-ренального континуумов: усугубление тяжести системной гипертензии. 3. Глаукома. |
| Очень часто изменения на глазном дне видны и без использования специальных средств2. «Благодаря» патологическому мидриазу в направленном луче света (от смартфона, например) у кошек с тяжёлыми нефропатиями (в т. ч. и с «нормальным» уровнем азотемии) глазное дно выглядит грязно-красно-зелёным, грязно-жёлто-красным или серо-жёлтым с красными вкраплениями (приблизительно так выглядят осенние листья в лужах различной степени загрязнённости). Фото 1–6. Благодаря уже стрессовому мидриазу у кошек, у которых глазное дно не поражено (хотя это не гарантирует того, что у пациента совершенно здоровые почки), при аналогичных методах осмотра можно увидеть лучистое изумрудно-зелёное свечение3. | |
| Нефрогенный (уремический) перикардит (в т. ч. с перикардиальным выпотом) | 1. Воздействие паратиреоидного гормона на свои рецепторы II типа, расположенные в структурах перикарда. 2. Гиперактивация САС и РААС. |
| Нистагм глазных яблок, скрежет зубами, нарушение координации движений, манежные движение головой, шейная вентрофлексия, кома | 1. Токсическое поражение центральной и периферической нервной системы. 2. Метаболический ацидоз. |
| Инспирационная одышка (в т. ч. с высунутым языком), брюшной тип дыхания | 1. Патологическое перераспределение жидкости в организме4 — гидроторакс (не путать с отёком легких) и гидроперикард. Часто на фоне общей гиповолемии. 2. Тромбоз лёгочных артерий на фоне системной гипертензии (положение усугубляется ещё и высокой порозностью этих артерий, свойственной кошкам). 3. Ацидоз. |
| Хронический дистресс (его развитие в некоторых случаях требует частичного или даже полного отказа от диагностических и лечебных мероприятий) | 1. Ухудшение общего самочувствия, дурнота, тошнота, сильная слабость (кошки в принципе крайне плохо переносят боль и близкие к ней по дискомфорту состояния). Автор располагает лишь единичными показаниями самих кошек об их ощущениях на клиническом этапе ХБП, явно недостаточными для глобального обобщения. Но, вероятнее всего, это что-то близкое к мироощущению при похмелье или пищевой токсикоинфекции средней или тяжёлой степени. 2. Необходимость проведения различных диагностических и лечебных процедур как в клинике, так и в домашних условиях. |
| Галитоз | 1. Нефрогенный (уремический) гингивит, гастроэнтерит. 2. Метаболический ацидоз. |
| Парез/паралич задних конечностей (или состояния, клинически напоминающие эти патологии) | 1. Тромбоз подвздошных артерий. 2. Токсическое поражение периферической нервной системы. |
| Иммунодефицитные состояния и обострение вирусных инфекций, ранее имеющих латентное течение | 1. Нефрогенный иммунодефицит, развивающийся в т. ч. и потому, что почки вырабатывают ряд аминокислот и иных БАВ, являющихся неотъемлемыми компонентами иммунной системы. 2. Хронический дистресс, развивающийся у некоторых кошек на фоне проведения лечебно-диагностических мероприятий (требует терапевтической коррекции рядом психотропных препаратов). |
1 Термин «уремический» совершенно не отражает всё многообразие нарушений в организме, возникающих на клиническом этапе ХБП, и фактически увязывает патогенез этой многофакторной нефропатии лишь с накоплением в организме конечных продуктов азотистого обмена. А также ставит знак равенства между степенью тяжести ХБП и уровнем азотемии. Что в корне неверно. Поэтому закостенелый термин «уремический» употребляется в данной статье лишь отдавая дань традиции и для некоторого облегчения понимания материала врачами, только недавно начавшими интересоваться ветеринарной нефрологией.
2 Капель, расширяющих зрачок, дорогих и очень дорогих офтальмоскопов, высококвалифицированных офтальмологов и т. д., хотя последнее, конечно, и не возбраняется, если у кошки уже определён нефрологический статус или офтальмологическое обследование проводится параллельно с этим.
3 Поэтому предложение, высказанное в одной известной песне «да загляни-ка в глазки ей…» может помочь не только в поиске определённого рода сокровищ, но также, например, и в установлении почечного статуса будущей избранницы.
4 Крайне неблагоприятный с прогностической точки зрения симптом ХБП, свидетельствующий о вовлечении в её патогенез сердечной и дыхательной систем. Прежде чем приступать к осмотру животного или любым иным действиям с ним (например, к термометрии, фиксации, постановке в/в катетера и т. д.), необходимо отойти от пациента в сторону и проинформировать владельцев о том, что животное может в любой момент погибнуть от острой полиорганной недостаточности.
Литература
- Barber P.J., Elliott J. Feline chronic renal failure: calcium homeostasis in 80 cases diagnosed between 1992 and 1995. J Small Anim Pract. 1998 Mar;39(3):108–16.
- Bartges Joe, Polzin David J. Nephrology and Urology of Small Animals. WILEY-BLACKWELL/ A John Wiley & Sons, Ltd., Publication, 2011.
- Brown, S., C. Atkins, et al. (2007). Guidelines for the identification, evaluation, and management of systemic hypertension in dogs and cats. J Vet Intern Med 21: 542–558.
- Elliott, J., P.J. Barber, et al. (2001). Feline hypertension: clinical findings and response to antihypertensive treatment in 30 cases.
J Small Anim Pract 42: 122–129. - KDIGO Clinical Practice Guideline for the Diagnosis, Evaluation, Prevention, and Treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD–MBD) // Kidney Int. 2009; 76 (suppl 113): S1–S130.
- Komaba H., Goto S., Fukagawa M. Critical issues of PTH assays in CKD // Bone. 2009; 44: 666–670.
- Noordzij M., Korevaar J.C., Boeschoten E.W., Dekker F.W., Bos W.J., Krediet R.T. The Kidney Disease Outcomes Quality Initiative (K/DOQI) Guideline for Bone Metabolism and Disease in CKD: association with mortality in dialysis patients. Am J Kidney Dis (2005) 46:925–932.
- Slatopolsky E. Role of phosphorus in the pathogenesis of secondary hyperparathyroidism //Am J Kidney Dis. 2001; 37: 54–57.
- Slatopolsky Е., Brown А., Dusso А. Pathogenesis of secondary hyperparathyroidism // Kidney Int. 2005; Vol. 56, Supplement 73: S14–S19.
- www.iris-kidney.com.
- www.vbps-online.org.
- Ветчинникова О. Н. Гиперпаратиреоз при хронической болезни почек. Эффективная фармакотерапия. Урология и Нефрология. Спецвыпуск (44), 2013.
- Волгина Г. В., Перепечёных Ю. В. Лечение вторичного гиперпаратиреоза у больных с хронической почечной недостаточностью (Практические рекомендации). Нефрология и диализ, Т. 2, № 4, 2000.
- Ермоленко В. М., Волгина Г. В., Добронравов В. А. и др. Национальные рекомендации по минеральным и костным нарушениям при хронической болезни почек. Российское диализное общество. «Нефрология и диализ» Т. 13, № 1 2011.
- Кирк Роберт. У., Бонагура Дж. Д. Современный курс ветеринарной медицины Кирка. Аквариум, 2014.
- Рожинская Л. Я. Вторичный гиперпаратиреоз и почечные остеопатии при хронической почечной недостаточности. Нефрология и диализ. Т. 2, № 4, 2000.
СВМ № 2/2018
Оценить материал
НравитсяНравится Поздравляю Сочувствую Возмутительно Смешно Задумался Нет слов
1
Дифференцировать предпочечную ОПН от внутри-/постпочеченой ОПН можно также на основе FEurea. При низком FEurea (urea необходимо сдать анализы на мочевину и креатинин в крови и моче. Введите теребуемые данные в свободные окна ниже. При подозрении на ОПН (анамнез+клиника+другие лабораторные данные и т.д.), соотношение мочевина к креатинину в крови >40 может указывать на пред- или постпочеченую ОПН, тогда как значения Внимание! Urea/Crea-Ratio >40 может также встречается при высокой белковой диете, при голодании, ожегах, лечение гормональными препаратами, кровотечения в желудке или кишечнике. Отсутствие клиники ОПН и часто нормальный креатинин в крови являются выжным момент при таких состояниях.
Литература: Thomas et al. Labor und Diagnose 2008; Herold. Innere-Medizin, 2009; некоторые формулы расчета были заимствованы с интернет страницы «LaborLimbach, Heidelberg» |
||||
Как оценить почечную функцию в клинической практике? | Трейнор Д., Мактиер Р., Геддес К.Г., Фокс Д.Г.
Точное измерение экскреторной функции почек крайне важно как в клинической практике, так и в исследовательских работах. Введение рутинного измерения скорости клубочковой фильтрации (СКФ) и новой дефиниции «хронические заболевания почек» возобновили интерес к методам измерения почечной функции. Кроме того, некоторые страны делают попытки скринирования всего населения на выявление заболеваний почек с целью снижения связанного с этими заболеваниями кардиоваскулярного риска. Точное измерение методологически сложно, поэтому более часто в клинической практике используются косвенные показатели, такие как уровень креатинина в плазме крови и специальные формулы (основанные на возрасте пациента, половой принадлежности и уровне сывороточного креатинина). В данной статье описываются рутинные и более специфичые методы оценки почечной функции и обсуждается СКФ.
Почки выполняют несколько связанных между собой функций (табл. 1), которые зависят от СКФ, интегративного показателя функции почек. СКФ определяется, как объем плазмы, очищенный от идеального вещества за единицу времени (обычно выражается в мл/мин.). «Идеальное вещество» – то, которое свободно фильтруется через клубочки и не секретируется, не реабсорбируется почечными канальцами.
Креатинин
Креатинин – эндогенное вещество, максимально близкое к идеальному для измерения СКФ [w1]. Креатинин плазмы крови является продуктом метаболизма креатинина и фосфокреатинина в скелетной мускулатуре (хотя незначительный вклад в его продукцию может вносить и потребление в пищу мяса) [w2,w3].
У пациентов со стабильной почечной функцией содержание креатинина в плазме крови обычно постоянно, варьирует в течение суток не более чем на 8% [w4,w5].
Креатинин свободно фильтруется в клубочках, не реабсорбируется, но (до 15%) активно секретируется почечными канальцами [w6]. При выраженной почечной недостаточности увеличивается экскреция креатинина через гастроинтестинальный тракт [w7].
Клиренс креатинина
Определение клиренса креатинина (КК) с использованием содержания креатинина в плазме крови и анализа собранной за определенный промежуток времени мочи, дает предположение о СКФ:
Клиренс креатинина = (креатинин мочи х объем)/ креатинин плазмы крови
Из–за секреции креатинина почечными канальцами при оценке СКФ по КК зачастую значение СКФ превышает истинное. Это систематичная ошибка при определении стабильных величин, однако до развития выраженной почечной недостаточности (ПН) КК остается адекватным методом оценки почечной функции пациентов. Главная проблема при измерении КК – это необходимость сбора мочи более 24 часов; для пациентов это крайне неудобно, и сбор мочи зачастую производится с погрешностями. Также вариабельность полученного данным методом значения составляет 25% в течение суток [w8]. Поэтому определение КК все реже используется в клинической практике.
Мочевина
Мочевина плазмы крови – менее надежный показатель СКФ, чем креатинин, поскольку ее содержание чаще меняется по причинам, не связанным с СКФ. Диета с высоким содержанием белка, повреждение тканей, обильное кровотечение из гастроинтестинального тракта, лечение кортикостероидами могут привести к увеличению мочевины плазмы крови, в то время как диета с низким содержанием белка и заболевания печени могут привести к ее снижению. Также 40–50% профильтрованной мочевины может реабсорбироваться канальцами, хотя при выраженной почечной недостаточности этот процент меньше [w9].
Содержание мочевины
и клиренс креатинина
При выраженной почечной недостаточности содержание мочевины и КК могут дать более точную информацию о СКФ, чем один КК, поскольку процессы реабсорбции мочевины и секреции креатинина взаимно уравновешивают друг друга [w10]. Этот метод рекомендуется для оценки резидуальной функции почек [w11] у пациентов, находящихся на диализе.
Клиренс инулина
В связи с отсутствием идеальной эндогенной субстанции для измерения СКФ требуется введение экзогенного агента, такого как инулин. Инулин, полимер фруктозы (5200 дальтон), обнаружен в Иерусалимских артишоках, георгинах и цикории и впервые был использован для измерения СКФ в 1951 г. [w12]. Его применение ограничено в связи с дороговизной очищенного инулина и трудностью его измерения, а определени СКФ этим методом требует больших временных затрат как для пациента, так и для врача. Болюсное введение и инфузия инулина выполняются до достижения устойчивой плазменной концентрации, вслед за этим (через несколько часов) выполняются общие анализы крови и мочи для определения содержания инулина. Данный метод (в настоящее время часто используется полифруктозан – Inutest: Fresenius, Австрия) используется только в исследовательских работах, когда необходима очень точная оценка почечной функции.
Радиоизотопные методы
С конца 1960–х гг. стали применяться радионуклеиды и был создан альтернативный метод оценки СКФ, позволяющий исключить некоторые практические недостатки определения КК. Использование радионуклеидов тесно коррелирует с клиренсом инулина [1–4] Обычно прием радионуклеидов производится однократно и СКФ вычисляется по скорости их выведения из плазмы крови, что устраняет необходимость проведения анализов мочи. Выведение вещества происходит в 2 фазы (рис. 1).
Для вычисления СКФ используется компьютерное оборудование на основе данных двух фаз (двойной пул) или терминальной элиминационной фазы (единичный пул). Метод единичного пула имеет то преимущество, что требуется меньшее количество образцов плазмы крови.
Недостаток радиоизотопного метода состоит в необходимости специальных условий хранения, обработки и использования радиоактивного материала. Также он дорог и не может использоваться во время беременности.
Важно отметить, что фаза конечной элиминации значительно удлинена при выраженной почечной недостаточности. У пациентов с почечной недостаточностью средней степени тяжести (СКФ 30–59 мл/мин.) образцы плазмы крови собираются до 5 часов после введения вещества, в то время как у пациентов с выраженной почечной недостаточностью сбор требуется вплоть до 24 часа после введения [5].
Радиоконтрастные агенты
Радиоконтрастные агенты были доступны с 1960–х гг., но трудности химического анализа и неприемлемое количество свободного йода в препарате ограничивало их применение [w13]. Эти проблемы решены, и сегодня радиоконтрастные агенты обладают рядом преимуществ перед радиоизотопами без беспокойства о радиоактивных свойствах. Агенты, используемые в последнее время: йофаламат (Conray; Mallinckrodt, St Louis, MO), сиатризоат меглумина (Hypaque; Amersham Health, NJ) и йохексол (Omnipaque; Amersham Health, NJ). Йохексол – препарат выбора, поскольку он быстр в использовании и результаты сопоставимы с клиренсом инулина [6,7].
Цистатин С
В последнее время возрос интерес к цистатину С, как эндогенному маркеру СКФ. Цистатин С – член цистатинового «суперсемейства» цистеин–протеазных ингибиторов. Он свободно фильтруется через клубочки. Его применение, однако, ограничено более высокой вариабельностью сывороточного уровня, по сравнению с креатинином (75% против 7%) [8]. Также его содержание в плазме крови повышается при опухолях, [w14,w15] ВИЧ–инфекции [w16] и лечении глюкокортикоидами [w17]. В настоящее время у цистатина С нет установленной роли, но он может использоваться для раннего выявления пациентов с почечной недостаточностью в рамках скринирующей программы [w18].
Специальные формулы
Чтобы избежать практических трудностей для измерения КК, существует несколько специальных формул. Наиболее часто используется уравнение Cockcroft и Goult и формулы, основанные на модификации диеты, использованной в исследовании заболеваний почек (рис. 2). В связи с ограниченной возможностью выявления почечной недостаточности по сывороточному креатинину возросла роль формул, в особенности формул MDRD (модификация диеты при заболеваниях почек) [9].
Уравнение Cockcroft и Goult
Уравнение Cockcroft и Goult, которое оценивает КК по уровню сывороточного креатинина, возрасту, полу и весу, было одним из первых [10] и все еще широко используется в клинической практике. Оно основано на экскреции креатинина у мужчины с нормальной функцией почек (с коррекцией для женщин, основанной на данных 3 других исследований [w19,w21]): однако имеется тенденция к оценке почечной функции как более низкой, особенно и ожирении или водной перегрузке (подобно тому, как увеличение веса не свидетельствует об увеличении мышечной массы).
Позже Левей и др. вывели формулу, основанную на данных исследований среди пациентов с выраженной почечной недостаточностью в исследованиях по коррекции диеты при заболеваниях почек [11–14]. Это относится к «6–вариабельной MDRD» или «6–v MDRD» формуле [15]. Эта формула дает оценку СКФ в миллилитрах в минуту по отношению к площади поверхности тела 1,73 м2 и основана на возрасте, поле, расе пациента и уровне мочевины, креатинина и альбумина в плазме крови. Отсутствие веса в формуле позволяет избежать ошибки при водной перегрузке и ожирении.
В 2000 г. формула модификации диеты при заболеваниях почек была упрощена (стали использоваться только возраст пациента, пол, раса и уровень креатинина в плазме крови) [16]. Эта формула получила название «4–вариабельной MDRD» или «4–v MDRD» формула.
Преимущество этих формул состоит в том, что разные лаборатории используют разные методы определения креатинина. Некоторые тесты более чувствительны, чем другие, к некреатининовым хромогенам, которые ложно повышают значения креатинина. Эта ошибка усугубляется при использовании формул, особенно у пациентов с более высоким уровнем почечной функции [17,18]. Для получения результатов, максимально близких к полученным в исследовании по коррекции диеты при заболеваниях почек, все значения сывороточного креатинина в идеале должны быть определены с использованием оригинальных методов клинической лаборатории Cleveland [17,18]. Это создает проблему для поставщиков аналитических систем и практически невыполнимо. Однако некоторые различия методов исследования могут быть скорректированы, и в Содиненном Королевстве (СК) существуют планы по адаптации факторов коррекции. С использованием корректирующих факторов получается немного модифицированная формула 4–v MDRD [19].
Поскольку эти формулы выведены для пациентов с выраженной почечной недостаточностью, правомерен вопрос об их применении для пациентов с нормальной или почти нормальной СКФ. Рекомендовано не использовать данные формулы при уровне СКФ более 60 мл/мин/1,73 м2. Необходимо отметить, что эти формулы не применимы в определенных клинических ситуациях (таких как острая почечная недостаточность, беременность, тяжелое истощение, заболевания скелетной мускулатуры, параплегия и квадриплегия), у детей или при быстром изменении почечной функции.
По литературным данным, около 5% взрослой популяции СК имеют хроническое заболевание почек 3 (СКФ 30–59 мл/мин.), 4 (15–29 мл/мин.), или 5 стадии (менее 15 мл/мин.). У этих людей значительно увеличен риск кардиоваскулярной заболеваемости и смертности, и их выявление позволяет по возможности более рано принимать меры для сокращения кардиоваскулярного риска и снижения скорости прогрессирования почечной недостаточности. В таблице 2 перечислены 5 стадий хронической почечной недостаточности.
Нефрологическая Ассоциация СК среди ассоциаций других стран, включая Канаду и Австралию, разработала рекомендации для направленного скринирования населения на выявление сниженной почечной функции на уровне поликлиник, используя CКФ. Эти рекомендации описывают, как лечить большинство пациентов в условиях поликлиники и какие пациенты должны быть направлены к нефрологу.
Заключение
Безусловно, в клинической практике наиболее широко используются специальные формулы, основывающиеся на уровне креатинина плазмы крови. Одна из них, модифицированная 4–v MDRD формула расчета СКФ [19], в настоящее время используется для определения CКФ лабораториями и стала стандартным методом выявления и мониторинга пациентов со сниженной почечной функцией в ОК и в других странах. Выявление и надлежащее лечение пациентов с хроническими заболеваниями почек сокращает кардиоваскулярный риск и замедляет ухудшение функции почек у этих пациентов.
Реферат подготовлен Э.Р. Великовой по материалам статьи Jamie Traynor, Robert Mactier, Colin G Geddes, Jonathan G Fox «How to measure renal function
in clinical practice».
BMJ, No.7571 October 7, 2006, pp733–737.
Список литературы w1–w21 Вы можете найти на сайте bmj.com
Литература
1. Chantler С, Garnett ES, Parsons V, Veall N. Glomerular filtration rate measurement in man by the single injection methods using 51 Cr-EDTA. Clin Sti 1969;37:169-80.
2. Rehling M, Moller ML, Thamdrup B, Lund JO, Trap-Jensen J. Simultane¬ous measurement of renal clearance and plasma clearance of 99mTc-labelled diethylenetriaminepenta-acetate, 51 Cr-labelled ethylenediaminetetra-acetate and inulin in man. Clin Sci (Land) 1984;66:613-9.
3. Israelit AH, Long DL, White MG, Hull AR. Measurement of glomerular filtration rate utilizing a single subcutaneous injection of 1251-iothalamate. Kidney Int 1973;4:346-9.
4. Dondi M, Fanti S. Determination of individual renal function through noninvasive methodologies. Curr Opin Nephrol Hypertens 1995;4:520-4.
5. Brochner-Mortensen J. Current status on assessment and measurement of glomerular filtration rate. Clin Physiol 1985;5:1-17.
6. Gaspari F, Perico N, Matalone M, Signorini O, Azzollini N, Mister M, et al. Precision of plasma clearance of iohexol for estimation of GFR in patients with renal disease./ Am Soc Nephrol 1998;9:310-3.
7. Gaspari F, Perico N, Ruggenenti P, Mosconi L, Amuchastegui CS, Guerini E, et al. Plasma clearance of nonradioactive iohexol as a measure of glomerular filtration rate./ Am Soc Nephrol 1995,6:257-63.
8. Keevil BG, Kilpatrick ES, Nichols SP, Maylor PW. Biological variation of cystatin C: implications for the assessment of glomerular filtration rate. Clin Chem 1998;44:1535-9.
9. Lamb EJ, Tomson CR, Roderick PJ, Clinical Sciences Reviews Committee of the Association for Clinical Biochemistry. Estimating kidney function in adults using formulae. Ann Clin Biochem 2005;42:321-45.
10. Cockcroft DW, Gault MH. Prediction of creatinine clearance from serum creatinine. Nephron 1976; 16:31 -41.
11. Effects of dietary protein restriction on the progression of moderate renal disease in the modification of diet in renal disease study./ Am Soc Nephrol 1996;7:2616-26.
12. Levey AS, Adler S, Caggiula AW, England BK, Greene T, Hunsicker LG, et al. Effects of dietary protein restriction on the progression of advanced renal disease in the modification of diet in renal disease study. Am J Kidney Dis 1996;27:652-63.
13. Peterson JC, Adler S, Burkart JM, Greene T, Hebert LA, Hunsicker LG, et al. Blood pressure control, proteinuria, and the progression of renal dis¬ease. The modification of diet in renal disease study. Ann Intern Med 1995;123:754-62.
14. Klahr S, Levey AS, Beck GJ, Caggiula AW, Hunsicker L, Kusek JW, et al. The effects of dietary protein restriction and blood-pressure control on the progression of chronic renal disease. Modification of Diet in Renal Disease Study Group. NEnglJMed 1994;330:877-84.
15. Levey AS, Bosch JP, Lewis JB, Greene T, Rogers N, Roth D. A more accu¬rate method to estimate glomerular filtration rate from serum creatinine: a new prediction equation. Modification of Diet in Renal Disease Study Group. Ann Intern Med 1999; 130:461-70.
16. Levey AS, Greene T, Kusek JW, Beck GJ. A simplified equation to predict glomerular filtration rate from serum creatinine. / Am Soc Nephrol 2000;ll:A0828.
17. Coresh J, Astor ВС, McQuillan G, Kusek J, Greene T, Van Lente F, et al. Calibration and random variation of the serum creatinine assay as critical elements of using equations to estimate glomerular filtration rate. Am]Kidney Dis 2002;39:920-9.
18. Van Biesen W, Vanholder R, Veys N, Verbeke F, Delanghe J, De Bacquer D, et al. The importance of standardization of creatinine in the implementation of guidelines and recommendations for CKD: implications for CKD management programmes. Nephrol Dial Transplant 2006;21:77-83.
19. Levey AS, Coresh J, Greene T, Marsh J, Stevens LA, Kusek J, et al. Expressing the MDRD study equation for estimating GFR with IDMS traceable (gold standard) serum creatinine values. / Am Soc Nephrol 2005; 16:69 A.
20. Verhave JC, Fesler P, Ribstein J, Du CG, Mimran A. Estimation of renal function in subjects with normal serum creatinine levels: influence of age and body mass index. Am J Kidney Dis 2005,46:233-41.
21. Poge U, Gerhardt T, Palmedo H, Klehr HU, Sauerbruch T, Woitas RP. MDRD equations for estimation of GFR in renal transplant recipients. Am] Transplant 2005;5:1306-l 1.
22. Pierrat A, Gravier E, Saunders C, Caira MV, Ait-Djafer Z, Legras B, et al. Predicting GFR in children and adults: a comparison of the Cockcroft-Gault, Schwartz, and modification of diet in renal disease for¬ mulas. [See comment] Kidney Int 2003;64:1425-36.
23. Zuo L, Ma YC, Zhou YH, Wang M, Xu GB, Wang HY. Application of GFR-estimating equations in Chinese patients with chronic kidney disease. [See comment] Am J Kidney Dis 2005;45:463-72.
24. Mahajan S, Mukhiya GK, Singh R, Tiwari SC, Kalra V, Bhowmik DM, et al. Assessing glomerular filtration rate in healthy Indian adults: a comparison of various prediction equations./ Nephrol 2005;18:257-61.
25. Anandarajah S, Tai T, De Lusignan S, Stevens P, O’Donoghue D, Walker M, et al. The validity of searching routinely collected general practice computer data to identify patients with chronic kidney disease (CKD): a manual review of 500 medical records. Nephrol Dial Transplant 2005;20:2089-96.
.
Острая и хроническая почечная недостаточность у собак, кошек и хорьков Ветеринарные статьи
« НазадОстрая и хроническая почечная недостаточность у собак, кошек и хорьков 10.03.2016 05:32Герке А.Н., ветеринарный врач, кандидат ветеринарных наук,
Герке В.С., ветеринарный врач, кандидат ветеринарных наук.
Почечная недостаточность — это нарушение функции почек, которое характеризуется снижением скорости фильтрации в почках, с развитием интоксикации и нарушением водно-солевого баланса.
Различают острую и хроническую почечную недостаточность. Прогноз болезни и возможность вылечить животное при одинаковых отклонениях в анализах различаются в зависимости от причины почечной недостаточности – острой или хронической болезни почек.
Хроническая почечная недостаточность связана с постепенным «отмиранием» структурных единиц почек (нефронов), поэтому в терминальной стадии, когда работает менее 5% нефронов, спасти животное невозможно.
При острой почечной недостаточности, когда нарушение функции почек может быть связано с отеком почки при воспалении или обезвоживании, ишурией (нарушением оттока мочи вследствие закупорки мочевыводящих путей), спазмом почечной артерии или закупоркой канальцев белковыми слепками вследствие массивной протеинурии, даже в состоянии уремии, устранение причин и форсированный диурез могут восстановить почечную функцию.
На стадии уремии (терминальная стадия, содержание креатинина в крови более 800 мкмоль/л) при хронической почечной недостаточности (ХПН) погибает практически 100 % животных, в то время как при острой почечной недостаточности (ОПН) смертность составляет 40-60%.
Клинические признаки почечной недостаточности неспецифичны, прежде всего, связаны с интоксикацией и обезвоживанием, к ним можно отнести угнетение животного, отсутствие аппетита, рвота. Диагностировать почечную недостаточность возможно по биохимическому анализу крови (повышение креатинина, азота мочевины и мочевины, на поздней стадии повышение фосфора, снижение гемоглобина).
У здоровых животных почки фильтруют большие объѐмы плазмы крови с целью выведения токсичных продуктов обмена веществ, однако в последующем 99% воды всасывается обратно в кровь, а продукты азотистого обмена в концентрированном виде выводятся в виде мочи. При хронической почечной недостаточности нарушается концентрационная функция почек, в связи с этим, несмотря на уменьшение числа функционирующих нефронов, объем мочи не уменьшается, а даже увеличивается. При этом организм теряет много воды, наступает обезвоживание и возникает повышенная жажда.
Снижение продукции мочи ниже 0,27 мл/кг/ч, что является признаком тяжѐлой дисфункции почек или двусторонней постренальной обструкции — прогностически плохой признак ОПН.
Внепочечные проявления почечной недостаточности связаны с синтезом активного витамина Д, эритропоэтина, контролем кровяного давления.
Гастрин, инсулин, глюкагон и гормон роста — это те гормоны, которые накапливаются при недостаточности почечного катаболизма. Гипергастринемия может предрасполагать к гастриту, избыток глюкагона и гормона роста у некоторых пациентов с уремией может привести к инсулинрезистентности и гипергликемии.
Гипертензия является основным осложнением болезни почек в результате активации системы ренин-ангиотензин, при этом гипертензия способствует прогрессированию почечной недостаточности.
Уремия является неинфекционной причиной иммунодефицита, нарушается клеточный иммунитет и функция нейтрофилов.
Уремия влияет на работу желудочно-кишечного тракта. Уремический язвенный стоматит и гастроэнтерит являются следствием высокой концентрации мочевины в слюне и желудочном соке. Бактериальная уреаза расщепляет мочевину до аммиака, который вызывает повреждение слизистой оболочки.
Поздними осложнениями почечной недостаточности считаются отѐк лѐгких и сердечные аритмии, также нельзя исключить развития уремической энцефалопатии — тремор, судороги, подѐргивания головы.
Лечение ОПН
Прежде всего, необходимо предпринять попытки устранить причины ОПН (например, отведение мочи при закупорке мочевыводящих путей) и провести коррекцию водно-электролитного баланса. Для этого животному ставят внутривенный периферический катетер и проводят инфузию растворов, проведя расчет дефицита жидкости (нужный объѐм (л)= % обезвоживания Х вес тела в кг). В среднем количество вводимой жидкости составляет 25-65 мл/кг/сутки плюс потери жидкости организмом. Устранение дефицита жидкости и стимулирование диуреза, как правило, достаточно для ликвидации гиперкалиемии и метаболического ацидоза лѐгкой или средней степени тяжести. Уровень мочевины и креатинина необходимо определять регулярно, до их нормализации в сыворотке крови. Для восполнения потерь жидкости и снятия интоксикации используют растворы Рингера, Рингера-Локка, Хартмана, а животным с сопутствующей сердечной и лѐгочной патологией рекомендуют вводить 0,45% раствор натрия хлорида на 2,5% глюкозе. Для коррекции гиперкалиемии проводят внутривенное введение 10% кальция глюконата в дозе 0,5-1,0 мл/кг. Отметим, что глюконат кальция является также кардиопротектором и действует около четырѐх часов.
После возмещения потерь жидкости образование мочи должно превышать 1 мл/кг/час (для контроля диуреза ставят мочевой катетер с мочеприѐмником и тем самым контролируют образование мочи). При олигурии у регидратированного пациента необходима стимуляция диуреза (фуросемид 2-3 мг/кг каждые 6-8 часов, допамин 1-5 мкг/кг/мин постоянно медленно, маннитол 0,5-1,0 г/кг в виде 10-20% раствора, глюкоза 10-20% 25-50 мл/кг каждые 8-12 часов).
Для уменьшения рвоты используют ранитидин 2 мг/кг в/в каждые 8-12 часов, метоклопрамид 0,2-0,4 мг/кг в/м или в/в.
Признаками улучшения состояния при ОПН считаются: стабилизация азотемии, исчезновение нарушений электролитного и кислотно-основного баланса, наличие полиурии. Восстановление функции почек может продолжаться несколько недель, поэтому важно контролировать ход выздоровления проведением анализа крови (биохимического и клинического), а также анализа мочи.
Для крупных пациентов с тяжѐлой и неустранимой уремией показан гемодиализ.
Лечение ХПН
При лечении хронической формы почечной недостаточности необходима строгая диета с ограничением белка и фосфора, контроль системной гипертензии протеинурии (ингибиторы АПФ, диуретики, ограничение соли и белка, противовоспалительная терапия).
Важно контролировать ХПН с помощью исследований крови и мочи. Для контроля анемия при ХПН хорошо зарекомендовал синтетический эритропоэтин, вводимый подкожно 1 – 3 раза в неделю.
К сожалению, часто владельцы животных обращаются за помощью слишком поздно, когда болезнь достигла терминальной стадии. На ранних стадиях хронической болезни почек подбор соответствующего рациона, кормовые добавки, контролирующие минеральный и азотистый обмен, контроль кровяного давления могут не только предотвратить прогрессирование почечной недостаточности, но и добиться стойкой ремиссии.
Своевременная диагностика болезней почек на доклинической (скрытой) стадии (биохимический и клинический анализы крови, анализ мочи, УЗИ мочевыводящей системы) значительно улучшает выживаемость пациентов с патологией почек.
Поэтому рекомендуется проводить контроль анализа мочи раз в 6 месяцев, биохимический анализ крови – ежегодно.
Концентрация мочевины и креатинина, соотношение мочевина: креатинин
Уровни креатинина и мочевины в крови отражают скорость клубочковой фильтрации (СКФ)
Обоснование использования измерения креатинина или мочевины для оценки почечной функции состоит в том, что их уровни в плазме / сыворотке отражают скорость клубочковой фильтрации (СКФ), параметр, который определяет функцию почек для клинициста. Независимо от причины заболевание почек связано со снижением СКФ, а тяжесть заболевания почек тесно, но обратно пропорционально коррелирует с СКФ.
Нормальная СКФ (~ 125 мл / мин) предположительно свидетельствует о здоровом функционировании почек. По мере снижения СКФ (то есть функции почек) экскреция мочевины и креатинина с мочой также снижается, а их концентрация в крови увеличивается.
Для того, чтобы концентрация эндогенно продуцируемого вещества в крови наиболее точно отражала СКФ при состоянии здоровья и болезни, это вещество должно обладать следующими свойствами:
- Выводится только почками
- Должен быть свободно отфильтрован от крови в клубочках
- Он не должен ни реабсорбироваться из фильтрата в кровь, ни секретироваться из крови в фильтрат клетками почечных канальцев (т.е. все, что фильтруется в клубочках, появляется в моче, а все, что находится в моче, происходит за счет клубочковой фильтрации)
- На концентрацию вещества в крови не должно влиять диета и / или изменение скорости эндогенной продукции
(т.е. на нее влияет только изменение СКФ)
Концентрация мочевины и креатинина в плазме является несовершенным показателем СКФ; ни один из аналитов полностью не удовлетворяет вышеуказанным критериям (см. Таблицу I ниже), и оба не обладают чувствительностью для обнаружения минимального изменения СКФ.
Как правило, СКФ необходимо снизить примерно на 50% до того, как концентрация мочевины или креатинина в плазме превысит верхние пределы соответствующего референсного диапазона [2]. Однако по сравнению с мочевиной креатинин более точно соответствует указанным выше критериям и по этой причине является предпочтительным тестом для оценки функции почек [3], [4].
Повышенный креатинин плазмы почти всегда является следствием снижения СКФ и, следовательно, имеет почечную причину. Хотя снижение СКФ (т. Е. Почечная недостаточность) также связано с повышением концентрации мочевины в плазме, существуют и другие непочечные состояния, которые могут вызвать повышение уровня мочевины в плазме [1].Таким образом, интерпретации повышенного содержания мочевины в плазме часто помогает одновременное измерение креатинина и расчет соотношения мочевина: креатинин, чтобы установить почечную или непочечную причину.
Различие между соотношением АМК: креатинин (BCR) и соотношением мочевина: креатинин (UCR)
В США и некоторых других странах концентрация мочевины выражается как содержание азота в мочевине (MW 28) и указывается как азот мочевины крови (BUN) в единицах, не относящихся к системе СИ (мг / дл). Во всех других частях мира результаты по мочевине выражаются в виде целой молекулы мочевины (MW 60) и указываются в единицах СИ (ммоль / л).Эти два разных способа представления результатов по мочевине дают два совершенно разных значения отношения.
Отношение не-SI (BCR) — это АМК (мг / дл) / креатинин плазмы (мг / дл). Контрольный диапазон составляет около 8-15 [5], а наиболее часто используемое пороговое значение для определения повышенного BCR — 20.
Коэффициент SI (UCR) — это мочевина плазмы (ммоль / л) / (креатинин плазмы (мкмоль / л), деленный на 1000). Коэффициент 1000 необходим для преобразования результата измерения креатинина из мкмоль / л в ммоль / л, единицу измерения мочевины.Референсный диапазон UCR намного выше, чем для BCR (порядка 40-100) из-за разницы между мочевиной и азотом мочевины, и менее четко определен, чем для BCR, возможно, потому что это соотношение используется реже.
Решение этой проблемы интерпретации состоит в том, чтобы преобразовать результаты SI для мочевины и креатинина в результаты, не относящиеся к SI, перед вычислением отношения. Это позволяет рассчитать более часто используемый и лучше ориентированный BCR.
Например:
У пациента А:
мочевина плазмы 5.0 ммоль / л
Креатинин плазмы 75 мкмоль / л
UCR для этого пациента составляет 5,0 / (75/1000) = 66
Чтобы рассчитать BCR для этого пациента, мы должны сначала преобразовать ммоль / л мочевины в мг / дл и креатинин мкмоль / л в мг / дл креатинина.
Для преобразования ммоль / л мочевины в мг / дл мочевины разделите на 0,357
Для преобразования креатинина мкмоль / л в креатинин мг / дл — разделите на 88,4
Так для пациента A:
АМК составляет 5,0 / 0,357 = 14 мг / дл
Креатинин 75/88.4 = 0,85 мг / дл
И BCR составляет 14 / 0,85 = 16
Все числовые значения отношения мочевина: креатинин в этой статье будут BCR, а не значениями UCR, если не указано иное.
Увеличенный BCR / UCR может быть представлен, по крайней мере теоретически, одним из трех способов:
- Повышенный уровень мочевины в плазме и нормальный креатинин в плазме
- Нормальный уровень мочевины в плазме и пониженный креатинин в плазме
- Повышение уровня мочевины в плазме непропорционально больше, чем повышение креатинина
Основные причины увеличения BCR / UCR перечислены в Таблице II ниже под этими тремя заголовками.Снижение BCR / UCR [6] встречается реже и обычно имеет меньшее клиническое значение. Это особенность очень редких наследственных нарушений цикла мочевины и запущенных заболеваний печени. Оба, как правило, связаны с пониженным содержанием мочевины в плазме, но с нормальным креатинином в плазме. Ложно повышенный креатинин плазмы (из-за веществ, которые мешают оценке креатинина) может вызвать снижение BCR / UCR.
ТАБЛИЦА I: Сравнение мочевины и креатинина как маркеров СКФ
| Критерии вещества для : его концентрация в плазме для наиболее точного отражения СКФ | Мочевина | Креатинин |
Выводится только почками | Не совсем — небольшое количество | Да, обычно |
| Свободно фильтруется в клубочках | Есть | Есть |
| Не реабсорбируется и не секретируется клетками почечных канальцев | Переменное количество мочевины | Креатинин не всасывается. Практически весь профильтрованный креатинин выводится с мочой. Однако небольшое количество секретируется проксимальными канальцами . |
| Концентрация в крови не зависит от факторов , кроме СКФ, то есть не должна зависеть от диеты, а должна производиться с постоянной скоростью | Ряд непочечных
| Производство креатинина и , следовательно, концентрация креатинина в плазме постоянна, так что , пока мышечная масса остается неизменной .Уровни в плазме зависят от этнической принадлежности и пола и временно повышаются на при употреблении в пищу вареного мяса . |
ТАБЛИЦА II: Причины увеличения BCR / UCR
Повышенный уровень мочевины в плазме / нормальный креатинин в плазме
|
| Уровень мочевины в плазме нормальный / Креатинин в плазме снижен Снижение мышечной массы |
Уровень мочевины в плазме непропорционально выше, чем повышенный уровень креатинина в плазме
|
Клиническое применение BCR / UCR 1. Желудочно-кишечное кровотечение
Желудочно-кишечное кровотечение представляет собой непочечную причину повышения уровня мочевины в плазме. При отсутствии сопутствующей почечной недостаточности пациенты с кровотечением из ЖКТ имеют нормальный креатинин плазмы и, следовательно, повышенный BCR / UCR.
Два механизма были предложены для объяснения увеличения мочевины и, как следствие, увеличения BCR / UCR, связанного с кровотечением из ЖКТ.Первый из них предполагает повышенное производство мочевины вследствие переваривания крови и повышенного всасывания производных аминокислот; кровь в кишечнике фактически представляет собой «пищу с высоким содержанием белка».
Второй механизм связан с гиповолемией и снижением почечной перфузии, связанным с любой значительной кровопотерей. Часть адаптивного ответа на гиповолемию и снижение почечной перфузии включает усиление реабсорбции мочевины почками и, как следствие, снижение экскреции мочевины с увеличением концентрации мочевины в плазме.Поскольку на СКФ не влияет (по крайней мере вначале) так называемая преренальная азотемия, креатинин плазмы остается в пределах нормы.
Измерение мочевины в плазме и расчет BCR / UCR оказалось клинически полезным для определения места кровотечения из ЖКТ. В частности, он помогает отличить кровотечение из верхнего и нижнего отделов желудочно-кишечного тракта. Анатомический участок, который используется для определения границы между верхним и нижним отделами желудочно-кишечного тракта, — это соединение двенадцатиперстной кишки и тощей кишки, где прикрепляется связка Трейца.
Ряд исследований [7], [8], [9], [10], [11], [12] продемонстрировали, что BCR / UCR значительно выше среди пациентов с кровотечением из верхних отделов ЖКТ, чем среди пациентов с кровотечением из верхних отделов ЖКТ. кровотечение из нижнего отдела желудочно-кишечного тракта. Наиболее широко рекомендуемое пороговое значение BCR для различения кровотечений из верхнего и нижнего ЖКТ — 30 [13]. (Эквивалентное значение для UCR, конечно, выше, 90–100) [7], [9].
Значение BCR более 30 идентифицирует кровотечение из верхних отделов ЖКТ со специфичностью около 95–99% и чувствительностью около 50% [13].
Таким образом, действительно редко бывает, чтобы кровотечение в месте ниже соединения двенадцатиперстной кишки и тощей кишки было связано с BCR> 30.
Предполагаемая причина более низкого BCR / UCR у пациентов с кровотечением из нижнего отдела желудочно-кишечного тракта состоит в том, что кровь, вызывающая нарушение, чаще всего оказывается ниже того участка тонкой кишки, где происходит наибольшая абсорбция аминокислот; тогда не может работать механизм «высокобелковой муки», увеличивающий производство мочевины.
Помимо своей роли в локализации места кровотечения из ЖКТ, измерение мочевины также играет роль в определении тяжести кровотечения.В 1980 г. Pumphrey и Beck [14] продемонстрировали положительную корреляцию между оценкой кровопотери и концентрацией мочевины в плазме у 57 пациентов с кровотечением из верхних отделов желудочно-кишечного тракта.
Подтверждение того, что концентрация мочевины в плазме является потенциальным маркером значительной кровопотери среди пациентов с кровотечением из верхних отделов желудочно-кишечного тракта, привело к включению концентрации мочевины в плазме в хорошо утвержденную систему баллов Глазго-Блатчфорда [15], [16], [17].
Эта простая система оценки, основанная на пульсе пациента, артериальном давлении, концентрации мочевины в плазме и концентрации гемоглобина, используется для первоначальной оценки пациентов с кровотечением из верхних отделов желудочно-кишечного тракта с целью выявления тех, кто входит в группу высокого риска (нуждающихся в срочной трансфузии / эндоскопии) и тех, кто относится к группе низкого риска. (который может быть безопасно выписан без дальнейшего обследования / лечения).
Клиническое применение BCR / UCR 2. Острое повреждение почек (AKI)
Хроническая болезнь почек (ХБП) определяется снижением СКФ, которое, в свою очередь, связано с повышением концентрации креатинина и мочевины в плазме. По мере прогрессирования ХБП уровни обоих в плазме повышаются последовательно, так что BCR / UCR обычно остается в пределах нормы при ХБП. Хотя снижение СКФ также является определяющим признаком острого повреждения почек (ОПП), уровни креатинина в плазме и мочевины не обязательно повышаются одновременно, а BCR / UCR иногда увеличивается.
Это позволило использовать расчет BCR / UCR в ранней оценке пациентов, страдающих ОПП. Чтобы понять это применение BCR / UCR, необходимо кратко рассмотреть причины AKI.
Причины ОПН подразделяются на три категории: преренальные (снижение перфузии почек, часто из-за гиповолемии), внутренние почечные (повреждение самой почки — клубочковой или канальцевой), постренальные (нарушение оттока мочи) [18].
Преренальные причины (гиповолемия из-за сильной рвоты, кровопотери, осмотического диуреза и др.)или снижение почечного кровотока из-за, например, кардиоренального синдрома, связанного с сердечной недостаточностью, сепсиса) составляют 70% случаев ОПП. Какой бы ни была точная причина, преренальная ОПП существует, несмотря на предположительно нормально функционирующую почку.
Именно гемодинамическая нестабильность является причиной снижения СКФ при преренальном ОПП. Частью ответа на гемодинамическую нестабильность, лежащую в основе преренальной ОПП, является повышенная реабсорбция мочевины почками [19], что способствует повышению уровня мочевины в плазме вследствие снижения СКФ.Поскольку креатинин не реабсорбируется, а увеличивается только в результате снижения СКФ, концентрация мочевины в плазме имеет тенденцию повышаться непропорционально повышению концентрации креатинина в плазме у пациентов с преренальным ОПН, что приводит к увеличению BCR / UCR.
Это позволило BCR / UCR сыграть давно установленную роль в различении ОПП, вызванной преренальными механизмами (связанными с BCR> 20), от ОПП, обусловленными внутренними почечными или постренальными механизмами (связанными с BCR).
Это различие важно, потому что преренальная ОПП часто легко обратима с помощью ранней инфузионной инфузии и связана с более низкой смертностью, чем внутренняя или постренальная ОПП.Таким образом, повышенный BCR (> 20) считается хорошим прогностическим показателем
у пациентов с ОПП.
Недавнее исследование [21], [22] ставит под сомнение обоснованность этого традиционного использования BCR / UCR. Эти исследования показывают, что высокий BCR может быть связан с плохим прогнозом и, следовательно, не обязательно указывать только на преренальное ОПП. Авторы одного из этих исследований [22] предупреждают, что BCR / UCR не следует использовать для различения преренальной ОПП от других форм ОПП, по крайней мере, у тяжелобольных.
Подтверждением этой точки зрения является наблюдение, что у тяжелобольных пациентов с нормальным уровнем креатинина сыворотки концентрация мочевины в плазме независимо связана со смертностью [23].
Клиническое применение BCR / UCR 3. Сердечная недостаточность
Здоровье и болезнь тесно связаны с функциями сердца и почек. Патологически эта связь проявляется в виде кардиоренального синдрома [24]. Около 60% пациентов с сердечной недостаточностью (HF) имеют определенную степень почечной дисфункции, которая увеличивает как заболеваемость, так и смертность из-за сердечной недостаточности [24].
Идентификация пациентов с сердечной недостаточностью с самым высоким риском смерти включает оценку функции почек, и ряд недавних исследований [25], [26], [27] предполагают, что расчет BCR / UCR пациента имеет важное прогностическое значение.
Эта роль основана на наблюдении, что сыворотка / плазма мочевины является более сильным показателем выживаемости среди жертв сердечной недостаточности с почечной дисфункцией, чем обычные показатели функции почек (креатинин плазмы и расчетная СКФ) [28].
Таким образом, эти исследования показывают, что для пациентов с сердечной недостаточностью, чем выше BCR / UCR, тем выше риск ухудшения почечной дисфункции и смерти.BCR / UCR в пределах нормы является благоприятным прогностическим признаком для этих пациентов.
Клиническое применение только измерения мочевины в плазме 1. Острый панкреатит
Измерение мочевины в сыворотке / плазме имеет значение при раннем обследовании пациентов с острым панкреатитом (в отделении неотложной помощи). В частности, это помогает отличить тех, у кого острый панкреатит, вероятно, протекает относительно доброкачественное самоограничивающееся течение, от примерно 20% пациентов, у которых разовьется тяжелый острый панкреатит, быстро развивающееся опасное для жизни состояние, которое может привести к обширной инфекции, сепсису и полиорганной недостаточности. .
Эти пациенты нуждаются в немедленном переводе в отделение интенсивной терапии для оптимального ухода и наилучших шансов на выживание.
Представление о том, что повышение уровня мочевины в плазме / сыворотке при поступлении и / или повышение уровня мочевины в плазме / сыворотке в течение первых 24 часов является плохим прогностическим признаком и указывает на тяжелый острый панкреатит, принималось в течение многих лет [29], [30]. Недавнее подтверждающее исследование подтвердило это клиническое применение измерения мочевины [31]. Авторы этого исследования получили результаты BUN (мочевины) в плазме при поступлении и через 24 часа у 1043 пациентов с острым панкреатитом.
Самая высокая смертность (15-20%) была очевидна у пациентов с повышенным уровнем мочевины> 20 мг / дл (7,1 ммоль / л) при поступлении без снижения по крайней мере на 5 мг / дл (1,7 ммоль / л) в течение 24 дней. часов, которые последовали. Было обнаружено, что снижение более чем на 5 мг / дл существенно снижает риск смерти для пациентов с повышенным уровнем мочевины при поступлении (смертность всего 0–3,2%).
Самая низкая смертность (0–1%) была обнаружена у пациентов с нормальной мочевиной, 2 мг / дл (0,7 ммоль / л) через 24 часа. Увеличение более чем на 2 мг / дл (0.7 ммоль / л) в течение 24 часов после госпитализации увеличивают смертность (6-11%) у пациентов с нормальным уровнем мочевины при поступлении.
Клиническое применение только измерения мочевины в плазме 2. Гемодиализ
Измерение концентрации мочевины в плазме / сыворотке давно играет роль в мониторинге адекватности / дозировки прерывистого гемодиализа, спасающей жизнь заместительной почечной терапии для пациентов с терминальной стадией почечной недостаточности. Концентрации мочевины в плазме до и после диализа используются для расчета коэффициента восстановления мочевины (URR), таким образом:
URR = [1 — Постдиализная мочевина) / Преддиализная мочевина] × 100
URR> 65% широко считается показателем адекватного диализа [32].
Альтернативный параметр, Kt / V, основанный на кинетическом моделировании мочевины, также используется для определения адекватности / дозы периодического гемодиализа. Расчет Kt / V также требует ввода концентраций мочевины в плазме до и после диализа.
K = общий клиренс мочевины при диализе (мл / мин)
t = время диализа (мин)
V = общее количество воды в организме (л).
Значение Kt / V> 1,2 указывает на адекватный диализ [32].
Сводка
Мочевина в сыворотке / плазме не рекомендуется для рутинной оценки функции почек, поскольку она является менее специфическим маркером скорости клубочковой фильтрации (СКФ), чем креатинин плазмы, предпочтительный анализ крови для оценки и мониторинга функции почек.Однако измерение мочевины имеет некоторую клиническую ценность, особенно при измерении вместе с креатинином плазмы.
Измерение только мочевины доказало свою ценность при оценке пациентов с острым панкреатитом и мониторинге эффективности гемодиализа.
Понимание ценностей вашей лаборатории | Национальный фонд почек
Людям с хроническим заболеванием почек могут быть назначены некоторые или все следующие тесты и измерения. Если у вас заболевание почек, спросите своего врача, какие анализы вам будут проходить и как часто они будут проходить.Поговорите со своим врачом о своих результатах. Если ваши числа не в нормальном диапазоне, спросите, как их улучшить.
Креатинин сыворотки: Креатинин — это отходы в крови, которые образуются в результате мышечной активности. Обычно он удаляется из крови почками, но когда функция почек замедляется, уровень креатинина повышается. Ваш врач должен использовать результаты теста на креатинин сыворотки для расчета СКФ.
Скорость клубочковой фильтрации (СКФ): СКФ показывает, насколько хорошо у вас функционируют почки.Это можно определить по уровню креатинина в крови. Если ваша СКФ упадет ниже 30, вам нужно будет обратиться к специалисту по заболеваниям почек (называемому нефрологом). СКФ ниже 15 указывает на то, что вам необходимо начать лечение почечной недостаточности. Ваш специалист по заболеваниям почек расскажет вам о методах лечения почечной недостаточности, например о диализе или трансплантации почки.
Азот мочевины крови (АМК): Азот мочевины — это нормальный продукт жизнедеятельности в крови, образующийся при расщеплении белка из пищи, которую вы едите, и в результате метаболизма вашего организма.Обычно он удаляется из крови почками, но когда функция почек замедляется, уровень азота мочевины повышается. АМК также может повыситься, если вы потребляете больше белка, и может снизиться, если вы потребляете меньше белка.
Белок в моче: Когда ваши почки повреждены, белок попадает в вашу мочу. Чтобы определить белок в моче, можно провести простой тест. Стойкий белок в моче — ранний признак хронического заболевания почек.
Микроальбуминурия: Это чувствительный тест, который может обнаружить небольшое количество белка в моче.
Креатинин мочи: Этот тест оценивает концентрацию вашей мочи и помогает дать точный результат белка. Соотношение протеина и креатинина: это оценивает количество протеина, которое вы выделяете с мочой за день, и позволяет избежать необходимости собирать 24-часовой образец мочи.
Сывороточный альбумин: Альбумин — это белок организма, который вырабатывается из белков, которые вы едите каждый день. Низкий уровень альбумина в крови может быть вызван недостатком белка или калорий из своего рациона.Низкий уровень альбумина может привести к проблемам со здоровьем, например, к трудностям в борьбе с инфекциями. Спросите своего диетолога, как получить нужное количество белка и калорий из своего рациона.
nPNA: Ваша nPNA (нормализованный внешний вид азота белка) — это тест, который может определить, достаточно ли вы едите белка. Это измерение происходит в результате лабораторных исследований, включающих сбор мочи и анализ крови. Ваш диетолог может попросить точный отчет о питании для проведения этого теста.
Субъективная глобальная оценка (SGA): Ваш диетолог может использовать SGA для выявления признаков проблем с питанием.Диетолог задаст вам несколько вопросов о вашем ежедневном питании и проверит ваш вес, а также запасы жира и мышц на вашем лице, руках, руках, плечах и ногах. Спросите своего диетолога о вашей оценке по шкале SGA. Если ваш результат слишком низкий, спросите, как его улучшить.
Гемоглобин: Гемоглобин — это часть красных кровяных телец, которая переносит кислород из легких во все части тела. Ваш уровень гемоглобина говорит вашему врачу, если у вас анемия, из-за которой вы чувствуете усталость и у вас мало энергии.
Гематокрит: Ваш гематокрит — это мера красных кровяных телец, вырабатываемых вашим телом. Низкий гематокрит может означать, что у вас анемия.
TSAT и сывороточный ферритин: Ваш TSAT (произносится как tee-sat) и сывороточный ферритин (произносится как ferry-tin) — это показатели железа в вашем организме. Ваш TSAT должен быть выше 20 процентов, а уровень ферритина в сыворотке должен быть выше 100. Это поможет вам создать красные кровяные тельца. Ваш врач порекомендует добавки железа, когда это необходимо для достижения целевого уровня.
Гормон паращитовидной железы (ПТГ): Высокий уровень гормона паращитовидной железы (ПТГ) может быть результатом плохого баланса кальция и фосфора в организме. Это может вызвать заболевание костей. Спросите своего врача, находится ли ваш уровень ПТГ в правильном диапазоне. Ваш врач может назначить специальную рецептурную форму витамина D, чтобы снизить уровень паратгормона. Внимание: не принимайте витамин D, отпускаемый без рецепта врача.
Кальций: Кальций — это минерал, который важен для крепких костей.Спросите своего врача, какой у вас должен быть уровень кальция. Чтобы сбалансировать количество кальция в крови, врач может попросить вас принимать добавки с кальцием и специальную рецептурную форму витамина D. Принимайте только добавки и лекарства, рекомендованные врачом.
Фосфор: Высокий уровень фосфора может привести к ослаблению костей. Спросите своего врача, каким должен быть уровень фосфора. Если ваш уровень слишком высок, ваш врач может попросить вас уменьшить потребление продуктов с высоким содержанием фосфора и принимать лекарство, связывающее фосфат, во время еды и перекусов.
Калий: Калий — это минерал в крови, который помогает сердцу и мышцам работать должным образом. Слишком высокий или слишком низкий уровень калия может ослабить мышцы и изменить ваше сердцебиение. Нужно ли вам изменить количество продуктов с высоким содержанием калия в вашем рационе, зависит от стадии заболевания почек. Спросите своего врача, какой у вас должен быть уровень калия. Ваш диетолог может помочь вам спланировать диету, чтобы получить нужное количество калия.
Масса тела: Поддержание здорового веса важно для вашего общего состояния здоровья.Если вы худеете, даже не пытаясь, возможно, вы не получаете правильного питания, чтобы оставаться здоровым. Ваш диетолог может посоветовать, как безопасно добавлять в свой рацион дополнительные калории, если это необходимо. С другой стороны, если вы медленно набираете слишком много веса, вам может потребоваться уменьшить количество калорий и повысить уровень активности. Резкое увеличение веса также может быть проблемой. Если это сопровождается отеком, одышкой и повышением артериального давления, это может быть признаком слишком большого количества жидкости в вашем теле. Поговорите со своим врачом, если ваш вес заметно изменился.
Артериальное давление: Спросите своего врача, какое у вас должно быть артериальное давление. Если у вас высокое кровяное давление, обязательно выполните все шаги назначенного вам лечения, которые могут включать в себя прием лекарств от высокого кровяного давления, сокращение количества соли в вашем рационе, снижение лишнего веса и выполнение регулярной программы упражнений.
Общий холестерин: Холестерин — это жироподобное вещество, которое содержится в вашей крови. Высокий уровень холестерина может увеличить ваши шансы на проблемы с сердцем и кровообращением.Для многих пациентов хороший уровень общего холестерина ниже 200. Если ваш уровень холестерина слишком высок, ваш врач может попросить вас внести некоторые изменения в свой рацион и повысить уровень активности. В некоторых случаях также используются лекарства.
Холестерин ЛПВП: Холестерин ЛПВП — это тип «хорошего» холестерина, который защищает ваше сердце. Для многих пациентов целевой уровень холестерина ЛПВП выше 40.
Холестерин ЛПНП: Холестерин ЛПНП — это тип «плохого» холестерина.Высокий уровень ЛПНП может увеличить ваши шансы на проблемы с сердцем и кровообращением. Для многих пациентов целевой уровень холестерина ЛПНП ниже 100. Если ваш уровень ЛПНП слишком высок, ваш врач может попросить вас внести некоторые изменения в свой рацион и повысить уровень активности.
Триглицерид: Триглицерид — это тип жира, который содержится в вашей крови. Высокий уровень триглицеридов наряду с высоким уровнем общего холестерина и холестерина ЛПНП может увеличить вероятность возникновения проблем с сердцем и кровообращением.
Dialysis Clinic, Inc. | Объяснение лабораторных значений
Общие тесты для диагностики заболеваний почек
Лабораторные работы, образцы мочи и другие анализы могут быть выполнены во время диагностики и лечения почечной недостаточности. Результаты теста будут использоваться, чтобы помочь медицинской бригаде (вашему врачу, медсестрам и другим) оценить вашу функцию почек и определить, что должен включать ваш план медицинского обслуживания. Помните, что все под вашим контролем и вы сами являетесь лучшим поставщиком медицинских услуг, поэтому вам важно понимать, что означают эти тесты.Помните, что эти значения могут отличаться в разных лабораториях, поэтому убедитесь, что вы знаете нормальные значения для своей лаборатории. Давайте начнем.
Азот мочевины крови (также называемый АМК)
Кровь переносит белок к клеткам по всему телу. После того, как клетки используют белок, оставшиеся отходы возвращаются в кровь в виде азота мочевины. Здоровые почки выводят азот мочевины из крови и выводят его с мочой. Если ваши почки не работают должным образом, азот мочевины останется в крови.Нормальная кровь содержит 7-20 мг / дл мочевины. Если уровень АМК превышает 20 мг / дл, возможно, ваши почки не работают в полную силу. Другие возможные причины повышенного АМК включают обезвоживание и сердечную недостаточность.
Креатинин сыворотки
Креатинин — это отходы в крови, образующиеся в результате нормального метаболизма мышечных клеток. Здоровые почки выводят креатинин из крови и выводят его с мочой, чтобы покинуть организм. Когда почки плохо работают, в крови накапливается креатинин.Если почки теряют способность фильтровать кровь (снижается СКФ), накапливается больше креатинина, и креатинин сыворотки повышается. В результате креатинин является косвенным маркером скорости клубочковой фильтрации (СКФ) или того, насколько хорошо работают почки. Уровень креатинина выше 1,2 у женщин и выше 1,4 у мужчин может быть ранним признаком того, что почки не работают должным образом.
Клиренс креатинина
Клиренс креатинина — это мера количества креатинина в моче.Он дает точную оценку способности почек выводить креатинин из вашего тела. Чтобы рассчитать клиренс креатинина, вас могут попросить сохранить мочу в течение 24 часов и принести ее в лабораторию. Лаборатория измеряет количество креатинина в моче. Нормальный клиренс креатинина превышает 90 мл / мин.
СКФ (скорость клубочковой фильтрации)
СКФ — это показатель того, насколько хорошо почки перерабатывают отходы. Образец вашей крови отправляется в лабораторию.Уровень креатинина в крови учитывается с учетом вашего возраста, пола, роста, расы и веса для расчета скорости клубочковой фильтрации (СКФ). Нормальная СКФ может варьироваться в зависимости от возраста. С возрастом он может уменьшаться. Нормальное значение СКФ составляет 90 мл / мин или выше. СКФ ниже 60 мл / мин — признак того, что почки не работают должным образом. СКФ ниже 15 мл / мин указывает на необходимость лечения почечной недостаточности, например диализа или трансплантации.
Анализ мочи на микроальбумин
Здоровые почки выводят шлаки из крови, но оставляют белок.Нарушенные почки могут не отделить белок крови, называемый альбумином, из отходов. Поначалу в мочу может просочиться лишь небольшое количество белка, которое слишком мало для измерения с помощью стандартного щупа. Это состояние известно как микроальбуминурия. Вот как читается тест:
- Менее 30 мг / л нормально
- Более 30 мг / л, но менее 300 мг / л называется микроальбуминурией
- Более 300 мг / л называется макроальбуминурией
Тест на белок в моче
По мере ухудшения функции почек количество альбумина и других белков в моче часто увеличивается, и это состояние называется протеинурией.Ваш врач может проверить на белок с помощью индикаторной полоски в небольшом образце вашей мочи, взятом в кабинете врача. Цвет индикаторной полоски указывает на наличие или отсутствие протеинурии. Этот тест должен быть отрицательным.
Анализы крови на анемию
Гематокрит
Гематокрит (Hct) — это анализ крови, который измеряет количество и размер эритроцитов. Он дает процент красных кровяных телец, обнаруженных в цельной крови. Его используют для проверки на анемию.Анемия, нехватка кислорода, переносящего эритроциты, часто начинается на ранних стадиях заболевания почек. Анемия поддается лечению. Нормальный гематокрит (Hct) для здорового взрослого человека составляет 38-45%. Для человека с ХБП желательный Hct составляет 33-36%.
Гемоглобин
Гемоглобин (Hb. Hgb) — это часть красных кровяных телец, которая переносит кислород к клеткам тела. И гемоглобин, и гематокрит измеряются для проверки на анемию. Трехкратный уровень гемоглобина равен гематокриту.Нормальный уровень гемоглобина для здорового взрослого человека составляет 12-15 г / дл. Для человека с ХБП желательный уровень гемоглобина составляет 11-12 г / дл.
Анализы крови для измерения контроля диабета
Глюкоза (сахар в крови)
Тест на уровень глюкозы в крови измеряет количество одного типа сахара, называемого глюкозой, в вашей крови. Глюкоза — это уровень сахара в крови. Он измеряется, чтобы убедиться, что ваше тело способно правильно переваривать и использовать сахар и углеводы. Если у вас слишком высокий уровень сахара в крови, это может означать, что у вас диабет.
Нормальное голодание (перед едой) Уровень глюкозы:
- Неизвестно диабет: менее 100 мг / дл.
- Более 125 мг / дл может указывать на диабет.
- Диабетики: 70-130 мг / дл находится в пределах целевого диапазона
Нормальный Без голодания (через 2 часа после еды)
- Неизвестно диабет: менее 140 мг / дл.
- Диабетики: менее 180 мг / дл
Гемоглобин A1C (HbA1c)
Показания гликозилированного гемоглобина A1C (также называемого HbA1c, гемоглобином A1C и A1C) показывают ваш средний уровень глюкозы в крови за последние три месяца и могут использоваться для контроля вашего диабета и прогнозирования риска при диабетических осложнениях.Как оно это делает? Ваше тело на самом деле запоминает след, который сахар оставляет в вашем теле. Когда уровень глюкозы в крови высок, молекулы сахара прикрепляются к эритроцитам. Красные кровяные тельца хранят информацию о сахаре около четырех месяцев. Затем анализ крови может получить ваши средние результаты глюкозы в крови в процентном формате. Чем выше значение A1C, тем выше риск диабетических осложнений. Для диабетиков с ХБП хороший контроль уровня сахара в крови может замедлить ухудшение функции почек.Спросите своего врача, каким должен быть ваш результат. Для большинства людей результат должен быть менее 7%.
Анализы крови на питание
Сывороточный альбумин
Альбумин — это уровень белка в крови. Он вырабатывается в печени и попадает в кровь. Это помогает предотвратить утечку крови из кровеносных сосудов. Он переносит лекарства и другие вещества через кровь и важен для роста и заживления тканей. Нормальный сывороточный альбумин является показателем полноценного питания.Исследования показывают, что люди с заболеванием почек, которые страдают от недоедания, имеют низкий уровень сывороточного альбумина и не получают достаточного количества белка, могут страдать от осложнений. Нормальный уровень сывороточного альбумина у здорового взрослого человека составляет 3,5 г / дл. Целевой показатель для взрослых с ХБП составляет 4 г / дл.
Lipid Panel
Липиды находятся в вашей крови и хранятся в ваших тканях. Они являются важной частью клеток и помогают вашему организму нормально работать. Нарушения липидов, такие как высокий уровень холестерина, могут привести к опасным для жизни заболеваниям, таким как ишемическая болезнь сердца, сердечный приступ и инсульт.Также появляется все больше доказательств того, что гиперлипидемия способствует не только сердечно-сосудистым заболеваниям, но и прогрессированию заболеваний почек.
Общий холестерин
Люди с высоким уровнем холестерина могут чувствовать себя хорошо, но они подвержены более высокому риску сердечных приступов и затвердевания артерий, чем люди с нормальным уровнем. Нормальный уровень холестерина у здоровых взрослых и взрослых с ХБП составляет менее 200 мг / дл.
ЛПВП (липопротеин высокой плотности)
Он известен как «хороший» холестерин.Более высокие уровни связаны с более низким риском сердечных заболеваний. Нормальный диапазон ЛПВП для здоровых взрослых и взрослых с ХБП составляет 40-79 мг / дл.
ЛПНП (липопротеин низкой плотности)
Он известен как «плохой» холестерин. Высокий уровень ЛПНП плох и связан с более высоким риском сердечных заболеваний и инсульта. Нормальный диапазон для здоровых взрослых и взрослых с ХБП составляет менее 100 мг / дл.
Триглицериды
Триглицериды являются основной формой жира в пищевых продуктах и в организме человека.Нормальный диапазон для здоровых взрослых и взрослых с ХБП составляет менее 150 мг / дл.
Дополнительные анализы на заболевание почек
Если анализы крови и мочи указывают на снижение функции почек, ваш врач может порекомендовать дополнительные тесты, которые помогут определить причину проблемы.
Визуализация почек
Методы визуализации почек (фотографирование почек) включают УЗИ, компьютерную томографию (КТ) и магнитно-резонансную томографию (МРТ).Эти инструменты наиболее полезны при обнаружении необычных новообразований или препятствий оттоку мочи.
Биопсия почек
Ваш врач может захотеть увидеть крошечный кусочек ткани вашей почек под микроскопом. Чтобы получить этот образец ткани, врач выполнит биопсию почек — больничную процедуру, при которой врач вводит иглу через кожу в почку. Игла извлекает нить ткани длиной от 1/2 до 3/4 дюйма. Для процедуры вы лягте на живот на стол и получите местный анестетик, чтобы обезболить кожу.Образец ткани поможет врачу определить причину и тяжесть вашего заболевания почек.
Womens Clinic
Важно понимать, что лабораторные результаты могут выходить за рамки так называемого «нормального диапазона» по многим причинам. Эти различия могут быть связаны с такими факторами, как раса, диета, возраст, пол, менструальный цикл, физическая активность, лекарства и употребление алкоголя. Большинство лабораторий устанавливают свой нормальный диапазон для конкретного теста, так что 95% здоровых пациентов попадают в нормальный диапазон.Аномальный результат не обязательно указывает на болезнь. Только ваш врач может определить, требуется ли дальнейшее обследование или лечение. Я настоятельно рекомендую вам обсудить ваши результаты, особенно любые отклонения от нормы, со своим врачом.
Триглицериды
Анализы крови, используемые для определения риска развития сердечных заболеваний. Высокий уровень также может указывать на плохо контролируемый диабет.
Холестерин
Холестерин отличается от большинства тестов тем, что он не используется для диагностики или мониторинга заболевания, а используется для оценки риска развития заболевания, особенно сердечного.
Общий холестерин
Высокий холестерин является основным фактором риска заболеваний сердца и кровеносных сосудов. Сам по себе холестерин — это не все плохо. Нашему телу нужно определенное количество для правильного функционирования.
Холестерин ЛПНП
Считается «плохим холестерином», потому что отложения холестерина образуются в артериях при высоком уровне ЛПНП. Рекомендуется уровень ЛПНП менее 130.
Холестерин ЛПВП
«Хороший холестерин». Защищает от болезней сердца.Высокий уровень, по-видимому, связан с низкой заболеваемостью ишемической болезнью сердца.
Глюкосев
Это показатель уровня сахара в крови. Высокий уровень может указывать на диабет. Низкий уровень может указывать на гипогликемию. Аномальные значения требуют дальнейшей оценки.
АМК (азот мочевины крови)
Этот тест оценивает функцию почек. Высокий уровень может указывать на заболевание почек, застойную сердечную недостаточность или тяжелые ожоги. Низкий уровень может указывать на диету с дефицитом железа.
Креатинин
Это фермент на основе белка. Высокие значения, особенно с высоким уровнем АМК, могут указывать на проблемы с почками или повреждение мышц. У людей с большой мышечной массой может быть повышенный уровень. Низкий уровень может указывать на заболевание печени или снижение мышечной массы.
BUN Creatinine Ratio
Математическая взаимосвязь этих двух величин. Это используется для постановки окончательного диагноза причины повышенного уровня азота мочевины и / или креатинина.
Натрий
Низкий уровень натрия может указывать на использование диуретиков или чрезмерное потребление воды у пациентов с заболеваниями сердца или печени.Высокий уровень может указывать на чрезмерное потребление натрия или заболевание почек.
Калий
Важен для правильного функционирования нервов и мышц, особенно сердца. Любое значение вне ожидаемого диапазона, высокое или низкое, требует медицинского обследования.
Хлорид
Важен для поддержания нормального уровня воды в организме. Хлорид обычно увеличивается или уменьшается в прямой зависимости от натрия.
Двуокись углерода
Укажите баланс натрия, калия, хлоридов и бикарбонатов в вашем организме.
Кальций
Высокий уровень может быть вызван приемом диуретиков или проблемами с почками. Низкий уровень кальция может быть связан с определенными нарушениями обмена веществ или применением диуретиков.
Всего белка
Это измерение может отражать состояние питания, заболевания почек, печени и многие другие состояния. Если общий белок является ненормальным, необходимо провести дальнейшие тесты, чтобы определить, какая фракция белка является ненормальной.
Альбумин и глобулин
Это показатель количества и типа белка в крови.Они являются общим показателем общего состояния здоровья и питания. Глобулин — это белок-«антитело», важный для борьбы с болезнями.
Соотношение альбумин / глобулин
Математическое соотношение между вышеуказанным.
Билирубин
Низкие значения не вызывают беспокойства. Высокие значения требуют дальнейшего обследования врачом из-за возможных проблем с печенью.
Щелочные фосфаты
Высокие значения могут указывать на повреждение костей или печени и требуют дальнейшей оценки.Низкие значения, вероятно, не имеют значения.
AST, ALT и щелочные фосфаты
Ферменты, которые помогают осуществлять все химические процессы в клетках. Аномальные результаты могут указывать на повреждение сердца или печени.
Объяснение полного анализа крови (CBC):
- Определение количества лейкоцитов (WBC) — Высокое содержание лейкоцитов может быть признаком инфекции или лейкемии. Низкий уровень белого может быть признаком заболевания костного мозга или увеличения селезенки.
- Анализ крови (RBC) — как высокие, так и низкие значения могут указывать на ненормальные условия и требовать дальнейших исследований.Высокий уровень может означать легочные (легкие) проблемы. Низкий уровень может указывать на анемию.
- Гемоглобин (Hgb) и гематокрит (Hct) — низкий уровень Hgb или Hct предполагает анемию. Высокий уровень Hgb может возникать из-за заболевания легких, проживания на большой высоте или чрезмерного производства клеток крови костным мозгом.
- Средний корпускулярный объем (MCV) — это расчет количества гемоглобина, переносящего кислород, внутри ваших эритроцитов. Высокие уровни могут не иметь значения. Низкий уровень может означать, что у вас недостаточно клеток, переносящих кислород, для снабжения вашего организма кислородом.
- Ширина распределения эритроцитов (RDW) — это расчет изменения размера ваших эритроцитов. Эта информация может использоваться для оценки степени тяжести некоторых анемий.
- Подсчет тромбоцитов (PLT) — помогает предотвратить кровотечение. Высокие значения могут возникать при кровотечении, курении сигарет или избыточной продукции костным мозгом. Низкие значения могут быть вызваны острой кровопотерей, инфекциями и лейкемией.
Существует пять различных типов белых кровяных телец, каждый из которых выполняет свою функцию по защите нас от инфекции.Дифференциал классифицирует лейкоциты человека по каждому типу: нейтрофилы, моноциты, эозинофилы и базофилы. Повышенный уровень может означать, что у вас есть или недавно была инфекция. Низкий уровень может указывать на низкую анемию Hgb и Hct.
Азот мочевины крови, уровень мочевины
Клиническое применение
BUN измеряет количество азота мочевины в кровь. Мочевина образуется в печени в виде конечный продукт белкового обмена и пищеварения. Мочевина откладывается в крови и транспортируется в почки с экскрецией. АМК служит показателем функции печени и почки. Пациенты с повышенным АМК уровни считаются азотемией или азотемией.
Почти все заболевания почек вызывают недостаточное выведение мочевина, которая вызывает повышение АМК. Поскольку синтез мочевины зависит от печени, тяжелое заболевание печени может вызвать снижение АМК. Следовательно АМК напрямую связано с метаболической функцией печени и выделительная функция почек.
АМК интерпретируется вместе с креатинином. тест.Эти тесты называются «исследования функции почек». В Соотношение АМК / креатинин является хорошим показателем функции почек и печени. Нормальный диапазон для взрослых — от 6 до 25, с 15,5 является оптимальным значением.
Повышенных уровней:
Преренальные причины:
- Гиповолемия, шок, ожоги, обезвоживание — со сниженным объем крови, почечный кровоток снижен. Следовательно, почечная экскреция BUN снижается, а уровни BUN повышаются.
- Застойная сердечная недостаточность, инфаркт миокарда — с снижение сердечной функции, почечный кровоток и уровни азота мочевины подъем.
- GI кровотечение, чрезмерное употребление белка (пищеварительная трубка кормление) — кровь или пищевые добавки перегружают кишечник белком. Мочевина образуется с большей скоростью, а АМК накапливается.
- Чрезмерный катаболизм белков и голодание — как белок расщепляется на аминокислоты с ускоренной скоростью, мочевина образуется более высокая ставка и БУН накапливается.
- Сепсис — по ряду причин почечный кровоток и основная функция почек снижена. БУЛОЧКА уровни повышаются.
Причины со стороны почек:
- Болезнь почек (e.г., гломерулонефрит, пиелонефрит, острый некроз канальцев), почечная недостаточность, нефротоксические препараты — первичная почечная все заболевания связаны со снижением выведения АМК.
Постренальная азотемия
- Обструкция мочеточника из-за камней, опухоли или врожденных аномалий, непроходимость выходного отверстия мочевого пузыря из-за гипертрофии или рака предстательной железы, или врожденные аномалии мочевого пузыря / уретры — причины нарушения оттока мочи снижение экскреции и повышение уровня азота мочевины.
Снижено уровней:
- Печеночная недостаточность — снижение функции печени связано с снижение уровня АМК.
- Гипергидратация из-за синдрома перегрузки жидкостью несоответствующая секреция антидиуретического гормона (SIADH) — BUN разжижается жидкостью перегрузка.
- Отрицательный азотный баланс (например, недоедание, мальабсорбция) — при истощении белков снижается выработка мочевины и поэтому АМК снижается.
- Беременность — ранняя беременность связана с повышенным задержка воды и разведение BUN.
- Нефротический синдром — этот синдром ассоциирован при потере белка с мочой.С белковое истощение, BUN снижается.
АМК / креатинин — Healthlabs.com
Анализ крови на соотношение АМК / креатинин используется для диагностики острого или хронического заболевания или повреждения почек. Его также можно использовать для определения желудочно-кишечного кровотечения или травмы. АМК (азот мочевины крови) и креатинин фильтруются почками и выводятся с мочой. Эти два показателя вместе используются для измерения общей функции почек.
Соотношение АМК / креатинин полезно при дифференциальной диагностике острого или хронического заболевания почек.Снижение перфузии почек, например, застойная сердечная недостаточность или недавнее начало обструкции мочевыводящих путей, приведет к увеличению отношения АМК / креатинин. Повышенное образование мочевины также приводит к увеличению соотношения, например, желудочно-кишечное кровотечение, травма и т. Д. Когда наблюдается снижение образования мочевины, как это наблюдается при заболевании печени, происходит уменьшение соотношения АМК / креатинин. В большинстве случаев хронического заболевания почек это соотношение остается относительно нормальным.
Что такое тест BUN?
A B lood U rea N itrogen ( BUN ) Тест измеряет количество азота в вашей крови и используется для предоставления врачам информации о том, насколько хорошо работают ваши почки и печень.Азот поступает из мочевины, которая превращается из азота и вырабатывается в печени, когда белок метаболизируется после еды. Затем здоровые почки фильтруют мочевину и удаляют другие отходы, такие как мочевина, при мочеиспускании. Некоторое количество мочевины в крови — это нормально, так как ваша печень всегда ее вырабатывает, но слишком большое количество мочевины может указывать на проблемы с вашими почками.
Что такое креатининовый тест?
Креатинин — это еще один тип молекулы, который образуется в результате метаболизма мышц.Как и мочевина, креатинин транспортируется через кровоток в почки, где он также фильтруется и выводится с мочой. Скорость образования креатинина зависит от мышечной массы человека. Поскольку мышечная масса остается стабильной, уровень креатинина остается практически неизменным в течение дня. Когда результаты теста на креатинин показывают его избыточное количество, это может указывать на нарушение функции почек или заболевание почек.
Что такое тест на соотношение АМК / креатинин?
После того, как человек выполнит и тест на АМК, и на креатинин, врачи могут использовать объединенные результаты для определения отношения АМК к креатинину.Сами по себе тесты на АМК и креатинин — отличные методы проверки здоровья печени и почек, но вместе врачи получают гораздо лучшее представление о вашем здоровье почек и могут поставить более точный диагноз для проблем, связанных с почками.
Зачем проходить тест на соотношение АМК / креатинин?
Основные причины пройти тест на соотношение АМК / креатинин — это оценка состояния почек, диагностика заболевания почек и контроль эффективности лечения, связанного с заболеванием или повреждением почек.Результаты теста на соотношение АМК / креатинин оказались одним из лучших способов диагностики острого или хронического заболевания почек, желудочно-кишечного кровотечения и закупорки мочевыводящих путей. Кроме того, этот тест практически не несет риска.
Что мне нужно знать заранее?
Тест АМК можно использовать для проверки серьезного обезвоживания, которое обычно вызывает повышение уровня АМК. Однако уровней креатинина нет, что означает, что выполнение теста на соотношение АМК / креатинин при обезвоживании может исказить результаты.Еще один фактор, который может повлиять на результаты АМК, — это потребление белка. Диеты с высоким содержанием белка могут вызывать аномально высокий уровень BUN, в то время как диеты с низким содержанием белка могут приводить к низким уровням BUN. Лучше всего получить должное количество жидкости и потреблять нормальное количество белка, прежде чем проходить тест на соотношение АМК / креатинин.
Как сдаются анализы?
Тестирование с Healthlabs так же просто, как и быстро. После того, как вы приобрели тест на АМК / креатинин и поехали в лабораторию, которую вы выбрали с помощью нашего средства поиска, лаборант выполнит простой анализ крови.Техник сначала осматривает вашу руку на предмет видимости вен, затем выбирает место для забора крови, очищает область антисептиком и оборачивает эластичную ленту вокруг вашего плеча, готовясь к забору крови. Он осторожно вводит в вену стерильную потребность и берет кровь. Весь процесс, в зависимости от загруженности лаборатории, должен занять около 5-10 минут.
Что означают ваши результаты теста на соотношение АМК / креатинин?
Соотношение АМК / креатинин определяется путем деления количества АМК на количество креатинина.Поскольку организм вырабатывает гораздо больше мочевины, чем креатинин, идеальное соотношение находится где-то между 10: 1 и 20: 1. Результаты, превышающие этот диапазон, означают, что в крови присутствует избыток азота мочевины, что может означать, что ваши почки не получают надлежащего кровотока. Чрезмерно высокое соотношение также может указывать на такие состояния, как застойная сердечная недостаточность, желудочно-кишечное кровотечение или сильное обезвоживание. Соотношение АМК / креатинин ниже рекомендованного диапазона может указывать на заболевание печени или недоедание.
Высокое соотношение мочевины и креатинина предсказывает долгосрочную смертность независимо от острого повреждения почек среди пациентов, госпитализированных с инфекцией
Долговременная смертность от всех причин выше у пациентов с неизлечимым ОПП
Мы изучили эффект острого повреждения почек и отношения мочевины к креатинину на долгосрочную смертность у 665 пациентов с инфекцией в отделении неотложной помощи, которые были живы на момент выписки из больницы (рис. 1). Средний балл по SIRS составил 2 (2–3, 95% ДИ), и 476 (72%) пациентов имели сепсис на основании критериев Sepsis-2.Всего у 14 (2%) был септический шок, а 21 пациент (3%) был госпитализирован в отделение интенсивной терапии (ОИТ). В течение средней продолжительности наблюдения 686 дней (664–713, 95% ДИ) после обращения в реанимацию в общей сложности 123 (18%) пациента умерли (таблица 1). Более половины пациентов имели частоту сердечных сокращений более 90 ударов в минуту (54%) и одна треть имели частоту дыхания более 20 ударов в минуту (34%), тогда как другие критерии ССВО выполнялись реже (таблица 1). ). Наиболее частым очагом инфекции были респираторные пути (31%), затем урогенитальные (19%) и абдоминальные инфекции (17%) (таблица 1).Хотя пациенты могут иметь более одного диагноза при обращении в отделение неотложной помощи, ни у одного из пациентов не было желудочно-кишечного кровотечения, которое, как известно, также увеличивает соотношение мочевины к креатинину. ОПП присутствовал у 130 пациентов (19%), у подавляющего большинства из которых при выписке из больницы вылечились ( n = 93, 72%) (Таблица 1). Чтобы оценить связь между преходящей и восстановленной ОПП и долгосрочной смертностью от всех причин, мы построили кривые выживаемости Каплана – Мейера для пациентов, стратифицированных по типу ОПП (рис.2). В отличие от преходящего ОПП, который не был связан с долгосрочной смертностью, неизлечимый ОПП был сильно связан с долгосрочной смертностью от всех причин, поскольку 13 из 37 (35%) пациентов с неизлечимым ОПП умерли во время наблюдения. по сравнению с 12 из 94 (13%) пациентов, выздоровевших от ОПН ( p <0,05, рис. 2). Таким образом, в отличие от преходящей ОПП, неизлечившаяся ОПП, которая наблюдалась у 6% пациентов с инфекцией ЭД, была связана с повышенной долгосрочной смертностью от всех причин.
Рисунок 1Блок-схема выбора пациента. Взрослые пациенты, посещавшие отделение неотложной помощи UMCG в период с марта 2016 г. по апрель 2018 г., были проверены на включение.
Таблица 1 Демографические и болезненные характеристики пациентов. Рисунок 2Выживаемость пациентов с острым повреждением почек и без него. Кривая выживаемости Каплана – Мейера для пациентов, страдающих инфекцией без ОПН, с преходящей ОПН или с неизлечимой ОПН. AKI острая травма почек.
Повышенное отношение мочевины к креатинину не является предиктором преходящего ОПП
Чтобы определить, связано ли повышенное отношение мочевины к креатинину при поступлении в отделение неотложной помощи с восстановлением ОПП во время госпитализации, пациенты были разделены на тертили в соответствии с их соотношению мочевина / креатинин (<61 n = 221, 61–84 n = 223 и> 84 n = 221; Таблица 1). Пациенты с более высоким соотношением мочевины и креатинина в среднем были старше, чаще использовали ингибиторы АПФ (ИАПФ), блокаторы рецепторов ангиотензина (БРА), калийсберегающие диуретики и петлевые диуретики (Таблица 1).Сопутствующие заболевания и очаг или тяжесть инфекции (то есть частота сепсиса, септического шока, показатель SIRS и количество госпитализаций в ОИТ) не различались между тертилями (таблица 1). У пациентов с высоким отношением мочевины к креатинину наблюдалось значительное повышение уровня мочевины в сыворотке по сравнению с ранее существовавшими значениями, в то время как уровни креатинина в сыворотке существенно не изменились при представлении ED по сравнению с исходными значениями (Таблица 2) . Пациенты с самым высоким отношением мочевины к креатинину имели более высокие уровни мочевины в сыворотке по сравнению с другими группами на исходном уровне, при поступлении в больницу и выписке.Важно отметить, что частота преходящей ОПП, не восстановленной ОПП и обоих типов ОПП вместе взятых не различалась между разными группами, стратифицированными в соответствии с уровнями мочевины к креатинину (Таблица 1). Многомерный бинарный логистический регрессионный анализ показал, что соотношение мочевины и креатинина не было связано с восстановлением функции почек в подгруппе пациентов, поступивших с ОПП ( n = 130, таблица 3). Напротив, более высокий показатель SIRS был связан с преходящим AKI (OR 1.55 [1,08–2,24, 95% ДИ], p = 0,02), при использовании калийсберегающих диуретиков (OR 0,27 [0,08–0,95, 95% CI], p = 0,04) или тиазидных диуретиков (OR 0,24 [0,08–0,75, 95% ДИ], p = 0,02) были связаны с невозможностью выздоровления от ОПП (неизлечимая ОПП) (Таблица 3). Чтобы проанализировать, какие элементы оценки SIRS были связаны с выздоровлением от AKI, мы отдельно ввели различные критерии SIRS в регрессионную модель. Из них только частота сердечных сокращений> 90 / мин была связана с восстановлением функции почек (OR 3.06 [1,02–9,13, 95% ДИ], p = 0,04; константа OR 1,21, p = 0,59; характеристики модели: χ 2 4,2, df 1, p <0,05). Следовательно, повышение отношения мочевины к креатинину не могло служить предиктором течения ОПП.
Таблица 2 Параметры функции почек. Таблица 3 Многопараметрический бинарный логистический регрессионный анализ факторов, связанных с восстановлением после острого повреждения почек в субпопуляции пациентов с острым повреждением почек.Пациенты с повышенным соотношением мочевины и креатинина имеют повышенный риск долгосрочной смертности от всех причин
Чтобы изучить, определяет ли повышенное соотношение мочевины и креатинина пациентов с риском долгосрочной смертности от всех причин, Мы стратифицировали пациентов по тертилям в соответствии с соотношением мочевины и креатинина, чтобы построить кривые выживаемости Каплана – Мейера и выполнить многомерный регрессионный анализ выживаемости Кокса. Показатель смертности от всех причин составил 32% среди пациентов с самым высоким соотношением мочевины и креатинина по сравнению с 12% среди пациентов с самым низким соотношением мочевины и креатинина в течение длительного периода наблюдения, составившего 605 человек (536–672). дней и 729 (687–760) дней соответственно (табл. 1).Повышенное соотношение мочевины и креатинина было связано с долгосрочной смертностью от всех причин как среди пациентов с ОПП, так и без них ( p <0,01, рис. 3a, b). Также после корректировки отношения мочевины к креатинину для не восстановленного ОПН, преходящего ОПН, возраста, пола, сопутствующих заболеваний (например, сахарного диабета, сердечно-сосудистых заболеваний, хронических заболеваний почек, злокачественных новообразований), показателя SIRS, септического шока и относительного изменения в креатинине и мочевине по сравнению с исходным уровнем соотношение мочевина / креатинин оставалось сильно и независимо связанным с долгосрочной смертностью от всех причин (HR 2.00 [1,37–2,91, 95% ДИ], p <0,01, таблица 4). Другими факторами риска, предсказывающими долгосрочную смертность от всех причин, были возраст (ОР 1,32 [1,18–1,47, 95% ДИ] на 10 лет, p <0,01), злокачественные новообразования (ОР 2,31 [1,61–3,32, 95% ДИ] , p <0,01) и невосстановленный AKI (HR 1,86 [1,03–3,33, 95% CI], p = 0,04), в то время как женский пол (HR 0,49 [0,33–0,45, 95% CI], p <0,01) было связано с более низким риском смертности. Таким образом, повышенное соотношение мочевины и креатинина даже сильнее связано с долговременной смертностью, чем неизлечимая ОПП.Более того, в отличие от невосстановленного AKI, соотношение мочевины и креатинина может быть определено уже при обращении в ED.
Рисунок 3Соотношение мочевины и креатинина и долгосрочный риск смертности с острым повреждением почек и без него. Кривая выживаемости Каплана – Мейера отношения мочевины к креатинину при поступлении в больницу среди пациентов с ОПП ( A ) и без ОПП ( B ).

