Щелочная фосфатаза – фактор прогноза летальности при гемодиализе
Щелочная фосфатаза — фактор прогноза летальности при гемодиализе
Высокие показатели щелочной фосфатазы (ЩФ) — маркера, традиционно оцениваемого при заболеваниях костей, могут быть сигналом повышенной вероятности смерти среди пациентов, находящихся на диализе по поводу хронических болезней почек, сообщают американские ученые. В исследовании приняли участие 73 960 пациентов, которым регулярно проводят гемодиализ в течение последних трех лет. Оказалось, что у пациентов с повышенными показателями ЩФ смертность на 25% больше по сравнению с больными с нормальными значениями этого маркера. В этом большом эпидемиологическом исследовании наглядно продемонстрировано существование выраженной связи между высоким уровнем в крови ЩФ и сердечно-сосудистой смертностью среди тысяч пациентов, находящихся на гемодиализе в США, сообщает доктор Камяр Калантар-Задех из Калифорнийского университета в Лос-Анджелесе, США.
Regidor DL, Kovesdy CP, Mehrotra R et al.Serum Alkaline Phosphatase Predicts Mortality among Maintenance Hemodialysis Patients. J Am Soc Nephrol. 2008 Jul 30.
У женщин с синдромом поликистозных яичников повышен уровень гомоцистеина
Принципиально, что это увеличение связано с уровнем инсулина сыворотки, а не с избытком андрогенов. Проведено обсервационное исследование типа случай-контроль, в которое включили 94 женщины с диагнозом бесплодие. У пациенток с синдромом поликистозных яичников (СПКЯ) и у пациенток без СПКЯ (группа контроля) определяли корреляцию между уровнями сывороточного гомоцистеина, возрастом, индексом массы тела, гормональным профилем, уровнем инсулина, глюкозы, показателями глюкозо-толерантного теста и резистентности к инсулину. Показано, что средние показатели уровня глюкозы в плазме натощак, уровня инсулина и резистентность к инсулину были достоверно выше у женщин с СПКЯ, чем в контрольной группе. Была выявлена положительная корреляция между средним уровнем гомоцистеина и индексом резистентности к инсулину. Таким образом, у женщин с СКПЯ уровень гомоцистеина в сыворотке крови повышен и это связано с уровнем инсулина сыворотки, а не с уровнем андрогенов. Предполагается, что снижение гипергомоцистеинемии у женщин с СПКЯ могло бы улучшить их репродуктивное здоровье и способствовать защите от сердечнососудистых рисков.
У пациенток с синдромом поликистозных яичников (СПКЯ) и у пациенток без СПКЯ (группа контроля) определяли корреляцию между уровнями сывороточного гомоцистеина, возрастом, индексом массы тела, гормональным профилем, уровнем инсулина, глюкозы, показателями глюкозо-толерантного теста и резистентности к инсулину. Показано, что средние показатели уровня глюкозы в плазме натощак, уровня инсулина и резистентность к инсулину были достоверно выше у женщин с СПКЯ, чем в контрольной группе. Была выявлена положительная корреляция между средним уровнем гомоцистеина и индексом резистентности к инсулину. Таким образом, у женщин с СКПЯ уровень гомоцистеина в сыворотке крови повышен и это связано с уровнем инсулина сыворотки, а не с уровнем андрогенов. Предполагается, что снижение гипергомоцистеинемии у женщин с СПКЯ могло бы улучшить их репродуктивное здоровье и способствовать защите от сердечнососудистых рисков.
J Obstet Gynaecol Res. 2008.
Щелочная фосфатаза в крови. Норма, повышение.
 Активность
АктивностьЩелочная фосфатаза — это фермент. Он присутствует в клетках внутренних органов. Преобладает в печени, костной ткани. Надо отметить такой факт, что в слизистой кишечника, плаценте в период беременности и молочных железах содержится большая доза данного фермента.
Роль фермента
Следует подчеркнуть активное участие щелочной фосфатазы в обмене фосфорной кислоты. В данном процессе происходит ее расщепление от органических соединений. Фермент способствует транспортировке фосфора по всему организму.
Многих интересует вопрос о том, какая норма должна щелочной фосфатазы. Что касается мужчин, то следует ориентироваться на показатель 270 единиц на литр. У женщин наблюдается меньший уровень — 240. Поскольку данный фермент оказывает влияние на рост костей, то этот момент отображается на его количестве у детей. Оказывается, у растущего организма фермента больше.
Необходимость анализа
Если надо диагностировать болезни почек, печени, желчного протока и костной системы, обязательно выполняют анализ на щелочную фосфатазу. При повышенном показателе данного фермента врачи могут диагностировать определенные недуги:
При повышенном показателе данного фермента врачи могут диагностировать определенные недуги:
- рахит;
- лимфогранулематоз;
- миеломную болезнь;
- мононуклеоз;
- опухоли костной ткани и ее болезни;
- заболевания печени;
- опухоли желчного протока;
- гиперпаратиреоз.
Следует обратить внимание, что щелочная фосфатаза повышается в период беременности, по окончании климакса, в случае дефицита в пищевых продуктах кальция, фосфатов. Также бывает повышение данного фермента в крови, если произошла передозировка аскорбиновой кислоты, либо люди принимали определенные лекарства. К примеру, антибиотики, оральные противозачаточные средства, в составе которых есть прогестерон и эстроген.
Уровень щелочной фосфатазы может быть пониженным, хотя встречается реже, чем повышенный. Если анализ крови показал, что содержание фермента ниже нормы, то это свидетельствует о таких недугах:
- малокровие;
- авитаминоз;
- гипотиреоз;
- нарушения роста костей.

Кроме того, прием некоторых лекарственных средств понижает щелочную фосфатазу. Также ее активность снижается в период вынашивания ребенка, когда недостаточно развита плацента.
Если возникла необходимость сделать анализ крови на щелочную фосфатазу либо полный биохимический анализ крови, обращайтесь в медцентр «Евромедпрестиж». Здесь можно пройти комплексное обследование у высококлассных специалистов. Современный центр всегда к вашим услугам. У нас выполняют различные анализы. Приходите в любое удобное для вас время. Принимаем без записи и очередей.
Щелочная фосфатаза!
1.Щелочная фосфатаза
Щелочная фосфатаза, сокращённо ЩФ, измеряется при анализе крове. Щелочная фосфатаза – это особый фермент, который вырабатывается в основном в печени
При некоторых условиях щелочная фосфатаза повышена. В эти условия входит повышенный рост костей во время пубертатного периода, заболевания костей (деформирующий остоз), недостаток витамина D и повреждённая печень.
Если уровень щелочной фосфатазы повышен, то проводятся дополнительные тесты, чтобы выяснить причину. Разные виды щелочной фосфатазы в крови могут быть измерены одновременно, чтобы выяснить причину ее повышенной концентрации. Такой тест называется фосфатазным изоферментым анализом.
Зачем проводить анализ щелочной фосфатазы крови?
Анализ щелочной фосфатазы в крови проводится для того, чтобы:
- Проверить здоровье печени. Симптомы болезней печени включают в себя желтуху, боль в животе, тошноту и рвоту.
- Проверить здоровье костей. Анализ щелочной фосфатазы в крови позволяет выявить рахит, рак костей, деформирующий остоз, повышенное содержание гормона роста. Щелочная фосфатаза также может показать, насколько хорошо проходит лечение перечисленных болезней.

2.Как подготовиться к анализу?
Анализ щелочной фосфатазы в крови может проводиться вместе с другими анализами крови. Ваш доктор может попросить вас не есть и не пить за 10 часов до взятия крови, т.к. уровень щелочной фосфатазы в крови возрастает после еды, особенно жирной.
Многие лекарственные препараты могут повлиять на уровень щелочной фосфатазы в крови. Поэтому расскажите своему доктору обо всех препаратах, которые вы принимаете, в том числе и о средствах народной медицины.
3.Как проводится анализ и риски анализа
Как проводится анализ щелочной фосфатазы крови?
Анализ щелочной фосфатазы крови проводится после взятия крови из вены. Забор крови из вены проводится по стандартной процедуре.
Риски анализа щелочной фосфатазы крови
Если вы сдаёте кровь на анализ щелочной фосфатазы в крови, то возможные риски могут быть связаны только с забором крови из вены.
4.Что может повлиять на анализ щелочной фосфатазы крови?
Причины, по которым вы можете получить неточный результат анализа:
- Приём препаратов, влияющих на печень: антибиотики, противозачаточные средства, долгое использование аспирина, лекарства от диабета;
- Менопауза. У женщин, у которых уже наступила менопауза, уровень щелочной фосфатазы повышен;
- Возраст. У детей уровень щелочной фосфатазы повышен, т.к. у них быстро растут кости;
- Злоупотребление алкоголем.
О чём стоит знать?
Если уровень щелочной фосфатазы повышен, то понадобятся другие тесты для выяснения причин её высокой концентрации.
Если анализ щелочной фосфатазы в крови проводится для того, чтобы определить состояние печени, то, как правило, анализ крови на аланинаминотрансферазу, АСТ и билирубин проводится в то же время.
Щелочная фосфатаза повышенная
Щелочная фосфатаза – группа ферментов, которые содержатся во всех тканях организма, преимущественно локализующихся в печени, костях и плаценте.
Норма щелочной фосфатазы в крови женщины – до 240 Ед/л, мужчины – до 270 ЕД/л. Повышенная щелочная фосфатаза у детей является следствием высокой активности процессов костеобразования.
Уровень фосфатазы определяется при биохимическом анализе крови во время диагностики заболеваний, печени, почек, желчевыводящих путей и костной системы.
Если при биохимическом анализе крови щелочная фосфатаза повышена, у пациента могут быть диагностированы следующие заболевания:
— Гиперпаратиреоз;
— Рахит;
— Заболевания печени;
— Миеломная болезнь;
— Опухоль желчевыводящих путей;
— Инфекционный мононуклеоз;
— Заболевания костной ткани.
Выделяют несколько групп причин повышенной щелочной фосфатазы.
К первой группе относятся заболевания печени, такие как желтуха, вызванная желчнокаменной болезнью, цирроз печени, гепатит, инфекционный мононуклеоз, рак желудка, печени или поджелудочной железы.
Повышенная щелочная фосфатаза в крови может свидетельствовать об изменениях костной ткани. К этой группе относятся следующие заболевания: остеомаляция, рахит, миеломная болезнь, остеосаркома, болезнь Педжета, а также метастазы, затрагивающие костную ткань.
Третью группу составляют другие причины, например, инфаркт миокарда или язвенный колит.
К четвертой группе относятся причины, не связанные с какими-либо заболеваниями. Повышенный уровень щелочной фосфатазы может возникнуть из-за беременности. Повышенная щелочная фосфатаза при беременности является нормальным явлением, т.к. фосфатаза в большом количестве содержится в плаценте. Повышение фосфатазы в крови происходит в последнем триместре.
Уровень фосфатазы может подниматься при нехватке кальция и фосфатов, передозировке витамина С, а также из-за приема лекарственных средств, например, оральных контрацептивов или антибиотиков.
Лечение при повышенной щелочной фосфатазе нацелено на выявление и устранение причины, которая повлияла на изменение ее уровня. Для этого проводится более тщательная диагностика, включающая в себя необходимые анализы и исследования.
Щелочная фосфатаза повышена: причины у ребенка
Что значит, если щелочная фосфатаза повышена, причины у ребенка? Щелочная фосфатаза, а точнее, ее показатели в организме человека много значат, так как благодаря им удается определить наличие у пациента того или иного заболевания – особенно важно проводить такой анализ детям, чтобы исключить развитие опасных патологий. Если показатели щелочной фосфатазы повышены у ребенка – это вызывает волнение у многих родителей. Поэтому если вам сделали анализ крови и определили высокий уровень ЩФ в крови – это означает, что в организме ребенка происходит развитие определенной болезни, от которой нужно быстро избавляться. Также повышенная фосфатаза гласит о нарушении работы органов. За что отвечают данные показатели и как можно понизить их уровень?
О чем говорит анализ
Щелочная фосфатаза – это группа жизненно важных ферментов, которые содержатся практически во всех тканях организма человека. Больше их располагается в костной ткани, желчных протоках и остеобластах. Также немалое количество ферментов можно наблюдать в слизистой оболочке кишечника, где она во время пищеварения может вырабатываться в небольшом количестве. Однако это не считается ее основной функцией в организме (поддержание пищеварения) – данные ферменты способствуют отщеплению фосфорной кислоты, которая важна для организма для защиты внутренних органов от опасных органических соединений.
Больше их располагается в костной ткани, желчных протоках и остеобластах. Также немалое количество ферментов можно наблюдать в слизистой оболочке кишечника, где она во время пищеварения может вырабатываться в небольшом количестве. Однако это не считается ее основной функцией в организме (поддержание пищеварения) – данные ферменты способствуют отщеплению фосфорной кислоты, которая важна для организма для защиты внутренних органов от опасных органических соединений.
Кроме того, это вещество разносит фосфор по всему организму, насыщая им ткани и органы. При наличии нарушений такой слаженной работы, фосфатаза щелочная понижается или повышается, что ведет к сбою работы всех систем – особенно это состояние опасно для ребенка, поэтому родители должны сразу принимать меры.
Признаки повышения щелочной фосфатазы бывают разными, поэтому стоит обращать внимание на каждый из них.
Наиболее явными и выраженными из них можно назвать:
- высокая температура;
- апатия;
- слабость;
- отсутствие аппетита;
- ломота в костях;
- вялость.

Также ребенок будет малоразговорчив и плаксив, так как такое состояние будет негативно действовать на общее самочувствие. При малейших признаках повышения ЩФ рекомендуется посетить врача, который назначит анализ крови и определит – повышена щелочная фосфатаза или нет. Если показатели окажутся нормальными, врач быстро определит причину такого состояния у ребенка, если же будут повышенными – вам придется пройти еще ряд анализов, после чего можно будет выявить причину этого явления. Как только заболевание будет выявлено, ребенку назначат лечение, которое быстро вернет в норму показатели ЩФ.
Щелочная фосфатаза в крови с возрастом меняется, поэтому не следует зацикливаться на одном ее показателе. С каждым годом роста малыша нормальные результаты будут немного увеличиваться, что также будет являться нормой. Проводить их расшифровку обязан только врач.
Нормальные показатели щелочной фосфатазы у детей
youtube.com/embed/udaKrUvjHOg» src=»data:image/gif;base64,R0lGODlhAQABAAAAACH5BAEKAAEALAAAAAABAAEAAAICTAEAOw==»/>
Увеличение результатов анализов не всегда гласит о развитии заболевания – возможно у ребенка произошло нарушение в работе организма и его нужно быстрее выявить.
Нормальными показателями щелочной фосфатазы в крови ребенка можно назвать:
- сразу после рождения результаты будут варьироваться в пределах 250 единиц на литр крови;
- спустя 5 суток после рождения они снизятся до 231 единицы;
- до 6 месяца развития малыша нормой будет считаться показатель 449 единицы на литр крови;
- с 6 месяцев до 1 года оптимальный уровень составит 462 ед/л;
- до 3 лет показатели немного снизятся до 281 единицы;
- с 4 до 6 лет уровень ЩФ в крови составит 269 ед/л;
- до 12-летнего возраста нормой считается 300 единиц;
- по достижению 17 лет показатели снова увеличиваются: у мальчиков нормой является 390 единиц, у девочек 187.

Важно отметить, что эти показатели могут немного «прыгать» в большую и меньшую сторону, но не более чем на 10 единиц. Если результаты сильно увеличены, это также может говорить о методе исследования или используемых для анализа реагентов. Однако в таком случае лучше поговорить с врачом о самочувствии ребенка, чтобы вовремя определить развитие опасных болезней, скрыто протекающих в организме.
Какие болезни появляются в результате увеличенных показателей фосфатазы
Проведение такого теста, в первую очередь, оценивает состояние печени и процесс поступления желчи в ЖКТ, ведь именно в таком случае показатели фосфатазы сильно повышены, что говорит о развитии опухолей, появлении камней в желчных путях, а также развитии нарушения работы печени.
Также врач может поставить и другой диагноз ребенку:
- заболевания костей, к которым также относится опухоль или появление метастаз;
- цитомегалия;
- гиперпаратиреоз;
- кишечные инфекции;
- миеломная болезнь.

Немалое значение анализ крови и определение уровня щелочной фосфатазы играет при выявлении рахита, так как его симптомы начинают атаковать организм уже при запущенной форме болезни.
Важно: как говорят врачи, повышение уровня ЩФ бывает естественное или по-другому физиологическое. Оно возникает в результате высокого уровня в крови сыворотки и наблюдается у слабых и недоношенных детей, а также у подростков во время полового созревания.
При приеме определенной группы лекарств, которые способны вызвать гепатотоксическое действие, также можно заметить повышение щелочной фосфатазы.
Но не только высокие показатели данного фермента несут за собой опасность – низкий уровень щелочной фосфатазы тоже несет опасность для здоровья ребенка. Такое состояние говорит о нарушении роста и развития костей и костной ткани, недостатке в организме микроэлементов (цинк, магний, железо), пониженном количестве витамина C и В12, развитии анемии и гипотиреоза.
В данном случае лечение также нужно проводить в срочном порядке, ведь пониженные показатели ЩФ не дают системам и органам полноценно работать, что сказывается на общем состоянии организма и самочувствии ребенка.
Как можно снизить показатели
Чтобы быстро и без вреда для организма снизить показатели щелочной фосфатазы в крови, нужно начать комплексное лечение основного заболевания, которое и вызвало повышение результатов теста. При этом лечение должно обязательно контролироваться врачом, так как в таком случае нередко возникает ухудшение состояния ребенка, особенно, если его регулярно не осматривает врач.
В комплексное лечение входит:
- прием препаратов;
- правильное питание;
- уменьшение физических нагрузок;
- частые прогулки;
- прием витаминов и биологических добавок.
Важно: нормализовать уровень щелочной фосфатазы при помощи народных методов не получится, поэтому не следует принимать народные рецепты, потому что так можно значительно ухудшить состояние ребенка.
Стоит отметить, что у детей показатели фосфатазы всегда несколько выше, чем у взрослых. Нередко увеличение результатов говорит о развитии опасных для здоровья патологий печени, которые нуждаются в срочном лечении.
Поэтому важно вовремя делать анализ крови и не затягивать с визитом к врачу – только в этом случае ребенку удастся быстро выздороветь и не приобрести серьезные осложнения в результате повышенного уровня фосфатазы в крови.
Биохимический анлиз крови: щелочная фосфатаза
Биохимия крови: Щелочная фосфатаза
Щелочная фосфатаза — это фермент, присутствующий в каждом органе и ткани человеческого организма и участвующий в процессах обмена фосфорной кислоты. Этот фермент располагается на поверхности клеточных мембран, ее активность возрастает при развитии целого ряда патологических процессов – заболеваний почек, печени, желчного пузыря, костной ткани, злокачественных новообразованиях. Биохимическое исследование щелочной фосфатазы необходимо для диагностирования этих заболеваний, контроля за активностью патологического процесса и мониторинга проводимого лечения.

Наибольшее количество щелочной фосфатазы синтезируют печень, желчные протоки, кишечник, легкие, костные клетки, эндометрий. Фосфатазы играют значительную роль в формировании костной ткани — поэтому их концентрация у детей немного больше, чем у взрослых людей. При патологических процессах в костях происходит увеличение концентрации щелочной фосфатазы, что способствует скорейшему восстановлению костной ткани.
Функция печени также зависит от уровня содержания в ее клетках фосфатаз, которые участвуют в ряде биохимических процессов. При разрушении печеночных клеток, все ферменты попадают в кровяное русло, этот процесс характеризуется повышением активности щелочной фосфатазы. Ферментативная активность наблюдается при процессах, препятствующих оттоку желчи (холестазе) и образовании опухолей. Исследование уровня содержания щелочной фосфатазы используют для своевременного определения развития патологий.
Кому и когда специалист может назначить обследование?
Анализ щелочной фосфатазы является частью стандартной комплексной диагностической панели («печеночных проб»), которая используется опытными специалистами – эндокринологом, инфекционистом, терапевтом, гастроэнтерологом, гематологом, хирургом:- в рамках плановых профилактических осмотров;
- при подготовке больного к операции;
- при признаках поражения костной ткани — частые переломы и деформации костей.

- слабости, усталости;
- потери аппетита;
- тошноты и рвоты;
- болей в области правового подреберья;
- желтушности кожных покровов и склер;
- кожного зуда;
- кала светлого цвета и мочи темного насыщенного цвета.
Методика проведения анализа
Биоматериал для исследования щелочной фосфатазы является сыворотка крови, забор производят из вены в кабинете медицинских манипуляций.
Рекомендации для пациента:
- Накануне исключить эмоциональное и физическое напряжение.
- Ужинать до 20 часов, запрещено спиртное.
- Утром не курить и не завтракать.
Расшифровка данных анализа
Таблица 1. Нормальная концентрация щелочной фосфатазы
| № | Возраст | Норма для женщин, Ед/л | Норма для мужчин, Ед/л |
| 1. | До 1 года | 120 — 340 | 80 — 380 |
| 2. | До 3-х лет | 105 — 315 | 103 — 343 |
| 3. | До 6 лет | 95 — 295 | 91 — 306 |
| 4. | До 10 лет | 50 — 330 | 40 — 360 |
5. | До 15 лет | 51 — 161 | 73 — 388 |
| 6. | До 18 лет | 45 — 115 | 50 — 170 |
| 7. | Взрослые | 30 — 120 | 35 — 130 |
Повышение фосфатазы характерно для:
- рахита;
- остеодистрофии;
- опухолей костной ткани, печени и желчных протоков, легких;
- лимфогранулематоза;
- гиперпаратиреоза;
- миеломной болезни;
- инфаркта почки;
- цирроза, гепатита;
- дефицита фосфора и кальция.
Понижение щелочной фосфатазы свидетельствует о:
- гипервитаминозе С или Д;
- гипотиреозе;
- дефиците цинка и магния;
- остеопорозе.

Биохимический анализ крови на щелочную фосфатазу общую
Диагностическое направление
Функциональное состояние организма
Общая характеристика
Катализирует гидролиз сложных эфиров фосфорной кислоты и органических соединений. Самая высокая концентрация ЩФ обнаруживается в костной ткани (остеобластах), гепатоцитах, клетках почечных канальцев, слизистой кишечника и плаценте. ЩФ участвует в процессах, связанных с ростом костей, поэтому активность ее в сыворотке детей выше, чем у взрослых. Патологическое повышение активности ЩФ в сыворотке связано, в основном, с заболеваниями костей (формированием костной ткани) и печени (обструкцией желчных протоков). У недоношенных, детей в период активного роста, беременных (третий триместр) может наблюдаться повышенная физиологическая активность ЩФ.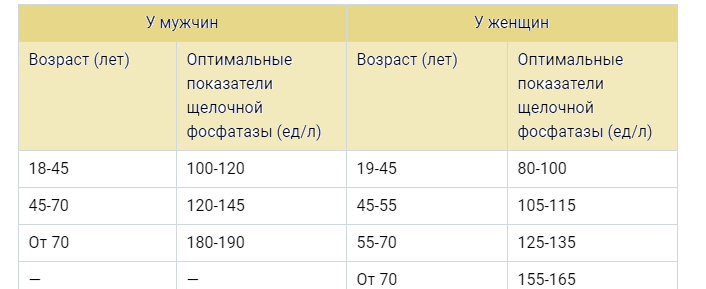
Показания для назначения
1. Диагностика заболеваний костной системы (остеопороз, дегенеративно-дистрофические процессы, новообразования и др.).2. Заболевания печени и желчевыводящих путей, почек.
Маркер
Маркер нарушений функции печени, костной ткани.
Клиническая значимость
Диагностика и лечение заболеваний печени, костей, кишечника и паращитовидных желез.
Состав показателей:
Щелочная фосфатаза общая
Метод: СпектрофотометрическийДиапазон измерений: 0-6600
Единица измерения: Единиц на литр
Референтные значения:
Возраст
Комментарии
0 Д — 2 Д
2 Д — 6 Д
6 Д — 7 М
Выполнение возможно на биоматериалах:
Биологический материал
Условия доставки
Контейнер
Объем
Сыворотка
Условия доставки:
24 Час. при температуре от 2 до 25 градусов Цельсия
при температуре от 2 до 25 градусов Цельсия
Контейнер:
Вакутейнер с разделительным гелем
Объем:
8.5 Миллилитров
Капиллярная кровь
Условия доставки:
24 Час. при температуре от 2 до 25 градусов Цельсия
при температуре от 2 до 25 градусов Цельсия
Контейнер:
Микровет с активатором свертывания крови
Объем:
500 Микролитр
Правила подготовки пациента
Стандартные условия: Утром до 11. 00, строго натощак, через 8-12 часов периода голодания.Возможно: В течение рабочего дня МЛ «ДІЛА», если имеются особые указания врача.Перерыв не менее 6 часов после приема пищи (должна быть исключена жирная пища).
00, строго натощак, через 8-12 часов периода голодания.Возможно: В течение рабочего дня МЛ «ДІЛА», если имеются особые указания врача.Перерыв не менее 6 часов после приема пищи (должна быть исключена жирная пища).
Вы можете добавить данное исследование в корзину на этой странице
Интерференция:
- Гепатотоксичные лекарственные препараты.
- Азатиоприн, клофибрат, даназол, эстрогены, перороальные контрацептивы.
Интерпретация:
- Повышенный метаболизм в костной ткани (заживление переломов, гиперпаратиреоз, остеомаляция, ювенильный рахит), метастазы рака в кости, остеогенная саркома, миеломая болезнь, лимфогранулематоз с поражением костей, болезнь Гоше, болезнь Педжета, синдром Кушинга, уремическая остеодистрофия, заболевания почек («почечный рахит»,), заболевания печени (инфекционный мононуклеоз, цитомегаловирусная инфекция у детей, холангит, гепатоцеллюлярный некроз, портальный цирроз, гепатиты и др.
 ), кишечные бактериальные инфекции, тиреотоксикоз.
), кишечные бактериальные инфекции, тиреотоксикоз. - Гипотиреоз, цинга, анемия, гипофосфатаземия, пернициозная анемия.
Для вывода актуальных данных для вашего региона
Скачайте наши приложениядля iOS и Android
Регулирование активности почвенной фосфатазы и хитиназы по доступности N и P в JSTOR
Почвенные микроорганизмы и растения вырабатывают ферменты, которые минерализуют органически связанные питательные вещества. Когда доступность питательных веществ низкая, биота может увеличивать производство этих ферментов, чтобы увеличить поступление неорганического азота (N) и фосфора (P). Регулирование производства ферментов может быть точкой взаимодействия N- и P-циклов. Мы измерили активность кислой фосфатазы и хитиназы (N-ацетил-β-D-глюкозаминида) в почве в хронологической последовательности на Гавайях, где доступность азота и фосфора существенно различается между участками, а участки для внесения удобрений на длительный срок поддерживались более 4 лет.Активность фосфатазы была высокой на всех участках. Активность хитиназы значительно снижалась с возрастом и доступностью азота по хронопоследовательности. Добавление фосфора подавляло активность фосфатазы на всех участках, в то время как добавление N увеличивало активность фосфатазы на молодом, ограниченном по N участку. Напротив, добавление N подавляло активность хитиназы только в ограниченном N молодом сайте, а добавление P не влияло на активность хитиназы.
Когда доступность питательных веществ низкая, биота может увеличивать производство этих ферментов, чтобы увеличить поступление неорганического азота (N) и фосфора (P). Регулирование производства ферментов может быть точкой взаимодействия N- и P-циклов. Мы измерили активность кислой фосфатазы и хитиназы (N-ацетил-β-D-глюкозаминида) в почве в хронологической последовательности на Гавайях, где доступность азота и фосфора существенно различается между участками, а участки для внесения удобрений на длительный срок поддерживались более 4 лет.Активность фосфатазы была высокой на всех участках. Активность хитиназы значительно снижалась с возрастом и доступностью азота по хронопоследовательности. Добавление фосфора подавляло активность фосфатазы на всех участках, в то время как добавление N увеличивало активность фосфатазы на молодом, ограниченном по N участку. Напротив, добавление N подавляло активность хитиназы только в ограниченном N молодом сайте, а добавление P не влияло на активность хитиназы. Эти результаты предполагают, что регуляторная взаимосвязь между поставкой питательных веществ и минерализацией питательных веществ асимметрична для азота и фосфора, и что различия могут помочь объяснить различия, наблюдаемые в моделях доступности азота и фосфора.
Эти результаты предполагают, что регуляторная взаимосвязь между поставкой питательных веществ и минерализацией питательных веществ асимметрична для азота и фосфора, и что различия могут помочь объяснить различия, наблюдаемые в моделях доступности азота и фосфора.
Biogeochemistry публикует оригинальные статьи и периодические обзоры
имея дело с биотическим контролем над химией окружающей среды, или с
геохимический контроль структуры и функций экосистем. Циклы
рассматриваются либо отдельные элементы, либо отдельные классы природных
или антропогенные соединения в экосистемах. Особый упор делается на
взаимодействия циклов элементов. Освещены глобальные аспекты биогеохимии.
в виде работы над глобальным циклом углерода и серы, например, и
исследования как естественных, так и искусственных экосистем публикуются, когда они вносят свой вклад
к общему пониманию биогеохимии.Biogeochemistry — важный международный журнал, посвященный
тема, актуальная в настоящее время. Импакт-фактор: 2,125 (2004 г.)
Раздел «Науки об окружающей среде»: 17 место из 134
Раздел «Науки о Земле»: 16 место из 128.
Импакт-фактор: 2,125 (2004 г.)
Раздел «Науки об окружающей среде»: 17 место из 134
Раздел «Науки о Земле»: 16 место из 128.
Springer — одна из ведущих международных научных издательских компаний, издающая более 1200 журналов и более 3000 новых книг ежегодно, охватывающих широкий круг предметов, включая биомедицину и науки о жизни, клиническую медицину, физика, инженерия, математика, компьютерные науки и экономика.
Регулирование активности фосфатазы и хитиназы почвы по наличию азота и фосфора
Адамс М.А. (1992) Активность фосфатазы и фракции фосфора в Karri Eucalyptus diversicolor F.Muell. лесных почв. Биол. Fertil. почв 14: 200–204
Google ученый
Амадор Дж. А., Глюксман А. М., Лион Дж. Б. и Горрес Дж. Х. (1997) Пространственное распределение активности фосфатазы почвы в прибрежных лесах.Почвоведение. 162 (11): 808–825
А., Глюксман А. М., Лион Дж. Б. и Горрес Дж. Х. (1997) Пространственное распределение активности фосфатазы почвы в прибрежных лесах.Почвоведение. 162 (11): 808–825
Google ученый
Бонмати М., Чекканти Б. и Наннипери П. (1991) Пространственная изменчивость фосфатазы, уреазы, протеазы, органического углерода и общего азота в почве. Soil Biol. Biochem. 23 (4): 391–396
Google ученый
Bray RH & Kurts LT (1945) Определение общего содержания, органических и доступных форм фосфора в почвах. Почвоведение.59: 39–45
Google ученый
Бремнер Дж. М. и Кини Д. Р. (1966) Определение и анализ изотопного соотношения различных форм азота в почвах: 3. Обменный аммоний, нитрат и нитрит методами экстракции-дистилляции. Почвоведение. Soc. Амер. Proc. 30: 577–582
Р. (1966) Определение и анализ изотопного соотношения различных форм азота в почвах: 3. Обменный аммоний, нитрат и нитрит методами экстракции-дистилляции. Почвоведение. Soc. Амер. Proc. 30: 577–582
Google ученый
Бернс Р.Г. (1982) Активность ферментов в почве: расположение и возможная роль в микробной экологии.Soil Biol. Biochem. 14: 423–427
Google ученый
Clarholm M (1993) Микробная биомасса P, лабильный P и активность кислой фосфатазы в гумусовом слое елового леса после многократного внесения удобрений. Биол. Fertil. почв 16: 287–292
Google ученый
Crews TE, Kitayama K, Fownes JH, Riley RH, Herbert DA, Mueller-Dumbois D & Vitousek PM (1995) Изменения фракций фосфора в почве и динамики экосистем в длинной хронопоследовательности на Гавайях. Экология 76 (5): 1407–1424
Экология 76 (5): 1407–1424
Google ученый
Дик Р.П., Расмуссен П.Е. и Керле Е.А. (1988). Влияние долгосрочной обработки пожнивных остатков на ферментативную активность почвы в зависимости от химических свойств почвы в системе пшеничный пар. Биол. Fertil. почв 6: 159–164
Google ученый
Дик Р.П., Сандор Дж. А. и Иаш Н. С. (1994) Активность ферментов почвы после 1500 лет террасного земледелия в долине Колка, Перу.Сельское хозяйство, экосистемы и окружающая среда 50: 123–131
Google ученый
Duff SMG, Sarath G & Plaxton WC (1994) Роль кислых фосфатаз в метаболизме фосфора растений. Physiologia Plantarum 90: 791–800
Physiologia Plantarum 90: 791–800
Google ученый
Frossard E, Brossard M, Hedley MJ и Metherell A (1995). Реакции, контролирующие круговорот фосфора в почвах. В: Tiessen H (Ed) Фосфор в глобальной окружающей среде (стр 107–137).John Wiley & Sons Ltd., Чичестер
Google ученый
Gooday GW (1994) Физиология и микробное разложение хитина и хитозана. В: Ratledge C (Ed.) Биохимия микробной деградации (стр 279-312). Kluwer Academic Publishers, Дордрехт, Нидерланды
Google ученый
Харрисон Ф.А. (1983) Взаимосвязь между интенсивностью активности фосфатазы и физико-химическими свойствами лесных почв. Soil Biol. Biochem. 15 (1): 93–99
Soil Biol. Biochem. 15 (1): 93–99
Google ученый
Хаусслинг М. и Маршнер Х (1989) Органические и неорганические почвенные фосфаты и активность кислых фосфатаз в ризосфере 80-летних деревьев ели обыкновенной [Picea abies (L.) Karst.]. Биол. Fertil. Почвы 8: 128–133
Google ученый
Джума Н.Г. и Табатабай М.А. (1978). Распространение фосфомоноэстераз в почвах.Почвоведение. 126 (2): 101–108
Google ученый
Куперман Р.Г. и Каррейро М.М. (1979). Взаимосвязь между концентрацией тяжелых металлов в почве, микробной биомассой и активностью ферментов в экосистеме загрязненных пастбищ. Soil Biol. Biochem. 29: 179–190
Soil Biol. Biochem. 29: 179–190
Google ученый
Malcolm RE (1983) Оценка активности фосфатаз в почвах. Soil Biol. Biochem.15 (4): 403–408
Google ученый
Маккарти Г. В., Шогрен Д. Р. и Бремнер Дж. М. (1992) Регулирование производства уреазы в почве путем ассимиляции азота микробами. Биол. Fertil. Почвы 12: 261–264.
Google ученый
McGill WB & Cole CV (1981) Сравнительные аспекты круговорота органических C, N, S и P через органическое вещество почвы. Геодерма 26: 267–286
Google ученый
Наннипиери П., Джонсон Р.Л. и Пол Э.А. (1978) Критерии измерения роста и активности микробов в почве.Soil Biol. Biochem. 10: 223–229
Google ученый
Панг ПКК и Коленко Х. (1986) Активность фосфомоноэстеразы в лесных почвах. Soil Biol. Biochem. 18 (1): 35–40
Google ученый
Paul EA & Clark FE (1996) Почвенная микробиология и биохимия. Academic Press, Сан-Диего
Google ученый
Родригес-Кабана Р., Годой Г., Морган-Джонс Г. и Шелби Р.А. (1983) Определение активности почвенной хитиназы: условия для анализа и экологических исследований. Растения и почва 75: 95–106
Растения и почва 75: 95–106
Google ученый
Rolstone DE, Rauschkolb RS и Hofman DL (1975) Проникновение органических фосфатных соединений в почву. Почвоведение. Soc. Амер. Proc. 39: 1089–1093
Google ученый
Рохо М.Дж., Карседо С.Г. и Матеос М.П. (1990) Распределение и характеристика фосфатазы и органического фосфора во фракциях почвы. Soil Biol.Biochem. 22 (2): 169–174
Google ученый
Sinsabaugh RL (1994) Ферментный анализ микробного образца и процесса. Биол. Fertil. Почвы 17: 69–74
Google ученый
Sinsabaugh RL, Antibus RK, Linkins AE, McClaugherty CA, Rayburn L, Repert D & Wei-land T (1993) Разложение древесины: динамика азота и фосфора в зависимости от активности внеклеточных ферментов.Экология 74 (5): 1586–1593
Google ученый
Spalding BP и Duxbury JM (1977) Ферментативная активность и экстрагируемое органическое вещество в почвах, зараженных кольцами фей Lycopodium tristachyum. Почвоведение. Soc. Амер. J. 41: 1109–1113
Google ученый
Speir TW & Cowling JC (1991) Фосфатазная активность пастбищных растений и почв: взаимосвязь с урожайностью растений и индексами плодородия почвы.Биол. Fertil. Почвы 12: 189–194
Google ученый
Spiers GA и McGill WB (1979). Влияние добавления фосфора и энергоснабжения на производство и активность кислой фосфатазы в почвах. Soil Biol. Biochem. 11: 3–8
Google ученый
Speir TW & Ross DJ (1978) Фосфатаза и сульфатаза почвы. В: Бернс Р.Г. (ред.) Почвенные ферменты (стр. 197–250). Academic Press, Нью-Йорк
Google ученый
Тадано Т., Озава К., Сакаи Х., Осаки М. и Мацуи Х (1993) Секреция кислой фосфатазы корнями сельскохозяйственных культур в условиях дефицита фосфора и некоторые свойства фермента, секретируемого корнями люпина.Растения и почва 155/156: 95–98
Google ученый
Tarafdar JC & Marschner H (1994) Активность фосфатазы в ризосфере и гидросфере микоризной пшеницы VA, снабженной неорганическим и органическим фосфором. Soil Biol. Biochem. 26 (3): 387–395
Google ученый
Торн М.С., Трумбор С.Е., Чедвик О.А., Витусек П.М. и Хендрикс Д.М. (1997) Минеральный контроль за хранением и оборотом органического углерода в почве.Природа 389: 170–173
Google ученый
Vitousek PM и Farrington H (1997) Ограничение питательных веществ и развитие почвы: экспериментальная проверка биогеохимической теории. Биогеохим. 3 (7): 63–75
Google ученый
Vitousek PM, Chadwick OA, Crews TE, Fownes JH, Hendricks DM & Herbert D (1997) Развитие почв и экосистем на Гавайских островах.GSA Today 7 (9): 1–8
Google ученый
Vitousek PM, Walker LR, Whiteaker LD & Matson PA (1993) Ограничения питательных веществ для роста растений во время первичной сукцессии в Национальном парке вулканов Гавайев. Биогеохимия 23: 197–215
Google ученый
Wilkinson L (1990) Systat. Система статистики. Systat Inc. Эванстон, Иллинойс
Google ученый
Zou X, Binkley D & Caldwell BA (1995) Влияние деревьев, связывающих диазот, на биогеохимический цикл фосфора в контрастирующих лесах. Почвоведение. Soc. Амер. J. 59: 1452–1458
Почвоведение. Soc. Амер. J. 59: 1452–1458
Google ученый
Фосфатаза WIP1 является негативным регулятором передачи сигналов NF-κB.
Li, Q. & Verma, I. M. Регуляция NF-κB в иммунной системе. Nature Rev. Immunol. 2 , 725–734 (2002).
CAS Статья Google ученый
Хайден, М. С. и Гош, С. Общие принципы передачи сигналов NF-κB. Cell 132 , 344–362 (2008).
CAS Статья Google ученый
Карин М. и Бен Нерия Ю. Фосфорилирование встречается с убиквитинированием: контроль активности NF-κB. Annu. Rev. Immunol. 18 , 621–663 (2000).
Rev. Immunol. 18 , 621–663 (2000).
CAS Статья Google ученый
Булавин Д.В. и др. Амплификация PPM1D в опухолях человека отменяет активность супрессора опухолей p53. Nature Genet. 31 , 210–215 (2002).
CAS Статья Google ученый
Булавин Д.В. и др. Инактивация фосфатазы Wip1 ингибирует онкогенез молочных желез посредством p38 MAPK-опосредованной активации пути p16 (Ink4a) –p19 (Arf). Nature Genet. 36 , 343–350 (2004).
CAS Статья Google ученый
Такекава, М.и другие.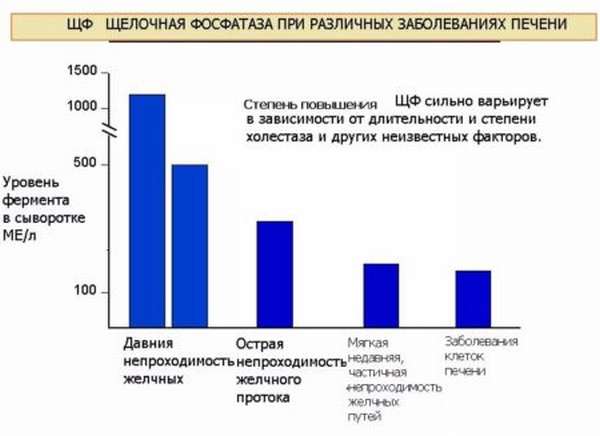 p53-индуцируемая фосфатаза wip1 опосредует регуляцию отрицательной обратной связи передачи сигналов p38 MAPK-p53 в ответ на УФ-излучение. EMBO J. 19 , 6517–6526 (2000).
p53-индуцируемая фосфатаза wip1 опосредует регуляцию отрицательной обратной связи передачи сигналов p38 MAPK-p53 в ответ на УФ-излучение. EMBO J. 19 , 6517–6526 (2000).
CAS Статья Google ученый
Lu, X., Nannenga, B. & Donehower, L.A. PPM1D дефосфорилирует Chk1 и p53 и отменяет контрольные точки клеточного цикла. Genes Dev. 19 , 1162–1174 (2005).
CAS Статья Google ученый
Lu, X.и другие. Фосфатаза Wip1 действует как привратник в ауторегуляторной петле p53-Mdm2. Cancer Cell 12 , 342–354 (2007).
CAS Статья Google ученый
Shreeram, S. et al. Фосфатаза Wip1 модулирует ATM-зависимые сигнальные пути. Мол. Ячейка 23 , 757–764 (2006).
CAS Статья Google ученый
Перкинс, Н.D. Посттрансляционные модификации, регулирующие активность и функцию пути NF-κB. Онкоген 25 , 6717–6730 (2006).
CAS Статья Google ученый
Chen, L. F. et al. Фосфорилирование NF-κB RelA регулирует ацетилирование RelA. Mol Cell Biol 25 , 7966–7975 (2005).
CAS Статья Google ученый
Мадрид, Л. V., Mayo, M. W., Reuther, J. Y. & Baldwin, A. S. Jr, Akt стимулирует трансактивационный потенциал субъединицы RelA / p65 NF-κB за счет использования киназы IκB и активации митоген-активируемой протеинкиназы p38. J. Biol. Chem. 276 , 18934–18940 (2001).
V., Mayo, M. W., Reuther, J. Y. & Baldwin, A. S. Jr, Akt стимулирует трансактивационный потенциал субъединицы RelA / p65 NF-κB за счет использования киназы IκB и активации митоген-активируемой протеинкиназы p38. J. Biol. Chem. 276 , 18934–18940 (2001).
CAS Статья Google ученый
Vermeulen, L., De Wilde, G., Van Damme, P., Vanden Berghe, W. & Haegeman, G. Транскрипционная активация субъединицы NF-κB p65 с помощью митоген- и стресс-активируемой протеинкиназы -1 (MSK1). EMBO J. 22 , 1313–1324 (2003).
CAS Статья Google ученый
Чжун, Х., Волл, Р. Э. и Гош, С. Фосфорилирование NF-κB p65 с помощью PKA стимулирует транскрипционную активность, способствуя новому бивалентному взаимодействию с коактиватором CBP / p300. Мол. Ячейка 1 , 661–671 (1998).
Мол. Ячейка 1 , 661–671 (1998).
CAS Статья Google ученый
Ким, К.и другие. Киназа p38α выполняет специфические для типа клеток воспалительные функции при повреждении кожи и координирует экспрессию про- и противовоспалительных генов. Nature Immunol. 9 , 1019–1027 (2008).
CAS Статья Google ученый
Saccani, S., Pantano, S. & Natoli, G. p38-зависимая маркировка воспалительных генов для увеличения набора NF-κB. Nature Immunol. 3 , 69–75 (2002).
CAS Статья Google ученый
Choi, J. et al. У мышей с дефицитом гена фосфатазы, индуцированного р53 дикого типа (Wip1), наблюдаются дефекты репродуктивных органов, иммунной функции и контроля клеточного цикла. Мол. Cell Biol. 22 , 1094–1105 (2002).
et al. У мышей с дефицитом гена фосфатазы, индуцированного р53 дикого типа (Wip1), наблюдаются дефекты репродуктивных органов, иммунной функции и контроля клеточного цикла. Мол. Cell Biol. 22 , 1094–1105 (2002).
CAS Статья Google ученый
Тергаонкар В. Н. Путь κB: хорошая сигнальная парадигма и терапевтическая мишень. Int. J. Biochem. Cell Biol. 38 , 1647–1653 (2006).
CAS Статья Google ученый
Дельхас, М., Хаякава, М., Чен, Ю. и Карин, М. Положительная и отрицательная регуляция активности киназы IκB посредством фосфорилирования субъединицы IKKβ. Наука 284 , 309–313 (1999).
CAS Статья Google ученый
Коваленко, А.и другие. Супрессор опухолей CYLD негативно регулирует передачу сигналов NF-κB посредством деубиквитинирования. Nature 424 , 801–805 (2003).
CAS Статья Google ученый
Wertz, I.E. et al. Домены деубиквитинирования и убиквитинлигазы A20 подавляют передачу сигналов NF-κB. Nature 430 , 694–699 (2004).
CAS Статья Google ученый
Шембаде, Н.и другие. Лигаза E3 Itch негативно регулирует воспалительные сигнальные пути, контролируя функцию фермента A20, редактирующего убиквитин. Nature Immunol. 9 , 254–262 (2008).
CAS Статья Google ученый
Ананьева О. и др. Киназы MSK1 и MSK2 действуют как негативные регуляторы передачи сигналов Toll-подобного рецептора. Nature Immunol. 9 , 1028–1036 (2008).
CAS Статья Google ученый
Палкович, Л., Leidner, J., Ghosh, S. & Marienfeld, RB Фосфорилирование Ser 68 в IκB-киназе (IKK) -связывающем домене NEMO влияет на структуру комплекса IKK и активность NF-κB, индуцированную фактором некроза опухоли . J. Biol. Chem. 283 , 76–86 (2008).
CAS Статья Google ученый
Грин, В. К. и Чен, Л. Ф. Регулирование действия NF-κB путем обратимого ацетилирования. Novartis.Найденный. Symp. 259 , 208–217 (2004).
CAS PubMed Google ученый
Saccani, S., Marazzi, I., Beg, A. A. & Natoli, G. Деградация связанного с промотором p65 / RelA необходима для быстрого прекращения ответа NF-κB. J. Exp. Med. 200 , 107–113 (2004).
CAS Статья Google ученый
Мэн, Г.N., Mao, X., Komarck, C.M. и Burstein, E. COMMD1 способствует убиквитинированию субъединиц NF-κB через кульлин-содержащую убиквитинлигазу. EMBO J. 26 , 436–447 (2007).
CAS Статья Google ученый
Танака Т., Грусби М. Дж. И Кайшо Т. PDLIM2-опосредованная терминация активации фактора транскрипции NF-κB путем внутриядерной секвестрации и деградации субъединицы p65. Nature Immunol. 8 , 584–591 (2007).
Nature Immunol. 8 , 584–591 (2007).
CAS Статья Google ученый
Чен, Л. Ф. и Грин, В. К. Формирование ядерного действия NF-κB. Nature Rev. Mol. Cell Biol. 5 , 392–401 (2004).
CAS Статья Google ученый
Li, S., Wang, L., Berman, M. A., Zhang, Y. & Dorf, M. E. Скрининг РНКи в астроцитах мышей идентифицирует фосфатазы, которые регулируют передачу сигналов NF-κB. Мол. Ячейка 24 , 497–509 (2006).
CAS Статья Google ученый
Янг, Дж., Фан, Г. Х., Вадзински, Б. Э. , Сакураи, Х. и Ричмонд, А. Белковая фосфатаза 2A взаимодействует с RelA и непосредственно дефосфорилирует его. J. Biol. Chem. 276 , 47828–47833 (2001).
, Сакураи, Х. и Ричмонд, А. Белковая фосфатаза 2A взаимодействует с RelA и непосредственно дефосфорилирует его. J. Biol. Chem. 276 , 47828–47833 (2001).
CAS Статья Google ученый
Li, H.Y. et al. Деактивация киназы IKK с помощью CUEDC2 за счет привлечения фосфатазы PP1. Nature Immunol. 9 , 533–541 (2008).
CAS Статья Google ученый
Prajapati, S., Verma, U., Yamamoto, Y., Kwak, Y. T. & Gaynor, R. B. Связь протеиновой фосфатазы 2Cβ с киназным комплексом IκB участвует в регуляции активности NF-κB. J. Biol. Chem. 279 , 1739–1746 (2004).
CAS Статья Google ученый
Kray, A.E. et al. Положительная регуляция передачи сигналов киназы IκB протеином Ser / Thr фосфатазой 2A. J. Biol. Chem. 280 , 35974–35982 (2005).
CAS Статья Google ученый
Сингх С. и Аггарвал Б. Б. Ингибиторы протеин-тирозинфосфатазы блокируют зависимую от фактора некроза опухоли активацию фактора ядерной транскрипции NF-κ B. J. Biol. Chem. 270 , 10631–10639 (1995).
CAS Статья Google ученый
Sun, S. C., Maggirwar, S. B. & Harhaj, E. Активация NF-κB ингибиторами фосфатазы включает фосфорилирование IκBα в сайтах, чувствительных к фосфатазе 2A. J. Biol. Chem. 270 , 18347–18351 (1995).
CAS Статья Google ученый
Щито, М.Л., Демидов, О. Н., Сайто, С., Эшвелл, Дж. Д. и Аппелла, Е. Мыши с дефицитом фосфатазы Wip1 обнаруживают дефектное созревание Т-клеток из-за устойчивой активации р53. J. Immunol. 176 , 4818–4825 (2006).
CAS Статья Google ученый
Дей, А., Вонг, Э. Т., Бист, П., Тергаонкар, В. и Лейн, Д. П. Нутлин-3 ингибирует путь NF-κB p53-зависимым образом: значение в терапии рака легких. Cell Cycle 6 , 2178–2185 (2007).
CAS Статья Google ученый
Тергаонкар В., Корреа Р. Г., Икава М. и Верма И. М. Определенные роли белков IκB в регуляции конститутивной активности NF-κB. Nature Cell Biol. 7 , 921–923 (2005).
CAS Статья Google ученый
Гош, С.и другие. Существенная роль генов туберозного склероза TSC1 и TSC2 в активации NF-κB и выживании клеток. Cancer Cell 10 , 215–226 (2006).
CAS Статья Google ученый
OMIM Запись — * 600031
Ген CHIT1 кодирует метилумбеллиферилтетра-N-ацетилхитотетраозидгидролазу (хитотриозидазу) в плазме крови, хитиназу человека (EC 3.2.1.14). Хитиназы играют роль в разрушении хитиновых стенок некоторых микроорганизмов (Boot et al., 1995).
Renkema et al. (1995) очистили и охарактеризовали белок хитотриозидазы из селезенки пациента с болезнью Гоше (230800), у которого была повышенная активность фермента CHIT1 в сыворотке. Две основные изоформы с изоэлектрическими точками 7,2 и 8,0 и молекулярными массами 50 и 39 кДа, соответственно, имели идентичные N-концевые аминокислотные последовательности. Антисыворотка, полученная против очищенной хитотриозидазы 39 кДа, осаждала все изоферменты.Полученные данные свидетельствуют о том, что один ген кодирует разные изоформы хитотриозидазы. Авторы предположили, что фермент может участвовать в защите от хитинсодержащих патогенов, таких как грибы, нематоды и насекомые, и в их деградации.
Две основные изоформы с изоэлектрическими точками 7,2 и 8,0 и молекулярными массами 50 и 39 кДа, соответственно, имели идентичные N-концевые аминокислотные последовательности. Антисыворотка, полученная против очищенной хитотриозидазы 39 кДа, осаждала все изоферменты.Полученные данные свидетельствуют о том, что один ген кодирует разные изоформы хитотриозидазы. Авторы предположили, что фермент может участвовать в защите от хитинсодержащих патогенов, таких как грибы, нематоды и насекомые, и в их деградации.
Boot et al. (1995) выделили кДНК, соответствующую гену хитотриозидазы, из библиотеки кДНК макрофагов. Выведенный белок из 445 аминокислот имеет молекулярную массу 49 кДа, что похоже на более крупную изоформу, обнаруженную Renkema et al.(1995). Секрецию активной хитотриозидазы получали после временной трансфекции клеток COS-1 клонированной кДНК. Хитотриозидаза содержит несколько участков с высокой гомологией с теми, которые присутствуют в хитиназах разных видов, принадлежащих к семейству 18 гликозилгидролаз. Нозерн-блоттинг показал, что экспрессия мРНК хитотриозидазы происходит только на поздней стадии дифференцировки моноцитов в активированные макрофаги в культуре клеток. Авторы предположили, что фермент может играть роль в разложении хитинсодержащих патогенов.
Нозерн-блоттинг показал, что экспрессия мРНК хитотриозидазы происходит только на поздней стадии дифференцировки моноцитов в активированные макрофаги в культуре клеток. Авторы предположили, что фермент может играть роль в разложении хитинсодержащих патогенов.
Boot et al. (1998) определили, что ген CHIT1 содержит 12 экзонов и занимает около 20 т.п.н.
Eiberg и Den Tandt (1997) картировали локус CHIT на хромосоме 1q31-qter между фланкирующими маркерами D1S191 и D1S245. Посредством флуоресцентной гибридизации in situ Boot et al. (1998) отнесли ген CHIT к 1q31-q32.
Hollak et al.(1994) наблюдали очень заметное повышение (более чем в 600 раз) активности хитотриозидазы в плазме 30 из 32 симптомных пациентов с болезнью Гоше I типа (230 800), что связано с мутацией в гене, кодирующем бета-глюкозидазу (GBA ; 606463). Повышение уровня хитотриозидазы в плазме, которое они наблюдали у пациентов с болезнью Гоше, было гораздо более выраженным, чем повышение уровня щелочной фосфатазы (ALPL; 171760), которая использовалась в качестве важного диагностического признака болезни. Активность хитотриозидазы резко снизилась во время терапии добавками ферментов.Напротив, у 3 пациентов с дефицитом GBA без клинических симптомов наблюдалось лишь небольшое повышение хитотриозидазы. Авторы считают маловероятным, что хитотриозидаза сама по себе способствует клиническим проявлениям болезни Гоше. Hollak et al. (1994) отметили, что сходство между лизоцимом (LYZ; 153450) и хитотриозидазой в отношении каталитической активности по отношению к конкретным субстратам предполагает, что последние также могут функционировать в механизмах защиты хозяина, например, через расщепление полисахарида бактериальной клеточной стенки.Hollak et al. (1994) предположили, что макрофаги, нагруженные глюкозилцерамидом при болезни Гоше, являются основным источником активности ферментов плазмы.
Повышение уровня хитотриозидазы в плазме, которое они наблюдали у пациентов с болезнью Гоше, было гораздо более выраженным, чем повышение уровня щелочной фосфатазы (ALPL; 171760), которая использовалась в качестве важного диагностического признака болезни. Активность хитотриозидазы резко снизилась во время терапии добавками ферментов.Напротив, у 3 пациентов с дефицитом GBA без клинических симптомов наблюдалось лишь небольшое повышение хитотриозидазы. Авторы считают маловероятным, что хитотриозидаза сама по себе способствует клиническим проявлениям болезни Гоше. Hollak et al. (1994) отметили, что сходство между лизоцимом (LYZ; 153450) и хитотриозидазой в отношении каталитической активности по отношению к конкретным субстратам предполагает, что последние также могут функционировать в механизмах защиты хозяина, например, через расщепление полисахарида бактериальной клеточной стенки.Hollak et al. (1994) предположили, что макрофаги, нагруженные глюкозилцерамидом при болезни Гоше, являются основным источником активности ферментов плазмы. При различных гранулематозных иммунологических нарушениях не было обнаружено повышения или только умеренное повышение содержания хитотриозидазы в плазме.
При различных гранулематозных иммунологических нарушениях не было обнаружено повышения или только умеренное повышение содержания хитотриозидазы в плазме.
Boot et al. (1995) отметили, что известно, что гомологичные хитиназы растений защищают от грибковых патогенов. Бактерицидная функция лизоцима также хорошо известна; тем не менее, у кроликов возникает наследственный дефицит лизоцима, который, по-видимому, не имеет большого значения для восприимчивости к инфекциям.Разнообразный набор защитных механизмов иммунной системы у млекопитающих, вероятно, обеспечивает достаточную устойчивость к дефектам отдельных ферментов, таких как лизоцим и хитотриозидаза.
Сравнивая противогрибковые свойства хитотриозидазы макрофагов человека и ее изолированных доменов, Vandevenne et al. (2011) показали, что каталитического домена достаточно для противогрибковой активности и, как правило, он более эффективен, чем интактный фермент. Напротив, хитин-связывающий домен не обладал какими-либо противогрибковыми свойствами. Мутации в хитотриозидазе, которые делали макрофагальный фермент неактивным, могли быть компенсированы лизоцимом, который обладал даже большей противогрибковой активностью, чем хитотриозидаза, а также антибактериальной активностью.
Мутации в хитотриозидазе, которые делали макрофагальный фермент неактивным, могли быть компенсированы лизоцимом, который обладал даже большей противогрибковой активностью, чем хитотриозидаза, а также антибактериальной активностью.
У лиц с дефицитом хитотриозидазы (CHITD; 614122) Boot et al. (1998) идентифицировали гомозиготную дупликацию длиной 24 п.н. в гене CHIT1 (600031.0001). Наблюдаемая частота носительства около 35% указывает на то, что дупликация является преобладающей причиной дефицита хитотриозидазы.Наличие дупликации у людей из различных этнических групп свидетельствует о том, что эта мутация относительно старая.
Grace et al. (2007) отметили, что идентификация мутаций гена CHIT1, которые изменяют активность плазмы, важна для использования этого биомаркера для мониторинга активности заболевания и терапевтического ответа при болезни Гоше. Они генотипировали ген CHIT1 у 320 неродственных пациентов с болезнью Гоше, в том числе 272 человека ашкеназского еврейского происхождения. Среди всех пациентов 4% и 37.2% были гомозиготными и гетерозиготными по дупликации 24 п.н. соответственно. Кроме того, Grace et al. (2007) идентифицировали 3 новые мутации в гене CHIT1 (600031.0002-600031.0004) у людей с болезнью Гоше и дефицитом хитотриозидазы.
Среди всех пациентов 4% и 37.2% были гомозиготными и гетерозиготными по дупликации 24 п.н. соответственно. Кроме того, Grace et al. (2007) идентифицировали 3 новые мутации в гене CHIT1 (600031.0002-600031.0004) у людей с болезнью Гоше и дефицитом хитотриозидазы.
% PDF-1.3
%
333 0 объект
>
endobj
xref
333 126
0000000016 00000 н.
0000002872 00000 н.
0000003104 00000 п.
0000003135 00000 п.
0000003200 00000 н.
0000004105 00000 н.
0000004473 00000 н.
0000004540 00000 н.
0000004751 00000 п.
0000004816 00000 н.
0000004912 00000 н.
0000005007 00000 н.
0000005127 00000 н.
0000005232 00000 н.
0000005297 00000 н.
0000005401 00000 п.
0000005466 00000 н.
0000005608 00000 н.
0000005672 00000 п.
0000005828 00000 н.
0000005955 00000 н.
0000006082 00000 н.
0000006221 00000 н.
0000006367 00000 н.
0000006431 00000 н.
0000006546 00000 н.
0000006610 00000 н.
0000006674 00000 н.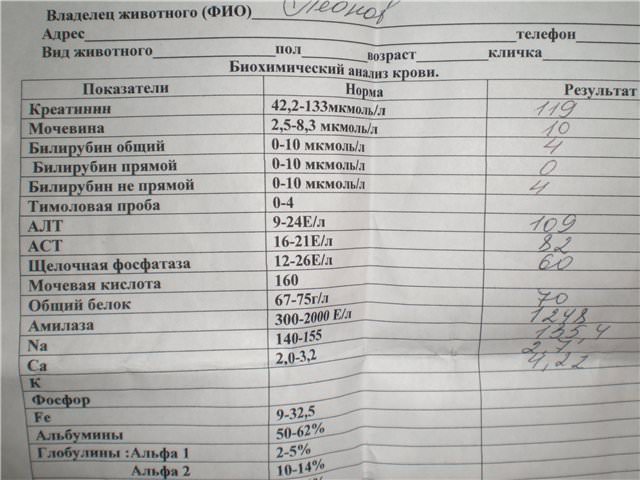 0000006738 00000 н.
0000006833 00000 н.
0000006937 00000 н.
0000007064 00000 н.
0000007133 00000 п.
0000007240 00000 н.
0000007304 00000 н.
0000007368 00000 н.
0000007483 00000 н.
0000007598 00000 н.
0000007713 00000 н.
0000007828 00000 н.
0000007943 00000 п.
0000008063 00000 н.
0000008159 00000 п.
0000008256 00000 н.
0000008352 00000 п.
0000008448 00000 н.
0000008543 00000 н.
0000008639 00000 н.
0000008736 00000 н.
0000008833 00000 н.
0000008928 00000 н.
0000009024 00000 н.
0000009120 00000 н.
0000009215 00000 н.
0000009311 00000 п.
0000009406 00000 п.
0000009502 00000 н.
0000009597 00000 н.
0000009693 00000 п.
0000009788 00000 н.
0000009884 00000 н.
0000009979 00000 н.
0000010074 00000 п.
0000010169 00000 п.
0000010263 00000 п.
0000010358 00000 п.
0000010452 00000 п.
0000010547 00000 п.
0000010641 00000 п.
0000010734 00000 п.
0000010831 00000 п.
0000010927 00000 п.
0000011023 00000 п.
0000011119 00000 п.
0000011215 00000 п.
0000011311 00000 п.
0000006738 00000 н.
0000006833 00000 н.
0000006937 00000 н.
0000007064 00000 н.
0000007133 00000 п.
0000007240 00000 н.
0000007304 00000 н.
0000007368 00000 н.
0000007483 00000 н.
0000007598 00000 н.
0000007713 00000 н.
0000007828 00000 н.
0000007943 00000 п.
0000008063 00000 н.
0000008159 00000 п.
0000008256 00000 н.
0000008352 00000 п.
0000008448 00000 н.
0000008543 00000 н.
0000008639 00000 н.
0000008736 00000 н.
0000008833 00000 н.
0000008928 00000 н.
0000009024 00000 н.
0000009120 00000 н.
0000009215 00000 н.
0000009311 00000 п.
0000009406 00000 п.
0000009502 00000 н.
0000009597 00000 н.
0000009693 00000 п.
0000009788 00000 н.
0000009884 00000 н.
0000009979 00000 н.
0000010074 00000 п.
0000010169 00000 п.
0000010263 00000 п.
0000010358 00000 п.
0000010452 00000 п.
0000010547 00000 п.
0000010641 00000 п.
0000010734 00000 п.
0000010831 00000 п.
0000010927 00000 п.
0000011023 00000 п.
0000011119 00000 п.
0000011215 00000 п.
0000011311 00000 п.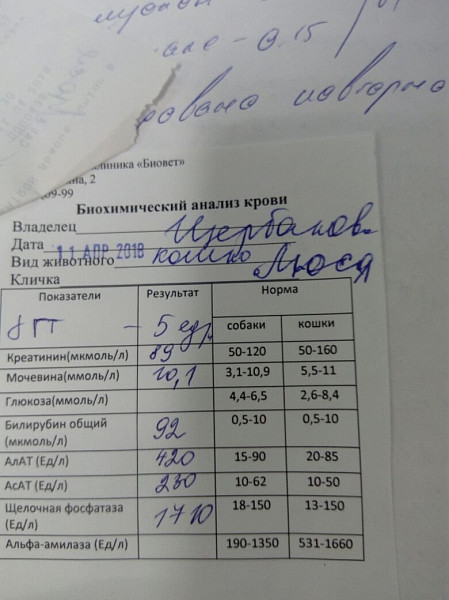 0000011407 00000 п.
0000011681 00000 п.
0000012122 00000 п.
0000012949 00000 п.
0000013536 00000 п.
0000014109 00000 п.
0000014150 00000 п.
0000014172 00000 п.
0000014425 00000 п.
0000014818 00000 п.
0000015603 00000 п.
0000015625 00000 п.
0000015864 00000 п.
0000016162 00000 п.
0000016515 00000 п.
0000016733 00000 п.
0000016806 00000 п.
0000017624 00000 п.
0000017646 00000 п.
0000017894 00000 п.
0000018238 00000 п.
0000018531 00000 п.
0000018820 00000 п.
0000018899 00000 п.
0000019669 00000 п.
0000019691 00000 п.
0000020509 00000 п.
0000020531 00000 п.
0000021316 00000 п.
0000021338 00000 п.
0000021582 00000 п.
0000021763 00000 п.
0000022083 00000 п.
0000022565 00000 п.
0000023381 00000 п.
0000023403 00000 п.
0000024251 00000 п.
0000024273 00000 п.
0000026951 00000 п.
0000033231 00000 п.
0000034134 00000 п.
0000034830 00000 п.
0000039690 00000 н.
0000042055 00000 п.
0000042134 00000 п.
0000042683 00000 п.
0000054963 00000 п.
0000056713 00000 п.
0000011407 00000 п.
0000011681 00000 п.
0000012122 00000 п.
0000012949 00000 п.
0000013536 00000 п.
0000014109 00000 п.
0000014150 00000 п.
0000014172 00000 п.
0000014425 00000 п.
0000014818 00000 п.
0000015603 00000 п.
0000015625 00000 п.
0000015864 00000 п.
0000016162 00000 п.
0000016515 00000 п.
0000016733 00000 п.
0000016806 00000 п.
0000017624 00000 п.
0000017646 00000 п.
0000017894 00000 п.
0000018238 00000 п.
0000018531 00000 п.
0000018820 00000 п.
0000018899 00000 п.
0000019669 00000 п.
0000019691 00000 п.
0000020509 00000 п.
0000020531 00000 п.
0000021316 00000 п.
0000021338 00000 п.
0000021582 00000 п.
0000021763 00000 п.
0000022083 00000 п.
0000022565 00000 п.
0000023381 00000 п.
0000023403 00000 п.
0000024251 00000 п.
0000024273 00000 п.
0000026951 00000 п.
0000033231 00000 п.
0000034134 00000 п.
0000034830 00000 п.
0000039690 00000 н.
0000042055 00000 п.
0000042134 00000 п.
0000042683 00000 п.
0000054963 00000 п.
0000056713 00000 п.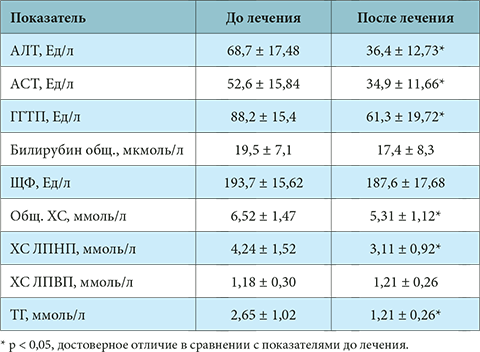 DzГA
DzГA
, 73 ??
Разработка микроРНК как потенциальных терапевтических средств против рака
) МикроРНК (миРНК) представляют собой небольшие некодирующие РНК, которые функционируют на посттранскрипционном уровне в процессе клеточной регуляции. .Экспрессия miRNA оказывает жизненно важное влияние на рост клеток, такое как пролиферация и выживаемость клеток. Было показано, что при раке miRNAs инициируют канцерогенез, при этом сообщается о сверхэкспрессии онкогенных miRNA (oncomiRs) или сниженной экспрессии miRNA-супрессоров опухоли. В этом обзоре мы обсуждаем участие miRNAs в онкогенезе, роль синтетических miRNAs как имитаторов или антагомиров в борьбе с ростом рака, доставку miRNA и подходы к увеличению их терапевтического потенциала.
1. Введение
Рак — вторая причина смерти после ишемической болезни сердца и инсульта во всем мире. По оценкам GLOBOCAN 2018, в 2018 году во всем мире было зарегистрировано более 18,1 миллиона новых случаев рака и 9,6 миллиона смертей [1].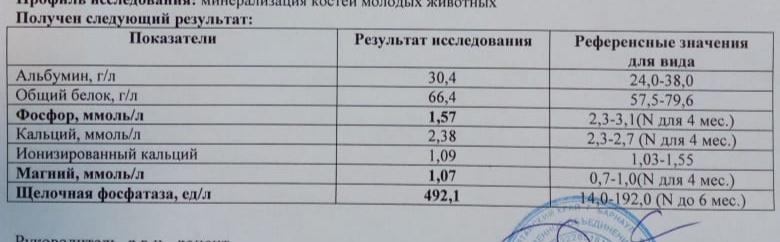 Нарушения роста клеток, которые включают нарушение регуляции экспрессии генов, способны инициировать канцерогенез. Со временем раковые клетки могут распространяться или метастазировать в другие части тела, что еще больше осложняет лечение болезни. Современные методы лечения рака, такие как хирургия, химиотерапия и лучевая терапия, не полностью успешны.Следовательно, существует необходимость в разработке других стратегий, дополняющих традиционные методы лечения. Многочисленные исследования подтвердили, что сверхэкспрессия микроРНК (миРНК) может способствовать развитию рака [2]. Интересно, что некоторые miRNA обладают противоопухолевым действием. Таким образом, определенные исследования онкогенных miRNAs (oncomiRs), которые могут приводить к нарушениям экспрессии генов или усилению miRNAs-супрессоров опухолей, могут стать потенциальными терапевтическими подходами.
Нарушения роста клеток, которые включают нарушение регуляции экспрессии генов, способны инициировать канцерогенез. Со временем раковые клетки могут распространяться или метастазировать в другие части тела, что еще больше осложняет лечение болезни. Современные методы лечения рака, такие как хирургия, химиотерапия и лучевая терапия, не полностью успешны.Следовательно, существует необходимость в разработке других стратегий, дополняющих традиционные методы лечения. Многочисленные исследования подтвердили, что сверхэкспрессия микроРНК (миРНК) может способствовать развитию рака [2]. Интересно, что некоторые miRNA обладают противоопухолевым действием. Таким образом, определенные исследования онкогенных miRNAs (oncomiRs), которые могут приводить к нарушениям экспрессии генов или усилению miRNAs-супрессоров опухолей, могут стать потенциальными терапевтическими подходами.
Открытие lin-4 miRNA в Caenorhabditis elegans ( C.elegans ) привело к идентификации др. miRNAs у растений, животных и человека [3]. Центральная догма молекулярной биологии включает транскрипцию дезоксирибонуклеиновой кислоты (ДНК) в рибонуклеиновую кислоту-мессенджер (мРНК) и трансляцию мРНК в белки. miRNAs представляют собой короткие последовательности некодирующих РНК (19-24 нуклеотидов), функционирующие на посттранскрипционной стадии, где они могут регулировать процесс трансляции белков. miRNA обладают способностью связываться с комплементарной последовательностью мРНК в 3′-нетранслируемой области (UTR), и связывание miRNA с мРНК останавливает прогрессию трансляции белка [4].Однако связывание пар оснований не обязательно должно быть идеальным связыванием для всех 20 нуклеотидов miRNA. Таким образом, одна miRNA может регулировать большое количество экспрессий генов, а трансляция множества мРНК может регулироваться одной miRNA. miRNAs, как сообщается, регулируют более 50% генов человека, которые расположены в связанных с раком геномных областях, которые образуют центральные узловые точки в путях развития рака [5, 6].
Центральная догма молекулярной биологии включает транскрипцию дезоксирибонуклеиновой кислоты (ДНК) в рибонуклеиновую кислоту-мессенджер (мРНК) и трансляцию мРНК в белки. miRNAs представляют собой короткие последовательности некодирующих РНК (19-24 нуклеотидов), функционирующие на посттранскрипционной стадии, где они могут регулировать процесс трансляции белков. miRNA обладают способностью связываться с комплементарной последовательностью мРНК в 3′-нетранслируемой области (UTR), и связывание miRNA с мРНК останавливает прогрессию трансляции белка [4].Однако связывание пар оснований не обязательно должно быть идеальным связыванием для всех 20 нуклеотидов miRNA. Таким образом, одна miRNA может регулировать большое количество экспрессий генов, а трансляция множества мРНК может регулироваться одной miRNA. miRNAs, как сообщается, регулируют более 50% генов человека, которые расположены в связанных с раком геномных областях, которые образуют центральные узловые точки в путях развития рака [5, 6]. Это предполагает, что miRNA могут играть решающую роль в патогенезе рака человека.
Это предполагает, что miRNA могут играть решающую роль в патогенезе рака человека.
2. miRNAs Biogenesis
miRNA представляют собой некодирующие последовательности в ДНК, которые не транслируются в белки. Однако было обнаружено, что они регулируют экспрессию генов. Биогенез miRNA первоначально начинается с транскрипции некодирующей области в большой первичный транскрипт (pri-miRNA) с помощью РНК-полимеразы II. Затем фермент РНКаза III, Дроша, будет взаимодействовать со специализированным связывающим белком РНК (DGCR8), чтобы сформировать микропроцессорный комплекс, и хвосты pri-miRNA будут удалены, чтобы произвести miRNA-предшественницу (pre-miRNA).Пре-миРНК будет перемещаться через ядерную мембрану с помощью белка Exportin-5. В цитоплазме Дайсер РНКазы III будет образовывать комплекс с элементом ответа на трансактивацию РНК-связывающим белком (TRBP) и расщепляет стебель-петлю на пре-miRNAs, в результате чего образуется дуплекс miRNA длиной 18-25 нуклеотидов. Дуплексная цепь будет разматываться, оставляя зрелую цепь внутри РНК-индуцированного комплекса молчания (RISC), в то время как цепь-пассажир miRNA будет деградировать [7]. RISC будет путешествовать, чтобы найти последовательность-мишень на мРНК [8]. Область на miRNA, которая может связываться с идеальным спариванием, называется «затравочной последовательностью», которая в основном расположена в положениях нуклеотидов 2-7 от 5′-конца miRNA. Идеальное спаривание miRNA с целевой мРНК способствует деградации мРНК, в то время как несовершенное спаривание оснований приводит к репрессии трансляции белка (Рисунок 1) [9]. Мутации в генах, кодирующих четыре ключевых фермента, таких как Drosha, Exportin-5, Dicer и Argonaute 2, участвующие в биогенезе miRNA, обычно обнаруживаются при раке [10].
RISC будет путешествовать, чтобы найти последовательность-мишень на мРНК [8]. Область на miRNA, которая может связываться с идеальным спариванием, называется «затравочной последовательностью», которая в основном расположена в положениях нуклеотидов 2-7 от 5′-конца miRNA. Идеальное спаривание miRNA с целевой мРНК способствует деградации мРНК, в то время как несовершенное спаривание оснований приводит к репрессии трансляции белка (Рисунок 1) [9]. Мутации в генах, кодирующих четыре ключевых фермента, таких как Drosha, Exportin-5, Dicer и Argonaute 2, участвующие в биогенезе miRNA, обычно обнаруживаются при раке [10].
3. miRNAs в раке
Рак является наиболее значимой патологией в мире взаимодействия miRNA-mRNA, где многие из сайтов-мишеней miRNA сгруппированы в связанных с раком геномных областях. К настоящему времени обнаружено около 28 465 miRNA [11]. Следовательно, miRNA считается главным регулятором в сотовой сети. Сообщалось, что нарушение регуляции экспрессии miRNAs связано со стадией, прогрессированием и метастазированием рака [12]. miРНК можно классифицировать как онкомиР или miРНК-супрессоры опухоли.OncomiRs постоянно сверхэкспрессируются и подавляют трансляцию генов-супрессоров опухолей, что приводит к стимулированию роста опухолевых клеток. Таким образом, высокая экспрессия oncomiR значительно увеличивает онкогенные свойства, такие как пролиферация, миграция и инвазия клеток. С другой стороны, миРНК-супрессоры опухоли обычно подавляли трансляцию мРНК, кодирующих онкогены, тем самым подавляя онкогенез и последующее развитие рака. miRNAs с функцией oncomiR или опухолевого супрессора представлены в таблице 1.
miРНК можно классифицировать как онкомиР или miРНК-супрессоры опухоли.OncomiRs постоянно сверхэкспрессируются и подавляют трансляцию генов-супрессоров опухолей, что приводит к стимулированию роста опухолевых клеток. Таким образом, высокая экспрессия oncomiR значительно увеличивает онкогенные свойства, такие как пролиферация, миграция и инвазия клеток. С другой стороны, миРНК-супрессоры опухоли обычно подавляли трансляцию мРНК, кодирующих онкогены, тем самым подавляя онкогенез и последующее развитие рака. miRNAs с функцией oncomiR или опухолевого супрессора представлены в таблице 1.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Активизированные онкомиры, такие как miR-2192, кластер miR-17 miR-155 может увеличивать онкогенез. miR-21 — один из наиболее часто сверхэкспрессируемых онкомов в различных типах солидных опухолей, таких как рак молочной железы, легких, толстой кишки, глиобластомы, поджелудочной железы, яичников, предстательной железы и желудка, а также лимфомы [13]. miR-21 является примером miRNA, которая нацелена на множественные онкогенные сигнальные каскады, а также вызывает глобальную дисрегуляцию экспрессии генов при раке. Было показано, что сверхэкспрессия miR-21 нацелена на ряд генов-супрессоров опухолей, таких как запрограммированная клеточная смерть 4 (PDCD4), гомолог фосфатов и тензинов ( PTEN ), RECK и тропомиозин 1 (TPM1) [13–16 ].Этот процесс способствует пролиферации клеток, метастазированию, инвазии и фенотипам, устойчивым к химиотерапии.
miR-21 — один из наиболее часто сверхэкспрессируемых онкомов в различных типах солидных опухолей, таких как рак молочной железы, легких, толстой кишки, глиобластомы, поджелудочной железы, яичников, предстательной железы и желудка, а также лимфомы [13]. miR-21 является примером miRNA, которая нацелена на множественные онкогенные сигнальные каскады, а также вызывает глобальную дисрегуляцию экспрессии генов при раке. Было показано, что сверхэкспрессия miR-21 нацелена на ряд генов-супрессоров опухолей, таких как запрограммированная клеточная смерть 4 (PDCD4), гомолог фосфатов и тензинов ( PTEN ), RECK и тропомиозин 1 (TPM1) [13–16 ].Этот процесс способствует пролиферации клеток, метастазированию, инвазии и фенотипам, устойчивым к химиотерапии.
Другой кластер oncomiR, miR-17-92, также транскрипционно активируется при нескольких типах рака, включая лимфомы, рак легких, толстой кишки и желудка [18]. Кластер miR-17-92 включает miR-12, miR-18a, miR-19a, miR-20a, miR-19b и miR-92a, и сообщалось, что он способствует пролиферации опухоли и индуцирует ангиогенез за счет активации c- Myc обычно активируется при раке [18, 19].
miR-155 является одной из выдающихся miRNA, способствующих развитию опухолей, которая, как было обнаружено, сверхэкспрессируется при лимфоме, раке легких, груди и яичников. Высокий уровень miR-155 был связан с плохим прогнозом [20, 21]. Предыдущие исследования показали, что избыточная экспрессия miR-155 непосредственно подавляет гены SHIP1 и C / EBP β , что, следовательно, блокирует дифференцировку B-клеток и увеличивает выживаемость клеток [38, 39]. Кроме того, miR-155 также подавляет экспрессию белка-супрессора опухолей, von Hippel-Lindau (VHL), что приводит к индукции ангиогенеза и способствует выживанию раковых клеток [22].
Другая miRNA, играющая особую роль в патологии рака, — это miR-10b, которая участвует в поздней стадии злокачественного новообразования, где она способствует инвазии и метастазированию раковых клеток. Сверхэкспрессия этой miRNA была обнаружена при глиобластоме, раке груди и пищевода [23-25]. Эта miRNA положительно регулирует миграцию и инвазию клеток за счет снижения экспрессии гена-супрессора опухолей, Kruppel-подобного фактора 4 (KLF4) в клетках пищевода человека [25]. С другой стороны, miR-10b также подавляет член фактора транскрипции гомеобокса ДНК-связывающего домена, известный как HOXD10, при раке груди и яичников, приводя к прометастатическому фенотипу [40, 41].miR-221 и miR-222 очень гомологичны, и их повышенная регуляция была продемонстрирована в нескольких типах опухолей человека. Было показано, что сверхэкспрессия miR-221/222 усиливает рост, миграцию и инвазию клеток при раке груди, легких и печени путем подавления PTEN [42].
С другой стороны, miR-10b также подавляет член фактора транскрипции гомеобокса ДНК-связывающего домена, известный как HOXD10, при раке груди и яичников, приводя к прометастатическому фенотипу [40, 41].miR-221 и miR-222 очень гомологичны, и их повышенная регуляция была продемонстрирована в нескольких типах опухолей человека. Было показано, что сверхэкспрессия miR-221/222 усиливает рост, миграцию и инвазию клеток при раке груди, легких и печени путем подавления PTEN [42].
Напротив, miRNAs, такие как семейство let-7 и miR-34, как известно, ингибируют трансляцию мРНК, кодирующих онкопротеины, которые регулируют апоптоз или дифференцировку клеток [43, 44]. Следовательно, они могут предотвращать развитие опухоли и известны как миРНК-супрессоры опухолей.Экспрессия let-7 была снижена при раке толстой кишки, груди и легких и была связана с плохой выживаемостью [45–47]. Было продемонстрировано, что активация let-7 подавляет рост рака легких in vitro [48]. Предыдущие исследования показали, что подавление let-7 увеличивает экспрессию проонкогенного белка RAS в опухолях легких [28, 29].
Три члена семейства miR-34, miR-34a, miR-34b и miR-34c подавлялись при раке легких, груди, толстой кишки и некоторых других раках [30–33].Они транскрипционно регулируются опухолевым супрессором p53 [30]. miR-34a играет важную роль в p53-опосредованном апоптозе при повреждении ДНК путем прямого нацеливания на антиапоптотические белки Bcl-2 и SIRT1 [31]. Кроме того, Liu et al. показали, что miR-34a может ингибировать стволовые клетки и метастазы рака простаты путем прямого подавления CD44 [32]. Истощение экспрессии miR-34a коррелировало с метастазированием и рецидивом рака, тогда как восстановление экспрессии miR-34a коррелировало с апоптозом и улучшало эффективность химиотерапии и облучения.
Другая группа miRNA-супрессоров опухолей, miR-15a и miR-16, впервые сообщалось об аберрантной экспрессии при раке в 2002 году, и было показано, что потеря этих miRNA связана с плохим прогнозом у пациентов с хроническим лимфолейкозом и раком толстой кишки. [34, 35]. Было продемонстрировано, что семейство miRNA-29 (miR-29a, miR-29b и miR-29c) аномально экспрессируется при множественном раке. Доказательства показали, что подавление активности семейства miR-29 коррелирует с онкогенезом, а также с прогрессированием рака [36].Fabbri et al. [37] сообщили, что miR-29 может функционировать как опухолевый супрессор, вмешиваясь в метилирование генов опухолевых супрессоров, где эта miRNA нацелена на ферменты, участвующие в метилировании ДНК (ДНК-метилтрансферазы 3A и 3B), которые активируются при раке легких. miR-29 был способен активировать повторную экспрессию подавляющих метилирование генов-супрессоров опухолей, включая хрупкий белок гистидиновой триады (FHIT) и оксидоредуктазу, содержащую WW-домен (WWOX) [37].
Доказательства показали, что подавление активности семейства miR-29 коррелирует с онкогенезом, а также с прогрессированием рака [36].Fabbri et al. [37] сообщили, что miR-29 может функционировать как опухолевый супрессор, вмешиваясь в метилирование генов опухолевых супрессоров, где эта miRNA нацелена на ферменты, участвующие в метилировании ДНК (ДНК-метилтрансферазы 3A и 3B), которые активируются при раке легких. miR-29 был способен активировать повторную экспрессию подавляющих метилирование генов-супрессоров опухолей, включая хрупкий белок гистидиновой триады (FHIT) и оксидоредуктазу, содержащую WW-домен (WWOX) [37].
Многочисленные исследования in vitro, , а также in vivo сообщили, что подавление экспрессии miRNA может способствовать онкогенезу.Активность онкогенных или опухолевых миРНК-супрессоров не ограничивалась типом опухоли или ее происхождением, поскольку опухолевые клетки могли пролиферировать и метастазировать в отдаленные органы [49, 50]. Хотя приведенные примеры включают небольшое подмножество miRNAs, участвующих в развитии рака, они подчеркивают концепцию, что нацеливание на аномально экспрессируемые miRNAs может иметь многообещающее влияние на разработку будущих методов лечения рака.
4. Механизм дерегуляции miRNA при раке
Известно, что в опухолевых клетках нарушена регуляция экспрессии miRNA [4, 51].Повышенные или пониженные уровни miRNAs в опухолях обычно приводят к генетическим аномалиям, изменениям в эпигенетической и транскрипционной регуляции или дефектам пути биогенеза miRNA [51]. Напр., Потеря кластера miR-15a и miR-16-1 на хромосоме 13q14 является одной из причин дерегуляции miRNA при раке. Онкогенез обычно коррелирует с хромосомными аберрациями, такими как амплификация, делеция или транслокация конкретных геномных областей, окружающих гены miRNA.Полногеномный анализ сообщил об изобилии генов miRNA, которые были расположены в связанных с раком геномных областях или хрупких сайтах, в минимальных областях потери гетерозиготности, минимальных областях амплификации или областях общих точек разрыва [52].
Известно, что экспрессия miRNA тесно регулируется различными факторами транскрипции. Факторы транскрипции могут активировать miRNA, индуцируя транскрипцию pre-miRNA.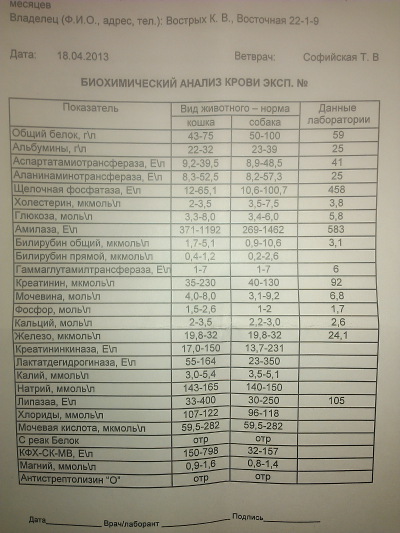 Этот процесс хорошо известен в некоторых случаях, когда тканеспецифическая miRNA активируется факторами транскрипции во время дифференцировки.Взаимосвязь между miRNA и факторами транскрипции была идентифицирована при раке, и было обнаружено, что измененная экспрессия ключевых факторов транскрипции, таких как c-Myc, p53 и E2F, приводит к нарушению регуляции экспрессии miRNA, которая может способствовать развитию опухоли [53-57] .
Этот процесс хорошо известен в некоторых случаях, когда тканеспецифическая miRNA активируется факторами транскрипции во время дифференцировки.Взаимосвязь между miRNA и факторами транскрипции была идентифицирована при раке, и было обнаружено, что измененная экспрессия ключевых факторов транскрипции, таких как c-Myc, p53 и E2F, приводит к нарушению регуляции экспрессии miRNA, которая может способствовать развитию опухоли [53-57] .
Кроме того, эпигенетические изменения также могут влиять на экспрессию miRNA. Изменение будет включать гипометилирование геномной ДНК, аномальное гиперметилирование ДНК генов-супрессоров опухолей и нарушение паттернов модификации гистонов [58].В большинстве случаев рака гиперметилирование CpG-островков в промоторных областях может приводить к наследственному подавлению транскрипции генов-супрессоров опухолей. Fazi et al. продемонстрировали, что экспрессия miR-223 эпигенетически подавляется с помощью AML1 / ETO, наиболее распространенного слитого белка, ассоциированного с острым миелоидным лейкозом, посредством метилирования CpG [59].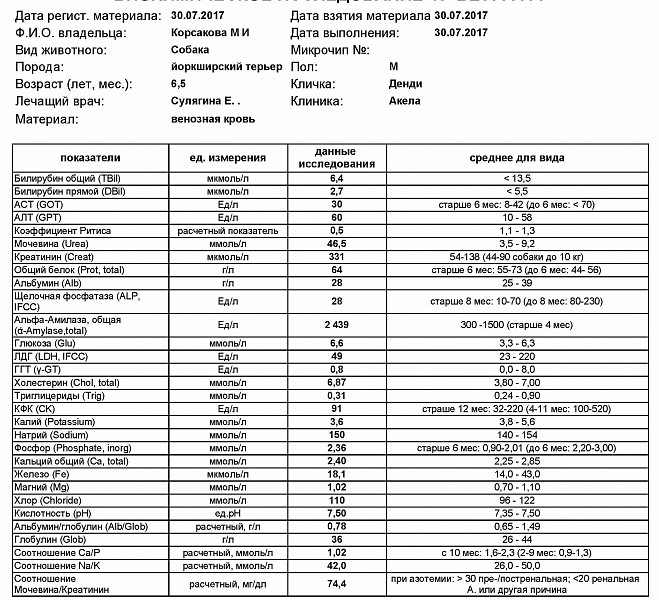 Кроме того, Сайто и др. сообщили, что 17 из 313 человеческих miRNAs были активированы в клетках рака мочевого пузыря Т24 после одновременного лечения ингибиторами метилирования ДНК и ацетилирования гистонов [60].Среди всех miRNA, miR-127, встроенная в островок CpG со сниженной экспрессией в раковых клетках, имела значительно повышенную экспрессию после обработок, за которой следовало подавление протоонкогена BCL6. Эти данные показали, что деметилирование ДНК и ингибирование гистондеацетилазы способны активировать экспрессию miRNA, которые могут действовать как опухолевые супрессоры. В другом исследовании Lujambio et al. показали, что метилирование CpG коррелирует с подавлением miR-148a и miR-34b / c из-за гиперметилирования в опухолях [61].Восстановление этих miRNA в опухоли коррелировало с препятствием для подвижности, роста опухоли и метастазирования in vivo . Таким образом, эти результаты продемонстрировали функцию эпигенетической регуляции экспрессии miRNA во время туморогенеза.
Кроме того, Сайто и др. сообщили, что 17 из 313 человеческих miRNAs были активированы в клетках рака мочевого пузыря Т24 после одновременного лечения ингибиторами метилирования ДНК и ацетилирования гистонов [60].Среди всех miRNA, miR-127, встроенная в островок CpG со сниженной экспрессией в раковых клетках, имела значительно повышенную экспрессию после обработок, за которой следовало подавление протоонкогена BCL6. Эти данные показали, что деметилирование ДНК и ингибирование гистондеацетилазы способны активировать экспрессию miRNA, которые могут действовать как опухолевые супрессоры. В другом исследовании Lujambio et al. показали, что метилирование CpG коррелирует с подавлением miR-148a и miR-34b / c из-за гиперметилирования в опухолях [61].Восстановление этих miRNA в опухоли коррелировало с препятствием для подвижности, роста опухоли и метастазирования in vivo . Таким образом, эти результаты продемонстрировали функцию эпигенетической регуляции экспрессии miRNA во время туморогенеза.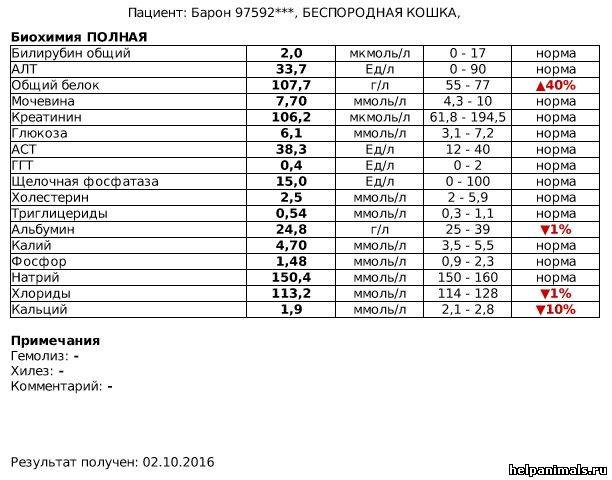
miRNA контролируется несколькими ферментами и регуляторными белками, такими как Drosha, Dicer, DGCR8, Argonaute белки и Exportin-5, которые обеспечивают правильное созревание miRNA из первичных предшественников miRNA. Таким образом, мутация или аномальная экспрессия любой части системы биогенеза miRNA может приводить к аберрантной экспрессии miRNAs, которая связана с плохим прогнозом и прогрессированием опухоли [62, 63].
5. Терапия, нацеленная на miRNA при раке человека
Поскольку miRNA участвуют в пролиферации, инвазии и метастазировании опухолей, генная терапия на основе miRNA становится новой стратегией лечения рака. Существуют две терапевтические стратегии, предназначенные для восстановления физиологической экспрессии miRNA в опухолевых клетках, либо путем ингибирования активности miRNA при сверхэкспрессии oncomiR, либо путем восстановления активности miRNA, когда miRNA-супрессор опухоли репрессируется.
5.1. Терапия ингибированием miRNA
Терапия ингибированием miRNA применяется для подавления функции онкомиР, которые значительно активированы в опухолевых клетках, и помогает восстановить нормальную экспрессию и функцию генов-супрессоров опухолей. OncomiRs можно ингибировать, применяя антисмысловые олигонуклеотиды против miR (AMO), заблокированные нуклеиновые кислоты (LNA), антагомиры miRNA и губки miRNA [64]. В основе этих подходов лежат ингибиторы miRNA, которые по существу комплементарны одноцепочечному олигонуклеотиду и способны изолировать эндогенную miRNA в нераспознаваемой структуре, что приводит к инактивации и удалению зрелых miRNA из RISC.
OncomiRs можно ингибировать, применяя антисмысловые олигонуклеотиды против miR (AMO), заблокированные нуклеиновые кислоты (LNA), антагомиры miRNA и губки miRNA [64]. В основе этих подходов лежат ингибиторы miRNA, которые по существу комплементарны одноцепочечному олигонуклеотиду и способны изолировать эндогенную miRNA в нераспознаваемой структуре, что приводит к инактивации и удалению зрелых miRNA из RISC.
AMO представляют собой одноцепочечные химически модифицированные антисмысловые олигонуклеотиды, которые имеют длину около 17–22 нуклеотидов и были разработаны, чтобы быть комплементарными интересующей микроРНК [65]. Этот антисмысловой олигонуклеотид был разработан для связывания с комплементарной зрелой миРНК и ингибирования взаимодействия этой миРНК с ее специфическими мишенями мРНК, тем самым обеспечивая нормальную трансляцию. LNA является примером модифицированного AMO [66]. LNA-модифицированные антисмысловые олигонуклеотиды были способны проявлять более высокую термостабильность и сродство со своими молекулами-мишенями miRNA, имели более высокую растворимость в воде и повышенную метаболическую стабильность для доставки in vivo и [67]. Исследование in vivo , проведенное Griveau et al. продемонстрировали, что LNA-модифицированные антисмысловые олигонуклеотиды способны подавлять сверхэкспрессию miR-21 в глиобластомах, что приводит к значительному снижению жизнеспособности клеток, а также к повышению внутриклеточного уровня каспазы [68].
Исследование in vivo , проведенное Griveau et al. продемонстрировали, что LNA-модифицированные антисмысловые олигонуклеотиды способны подавлять сверхэкспрессию miR-21 в глиобластомах, что приводит к значительному снижению жизнеспособности клеток, а также к повышению внутриклеточного уровня каспазы [68].
Антагомиры представляют собой химически модифицированные одноцепочечные молекулы РНК из 23 нуклеотидов, комплементарные целевым miRNA, для повышения стабильности РНК и предотвращения ее деградации [69, 70]. Ma et al.сообщили, что подавление miR-10b с помощью антагомира ингибирует метастазирование в модели опухоли молочной железы мышей. Они также сообщили, что подавление этой miRNA с помощью антагомиров значительно снижает уровни miR-10b и индуцирует уровни функционально жизнеспособной мишени miR-10b, HOXD10 [41].
Помимо обработки LNA, губки miRNA также использовались для ингибирования онкомиР. Губки miRNA представляют собой класс РНК, которые содержат множество искусственных сайтов связывания miRNA, которые конкурируют с эндогенными мишенями miRNA за связывание miRNA [71].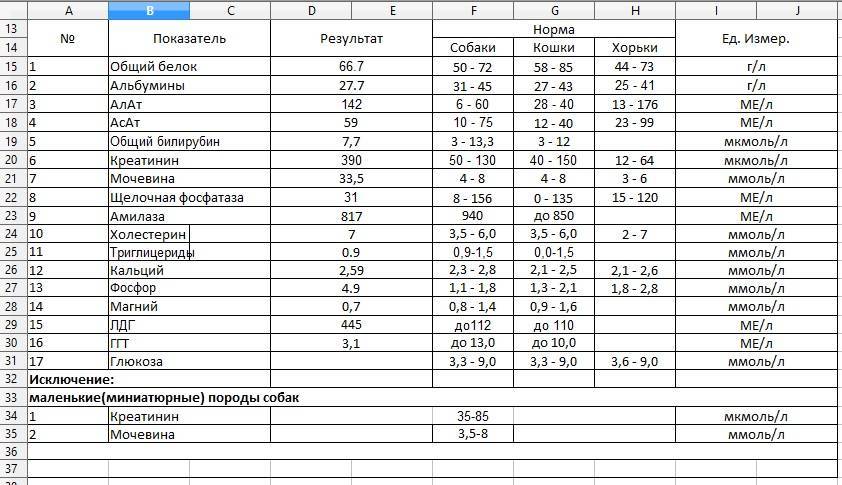 В клетках рака груди miR-9 сверхэкспрессируется и препятствует экспрессии CDh2, гена-супрессора опухоли. Губки miRNA, содержащие четыре сайта связывания miR-9, способны эффективно блокировать функцию miR-9 и восстанавливать эндогенную экспрессию CDh2, что, следовательно, ингибирует метастазирование [72]. Недавно была изготовлена недавно разработанная искусственная губка miRNA. На основе естественной кольцевой РНК (circRNA), документально подтвержденной как эндогенные губки miRNA, была синтезирована функциональная искусственная губка circRNA с использованием простого метода ферментативного лигирования.Эта искусственная молекула circRNA была разработана как экзогенный ингибитор miRNA, который эффективно связывает и ингибирует зрелую РНК, таким образом проявляя терапевтический потенциал [73]. Одна circRNA может регулировать одну или несколько miRNA через разные сайты связывания miRNA в кольцевой последовательности. Лю и др. разработали губки circRNA для miR-21 и miR-221, которые были перенесены в вектор, продуцирующий кольцевые губки, и, как сообщалось, он был более эффективным в ингибировании мишеней miRNA по сравнению с линейными губками в клеточных линиях злокачественной меланомы.
В клетках рака груди miR-9 сверхэкспрессируется и препятствует экспрессии CDh2, гена-супрессора опухоли. Губки miRNA, содержащие четыре сайта связывания miR-9, способны эффективно блокировать функцию miR-9 и восстанавливать эндогенную экспрессию CDh2, что, следовательно, ингибирует метастазирование [72]. Недавно была изготовлена недавно разработанная искусственная губка miRNA. На основе естественной кольцевой РНК (circRNA), документально подтвержденной как эндогенные губки miRNA, была синтезирована функциональная искусственная губка circRNA с использованием простого метода ферментативного лигирования.Эта искусственная молекула circRNA была разработана как экзогенный ингибитор miRNA, который эффективно связывает и ингибирует зрелую РНК, таким образом проявляя терапевтический потенциал [73]. Одна circRNA может регулировать одну или несколько miRNA через разные сайты связывания miRNA в кольцевой последовательности. Лю и др. разработали губки circRNA для miR-21 и miR-221, которые были перенесены в вектор, продуцирующий кольцевые губки, и, как сообщалось, он был более эффективным в ингибировании мишеней miRNA по сравнению с линейными губками в клеточных линиях злокачественной меланомы. Было показано, что трансфекция circRNA, нацеленная на miRNA-21, ингибирует пролиферацию клеток рака желудка, вызывая апоптоз и дерегулируя глобальную экспрессию белка [74].
Было показано, что трансфекция circRNA, нацеленная на miRNA-21, ингибирует пролиферацию клеток рака желудка, вызывая апоптоз и дерегулируя глобальную экспрессию белка [74].
5.2. Терапия восстановления миРНК
Терапия восстановления миРНК используется для индукции апоптоза или подавления пролиферации опухолевых клеток путем восстановления экзогенных миРНК, подавляющих опухоль, которые подавляются в опухолевых клетках. Терапия восстановления miRNA может быть реализована с использованием синтетических миметиков miRNA или вирусных векторов, экспрессирующих miRNA.Миметики miRNA способны восстанавливать нормальную функцию эндогенных miRNA, заменяя потерю miRNA. Химически модифицированные дуплексы РНК могут быть загружены в RISC для обеспечения последующего ингибирования целевых мРНК [64]. Различные исследования продемонстрировали эффективность терапии восстановления miRNA in vitro и in vivo . Например, добавление miRNA, имитирующей miR-15, в клеточные линии рака простаты вызывало значительный апоптоз и подавляло пролиферацию [75]. Исследование in vivo на мутантных мышах по K-ras путем интраназального введения let-7 эффективно сдерживало рост опухолей, блокируя пролиферацию клеток и пути клеточного цикла [76, 77].
Исследование in vivo на мутантных мышах по K-ras путем интраназального введения let-7 эффективно сдерживало рост опухолей, блокируя пролиферацию клеток и пути клеточного цикла [76, 77].
Другой стратегией терапии восстановления miRNA является использование векторов экспрессии miRNA, таких как аденовирусные, лентивирусные и ретровирусные векторы, для увеличения экспрессии miRNA, которые приводят к подавлению опухоли. Kota et al. сообщили о потере экспрессии miR-26 при раке печени человека, даже несмотря на то, что он экспрессируется на высоких уровнях в нормальных тканях [78].Было продемонстрировано, что эктопическая экспрессия этой миРНК в клеточных линиях рака печени индуцирует остановку клеточного цикла. Внутривенная инъекция рекомбинантного аденовируса, несущего miR-26, приводила к ингибированию онкогенности за счет усиления апоптоза опухоли и подавления роста клеток без каких-либо признаков токсичности.
6. Проблемы при разработке терапевтических средств на основе miRNA
Использование miRNA для лечения рака в последние годы привлекло большое внимание. Несмотря на наличие некоторых достижений в использовании miRNA для ингибирующей и восстанавливающей терапии в доклинических исследованиях, остаются серьезные препятствия для их успешного внедрения.Основным препятствием терапии миРНК при раке является доставка антагонистов миРНК или миметиков миРНК к тканям опухоли-мишени с эффективным проникновением в опухолевую массу. Сдавление аномальных сосудов опухоли, а также протекающие структуры способствовали плохой перфузии крови, что могло снизить эффективность доставки голой miRNA [79].
Несмотря на наличие некоторых достижений в использовании miRNA для ингибирующей и восстанавливающей терапии в доклинических исследованиях, остаются серьезные препятствия для их успешного внедрения.Основным препятствием терапии миРНК при раке является доставка антагонистов миРНК или миметиков миРНК к тканям опухоли-мишени с эффективным проникновением в опухолевую массу. Сдавление аномальных сосудов опухоли, а также протекающие структуры способствовали плохой перфузии крови, что могло снизить эффективность доставки голой miRNA [79].
Другой проблемой доставки miRNA является поддержание целостности и стабильности miRNAs в циркуляции. Немодифицированные или голые miRNA быстро разлагаются в течение нескольких секунд нуклеазами сыворотки, такими как РНКаза A-типа, и выводятся из кровотока.Кроме того, голые миРНК быстро выводятся почками, что приводит к короткому периоду полужизни в системном кровотоке [80]. Кроме того, miRNA также способны вызывать иммунотоксичность. Системная доставка miRNA активирует врожденную иммунную систему, что приводит к резкой токсичности и значительным нежелательным побочным эффектам.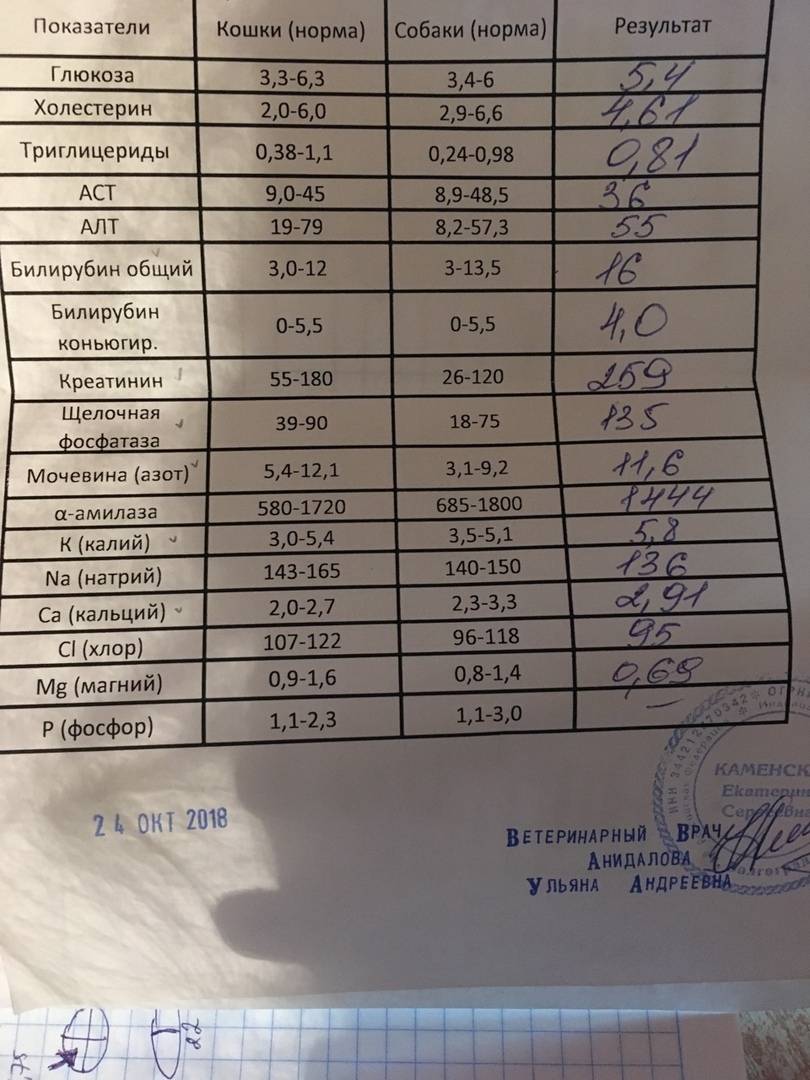 Системное введение дуплексов miRNA может запускать секрецию воспалительных цитокинов и интерферонов I типа (IFN) через Toll-подобные рецепторы (TLR).
Системное введение дуплексов miRNA может запускать секрецию воспалительных цитокинов и интерферонов I типа (IFN) через Toll-подобные рецепторы (TLR).
Одна из огромных проблем, связанных с терапией миРНК, — это побочные эффекты миРНК, не соответствующие цели.Поскольку они предназначены для нацеливания на множественные пути через несовершенное совпадение в 3 ‘UTR, miRNAs могут вызывать нежелательное подавление гена множественных генов-супрессоров опухолей. Молчание нецелевого гена может вызвать потенциальную токсичность и впоследствии снизить терапевтические эффекты. Комбинаторная стратегия может быть добавлена к терапии miRNA для предотвращения нежелательных эффектов вне мишени [81]. Сообщалось, что многофункциональные наночастицы, которые кодируют miRNA и siRNA, которые могут заглушать определенные онкогенные пути и активировать miRNA, подавляющие опухоль, избегают нецелевых эффектов [82].
7. Доставка терапевтических средств на основе miRNA
Для повышения эффективности доставки miRNA существуют две основные стратегии: местная (внутри опухоли) или системная доставка. Местная доставка полезна, так как требует меньших доз miRNA, демонстрирует пониженную токсичность и может избирательно доставлять miRNA к тканям-мишеням [83]. Тем не менее, местная доставка полезна только при солидных опухолях и бесполезна при гематологических злокачественных новообразованиях, таких как лейкемия. Кроме того, местная доставка также не подходит для метастазирующих раковых клеток, наблюдаемых на поздних стадиях заболевания, поскольку они не подвергаются действию РНК-препаратов, находящихся в кровотоке.Таким образом, системная доставка является предпочтительным путем введения, поскольку она обеспечивает большую эффективность биораспределения лекарств в тканях-мишенях. Значительный прогресс был достигнут в разработке системных стратегий доставки miRNA. В настоящее время используются как невирусные, так и вирусные системы доставки miRNA, где есть определенные преимущества и недостатки для каждого из подходов (Таблица 2).
Местная доставка полезна, так как требует меньших доз miRNA, демонстрирует пониженную токсичность и может избирательно доставлять miRNA к тканям-мишеням [83]. Тем не менее, местная доставка полезна только при солидных опухолях и бесполезна при гематологических злокачественных новообразованиях, таких как лейкемия. Кроме того, местная доставка также не подходит для метастазирующих раковых клеток, наблюдаемых на поздних стадиях заболевания, поскольку они не подвергаются действию РНК-препаратов, находящихся в кровотоке.Таким образом, системная доставка является предпочтительным путем введения, поскольку она обеспечивает большую эффективность биораспределения лекарств в тканях-мишенях. Значительный прогресс был достигнут в разработке системных стратегий доставки miRNA. В настоящее время используются как невирусные, так и вирусные системы доставки miRNA, где есть определенные преимущества и недостатки для каждого из подходов (Таблица 2).
| |||||||||||||||||||||||||||||||||||||||
7.1. Невирусные векторы
Использование невирусных векторов является эффективным подходом для доставки микроРНК. Невирусные векторные системы обладают низкой иммуногенностью и меньшей токсичностью, и нет ограничений на размер доставляемых генов. Благодаря этим особенностям невирусная доставка стала более популярной и широко применяется для доставки miRNA, поскольку она может увеличивать клеточное поглощение и фармакологическую эффективность антисмысловых олигонуклеотидов in vivo . Невирусные векторы доставки можно разделить на три основные группы, включая векторы на основе липидов, полимерные векторы и векторы на основе неорганических частиц.
Благодаря этим особенностям невирусная доставка стала более популярной и широко применяется для доставки miRNA, поскольку она может увеличивать клеточное поглощение и фармакологическую эффективность антисмысловых олигонуклеотидов in vivo . Невирусные векторы доставки можно разделить на три основные группы, включая векторы на основе липидов, полимерные векторы и векторы на основе неорганических частиц.
7.1.1. Векторы на основе липидов
Наиболее изученными носителями для доставки миРНК являются векторы на основе липидов. Подходы на основе липидов используют липидные комплексы, известные как липосомы, в качестве носителей для доставки. Существует три типа липосом, основанных на зарядах, таких как катионные, анионные и нейтральные липосомы. Например, катионные липоплексы чаще всего используются в невирусных системах доставки, поскольку они обладают уникальными характеристиками, такими как высокое сродство к клеточной мембране, неиммуногенность, непатогенность и простота получения. Системная доставка miR-29b с использованием катионного липоплекса в немелкоклеточный рак легкого (NSCLC), как было показано, увеличивает экспрессию miR-29b в пять раз и снижает скорость роста опухоли примерно на 60% [84]. Piao et al. продемонстрировали доставку pre-miR-107 на доклинической модели плоскоклеточного рака головы и шеи с использованием наночастиц катионных липидов, что показало снижение роста опухоли на 45,2% по сравнению с контрольными препаратами, получавшими pre-miR [85].
Системная доставка miR-29b с использованием катионного липоплекса в немелкоклеточный рак легкого (NSCLC), как было показано, увеличивает экспрессию miR-29b в пять раз и снижает скорость роста опухоли примерно на 60% [84]. Piao et al. продемонстрировали доставку pre-miR-107 на доклинической модели плоскоклеточного рака головы и шеи с использованием наночастиц катионных липидов, что показало снижение роста опухоли на 45,2% по сравнению с контрольными препаратами, получавшими pre-miR [85].
Lipofectamine®, TransIT® 2020 и Oligofectamine ™ являются несколькими примерами коммерчески доступных катионных липосом, способных транспортировать нуклеиновые кислоты в клетки [86, 87].Однако наиболее существенным недостатком липосомальной системы доставки является стабильность наночастиц в сыворотке крови из-за неспецифического связывания с белками сыворотки. Для увеличения периода полужизни из кровообращения конъюгация липидов с гидрофильными полимерами, такими как полиэтиленгликоль (ПЭГ), может значительно повысить их стабильность, что приводит к длительному периоду полужизни до 72 часов в сыворотке [88].
Липосомы дают возможность сочетать доставку miRNA с различными химиотерапевтическими препаратами, что может привести к синергическому и улучшенному терапевтическому эффекту.Для улучшения терапии цисплатином и снижения лекарственной устойчивости использовали покрытые цисплатином липосомы, нагруженные miR-375, при гепатоцеллюлярной карциноме (HCC). Наночастицы были разработаны путем объединения двух обратных микроэмульсий, состоящих из раствора KCl и растворимой цис -диаминдигидроплатины (II), покрытой катионным липидным слоем, с интеграцией miR-375 в покрытый липидом цисплатин. In vitro анализ исследования показал, что этот тип кодирования показал эффективное ускользание miR-375, а также индуцировал скорость апоптоза и остановку клеточного цикла в клетках HCC [89].
7.1.2. Векторы на основе полимеров
Полимерные векторы заняли выдающееся положение среди невирусных векторов благодаря своим положительным свойствам, таким как низкая токсичность и иммуногенность, а также высокая вариабельность состава, и ими можно было манипулировать для улучшения клеточного поглощения, тканевой специфичности и стабильности. Примерами полимерных векторов являются полиэтиленимин (PEI), сополимер молочной и гликолевой кислоты (PLGA) и полиамидоамин (PAMAM). PEI является наиболее широко используемым катионным полимером из-за его высокой эффективности трансфекции.PEI с высоким молекулярным весом обеспечивают высокую эффективность трансфекции при высокой токсичности, тогда как PEI с низким молекулярным весом более биосовместимы с меньшей эффективностью. Ибрагим и др. использовали низкомолекулярные PEI для доставки миметиков miR-33a, а также miR-145 мышам с ксенотрансплантатом рака толстой кишки, а полимерные наночастицы с miRNA приводили к увеличению гибели клеток и снижению роста опухоли [90]. Кроме того, доставка miR-145, инкапсулированной в короткий полиуретан, и разветвленный полиэтиленимин (PU-PEI) в комбинации с цисплатином снижает рост опухоли и метастазирование в модели ксенотрансплантата рака легких у мышей [91].
Примерами полимерных векторов являются полиэтиленимин (PEI), сополимер молочной и гликолевой кислоты (PLGA) и полиамидоамин (PAMAM). PEI является наиболее широко используемым катионным полимером из-за его высокой эффективности трансфекции.PEI с высоким молекулярным весом обеспечивают высокую эффективность трансфекции при высокой токсичности, тогда как PEI с низким молекулярным весом более биосовместимы с меньшей эффективностью. Ибрагим и др. использовали низкомолекулярные PEI для доставки миметиков miR-33a, а также miR-145 мышам с ксенотрансплантатом рака толстой кишки, а полимерные наночастицы с miRNA приводили к увеличению гибели клеток и снижению роста опухоли [90]. Кроме того, доставка miR-145, инкапсулированной в короткий полиуретан, и разветвленный полиэтиленимин (PU-PEI) в комбинации с цисплатином снижает рост опухоли и метастазирование в модели ксенотрансплантата рака легких у мышей [91].
PLGA — это хорошо известный одобренный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) нетоксичный, биосовместимый и биоразлагаемый полимер, используемый для доставки лекарств, а также для доставки анти-миРНК [92]. Система доставки на основе PLGA была способна поддерживать высвобождение лекарств и поддерживать физическую адсорбцию множества нацеленных лигандов на их поверхности. Ли и др. продемонстрировали, что лечение комплексами наночастиц на основе PLGA / ингибитор miR-221 подавляет рост клеток, способность к колониеобразованию, миграцию и инвазию ГЦК [93].Кроме того, полимер PLGA также может быть модифицирован. Модификация поверхности PLGA с помощью PEG значительно увеличивала время удерживания и циркуляции частиц in vivo [94, 95]. Например, модификации поверхности частиц успешно кодировали анти-miR-10b и анти-miR-21, что привело к снижению роста опухоли в ксенотрансплантате рака молочной железы мыши [96]. Одним из преимуществ использования PLGA в системе доставки является высокая емкость частиц PLGA. Доставка сополимеров, содержащих PLGA и PEI, была основана на использовании преимуществ высокой эффективной загрузочной способности PLGA и эффективного клеточного поглощения PEI.Wang et al.
Система доставки на основе PLGA была способна поддерживать высвобождение лекарств и поддерживать физическую адсорбцию множества нацеленных лигандов на их поверхности. Ли и др. продемонстрировали, что лечение комплексами наночастиц на основе PLGA / ингибитор miR-221 подавляет рост клеток, способность к колониеобразованию, миграцию и инвазию ГЦК [93].Кроме того, полимер PLGA также может быть модифицирован. Модификация поверхности PLGA с помощью PEG значительно увеличивала время удерживания и циркуляции частиц in vivo [94, 95]. Например, модификации поверхности частиц успешно кодировали анти-miR-10b и анти-miR-21, что привело к снижению роста опухоли в ксенотрансплантате рака молочной железы мыши [96]. Одним из преимуществ использования PLGA в системе доставки является высокая емкость частиц PLGA. Доставка сополимеров, содержащих PLGA и PEI, была основана на использовании преимуществ высокой эффективной загрузочной способности PLGA и эффективного клеточного поглощения PEI.Wang et al. показали, что покрытые гиалуроновой кислотой наночастицы PEI-PLGA, кодируемые химиотерапевтическим препаратом доксорубицин и miR-542-3p, индуцировали хорошее поглощение лекарства и вызывали цитотоксичность в трижды отрицательных клетках рака груди [97].
показали, что покрытые гиалуроновой кислотой наночастицы PEI-PLGA, кодируемые химиотерапевтическим препаратом доксорубицин и miR-542-3p, индуцировали хорошее поглощение лекарства и вызывали цитотоксичность в трижды отрицательных клетках рака груди [97].
ПАМАМ представляет собой положительно заряженный полимер с большим количеством поверхностных аминогрупп. В отличие от неразлагаемого PEI, PAMAM представляет собой биоразлагаемый и биосовместимый полимер, который проявляет относительно низкую токсичность. Ren et al. продемонстрировали, что доставка анти-miR-21 к клеткам глиобластомы человека с использованием PAMAM в качестве носителя может значительно индуцировать апоптоз и снижать рост клеток [98].Кроме того, Conde et al. продемонстрировали, что конъюгация тройных спиралей РНК с дендримером PAMAM G5, содержащим miR-205 и анти-miR-221, приводит к уменьшению размера опухоли на 90% и увеличению выживаемости [99].
7.1.3. Доставка на основе неорганических материалов
Помимо липидов и полимеров, неорганические наночастицы используются во многих исследованиях для доставки миРНК. Примеры неорганических векторов для доставки miRNA включают наночастицы золота (AuNP), углеродные нанотрубки и наночастицы на основе оксида железа.Преимущество неорганических носителей состоит в том, что они нетоксичны и неиммуногенны, обладают высокой стабильностью in vivo и относительно просты в производстве. Однако общей проблемой неорганических наночастиц является взаимодействие между носителями и нуклеиновыми кислотами. Неорганические носители обладают долговременной коллоидной стабильностью в водных растворах в отсутствие поверхностно-активных веществ и неспецифическим сродством связывания с многочисленными функциональными группами, присутствующими в биологических системах [100].
Примеры неорганических векторов для доставки miRNA включают наночастицы золота (AuNP), углеродные нанотрубки и наночастицы на основе оксида железа.Преимущество неорганических носителей состоит в том, что они нетоксичны и неиммуногенны, обладают высокой стабильностью in vivo и относительно просты в производстве. Однако общей проблемой неорганических наночастиц является взаимодействие между носителями и нуклеиновыми кислотами. Неорганические носители обладают долговременной коллоидной стабильностью в водных растворах в отсутствие поверхностно-активных веществ и неспецифическим сродством связывания с многочисленными функциональными группами, присутствующими в биологических системах [100].
AuNP были использованы для эффективной доставки miRNA к клеткам рака груди и простаты in vitro .Исследование Ekin et al. разработали высокоаффинный наноноситель на основе наночастиц золота, модифицированный тиолированными РНК, и miR-145 была гибридизирована с РНК, прикрепленными к AuNP. Комплекс AuNP-РНК-миРНК-носитель успешно доставлялся и усиливал экспрессию miR-145 как в клетках рака груди, так и в клетках рака простаты [101].
Комплекс AuNP-РНК-миРНК-носитель успешно доставлялся и усиливал экспрессию miR-145 как в клетках рака груди, так и в клетках рака простаты [101].
Карбонат-апатит представляет собой привлекательную характеристику среди неорганических наночастиц из-за его способности к биоразложению, гетерогенного распределения заряда и легко генерируемых наноразмерных частиц [102].Hossain et al. продемонстрировали эффективную трансфекцию miRNA-супрессоров опухолей в клетки рака толстой кишки с использованием системы доставки на основе карбонат-апатита [103]. Hiraki et al. сообщили, что системное введение карбонат-апатита в составе miR-4689 резко ингибирует рост опухоли in vivo путем прямого воздействия на KRAS, а также AKT [104]. С другой стороны, Inoue et al. также показали, что на моделях ксенотрансплантатов мышей системное введение miR-29b-1-5p с использованием карбонат-апатита в качестве носителя для доставки значительно ингибирует рост опухоли и пролиферацию мутантных клеток рака толстой кишки по KRAS без какой-либо особой токсичности [105].
7.2. Вирусные векторы
Системы на основе вирусных векторов, такие как ретровирусы, лентивирусы и аденовирусы или аденоассоциированные вирусы (AVV), были модифицированы в некоторых конкретных геномных областях, так что они не могли реплицироваться, и их безопасность могла быть повышена. Преимуществами систем доставки вирусных векторов являются их высокая эффективность трансфекции и высокие уровни постоянной экспрессии miRNA или антагомиров. Например, было показано, что система экспрессии лентивирусной miR-34a значительно индуцирует экспрессию miR-34a и усиливает апоптоз в клетках множественной миеломы.Трансдуцированные лентивирусным вектором ксенотрансплантаты множественной миеломы с конститутивной экспрессией miR-34a продемонстрировали значительное ингибирование роста мышей с тяжелым комбинированным иммунодефицитом (SCID) [106]. Кроме того, лентивирусный вектор также использовался для доставки miR-34a к клеткам рака простаты, и полученные данные показали, что он ингибирует метастазирование опухолевых клеток и увеличивает выживаемость животных [32].
Системная доставка miR-26a, переносимая AAV и доставляемая в HCC человека, была способна вызывать остановку клеточного цикла, апоптоз раковых клеток и ингибирование роста опухоли.Более того, системное введение AAV-miR-26 показало неопределяемую токсичность [78]. Таким образом, восстановительная терапия miRNA с использованием AAV является безопасной и эффективной стратегией лечения рака. Недавние исследования показали, что экзосомы, представляющие собой наноразмерные липидные везикулы, высвобождаемые инфицированными вирусом клетками, были способны инкапсулировать и доставлять терапевтические РНК в клетки-мишени. Pegtel et al. продемонстрировали, что инфицированные вирусом клетки упаковывают кодируемые вирусом miRNA в экзосомы, а грузы miRNA позже доставляются в неинфицированные клетки-мишени [107, 108].Это указывает на то, что экзосомы могут быть использованы для терапевтической доставки miRNA. Например, экзосомы, полученные из вирусов, нацеленных на клетки печени, были разработаны для доставки терапевтических миРНК для лечения рака печени [109].
8. Нанотерапия, направленная на микроокружение опухоли
Микроокружение опухоли играет важную роль в контроле распределения и биологических эффектов нанохимиотерапевтических средств. Сложность микросреды опухоли снижает доставку эффективных концентраций обычных лекарств для уничтожения раковых клеток.Это привело к использованию различных стратегий, включающих доставку лекарств в виде наночастиц, для достижения опухолевой специфичности, а также для повышения терапевтического индекса химиотерапевтических препаратов. Крайне важно понимать биологию опухоли, чтобы разработать эффективное лекарственное лечение, которое может победить лекарственную устойчивость, остановить прогрессирование опухоли и препятствовать метастазированию [110]. В общем, стратегии нацеливания концентрируются на праймировании микроокружения опухоли, чтобы способствовать большему поглощению нано-химиотерапевтических средств, а также наноносителей, нацеленных на опухоли, посредством использования соответствующих подходов, таких как экспрессия рецепторов, ферменты или модуляция микроокружения опухоли.
Нанохимиотерапевтические препараты зависят от сосудистой сети опухоли, в которой они экстравазируются в интерстиций опухоли для поглощения лекарственного средства. Тем не менее, локализации нано-химиотерапевтических средств в микроокружении опухоли также может препятствовать повышенное давление интерстициальной жидкости, нарушение состава внеклеточного матрикса (ЕСМ), усиленное деление клеток и снижение лимфатического дренажа [111]. Таким образом, сосудистая сеть, связанная с опухолью, является одной из важных мишеней для получения локализации антиангиогенных химиотерапевтических средств для подавления роста опухоли.Наблюдается, что быстрорастущая сосудистая сеть опухоли имеет аномальные характеристики, такие как неправильная форма, хрупкость, извилистость и расширение [112]. Эти аномалии привели к более высокой проницаемости сосудов, что привело к изменчивости распределения крови. Плохой кровоток и повышенное давление интерстициальной жидкости привели к развитию гипоксических состояний, а также к появлению кислых участков.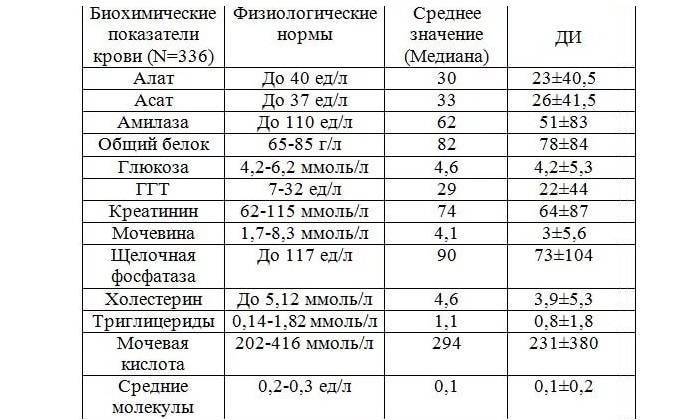 Эффект повышенной проницаемости и удерживания (EPR) макромолекул в опухолях коррелирует с протекающей сосудистой сетью опухоли.Эти протекающие сосуды способствуют инвазии опухолевых клеток и метастазированию. Все эти аномалии сосудистой сети опухоли могут нарушать доставку и препятствовать эффективности нано-химиотерапевтических средств [113]. Было предложено несколько методов преодоления неэффективной доставки лекарств в микросреде опухоли, включая восстановление сосудистой функции и декомпрессию сосудов опухоли. Стратегия нормализации сосудов была использована для ремоделирования сосудистой сети опухоли и приближения ее к «нормальному» состоянию.Его можно проводить с селективной дозировкой антиангиогенных препаратов, которые в первую очередь нацелены на фактор роста эндотелия сосудов (VEGF) или его рецепторы. Эта стратегия восстанавливает перфузию опухоли за счет укрепления стенки сосуда, а также структуры сосудистой сети, которая может снизить давление интерстициальной жидкости из-за уменьшения утечки жидкости из сосудов [114].
Эффект повышенной проницаемости и удерживания (EPR) макромолекул в опухолях коррелирует с протекающей сосудистой сетью опухоли.Эти протекающие сосуды способствуют инвазии опухолевых клеток и метастазированию. Все эти аномалии сосудистой сети опухоли могут нарушать доставку и препятствовать эффективности нано-химиотерапевтических средств [113]. Было предложено несколько методов преодоления неэффективной доставки лекарств в микросреде опухоли, включая восстановление сосудистой функции и декомпрессию сосудов опухоли. Стратегия нормализации сосудов была использована для ремоделирования сосудистой сети опухоли и приближения ее к «нормальному» состоянию.Его можно проводить с селективной дозировкой антиангиогенных препаратов, которые в первую очередь нацелены на фактор роста эндотелия сосудов (VEGF) или его рецепторы. Эта стратегия восстанавливает перфузию опухоли за счет укрепления стенки сосуда, а также структуры сосудистой сети, которая может снизить давление интерстициальной жидкости из-за уменьшения утечки жидкости из сосудов [114]. С другой стороны, декомпрессия сосудов опухоли может быть достигнута с помощью стратегий снятия стресса, направленных на ECM (коллаген и гиалуронан).Эта стратегия может улучшить перфузию спавшихся сосудов, снизить давление в интерстициальной жидкости за счет воздействия на компонент внеклеточного матрикса (коллаген и гиалуронан) и повысить проникновение лекарств в сосудистую сеть опухоли [115, 116].
С другой стороны, декомпрессия сосудов опухоли может быть достигнута с помощью стратегий снятия стресса, направленных на ECM (коллаген и гиалуронан).Эта стратегия может улучшить перфузию спавшихся сосудов, снизить давление в интерстициальной жидкости за счет воздействия на компонент внеклеточного матрикса (коллаген и гиалуронан) и повысить проникновение лекарств в сосудистую сеть опухоли [115, 116].
Нано-химиотерапевтические средства, направленные на микроокружение опухоли, могут быть одной из успешных стратегий снижения лекарственной устойчивости. Несколько эндогенных факторов, включая кислый pH, ферментативную активность, окислительный стресс, гипоксию, гипертермию, окислительно-восстановительный потенциал, АТФ и высокое давление интерстициальной жидкости, были рассмотрены для эффективной доставки нано-химиотерапевтических средств в микроокружение опухоли [117].Кроме того, во внимание принимаются специфические патофизиологические факторы в микроокружении опухоли, такие как различные уровни аминокислот, функциональных белков, фрагментов ДНК. Доклинические исследования с использованием пегилированных наноносителей, реагирующих на стимулы наноносителей и двойных функциональных наноносителей продемонстрировали выдающиеся результаты в подавлении роста опухоли за счет воздействия на микросреду опухоли. Все эти стратегии включают сайт-специфическое отщепление связи PEG, изменение поверхностного заряда, уменьшение размера частиц и восприимчивость к стимулам, таким как pH и температура [118–120].
Доклинические исследования с использованием пегилированных наноносителей, реагирующих на стимулы наноносителей и двойных функциональных наноносителей продемонстрировали выдающиеся результаты в подавлении роста опухоли за счет воздействия на микросреду опухоли. Все эти стратегии включают сайт-специфическое отщепление связи PEG, изменение поверхностного заряда, уменьшение размера частиц и восприимчивость к стимулам, таким как pH и температура [118–120].
Нано-химиотерапевтические средства могут изменять доставку лекарств, способствуя нарушениям в микросреде опухоли. Нанотехнология обеспечивает гибкий подход, позволяющий доставлять один или комбинацию химиотерапевтических средств вместе с множественными целевыми лигандами для специфического воздействия на восстановительную среду или сверхэкспрессированные рецепторы и ферменты, что является преобладающей характеристикой микроокружения опухоли [117]. Примеры лиганд-опосредованных нанохимиотерапевтических средств включают пептиды, антитела, углеводы и аптамер, связанный с наночастицами. Нано-химиотерапевтические конъюгаты с функциональным лигандом на поверхности могут играть значительную роль в повышении селективности лекарств в отношении сверхэкспрессированных рецепторов, особенно в отношении опухолевых клеток на всех участках [117, 121]. Эта стратегия проявляет целевую специфичность и способствует эффективному лечению с минимальными побочными эффектами.
Нано-химиотерапевтические конъюгаты с функциональным лигандом на поверхности могут играть значительную роль в повышении селективности лекарств в отношении сверхэкспрессированных рецепторов, особенно в отношении опухолевых клеток на всех участках [117, 121]. Эта стратегия проявляет целевую специфичность и способствует эффективному лечению с минимальными побочными эффектами.
9. Терапевтические миРНК в клинических испытаниях
миРНК обладают многообещающим терапевтическим потенциалом, и они находятся в стадии исследования нескольких фармацевтических фирм.OncomiR или miRNA-супрессоры опухолей, которые функционируют как главные регуляторы клеточных процессов, были оценены в нескольких клинических испытаниях, проведенных такими компаниями, как Mirna Therapeutics, EnGeneIC и miRagen Therapeutics (Таблица 3). В мае 2013 года MRX34 является наиболее продвинутым миметиком miRNA, который прошел клинические испытания (идентификатор ClinicalTrials.gov NCT01829971). Этот препарат является имитатором miR-34a в составе липосом, который действует как опухолевый супрессор. miR-34a обычно подавляется при большинстве раковых заболеваний человека, таких как рак груди, толстой кишки, почек, яичников, предстательной железы и кожи [124–126].Восстановление miR-34a потенциально может вызвать остановку клеточного цикла, старение и апоптоз раковых клеток [127, 128]. В июне 2016 г. в исследование были включены 99 пациентов с запущенными солидными опухолями [129]. Испытание включало исследование с увеличением дозы с двумя дозами в неделю или пятью дозами в день, вводимыми внутривенно. Каждый из пациентов с ГЦК, акральной меланомой и почечно-клеточной карциномой (ПКР) достиг частичного ответа в конце испытания, который оценивался с помощью критериев оценки ответа на солидную опухоль (RECIST), и у 14 пациентов было выявлено стабильное заболевание.Анализ лейкоцитов показал значительную репрессию генов-мишеней miR-34a, таких как PI (FOXP1) и BCL2. Однако в 2016 г. исследование было остановлено из-за пяти тяжелых иммунных побочных эффектов, приведших к смерти пациентов [129].
miR-34a обычно подавляется при большинстве раковых заболеваний человека, таких как рак груди, толстой кишки, почек, яичников, предстательной железы и кожи [124–126].Восстановление miR-34a потенциально может вызвать остановку клеточного цикла, старение и апоптоз раковых клеток [127, 128]. В июне 2016 г. в исследование были включены 99 пациентов с запущенными солидными опухолями [129]. Испытание включало исследование с увеличением дозы с двумя дозами в неделю или пятью дозами в день, вводимыми внутривенно. Каждый из пациентов с ГЦК, акральной меланомой и почечно-клеточной карциномой (ПКР) достиг частичного ответа в конце испытания, который оценивался с помощью критериев оценки ответа на солидную опухоль (RECIST), и у 14 пациентов было выявлено стабильное заболевание.Анализ лейкоцитов показал значительную репрессию генов-мишеней miR-34a, таких как PI (FOXP1) и BCL2. Однако в 2016 г. исследование было остановлено из-за пяти тяжелых иммунных побочных эффектов, приведших к смерти пациентов [129]. Это неудача в терапии миРНК с использованием MRX34, и это стало неожиданностью из-за неблагоприятных иммунных исходов. В свете этой остановки становится еще яснее, что эффективная доставка и нацеливание критичны для перевода miRNAs в терапевтический успех.
Это неудача в терапии миРНК с использованием MRX34, и это стало неожиданностью из-за неблагоприятных иммунных исходов. В свете этой остановки становится еще яснее, что эффективная доставка и нацеливание критичны для перевода miRNAs в терапевтический успех.
| |||||||||||||||||||||||||||||||||||||||||
По материалам Balacescu et al. [122] и Рупаймуле и Слэк [123]. Аббревиатура: LNPs, липидные наночастицы; НМРЛ, немелкоклеточный рак легкого; ПКР, почечно-клеточная карцинома; EDV, средство доставки EnGeneIC; EGFR, рецептор эпидермального фактора роста; и LNA, заблокированная нуклеиновая кислота. [122] и Рупаймуле и Слэк [123]. Аббревиатура: LNPs, липидные наночастицы; НМРЛ, немелкоклеточный рак легкого; ПКР, почечно-клеточная карцинома; EDV, средство доставки EnGeneIC; EGFR, рецептор эпидермального фактора роста; и LNA, заблокированная нуклеиновая кислота. | |||||||||||||||||||||||||||||||||||||||||
В 2014 г. был разработан миметик miR-16, который прошел фазу I клинических испытаний на пациентах со злокачественной мезотелиомой плевры и НМРЛ, у которых не удалось провести стандартную терапию (идентификатор ClinicalTrials.gov NCT02369198). Миметики miR-16 были доставлены внутривенно с использованием упаковки EnGeneIC delivery carrier (EDV) и конъюгированы с антителом, нацеленным на EGFR, для облегчения нацеливания на сайт опухоли [130].Предварительные данные van Zandwijk et al. показали, что лечение имело управляемый профиль безопасности у 5 пациентов в ответ на инфузию 5 миллиардов наноклеток, загруженных miR-16 [131]. Ожидается, что это исследование TargomiR продолжит фазу II исследования, поскольку результаты были обнадеживающими и не выявили неблагоприятного иммунного ответа и токсических эффектов [131].
В марте 2016 года MiRagen Therapeutics (идентификатор ClinicalTrials.gov NCT02580552) инициировала фазу I клинического испытания LNA-модифицированного анти-miR-155 (MRG-106).Это испытание проводилось на пациентах с диагнозом кожная Т-клеточная лимфома (CTCL) подтипа грибовидного микоза, и результаты были обнадеживающими. Предварительные данные показали, что внутриопухолевая инъекция MRG-106 приводила к уменьшению кожных повреждений практически без побочных эффектов [132]. Таким образом, MiRagen Therapeutics в 2018 году инициировала клиническое испытание фазы II для дальнейшей оценки эффективности MRG-106 против CTCL (идентификатор ClinicalTrials.gov NCT03713320). Это укрепляет доверие к ингибированию miRNA в клинических применениях и может способствовать потенциальным попыткам улучшить анти-miR для терапии рака.
10. Выводы
Рак — это сложное заболевание, в котором задействованы различные регуляторные механизмы, способствующие их прогрессированию. Измененная экспрессия miRNA в результате клеточных событий, таких как мутации хромосомной ДНК и дефекты биогенеза miRNA, приведут к раку. Развитие miRNA в качестве терапевтических средств обещает дальнейшее изучение для лечения рака. Терапия ингибированием и восстановлением miRNA может быть использована в качестве эффективных стратегий для нацеливания и подавления множественных онкогенных путей.Несмотря на то, что проводятся фазы I и II испытаний по изучению препаратов, нацеленных на miRNA, на сегодняшний день нет препаратов miRNA, которые вошли в клиническую фазу 3 исследования. Таким образом, очень важно определить отчетливую экспрессию miRNAs при различных типах рака для дальнейшей разработки стратегий лечения и предотвращения нецелевых эффектов miRNA лекарств. Разработка новых систем доставки miRNA к конкретным типам клеток, тканям и органам путем установления конкретных носителей будет способствовать дальнейшему повышению эффективности и специфичности терапии miRNA для рака.Было разработано нацеливание miRNA на определенные типы клеток с использованием антител, лигандов и наночастиц, которые показали повышенную специфичность и пониженную иммунотоксичность [82].
Развитие miRNA в качестве терапевтических средств обещает дальнейшее изучение для лечения рака. Терапия ингибированием и восстановлением miRNA может быть использована в качестве эффективных стратегий для нацеливания и подавления множественных онкогенных путей.Несмотря на то, что проводятся фазы I и II испытаний по изучению препаратов, нацеленных на miRNA, на сегодняшний день нет препаратов miRNA, которые вошли в клиническую фазу 3 исследования. Таким образом, очень важно определить отчетливую экспрессию miRNAs при различных типах рака для дальнейшей разработки стратегий лечения и предотвращения нецелевых эффектов miRNA лекарств. Разработка новых систем доставки miRNA к конкретным типам клеток, тканям и органам путем установления конкретных носителей будет способствовать дальнейшему повышению эффективности и специфичности терапии miRNA для рака.Было разработано нацеливание miRNA на определенные типы клеток с использованием антител, лигандов и наночастиц, которые показали повышенную специфичность и пониженную иммунотоксичность [82]. Нацеливающие агенты, такие как антитела (одноцепочечный вариабельный фрагмент, scFv; дизиалоганглиозид, GD2), пептиды или лиганды (гиалуроновая кислота), могут улучшить тканеспецифичную доставку и биораспределение и снизить доставляемую дозу, дополнительно предотвращая токсичность, связанную с доставкой [133 , 134]. Липидные наночастицы обычно модифицируются другими молекулами, включая гиалуроновую кислоту и ПЭГ, для улучшения нацеливания на опухоль и стабильности [135].Наночастицы на неорганической основе модифицируются путем конъюгации с антителами или инкапсулируются в естественные везикулы для получения наночастиц с клинически значимыми свойствами, включая способность нацеливания на опухоль [136, 137]. Поскольку большинство неорганических наночастиц не являются в природе опухолеспецифическими, для повышения способности наночастиц к самонаводству в опухоли использовалось несколько методов, таких как конъюгация с антителом, нацеленным на антигены GD2, сверхэкспрессированные на поверхности твердых опухолевых клеток [136], конъюгация с антитело, нацеленное на рецептор эпидермального фактора роста специфического для рака антигена [138], или конъюгация с гиалуроновой кислотой, которая может нацеливать CD44 на клетки рака толстой кишки [139].
Нацеливающие агенты, такие как антитела (одноцепочечный вариабельный фрагмент, scFv; дизиалоганглиозид, GD2), пептиды или лиганды (гиалуроновая кислота), могут улучшить тканеспецифичную доставку и биораспределение и снизить доставляемую дозу, дополнительно предотвращая токсичность, связанную с доставкой [133 , 134]. Липидные наночастицы обычно модифицируются другими молекулами, включая гиалуроновую кислоту и ПЭГ, для улучшения нацеливания на опухоль и стабильности [135].Наночастицы на неорганической основе модифицируются путем конъюгации с антителами или инкапсулируются в естественные везикулы для получения наночастиц с клинически значимыми свойствами, включая способность нацеливания на опухоль [136, 137]. Поскольку большинство неорганических наночастиц не являются в природе опухолеспецифическими, для повышения способности наночастиц к самонаводству в опухоли использовалось несколько методов, таких как конъюгация с антителом, нацеленным на антигены GD2, сверхэкспрессированные на поверхности твердых опухолевых клеток [136], конъюгация с антитело, нацеленное на рецептор эпидермального фактора роста специфического для рака антигена [138], или конъюгация с гиалуроновой кислотой, которая может нацеливать CD44 на клетки рака толстой кишки [139]. Кроме того, использование наноносителей для доставки miRNAs особенно полезно при терапии рака, где они имеют возможность пассивного накопления в опухолевых тканях из-за их протекающей сосудистой сети и пониженной лимфатической функции, известной как эффект EPR [140, 141]. Несмотря на все проблемы, терапевтические средства, нацеленные на miRNA, станут потенциальными терапевтическими средствами, как только подходящая система доставки miRNA с повышенной эффективностью и специфичностью сможет перейти от фазы I / II к фазе III. Поскольку развитие рака обусловлено множественными клеточными путями, обычные методы лечения, такие как химиотерапия и лучевая терапия, эффективны лишь частично.Следовательно, следует поощрять комбинаторные подходы к терапии миРНК.
Кроме того, использование наноносителей для доставки miRNAs особенно полезно при терапии рака, где они имеют возможность пассивного накопления в опухолевых тканях из-за их протекающей сосудистой сети и пониженной лимфатической функции, известной как эффект EPR [140, 141]. Несмотря на все проблемы, терапевтические средства, нацеленные на miRNA, станут потенциальными терапевтическими средствами, как только подходящая система доставки miRNA с повышенной эффективностью и специфичностью сможет перейти от фазы I / II к фазе III. Поскольку развитие рака обусловлено множественными клеточными путями, обычные методы лечения, такие как химиотерапия и лучевая терапия, эффективны лишь частично.Следовательно, следует поощрять комбинаторные подходы к терапии миРНК.
Конфликт интересов
У авторов нет конфликта интересов, о котором следует раскрывать.
Вклад авторов
NA подготовил план рукописи, подготовил черновик рукописи и отредактировал рукопись. НИК принимал участие в подготовке проекта рукописи. CLP была вовлечена в критическую редакцию и окончательно одобрила рукопись.
CLP была вовлечена в критическую редакцию и окончательно одобрила рукопись.
Благодарности
Авторы этого обзора выражают признательность за исследовательскую поддержку Sunway University.Эта работа финансировалась грантом исследовательского центра Университета Сануэй (2019) Центру исследований вирусов и вакцин (CVVR).
| Наши журналы | ||||||
| Как крупный международный издатель академических и исследовательских журналов Science Alert издает и разрабатывает названия в сотрудничестве с самыми престижные научные общества и издатели.Наша цель заключается в том, чтобы максимально широко использовать качественные исследования аудитория. | ||||||
| Для авторов | ||||||
Мы прилагаем все усилия, чтобы поддержать исследователей
которые публикуют в наших журналах. Есть масса информации
здесь, чтобы помочь вам публиковаться вместе с нами, а также ценные
услуги для авторов, которые уже публиковались у нас. Есть масса информации
здесь, чтобы помочь вам публиковаться вместе с нами, а также ценные
услуги для авторов, которые уже публиковались у нас. | ||||||
| Подписчикам | ||||||
| 2021 цены уже доступны. Ты может получить личную / институциональную подписку на перечисленные журналы прямо из Science Alert. В качестве альтернативы вы возможно, пожелает связаться с выбранным вами агентством по подписке. Направляйте заказы, платежи и запросы в службу поддержки. в службу поддержки клиентов журнала в Science Alert. | ||||||
| Для обществ | ||||||
Science Alert гордится своей
тесные и прозрачные отношения с обществом. В качестве
некоммерческий издатель, мы стремимся к самым широким
возможное распространение публикуемых нами материалов и
на предоставление услуг высочайшего качества нашим
издательские партнеры. В качестве
некоммерческий издатель, мы стремимся к самым широким
возможное распространение публикуемых нами материалов и
на предоставление услуг высочайшего качества нашим
издательские партнеры. | ||||||
| Справочный центр | ||||||
| Здесь вы найдете ответы на наиболее часто задаваемые вопросы (FAQ), которые мы получили по электронной почте или через контактную форму в Интернете. В зависимости от характера вопросов мы разделили часто задаваемые вопросы на различные категории. | ||||||
| База данных ASCI | ||||||
Азиатский индекс научного цитирования (ASCI)
стремится предоставить авторитетный, надежный и
значимая информация по освещению наиболее важных
и влиятельные журналы для удовлетворения потребностей мировых
научное сообщество.
| ||||||




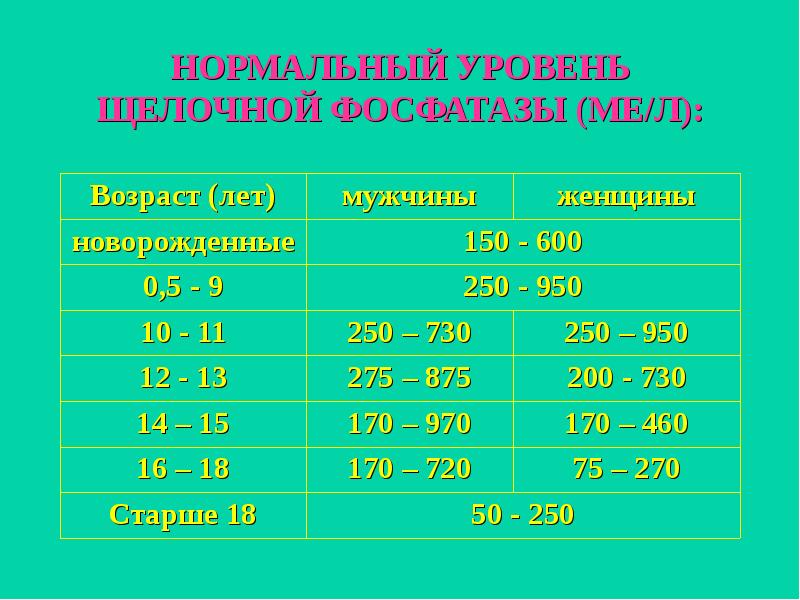

 ), кишечные бактериальные инфекции, тиреотоксикоз.
), кишечные бактериальные инфекции, тиреотоксикоз. g., углеродные нанотрубки (УНТ), металлические наночастицы и наностержни на основе оксидов железа (ИО)
g., углеродные нанотрубки (УНТ), металлические наночастицы и наностержни на основе оксидов железа (ИО)