Диагноз энцефалопатия у детей стал ставиться все чаще, что очень пугает тысячи родителей. Это заболевание действительно является весьма серьезным и требует неотложного начала комплексного лечения во избежание различных осложнений. Своевременное начало адекватной терапии может привести к полному выздоровлению ребенка, если же добиться этого не удается, под наблюдением врачей состояние можно стабилизировать, уменьшить вероятность серьезных последствий для малыша.


Содержание статьи
Что это?
Поставленный врачом диагноз энцефалопатия может ставить в тупик родителей, которые не знают, что это такое. Этот термин подразумевает целую группу заболеваний мозга ребенка, не связанных с воспалительными процессами. Это диффузное расстройство развивается под воздействием различных причин и заключается в повреждении мозговых клеток.
Энцефалопатия у детей может развиваться как внутриутробно, так и в процессе жизни. В зависимости от этого различают врожденную (перинатальную) или приобретенную формы заболевания.
Перинатальная энцефалопатия может развиваться с 28 недель беременности и до 7 суток с момента рождения ребенка (а у недоношенных детей до 28 дней). Если при обнаружении первых же признаков болезни начато грамотное комплексное лечение, в 90% случаев удается купировать абсолютно все симптомы и избежать последствий, проявляющихся во взрослом возрасте.


Вне зависимости от формы заболевания и времени, когда оно проявилось, детскую энцефалопатию лечат под контролем врача-невролога.
Причины развития заболевания
Энцефалопатия у новорожденных возникает часто в процессе внутриутробного развития или же в момент родов. Однако и у подросших детей болезнь может развиваться под воздействием самых разных причин. Самыми частыми причинами появления заболевания у новорожденных считаются:
- Ранняя беременность.
- Наследственные заболевания.
- Инфекции во время беременности.
- Патологии беременности, в том числе токсикоз, угрозы преждевременных родов или выкидыша.
- Прием некоторых медикаментов.
- Недоношенность.
- Патологии родового процесса и травмы во время родов.
Нередко достоверно выяснить причину развития перинатальной энцефалопатии не удается.

 У детей более старшего возраста энцефалопатия возникает вследствие некоторых инфекционных заболеваний (например, краснухи), травм головы или токсических воздействий на центральную нервную систему.
У детей более старшего возраста энцефалопатия возникает вследствие некоторых инфекционных заболеваний (например, краснухи), травм головы или токсических воздействий на центральную нервную систему.
Виды заболевания

 Детскую энцефалопатию делят в первую очередь на перинатальную (проявившуюся сразу после рождения) и резидуальную (ее симптомы появляются у детей более старшего возраста, нередко в возрасте после трех лет). В зависимости от повреждающего фактора выделяют такие виды энцефалопатии новорожденных:
Детскую энцефалопатию делят в первую очередь на перинатальную (проявившуюся сразу после рождения) и резидуальную (ее симптомы появляются у детей более старшего возраста, нередко в возрасте после трех лет). В зависимости от повреждающего фактора выделяют такие виды энцефалопатии новорожденных:
- сосудистая. Аномалии или заболевания сосудов, нарушающие нормальное кровоснабжение мозга;
- дисциркуляторная. Заключается в застоях крови в головном мозге из-за нарушения ее оттока;
- посттравматическая. Развивается в результате травм, в том числе родовых;
- мелкоочаговая лейкоэнцефалопатия. Поражения клеток мозга возникают из-за перенесенного менингита или энцефалита;
- токсическая. Заключается в воздействии на мозговые клетки различных токсических веществ, в том числе при гемолитической болезни и прочих видах желтухи новорожденных;
- гипертензивная. Происходит повреждение нейроцитов из-за частого повышения артериального давления, а также при нарушениях функций почек и надпочечников;
- энцефалопатия Вернике. Развивается вследствие значительного недостатка витаминов группы В, что приводит к гибели мозговых клеток из-за недостатка их питания.


Нередко это заболевание может иметь сразу несколько причин развития. Лечение энцефалопатии зависит от того, что повлияло на ее возникновение, поэтому врачи первым делом стараются максимально точно определить, что же послужило причиной развития болезни.
Симптомы энцефалопатии
Разнообразие симптомов заболевание обусловлено широким спектром возможных патологий нервной системы. Наиболее специфичными признаками энцефалопатии у младенцев считаются:
- Поздний или слишком слабый первый крик при родах.
- Отсутствующий сосательный рефлекс.
- Плохой сон (чрезмерная сонливость или, напротив, бессонница в ночное время суток), частые беспокойства и непрерывный плач.
- Нарушения сердцебиения.
- Гипо- или гипертонус мышц.
- Запрокидывание головы.
- Внутричерепное давление.
- Косоглазие.
- Срыгивания во время или сразу после еды.
- Снижение памяти и познавательной функции.
- Гиперактивность и неуправляемость или противоположное состояние — заторможенность.
Признаки энцефалопатии могут быть как ярко выраженными, так и едва заметными, поэтому крайне важно наблюдение ребенка у невролога. Выраженность симптомов напрямую зависит от локализации органического поражения головного мозга у детей, а также от его объема, а также от других заболеваний, которые есть у ребенка, его возраста и степени зрелости нервной системы.
При усугублении энцефалопатии признаки заболевания становятся более серьезными – у ребенка могут начаться обмороки, головокружения, нарушения интеллекта, мышления и памяти, а также общая задержка развития.
Возможные осложнения заболевания
Благодаря возможностям современной медицины, большинство случаев детской энцефалопатии поддается лечению с последующим полным выздоровлением. Но в случае наличия слишком большого количество пораженных мозговых клеток, отсутствии терапии или невозможности устранить фактор, негативно влияющий на мозг, высока вероятность развития различных последствий. Наиболее частыми осложнениями являются:
- мигрени;
- астенический синдром;
- неврозы;
- гидроцефалия;
- эпилепсия;
- патологии глаз;
- трудностям социальной адаптации;
- ДЦП;
- депрессии и другие патологии эмоциональной сферы;
- развитие шизофрении в период взрослости;
- слабоумие.
Последствия могут быть как незначительными, так и очень серьезными, которые повлекут за собой немалые проблемы во взрослой жизни. Поэтому крайне важно наблюдать за состоянием ребенка и при малейших подозрениях на энцефалопатию пройти полное обследование и при подтверждении диагноза начать лечение.
Диагностика

 Грамотный подход при диагностике позволяет в максимально короткие сроки определить наличие или отсутствие этой серьезной болезни. Энцефалопатия головного мозга диагностируется у детей с помощью лабораторных и инструментальных методов, а также при консультациях со специалистами. При подозрении на заболевание проводятся:
Грамотный подход при диагностике позволяет в максимально короткие сроки определить наличие или отсутствие этой серьезной болезни. Энцефалопатия головного мозга диагностируется у детей с помощью лабораторных и инструментальных методов, а также при консультациях со специалистами. При подозрении на заболевание проводятся:
- Анализы крови: общий, биохимия, на токсины, оксигемометрия.
- Общий анализ мочи.
- Исследование спинномозговой жидкости.
- Нейросонография.
- ЭЭГ.
- Допплерография.
- Магнитнорезонансная ангиография.
- Консультации невролога, офтальмолога, психолога.
Диагноз ставят только на основе полного обследования ребенка.
Как лечится детская энцефалопатия?
При своевременной диагностике энцефалопатия новорожденных успешно лечится при соблюдении всех назначений и рекомендаций врача. Важной задачей лечения является устранение факторов, воздействующих на мозг, а также восстановление нормального функционирования поврежденных мозговых клеток.


В зависимости от тяжести заболевания лечение энцефалопатии у детей может проходить как амбулаторно, так и в условиях стационара. При серьезных повреждениях мозговых структур терапия обязательно проводится под постоянным наблюдением врачей – требуется госпитализация. Лечение может быть весьма длительным.
Способы лечения выбираются исходя из степени тяжести болезни и комплекса симптомов у ребенка. Помимо основного курса лечения ребенку может понадобиться искусственная вентиляция легких, питание с помощью зонда, а также гемодиализ.
Медикаментозная терапия может заключаться в приеме:
- нейропротекторов (ноотропы, а также аминокислоты), которые призваны восстановить структуру мозга и предотвратить негативное воздействие на нейроны;
- препараты для улучшения кровоснабжения мозга;
- витамины группы В, которые помогают улучшить обменные процессы в мозговых клетках;
- транквилизаторы и седативные лекарственные препараты;
- медикаментозные средства устраняющие симптомы (снимающие гипертонус мышц, судороги, исправляющие двигательные дисфункции).
В зависимости от назначенных препаратов и возраста ребенка могут использоваться различные методы введения лекарств – внутримышечно и внутривенно, энтерально, а также с помощью электрофореза.
В дополнение к медикаментозному лечению может быть показано использование физиотерапевтических процедур, также при энцефалопатии часто назначается лечебная физкультура, массаж, фитотерапия. По окончании лечения ребенку показаны занятия плаванием с опытным инструктором.


В особенно тяжелых случаях может применяться и хирургическое вмешательство, заключающееся в проведении операции с целью улучшения кровообращения мозга.
Параллельно с любым назначенным лечением важно организовать ребенку правильное и сбалансированное питание, регулярные прогулки на свежем воздухе. Также важно нормализовать режим дня с регулированием сна и бодрствования.
Детям с энцефалопатией очень полезно периодически принимать витаминные комплексы, особенно препараты витаминов группы В. Выбор принимаемых препаратов лучше доверить лечащему врачу.
Эффективность лечения повреждений мозга у новорожденного зависит от своевременности постановки диагноза, назначения полноценного и комплексного лечения в соответствии с существующими проблемами, а также строгого выполнения всех рекомендаций специалистов. В таком случае большинство детей имеет благоприятные прогнозы на выздоровление без развития последствий во взрослом возрасте.
Профилактика энцефалопатии
Существует ряд профилактических мер, которые направлены на предупреждение развития энцефалопатии и ребенка. К ним относятся:
- Своевременное и адекватное лечение любых инфекционных заболеваний во время беременности и у родившегося ребенка.
- Предупреждение развития гипоксии плода.
- Действия по защите новорожденного от токсических веществ.
Такие меры позволяют существенно снизить вероятность развития заболевания у новорождённого.
Диагностирование у новорожденного энцефалопатии может стать настоящей трагедией для родителей. Но повреждения нервной системы при таком заболевании часто не становятся приговором для ребенка, так как абсолютное большинство проявлений болезни можно вылечить, строго следуя инструкциям врачей. А при раннем обнаружении таких проблем у новорожденного, есть высокие шансы на полное выздоровление.


Родители, у детей которых выявлена энцефалопатия головного мозга, хотят знать, что это такое и почему она развивается у ребенка. Данная патология действительно очень серьезная. Чтобы избежать осложнений, необходимо как можно раньше начать лечение, которое даст шанс маленькому человеку на выздоровление. Если же здоровье полностью восстановить не удастся, то терапия поможет стабилизировать состояние малыша и уменьшить вероятность тяжелых последствий.
Что это за патология
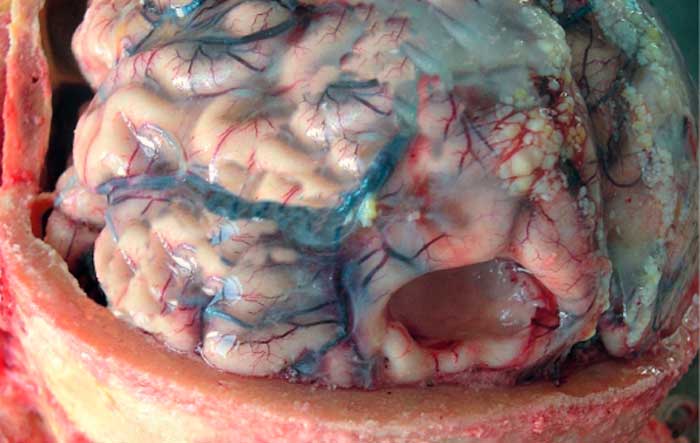

Энцефалопатия головного мозга у новорожденных – это целый ряд патологических состояний, при которых здоровые ткани мозга заменяются дистрофическими, что ведет к различным нарушениям в работе главного органа нервной системы. Энцефалопатия повреждает нейроны головного мозга как в утробе матери, так и в процессе жизни. Поэтому специалисты разделяют патологию на врожденную (перинатальную) и приобретенную.
Перинатальная энцефалопатия может возникнуть с 28 недели беременности и на протяжении недели после появления малыша (у глубоко недоношенных младенцев в течение 28 дней после рождения). Но впадать в отчаяние не нужно. Своевременно выявленное расстройство и грамотное лечение позволяют купировать все симптомы и полностью избежать осложнений, проявляющихся в будущем.
Не зависимо от вида энцефалопатии и периода, когда она была выявлена, за лечением и состоянием ребенка постоянно наблюдает невролог.
Причины развития патологии

У младенцев энцефалопатия развивается по разным причинам, но у большинства она является результатом негативного воздействия гипоксии, которая возникает на разных стадиях внутриутробного развития плода.
Вызвать кислородное голодание мозга во внутриутробном периоде могут:
- Угроза невынашивания.
- Хронические заболевания беременной.
- Инфекционные болезни.
- Плацентарная недостаточность хронической формы.
- Вредные привычки будущей мамы.
Также крайне опасны такие ситуации как:
- Заглатывание ребенком околоплодных вод.
- Асфиксия в результате обвития пуповиной.
- Раннее отслоение плаценты.
- Затяжные или, наоборот, быстрые роды.
Кроме этого детская энцефалопатия появляется в результате травмы при родах, недоношенности, наследственных заболеваний. У старших детей расстройство провоцируют травмы головы, нейроинфекционные болезни, влияние токсических веществ.
Классификация


Энцефалопатию, развивающуюся в детском возрасте, разделяют на
- Перинатальную. Проявляется в младенчестве.
- Резидуальную. Признаки и симптомы данной формы энцефалопатии головного мозга у детей выявляются после 3 лет.
В зависимости от провоцирующих факторов заболевания выделяют такие формы:
- Сосудистая, вызванная прогрессирующими заболеваниями артерий и вен, которые нарушают кровоснабжение мозга.
- Дисциркуляторная, связанная с застоем крови и нарушенным оттоком. Зачастую наблюдается у детей, страдающих врожденными патологиями церебральных сосудов, вирусными болезнями, осложненными сепсисом, эндокринными нарушениями со стойкими изменениями сосудистого строения. В группу риска входят дети, чьи мамы при беременности употребляли алкоголь или наркотические средства.
- Посттравматическая, развивающаяся после перенесенной травмы головы, включая родовую. Тяжесть данного заболевания напрямую зависит от интенсивности симптомов патологии, возраста ребенка, проблем с сосудами. В основном проявляется головокружениями и головными болями. Характеризуется нарушениями сна, слабостью, перепадами настроения.
- Токсическая, вызванная отравляющими веществами, в огромном количестве накопленными в крови с поражением клеток мозга. Например, при возникновении патологической желтухи у новорожденных, когда билирубин, образующийся при распаде фетального гемоглобина, не расщепляется ферментами печени, а преобразуется в ядовитые элементы и попадает в мозг, разрушая клетки нервной системы. Зачастую желтуха в такой форме возникает из-за прогрессирующей болезни крови, несовпадения групп крови мамы и малыша, аномального строения печени и желчных протоков, заражения гепатитом или токсоплазмозом.
- Гипертензивная, при которой нарушение функций почек и надпочечников, а также устойчивое высокое кровяное давление приводит к диффузным изменениям, повреждающим клетки нервной системы.
- Энцефалопатия Вернике. Развивается вследствие дефицита витаминов группы B, что служит причиной недостаточного питания нейронов и их неминуемого разрушения.
- Эпилептическая энцефалопатия развивается при эписиндроме прогрессирующего типа. На фоне учащения судорожных приступов погибают нейроны, формируя дополнительные очаги эпиактивности, которые фиксируются электроэнцефалограммой.
Симптоматика детской энцефалопатии


Так как резидуальные и перинатальные изменения головного мозга поражают любой его участок, отвечающий за разные функции и органы, то и признаки патологии могут проявиться по-разному. Выраженность патологических проявлений зависит от:
- Места расположения и размеров поврежденной ткани мозга.
- Главной причины и продолжительности ее повреждающего влияния на мозговые структуры.
- Сопутствующих болезней или их отсутствия.
- Возраста пострадавшего и зрелости его нервной системы.
Специфическими симптомами энцефалопатии у грудничков являются:
- Слабый сосательный рефлекс.
- Беспокойность, возбудимость, чуткий сон.
- Мышечный гипо- или гипертонус.
- Монотонный плач.
- Недобор веса.
- Запрокидывание головы.
- Срыгивание фонтаном.
- Заторможенность или, наоборот, гиперактивность.
- Выпирание или западание родничка.
- Высокое внутричерепное давление.
- Страбизм.
Врожденная энцефалопатия, развивавшаяся еще в утробе либо появившаяся сразу после родов, может выражаться не явно. Болезнь будет ярче проявляться во взрослой жизни, поэтому очень важно начать лечение как можно раньше. Признаки резидуальной энцефалопатии проявляются сонливостью днем, постоянной усталостью, снижением интеллекта.
Кроме этого у ребенка можно встретить такие отклонения:
- Плохая память.
- Частые обмороки.
- Судороги, тики, вздрагивания, замирания.
- Невнятность речи.
- Паралич, паркинсонизм.
- Внезапные головные боли.
Диагноз «резидуальная энцефалопатия» предполагает нарастание симптоматики, которая приобретает постоянный характер. С каждым днем патология станет проявляться все сильней, что негативно отразится на физическом состоянии и интеллектуальном развитии ребенка.
Важно! Органическое поражение мозга может развиваться сразу из-за нескольких факторов-провокаторов. Поэтому лечение энцефалопатии во многом зависит от того, будут ли они вовремя найдены и максимально устранены. Если не провести диагностику и не начать терапию, то дистрофические изменения в клетках мозга, разрыв связей между нейронами и последующее их разрушение будут прогрессировать и приведут к необратимым отклонениям в ЦНС.
Диагностика

Заболевания, затрагивающие мозговые ткани, диагностируются лабораторными и инструментальными методами. Если у доктора есть подозрение, что у маленького пациента развилась резидуальная или перинатальная энцефалопатия головного мозга, он разъяснит родителям что это такое, и какие действия необходимо предпринять.
Как можно скорее нужно провести обследование ребенка:
- Сдать общие анализы крови и мочи.
- Исследовать цереброспинальную жидкость.
- Пройти нейросонографию (если это грудничок до года).
- Пройти электроэнцефалограмму (чтобы проверить грудничков, как и детей до 3 лет ее проводят во сне).
- Допплерографию.
- Магниторезонансную томографию.
Обязательно нужно проконсультироваться у эндокринолога, кардиолога, отоларинголога, офтальмолога. Окончательный диагноз ставят только после получения всех результатов обследования.
Как лечат патологию

Данное расстройство является мультиэтиологическим заболеванием, но главная задача медиков – выявить истинные причины при продолжающемся воздействии негативных факторов и максимально их устранить. Лечебные мероприятия направляются на восстановление функций поврежденных нервных клеток мозга. В зависимости от степени тяжести энцефалопатии терапия проводится либо стационарно, либо амбулаторно.
Кроме основного лечебного курса маленькому пациенту может понадобиться гемодиализ, искусственная вентиляция легких, кормление через зонд.
Медикаментозное лечение основывается на приеме:
- Ноотропов, восстанавливающих поврежденные структуры мозга.
- Препаратов, улучшающих кровоциркуляцию.
- Витаминов группы B.
- Транквилизаторов и успокоительных препаратов.
- Симптоматических лекарств, устраняющих неприятные симптомы. Например, противосудорожных препаратов, снимающих судороги и гипертонус.
Медикаменты могут вводиться внутримышечно, капельно, перорально, а также при помощи электрофореза. В особо тяжелых случаях показано оперативное вмешательство для улучшения мозгового кровообращения и восстановления поврежденных связей между нейроцитами. Дополнительно могут назначаться физиопроцедуры:
- Фитотерапия (лечение лекарственными растениями).
- Лечебный массаж, который проводит профессиональный массажист.
- Лечебная физкультура.
Больному ребенку необходимо обеспечить правильное, здоровое питание (если это грудничок, то грудное вскармливание), ежедневные прогулки на улице, четкий режим дня.
Последствия


Современные медицинские технологии и профессионализм талантливых врачей в состоянии помочь большинству пациентов навсегда избавиться от данной патологии мозга и ее неприятных последствий. Но если повреждающего фактора на мозг выявить не получается (а это бывает, когда симптомы болезни проявляются не выражено, и поэтому за врачебной помощью родители обращаются поздно), а количество разрушенных нейронов достигает критической отметки, то высока вероятность развития серьезных осложнений.
Чаще всего пострадавшие дети страдают от:
- Приступов мигрени.
- Астении.
- Неврозов.
- Офтальмологических патологий.
- ДЦП.
- Депрессивных состояний.
Кроме этого энцефалопатия чревата развитием шизофрении, выраженной умственной отсталостью, компенсированным гидроцефальным синдромом, проблемами с социальной адаптацией в старшем возрасте. Эпилептическая энцефалопатия в пубертатном периоде несколько ослабевает, но характеризуется серьезным нейрокогнитивным дефицитом. Осложнения при энцефалопатии у малышей могут слегка повреждать ткани головного мозга, и быть ярко выраженными, что сильно повлияет на качество жизни таких детей в дальнейшем.
Термином «энцефалопатия головного мозга» у детей среди специалистов принято обобщать патологические изменения, произошедшие вследствие различных не воспалительных процессов в структурах этого органа и других частей ЦНС.


Энцефалопатия головного мозга у детей что это
Для того чтобы разобрать в том что такое энцефалопатия головного мозга и какие последствия она может спровоцировать в дальнейшем, для начала требуется выявить причину, из-за которой происходят эти изменения. Чаще всего это состояние у детей развивается в результате дистрофии нейронов головного мозга и их связей вследствие нарушения кровоснабжения этих структур и, как следствие, недостатка кислорода и других питательных веществ, требующихся для нормального функционирования и развития мозговых тканей.
Чаще всего подобным изменениям в головном мозге подвержены дети в последние месяцы внутриутробного развития и дети в 1 год жизни. Несмотря на то что эти периоды крайне важны и любые отклонения и заболевания в это время могут сказаться на дальнейшем формировании организма, не стоит отчаиваться, так как своевременная диагностика энцефалопатии и последующее адекватное лечение, снижает риск развития более тяжелых заболеваний и существенно облегчат состояние малыша.
Если же поражения тканей незначительны, а терапия энцефалопатии оправдала ожидания, то в таком случае происходит полное выздоровление ребенка.
В медицине выделяют несколько видов подобной патологии, которые отличаются друг от друга симптомами и причинами, вследствие которых развилась заболевание. Оттого насколько точно будет определена природа изменений, зависит лечение и прогнозирование возможных последствий в дальнейшем.
Последствия энцефалопатии у малышей
В настоящий момент специалисты выделяют несколько причин, вызвавших подобные изменения в структурах головного мозга малышей. Например, известно, что перинатальная энцефалопатия способна передаваться по наследству от родителей к ребенку. То есть, если в семье уже были случаи развития подобных патологий, то риск ее появления у их детей в разы повышается.
Последствия такого разрушения структур сложно прогнозировать заранее, ввиду того что изучение случаев развития энцефалопатии, часто затрудняется в младенческом возрасте, так как ее проявления менее выражены чем во взрослом состоянии.
Так как в последние дни беременности и первые месяцы жизни ребенка происходит активное развитие головного мозга, самым опасным последствием энцефалопатии в этом возрасте считается нарушение снабжения мозговых тканей питательными веществами, вследствие которого вначале происходит сбой метаболизма, который ведет к повреждению нервных клеток. К сожалению, это часто приводит к отмиранию нейронов и разрушению их связей. В итоге подобные патологические процессы приводят к остановке развития головного мозга и его отделов, что сказывается на функционировании всего организма.
Далее нарушается отток, секреция и циркуляция ликвора в мозговых тканях, что ведет к увеличению размеров черепной коробки и гидроцефалии, которая приводит к гидроэнцефалопатии (поражению, вызванному повышенным давлением ликвора) головного мозга у ребенка.
Однако не стоит отчаиваться, вовремя начатая терапия способна замедлить течение заболевания. Лечение обычно сводится к уменьшению отечности и улучшению мозгового кровообращения.
В любом случае последствия будут зависеть от степени поражения структур головного мозга, и причин, которые вызвали подобные изменения.
Виды энцефалопатии
В зависимости от того в какой момент начал развиваться этот недуг разделяют врожденную и перинатальную приобретенную форму заболевания.
Так, если патологические процессы начали происходить еще во время внутриутробного развития плода, вследствие плохой наследственности, то этот вид заболевания считается врожденным.
В случае если нарушения произошли во время беременности или уже после рождения из-за пагубного влияния некоторых провоцирующих факторов, воздействующих на поступление питательных веществ к структурам головного мозга ребенка то этот вид нарушения считается приобретенным перинатальным.
При этом симптомы обоих форм патологии схожи с признаками нарушения целостности мозговых структур в более взрослом состоянии.
Существует огромное количество причин развития приобретенной энцефалопатии головного мозга у детей, однако, основным провоцирующим фактором принято считать нарушение плацентарного кровотока и недостаточное поступление важных микроэлементов во время внутриутробного развития.
Родовые и последующие травмы провоцируют около 10% случаев резидуальной (возникающей впоследствии негативного воздействия на нейроны) формы патологии, так как в это период нервные клетки головного мозга и их связи особо нежны и требуют осторожного обращения. В этом случае существует большой риск получения черепно-мозговой травмы, последствия и осложнения которой способны проявиться спустя некоторое время.
Дисциркуляторная или токсическая
Этот вид энцефалопатии относится к приобретенным перинатальным формам заболевания и отличается от резидуальной тем, что вызывает структурные изменения в нервных клетках, развивающихся в результате неправильного функционирования кровеносной системы или воздействия токсических веществ, по тем или иным причинам попавших в кровоток.
Основными провоцирующими факторами этого вида энцефалопатии считается:
- нарушение местного или общего кровоснабжения;
- различные аневризмы кровеносных сосудов;
- заражение крови некоторыми паразитарными заболеваниями, например, токсоплазмозом;
- инфицирование вирусами (гепатиты, грипп, вирусная пневмония) с последующими осложнениями;
- лейкоз;
- превышение или недостаток билирубина в крови ребенка.
Проявление патологии начинается с нарушения сна и появления беспричинных капризов, вследствие которых начинает страдать психическое здоровье: изменяется восприятие информации, ребенка становится трудно чем-либо отвлечь, таким образом проявляется псевдоневрастенический синдром.
Далее становятся явными и другие признаки развития расстройства: появляется головокружение, изменяется походка — она делается шаткой и неустойчивой, начинаются проблемы с артериальным давлением, а также в результате плохого кровоснабжения страдают органы слуха и зрения.
Если вовремя не диагностировать заболевание и не начать терапию, то состояние в дальнейшем только ухудшается: появляются частые обмороки, повышенный мышечный тонус, затем начинает страдать вегетативная система: возникают нарушения, составляющие сосудистый генезис, изменяется их лабильность, которая влияет на внимание и запоминание новой информации ребенком.
Перинатальная
Этот вид энцефалопатии развивается в последнем триместре беременности или непосредственно во время родовой деятельности. Причины такого нарушения могут быть различны, так, провоцирующим фактором может быть стресс, некоторые заболевания или травмы, которые получила будущая мать.
В зависимости от причины, признаки развития энцефалопатии различаются, однако, первыми симптомами патологии головного мозга считаются:
- слабый крик новорожденного, который прозвучал с задержкой;
- отсутствие сосательного рефлекса;
- нарушение сна, состояние постоянного беспокойства;
- сбивчивое сердцебиение;
- гипер — или гипотонус мышц;
- частые срыгивания.
Так или иначе, такие дети нуждаются в пристальном внимании со стороны специалистов, и чем раньше будет выявлена причина развития нарушения, тем лучше. Терапия в этом случае обычно направлена на устранение основного заболевания, в качестве вспомогательных методов применяются процедуры, улучшавшие кровоток и обменные процессы.
Если лечение назначено правильное и выполняются все предписания специалистов, то последствия патологии сводятся к нулю, а ребенок на 90—95% избавляется от недуга в течение первого года жизни.
Билирубиновая
Гемолитическое заболевание крови, вызванное несовместимостью групп крови матери и плода, способно спровоцировать билирубинувую форму энцефалопатии головного мозга. Природа этого нарушения заключается в неполной переработке и выведении билирубина печенью заболевшего. В норме, показатель не должен превосходить значение 0,1—0,2 г/литр крови, если происходит превышение, то наступает токсическое отравление структур головного мозга, появляется желтушность кожных покровов и слизистых.
Подобное нарушение может быть спровоцировано массой факторов, основные из которых перечислены ниже:
- заражение крови;
- травмы, полученные во время родов;
- инфицирование токсоплазмозом;
- дисфункция поджелудочной железы матери;
- генетическая предрасположенность;
- внутриутробная желтуха.
Эта форма заболевания поражает мозжечок, базальные ядра и другие подкорковые структуры головного мозга. Впоследствии нарушается обмен веществ, падает иммунитет, в более тяжелых случаях начинает развиваться дисфункция некоторых внутренних органов.
Специалисты выделяют 3 фазы билирубиновой энцефалопатии:
- На начальной стадии отмечаются все признаки отравления: тошнота, слабость, гипотонус, появляются частые срыгивания и рвота.
- Вторая стадия, напротив, характеризуется гипертонусом мышц рук и шеи ребенка, появляется болезненность в области суставов, повышается температура тела, нарушается дыхание.
- Следующая стадия начинается с ложного облегчения, которое быстро сменяется возвратом всех признаков поражения головного мозга в усиленной форме, которые способны привести к церебральному параличу, перенапряжению мышц спины, закатыванию глаз.
Лечение энцефалопатии у детей
Терапия подобных патологий начинается со всевозможных методов обследования структур головного мозга с целью определить причину этих изменений. Обычно состоит из комплекса специальных процедур, способных улучшить мозговое кровообращение, нормализацию артериального давления и подавления состояний, которые способны спровоцировать судорожный синдром.
Основные процедуры при этом заключаются в проведении:
- гемодиализа (очищения от токсических веществ) крови;
- гемоперфузии;
- младенец переводится на специальное питание;
- при необходимости проводится искусственная вентиляция легких;
- назначается рефлексотерапия и специальный массаж.
Медикаментозное лечение этого состояния направлено на улучшение и активацию метаболизма головного мозга. При этом обычно назначаются различные ноотропы, аминокислоты, липотопы и комплексная витаминотерапия.
Также применяются препараты, способные облегчить ПЭП (перинатальную энцефалопатию) головного мозга новорожденных: сосудорасширяющие лекарства (папаверин, никотиновая кислота или витамин РР), расслабляющие и успокоительные (глицин, элениум), а также различные допустимые в этом случае анальгетики.
Видео: Лечение энцефалопатии у детей
признаки и симптомы, как лечить и последствия
Энцефалопатией называют патологии мозга с дистрофическими изменениями тканей, вызванные невоспалительными причинами. Перинатальную энцефалопатию (ПЭП) диагностируют у новорожденных. Заболевание возникает в утробе, вследствие родовых травм или в первые дни жизни, то есть в перинатальный период. ПЭП – следствие воздействия на ЦНС плода или новорожденного негативных внешних факторов или недополучения питательных веществ от матери.
Что называют энцефалопатией у грудничка
С медицинской точки зрения ПЭП – не диагноз. Понятие энцефалопатия обозначает дисфункции работы мозга, которые выражаются в различных синдромах, состояниях, задержках физического, психомоторного развития. Основная причина – гибель клеток головного мозга, нейронов. Эти синдромы отличает схожесть симптомов, причин, по которым они возникают.
Энцефалопатию вызывают токсические, травматические, метаболические факторы. Ведущую роль играет гипоксия – недостаток кислородного питания при внутриутробном развитии или нарушения дыхательных функций у новорожденного. Факторы часто накладываются, усиливают действие друг друга. Нередко ПЭП остается неуточненной – выяснить причины не удается.
Основные причины
На формирование ЦНС у новорожденного оказывает влияние целый ряд факторов. Рассмотрим основные причины развития энцефалопатии у новорожденных.
Антенатальные и интранатальные инфекции
Опасность для плода представляет инфицирование матери. Патогенная флора при ветрянке, кори, а также ОРВИ, простудах и других инфекциях отравляет организм женщины и передается плоду. Интранатальные инфекции новорожденный получает при родах. Опасность инфицирования увеличивается при вагинальных кровотечениях, стимуляции родов и регионарной аналгезии.


Травматические поражения плода
При родовспоможении нередко страдают головной и спинной мозг, периферические нервы у новорожденного. Все виды травм, особенно внутричерепные, вызывают ПЭП.
Хронические заболевания матери
Патологии сердечно-сосудистой системы, почек, эндокринные заболевания, включая сахарный диабет, негативно влияют на плод при внутриутробном развитии.
Затруднения в раскрытии родовых каналов
Затяжные роды способствуют инфицированию, при использовании акушерских инструментов младенец нередко получает родовые травмы. Опасны также преждевременные и стремительные роды.
Чрезмерный вес плода
Риск развития энцефалопатии возрастает, если новорожденный слишком велик. Увеличивается опасность длительных родов, необходимости использования инструментов, разрывов и инфицирования.


Важно: подготовка женщины к беременности, забота о здоровье, соблюдение рекомендаций врача защитит плод от гипоксии и развития энцефалопатии.
Осложнения
Патологическое течение беременности с угрозой выкидыша, гестозом, ранним или поздним токсикозом увеличивает риск развития внутриутробной энцефалопатии. Риск возрастает у слишком молодых или старых женщин.
Экология
Токсическое влияние условий внешней среды – загрязненная территория, длительное нахождение беременной во вредных условиях, в том числе рядом с курильщиками, опасно для плода. Токсины с кровью попадают к плоду, нарушая формирование ЦНС.
Классификация
По способу приобретения энцефалопатии делят на две группы – врожденные и приобретенные.


Врожденная
Врожденная или перинатальная энцефалопатия – это болезнь, которая развивается в перинатальном периоде (с 22 недели беременности до недели после рождения младенца). Определяется и выявляется в первые месяцы жизни.
Приобретенная
Приобретенной энцефалопатией страдают, в основном, лица среднего и старшего возраста. Причины данной патологии различны, но в основе лежат постгипоксические состояния, то есть кислородная недостаточность и обменные нарушения мозговых клеток.
Разновидности
Энцефалопатии классифицируют по виду негативного воздействия на мозг, причинам, которые вызвали заболевания, и характеру повреждений нервных клеток.
Гипоксически-ишемическая
Заболевание этого вида возникает из-за продолжительной гипоксии плода и развивающегося нарушения кровоснабжения мозга. Диагностируется сразу после рождения. Относится к перинатальному виду энцефалопатий. Основные симптомы у новорожденных – гипервозбудимость, нарушения сна, замедленное развитие, беспокойство.


Билирубиновая
Развитие энцефалопатии связано с увеличением содержания в крови непрямого билирубина. Сопровождается ядерной желтухой. Младенец вялый, апатичный, развивается синдром угнетения. Рефлексы слабые, со склонностью к угасанию. Часто спровоцирована гемолитической болезнью.
Эпилептическая
Вызывается патологическими изменениями структур мозга. Энцефалопатия сопровождается эпилептическими припадками с судорогами, выгибаниями тела. Нервные клетки в поврежденных очагах мозга гибнут, вызывая поведенческие и интеллектуальные отклонения у ребенка.
Резидуальная
Энцефалопатию резидуального вида вызывают разные виды инфекции, травмы, полученные в родах. У ребенка развиваются множественные неврологические отклонения, часто фиксируется головная боль, наблюдается отставание в психомоторном развитии.


Сосудистая
Развитию сосудистой энцефалопатии способствуют врожденные или развившиеся изменения сосудов мозга, недостаточность кровообращения. За счет этого структура мозга изменяется. У ребенка наблюдаются признаки внутричерепной гипертензии, частые смены настроения, поведения, нестабильность психики, мигрени.
Токсическая
Возникает при длительном воздействии на мозг токсинов разного вида. Энцефалопатия часто развивается после ядерной желтухи. Сопровождается множественными признаками отклонения в работе разных органов и систем у ребенка, развитием судорог, эписиндрома.
Посттравматическая
Провокатором этого вида энцефалопатии служат родовые травмы при акушерских действиях. Тяжесть зависит от степени негативного воздействия на мозг и периферические нервы. Признаки – вестибулярные нарушения, выраженные задержки развития, головная боль, расстройства сна и поведения.


Степени тяжести
Степень тяжести энцефалопатии отражает особенности нарастания симптомов и последствия для мозга и всего организма.
Легкая
При незначительных повреждениях мозга фиксируют слабую степень ПЭП. Симптоматика невыраженная, заболевание определяют по анализам и исследованиям мозга. При своевременном лечении улучшение наступает быстро, последствий и осложнений не вызывает.
Средняя
Симптомы энцефалопатии средней тяжести проявляются как временные явления, не постоянно. У ребенка наблюдаются расстройства поведения, ослабление рефлексов (сосательный, глотательный, другие). При аппаратных исследованиях мозга фиксируются очаги повреждений, кровоизлияния.
Тяжелая
При тяжелой стадии ПЭП новорожденный ослаблен, наблюдается угасание рефлексов, множественные отклонения в поведении. Грудничок отказывается от груди, не реагирует на раздражение или гипервозбудим. При любом качестве лечения остаются осложнения в виде задержек развития, расстройств поведения. Дети часто остаются инвалидами.


Сопутствующие синдромы
Нарушения работы мозга проявляются у новорожденных при ПЭП в виде синдромов и расстройств поведения.
Гипертензионно-гидроцефальный
Этот синдром фиксируется при внутричерепной гипертензии, избытке жидкости в структурах мозга. У грудничка быстро растет голова из-за нарастания гидроцефалии, часто раскрывается и уплотняется родничок, рефлексы ослабевают, фиксируется симптом Грефе.
Спинномозговая жидкость не может покинуть мозг из-за нарушений кровотока.
Синдром двигательных нарушений
Синдром характеризует повышенный или пониженный тонус мышц, непроизвольные сокращения мышц (дистония). Малыш принимает неестественные позы, остается в них продолжительное время. Нарушены реакции на свет, звук, прикосновения. Грудничок часто кричит, но эмоциональной окраски у плача нет.
Гипервозбудимость
К наиболее частым синдромам ПЭП относится гипервозбудимость. Грудничок чрезмерно активен, мышцы постоянно в повышенном тонусе, все реакции преувеличены. Ручки и ножки сжаты, часто фиксируются судороги, тремор подбородка, нистагм, бессонница. Малыш ненадолго засыпает, быстро и с плачем пробуждается.
Судорожный
Судороги могут носить местный характер (дрожание глаз, подбородка) или генерализованный, когда выгибается все тельце. Грудничку трудно удержать пищу, он постоянно и обильно срыгивает, иногда до рвоты. Наблюдаются дыхательные нарушения, апноэ.
Коматозный
Фиксируется после родовых травм и токсического воздействия при значительном поражении мозга. Грудничок полностью теряет способность сосать и глотать, все основные функции организма нарушены.


Синдром вегето-висцеральных нарушений
При этом синдроме фиксируется стойкое нарушение работы внутренних органов и систем у новорожденного, вызванное дисфункциями ЦНС. Наряду с внешними проявлениями – нарушением окраски кожных покровов, наблюдаются расстройства дыхания, пищеварения, мочеполовой системы, двигательные дисфункции.
Дефицита внимания и гиперактивности
Синдром характеризует неадекватность поведения – неспособность сосредоточиться, патологическая активность, невнимательность, отсутствие способности к усвоению нового.
Симптомы и внешние признаки у детей до года
Заметить развитие ПЭП у детей можно по ряду признаков, характеризующих заболевание.
Головная боль
Энцефалопатия сопровождается приступообразными или постоянными головными болями, при которых грудничок кричит, не может успокоиться и расслабиться.


Бессонница
Нарушения сна проявляются повышенной сонливостью, нахождением постоянно в полубессознательном состоянии. Часто ребенок не может уснуть, засыпает на несколько минут и просыпается с криком.
Нарушение памяти
Снижается способность к обучению, запоминанию. Грудничок при энцефалопатии медленнее осваивает новые знания и навыки, позже начинает интересоваться игрушками, узнавать близких.
Снижение двигательной активности ребенка
Грудничок позже приобретает способность держать головку, сидеть, ползать. Нарушена двигательная активность, ему трудно координировать движения из-за недостаточности работы мозга.
Фобии
Дети часто страдают навязчивыми страхами – боятся темноты, отсутствия в комнате родителей, шума, яркого света.


Гидроцефалия
У детей до года нередко развивается гидроцефалия из-за скопления в желудочках мозга жидкости. Это выражается в непропорциональном росте головы.
Методы диагностики
Для диагностики ПЭП используются анализы и аппаратные исследования структур мозга и сосудов головы и шеи.
Нейросонография
Исследование проводят грудничкам с рождения через большой родничок. Выявляют скопления спинномозговой жидкости, кровоизлияния, изменения структур мозга.
Ультразвуковая допплерография
УЗ-исследование направлено на изучение состояния сосудов мозга и шеи – проводимости, сужений, изменения структуры, наличие кист и повреждений.


Электроэнцефалография
Аппаратная процедура выявляет активность мозга, скорость прохождения импульсов, наличие патологий строения, состояние сосудов.
Реоэнцефалография
С помощью процедуры выявляют интенсивность кровотока, разделяют органические и функциональные нарушения проводимости вен и артерий мозга, величину пульсового наполнения.
Анализ крови
По анализу крови определяют наличие лейкоцитоза, формы ПЭП, связанные с изменением билирубина.
Как лечить
Раннее лечение ПЭП позволяет значительно снизить вероятность развития осложнений у грудничков и добиться полного восстановления.
При энцефалопатии используют комплексное лечение – лекарственные препараты разных классов и физиотерапию.


Медикаменты
Медикаменты выбирают нескольких основных групп, другие добавляют по симптомам.
Ноотропы
Стимуляторы нейрометаболической деятельности улучшают проводимость нервных импульсов, повышают устойчивость мозга к гипоксии. Для грудничков используют:
- Винпоцетин;
- Пантогам;
- Пирацетам;
- Актовегин.
Препараты назначают курсом, при необходимости заменяют и повторяют лечение.
Вазодилататоры
Для расширения сосудов, улучшения проводимости, расслабления гладкой мускулатуры сосудистых стенок применяют вазодилататоры – Винпоцетин, Циннаризин, Папаверин.


Психолептики
Группа препаратов для подавления психомоторного возбуждения, нормализации гипервозбудимости – Элениум, Валерианахель.
Антиконвульсанты
Для купирования мышечных судорог, дистонии используют антиконвульсанты – Фенобарбитал, Диазепам.
Дополнительные назначения
Остальные медикаменты назначают в зависимости от ведущих синдромов и тяжести состояния. Это анальгетики для купирования болей, спазмолитики, миорелаксанты для снижения напряженности в мышцах. В тяжелых случаях назначают кортикостероиды для улучшения работы надпочечников. Инфузионная терапия восполняет недостаток глюкозы, натрия, магния.
Физиотерапия
Физиотерапевтическое лечение стимулирует метаболизм в тканях мозга, улучшает состояние сосудов.


Электрофорез
Электрофорез с лекарственными препаратами делают для улучшения трофики сосудов и тканей, стимулирования местного иммунитета и метаболизма.
Амплипульстерапия
Аппарат Амплипульс воздействует переменными токами, способствует улучшению проводимости сосудов, питанию мозга.
Фототерапия
Фототерапия показана при значительном повышении билирубина, при желтушности новорожденного. Выполняется непрерывно с перерывом на кормление.


Лечебный массаж
Массаж и гимнастика нормализуют тонус мышц, оказывают общеукрепляющее действие, улучшают кровоснабжение тканей.
Важно: грудничкам, при любой степени тяжести состояния, при ПЭП рекомендовано кормление грудным молоком.
Возможные последствия
Легкая форма ПЭП при правильном лечении заканчивается выздоровлением. При средней и тяжелой форме энцефалопатии у ребенка могут развиться многочисленные осложнения вплоть до инвалидности.
Неврозы
Перенесшие ПЭП груднички чаще других страдают во взрослой жизни неврозами – функциональными расстройствами высшей нервной деятельности.
Эпилепсия
Осложнением ПЭП может стать эпилепсия – хроническое заболевание с припадками и судорогами.


ДЦП
Одно из наиболее опасных последствий ПЭП – детский церебральный паралич – комплекс двигательных расстройств, связанных с поражением головного мозга.
Слабоумие
Органические поражения мозга, вызванные ПЭП, могут привести к развитию слабоумия – нарушению интеллекта, памяти, способности мыслить.
Депрессии
Склонность к депрессивным состояниям – возможное последствие энцефалопатии.
Косоглазие
Возникающее на фоне ПЭП косоглазие может остаться у детей навсегда из-за нарушений работы мозга.


Мигрени
Мигренью с болезненными ощущениями в одной части головы страдают многие дети, переболевшие ПЭП.
Гидроцефалия
Нарушение циркуляции цереброспинальной жидкости в мозговых структурах может сохраняться как осложнение энцефалопатии.
Шизофрения
Расстройство психики может привести к развитию шизофрении.
Обмороки
Из-за нарушений мозгового кровообращения и метаболизма у перенесших энцефалопатию детей могут случаться обмороки.
Головокружение
Потери ориентации в пространстве происходят из-за нарушений в работе мозга и всей ЦНС.


Нарушение моторики
Из-за отсутствия скоординированной деятельности всех частей ЦНС возможно нарушение моторики – всех частей организма или только отдельных органов.
Немного статистики
Несколько статистических данных о ПЭП у новорожденных:
- энцефалопатию регистрируют у 5 % грудничков;
- среди всех заболеваний НС у детей раннего возраста ПЭП составляет 60 %;
- до 30 % детей с легкой формой ПЭП выздоравливают без последствий и осложнений.
Во многих случаях диагноз ПЭП не подтверждается после уточняющих исследований аппаратным способом. Симптомы в виде тонусных нарушений, дрожания подбородка – просто особенности развития малыша.
Профилактика
Основным способом не допустить развития энцефалопатии у малыша врачи называют вдумчивое и ответственное отношение женщины к беременности. При наличии хронических заболеваний нужно компенсировать все состояния, не допускать развития обострений. Во время беременности женщинам следует соблюдать режим, отдыхать, гулять, дышать свежим воздухом. При визитах к акушеру-гинекологу следует сообщать о проблемах, чтобы исключить гипоксию у плода, подготовиться к родам и избежать интранатального травматизма.
Перинатальная энцефалопатия – заболевание новорожденного, которого можно избежать при соблюдении женщиной осторожности, поддержании здорового образа жизни. Если же диагноз поставлен, следует следовать рекомендациям врача, провести полноценное лечение, делать грудничку массаж, гимнастику, чтобы предупредить осложнения.
Малыши, наравне со взрослыми, подвержены большому количеству тяжелых и смертельных заболеваний, одним из которых является энцефалопатия. При несвоевременной диагностике и отсутствии лечения болезнь способна полностью разрушить головной мозг ребенка и привести к летальному исходу. Ситуация осложняется тем, что у новорожденных и маленьких детей симптоматика малозаметна, поэтому диагностика и лечение могут начаться с серьезным запозданием.
Итак, что такоеэнцефалопатия у детей, чем опасно данное заболевание и можно ли его вылечить?
Что это такое, причины возникновения и симптомы
Энцефалопатия головного мозга у детей – тяжелое неинфекционное заболевание, характеризующееся поражением нейронов головного мозга. Возникает вследствие неблагоприятных факторов, таких как травмы, инфекции, отравления. Из-за них возникает кислородное голодание в тканях мозга, что приводит к нарушению обменных процессов в его тканях. Как следствие, начинается отмирание нейронов и отключение больших областей мозга, отвечающих за органы и системы организма.

Факторами, провоцирующими развитие энцефалопатии у детей, являются различные типы инфекций, которые поражают малыша. Родовые травмы и врожденные патологии. Если мать страдает от хронических заболеваний, а во время беременности принимала лекарственные препараты длительное время.
Существует 2 большие группы, на которые можно разделить все случаи энцефалопатии головного мозга у детей:
- Врожденная. Причинами ее появления являются неблагополучное протекание беременности, генетические нарушения, патологии в развитии головного мозга у ребенка.
- Приобретенная. Может возникнуть в любом возрасте, однако от нее страдают в основном взрослые. Причинами являются неблагоприятные факторы, отрицательно влияющие на здоровье головного мозга.

Классификация
Различают следующие виды заболевания.
Перинатальная энцефалопатия у новорожденных. Возникает вследствие влияния негативных факторов на плод, начиная с 28 недель беременности и заканчивая десятым днем жизни новорожденного. Малыш становится возбудимым, плохо спит, запрокидывает голову, наблюдается патологический тонус и частые срыгивания.
Сосудистая. Ее могут вызвать сосудистые патологии. Характеризуется переменами настроения, головными болями, быстрой утомляемостью.
Эпилептическая. Причины возникновения – патологи головного мозга. Наблюдаются эпилептические припадки, замедление интеллектуального развития, нарушения речи и психики.
Посттравматическая. Возникает после различных травм черепа переломов. Наблюдаются постоянные головные боли, проблемы со сном, головокружения, нарушения вестибулярного аппарата.

Билирубиновая. Толчком к развитию у новорожденного ребенка может стать желтуха и подкожные кровоизлияния. Ребенок становится апатичным, сосательный рефлекс выражен неярко. Дыхание редкое, с задержками. Заметно нарастание напряжения в разгибательных мышцах.
Токсическая. Появляется при отравлении ядами или поражении токсическими веществами. Возникают эпилептические припадки, нарушения психики, терморегуляции. Возможны нарушения в работе вегетососудистой нервной системы.
Также энцефалопатия у детей различается по степеням тяжести. Всего их три:
- Легкая. Симптомы практически отсутствуют, но могут усиливаться после стрессовых ситуаций или нагрузок. На данном этапе зафиксировать поражения мозга возможно только при помощи приборов. Прогноз излечения благоприятный при своевременном обнаружении и пролечивании.
- Средняя. На данном этапе энцефалопатия у детей имеет слабо выраженную симптоматику, которая носит периодический характер. Родители могут заметить нарушение координации и некоторых рефлекторных движений. Во время обследования приборы покажут очаги с кровоизлияниями на поверхности мозга.
- Тяжелая. Такая энцефалопатия у детей приводит значительным нарушениям не только двигательных, но и дыхательных функций. Наблюдаются тяжелые расстройства со стороны неврологии, больной не в состоянии обслуживать себя сам. Часто данное состояние приводит к возникновению инвалидности.
Помимо вышеописанной классификации, энцефалопатия головного мозга у новорожденных и малышей может сопровождаться сопутствующими синдромами.

Гипертензионно-гидроцефальный. У малыша повышается внутричерепное давление, в мозге начинает скапливаться жидкость. Энцефалопатия новорожденных с данным синдромом характеризуется тем, что ежемесячно диаметр головы увеличивается на 1 см. Возможно набухание родничка, врожденные рефлексы выражены слабо. Может наблюдаться косоглазие.
Двигательные нарушения. Энцефалопатия новорожденного в сочетании с таким синдромом проявляется нарушением тонуса мышц. Может возникать как гипертонус, так и мышечная дистония. Новорожденный не может принимать позы, характерные для его возраста, в последствии наблюдается значительное отставание в физическом и психическом развитии. Заподозрить данный синдром поможет непривычно монотонный крик, также задержки реакции на свет, тепло и холод.
Гипервозбудимость. Ребенок чересчур бурно реагирует на любые раздражители, будь то прикосновения, звуки или свет. Энцефалопатия у новорожденного с данным синдромом характеризуется постоянным гипертонусом конечностей, закидыванием головки, обильными срыгиваниями и медленным прибавлением в весе.

Судороги. Возникают при наличии любых раздражителей, могут локализоваться в конечностях либо охватывают все тело. Во время приступа наблюдается рвота, нерегулярное дыхание и пена изо рта.
Коматоз. Энцефалопатия у новорожденного в сочетании с данным синдромом появляется как следствие родовых травм или инфекционных заболеваний. У малыша отсутствует сосательный и глотательный рефлекс, снижены двигательная активность и чувствительность.
Вегето-висцелярные нарушения. У ребенка происходят патологические изменения практически во всех системах организма, кожные покровы становятся багровыми либо очень бледными, нарушается терморегуляция.

Дефицит внимания и гиперактивность. Детская энцефалопатия в данном случае характеризуется высокой возбудимостью, снижением концентрации внимания и импульсивностью. Ребенку тяжело справляться с собственными эмоциями.
Если родители заметили подобные симптомы и проявления у ребенка, то это может свидетельствовать о начале энцефалопатии у новорожденных и детей. В таком случае крайне важно не пытаться поставить диагноз самостоятельно и не заниматься самолечением. Необходимо как можно скорее показать ребенка неврологу.
Диагностика
Сначала врач опрашивает родителей и собирает первичный анамнез. После этого могут быть назначены следующие обследования:
- Общий анализ крови. С его помощью можно определить наличие воспалительных процессов в организме и выяснить уровень билирубина.
- Если ребенок ходит в детский сад, то могут быть проведены тесты для оценки концентрации внимания и памяти, психического состояния маленького пациента.
- Нейросонография подойдет новорожденным, с ее помощью можно обследовать мозг и выявить патологии.
- УЗ допплерография. С ее помощью оценивают состояние сосудистой системы и степень ее поражения. Также производятся замеры скорости кровотока, наличие тромбов.
- Электроэнцефалография. С ее помощью диагностируют наличие опухолей и прочих патологий, протекающих в головном мозге.
- Реоэнцефалография. Благодаря ей врач оценивает состояние сосудов, наличие в них повреждений, а также скорость кровотока.

После получения результатов обследований ребенку ставится диагноз, а врач расписывает схему лечения, исходя из возраста и состояния пациента.
Лечение
Энцефалопатия – тяжелое заболевание, которое поддается исключительно медикаментозному лечению, успех зависит от стадии болезни. Поэтому самолечение не только не даст результата, но и может оттянуть время, необходимое для постановки диагноза и назначения адекватного лечения.
Важно помнить, что все лекарственные препараты подбираются врачом исключительно индивидуально, дозировка и длительность приема могут значительно варьироваться.
Ниже представлен примерный список лекарств, который может быть назначен для лечения болезни:
- Лекарства, которые улучшают кровоток и активизируют работу нервных клеток. Это могут быть Пантогам, Винпоцетин.
- Сосудорасширяющие средства. Помогают улучшить снабжение мозга кислородом и питательными веществами. К таким препаратам относятся Винпоцетин, Папаверин.
- Успокоительные. Показаны малышам, страдающим от гипервозбудимости. Часто используют Элениум.
- Препараты от эпилептических припадков. Их принимают с целью предотвращения припадков и купирования судорог любого типа. К таким медпрепаратам относятся Фенобарбитал и Вальпарин.
- Обезболивающие. Применяются для симптоматического лечения болей различного генеза. Детям часто назначают Ибупрофен или Анальгин.

Помимо медпрепаратов, врач может назначить прохождение курса физиопроцедур или фотолечение. Родителям придется приложить немало усилий для нормализации состояния ребенка. Помимо медикаментов, следует придерживаться следующих рекомендаций:
- У ребенка должен быть строгий режим дня, которого необходимо придерживаться.
- Рацион должен быть богат витаминами и микроэлементами, которые бы покрывали суточную потребность организма в них.
- Благотворно влияют на состояние ребенка занятия ЛФК и массаж.
- Детям постарше может понадобиться консультация логопеда или дефектолога для коррекции возникающих особенностей развития.

Все эти меры будут способствовать не только поддержанию стабильного состояния, но и лучшей социализации ребенка.
Детская энцефалопатия – грозный недуг, который при отсутствии лечения приводит к замедлению психического и физического развития. Прогноз заболевания зависит от степени тяжести и сопутствующих синдромов. В одних случаях возможно полное излечение, в других – получение инвалидности и летальный исход. Именно поэтому крайне важно своевременно показывать ребенка врачу и пролечивать все возникающие патологии.

Эпилептическая энцефалопатия у детей – прогрессивное нарушение познавательных функций под влиянием эпилептического процесса. Проявляется дефицитом когнитивных, поведенческих функций, неврологическими отклонениями. Диагностика комплексная, включает клиническое обследование невролога и психиатра, энцефалографию, томографию, ультразвуковую допплерографию головного мозга, психодиагностическое исследование памяти, мышления, интеллекта, ряд лабораторных тестов. Лечение проводится противоэпилептическими препаратами, ноотропами, сосудорасширяющими, успокоительными средствами.
Общие сведения
Термин «энцефалопатия» произошел из греческого языка, означает «болезнь, страдание головного мозга». Органическое повреждение его различных отделов при эпилепсии возникает вследствие интенсивных нейронных разрядов – чрезмерной биоэлектрической активности. Эпилептическая энцефалопатия (ЭЭ) обычно диагностируется у детей в первые месяцы жизни, распространенность в целом низкая, частота не превышает 0,05%. Эпидемиологические данные тяжелых синдромов искажаются ранней смертностью больных. Среди мальчиков заболеваемость стабильно выше – 60-66%. У дошкольников, подростков и взрослых ЭЭ развивается редко.

Эпилептическая энцефалопатия у детей
Причины
Эпилептическое органическое поражение головного мозга возникает как результат воздействия наследственных и анамнестических факторов. Причинами патологии являются:
- Генетические изменения. Отдельные формы болезни развиваются при мутациях генов, хромосомных аномалиях (например, при синдроме Ангельмана).
- Метаболические сдвиги. Врожденными нарушениями метаболизма, приводящими к ЭЭ, являются некетотическая гиперглицинемия, метилмалоновая ацидурия, дефицит ксантиндегидрогеназы, синдром Зеллвегера, пропионовая ацидемия, D-глицериновая ацидурия.
- Новообразования мозга. Некоторые опухоли обладают эпилептогенным потенциалом, вовлечены в процесс формирования приступов (например, гамартома гипоталамуса).
- Пороки развития ЦНС. ЭЭ возникает на фоне гемимегалэнцефалии, порэнцефалии, синдрома Экарди, врожденного отсутствия сосцевидных тел, церебральной дисгенезии, фокальных кортикальных дисплазий.
- Поражения головного мозга. Повреждения ЦНС пренатального, натального и постнатального периода – распространенная причина эпилептической энцефалопатии у детей.
К факторам риска развития ЭЭ у ребенка относятся патологические процессы при беременности (инфекции, интоксикации, травмы), осложненные роды, перенашивание и недонашивание плода, эпилепсия у ближайших родственников, травмы головы.
Патогенез
Прогрессирующее когнитивное и нейропсихологическое ухудшение при эпилептических энцефалопатиях у детей объясняется агрессивной иктальной и электрической эпилептогенной активностью в период созревания головного мозга. Ее интенсивность определяется стадией созревания мозга, возрастом дебюта. У новорожденных отклонения ЭЭГ представлены вспышкой-подавлением, у младенцев – гипсаритмией, у детей раннего возраста – генерализованными разрядами медленных волн.
Эпиактивность в левом полушарии отражается изменениями речевых функций – диагностируется афазия, аграфия, акалькулия, алексия, речевая диспраксия. Вовлечение в патологический процесс правого полушария проявляется агнозиями, монотонностью речи, бедностью жестикуляции, нарушениями артикуляции. Активность в орбитофрональных, цингулярных областях, срединных структурах формирует отклонения в поведении – аутистические, агрессивные проявления, мутизм. Патологические изменения эмоций, специфической памяти возникают при очагах в гиппокампальных структурах, амигдале.
Классификация
Эпилептические энцефалопатии у детей классифицируют по характеру течения и особенностям клинической картины. Выделяют два типа патологий – I и II.
Эпилептическая энцефалопатия I характеризуется прогрессирующими нарушениями речи, интеллекта, когнитивных и опорно-двигательных функций, отклонениями поведения, эмоций. Сопровождается эпилептическими приступами, развивается в рамках следующих синдромов:
- Синдром Драве. Тяжелая миоклоническая эпилепсия младенчества. Проявляется ранними инфантильными фебрильными клоническими судорогами, миоклоническими и комплексными фокальными приступами, атипичными абсансами.
- Эпилепсия со статусом медленного сна. Характеризуется фокальными ночными моторными приступами, осложненными абсансами, атоническими, клоническими или генерализованными тонико-клоническими приступами.
- Гипоталамическая эпилепсия. Наблюдаются тонические, атонические, тонико-клонические абсансы, нарушения сознания, немотивированный смех, реже плач.
- Синдром Ландау-Клеффнера. Выявляется вербальная слуховая агнозия, афазии, мутизм.
- Синдром Леннокса-Гасто.
- Миоклонический статус при непрогрессирующих энцефалопатиях. Миоклонии хаотичны, в периоды абсансов становятся ритмичными, синхронными.
- Синдром Отахара. Преобладают тонические спазмы (одиночные, кластерами). В трети случаев возникают хаотичные фокальные моторные клонические приступы, гемиконвульсии.
- Синдром Веста. Характеризуется инфантильными спазмами (кластеры), сопровождающимися плачем.
При эпилептической энцефалопатии II определяются нарушения эмоционально-поведенческой, когнитивной сферы. Наблюдается быстрая утомляемость, агрессивность, сниженная работоспособность, трудности концентрации внимания. Эпилептические приступы отсутствуют.
Симптомы эпилептической энцефалопатии у детей
Клиническая картина у детей представлена спектром психических и поведенческих расстройств, нейропсихологическими нарушениями, свойственными органическим поражениям мозга при неврологических болезнях. Энцефалопатические признаки носят специфический характер, зависят от возраста больного ребенка. У детей первого года жизни наблюдается беспокойство, капризность, беспричинная смешливость или плаксивость. Реакции на изменение освещения, звука, положения бывают неадекватными. Дети часто срыгивают, неспособны сосать, плохо спят. Сердцебиение неравномерное, мышечный тонус повышен.
Дошкольники страдают нарушениями сна, интенсивными головными болями. Сохраняется высокий тонус мышц, развиваются обморочные состояния. Эмоционально-волевая сфера отличается неуверенностью, перепадами настроения, чертами гневливости. Дети быстро утомляются, имеют проблемы с запоминанием, трудности переключения внимания. Появляются первые признаки ригидности психической деятельности. В школьном возрасте полностью разворачивается симптоматика когнитивного дефицита. Определяется снижение функции запоминания, усвоения новой информации. Недостаточная гибкость мышления проявляется трудностями адаптации, интеллектуальным дефицитом. Сохраняются расстройства сознания, головные боли, головокружения. Формируется эпилептоидный тип личности с раздражительностью, рассеянностью, депрессивными состояниями.
Осложнения
Эпилептическая энцефалопатия у детей приводит к патологиям двигательной, физической, речевой и психической сферы. Прогрессирующие формы осложняются деменцией, олигофренией, гидроцефалией, детским церебральным параличом, психозами, аффективными расстройствами, психопатологическими изменениями личности. Дети не осваивают школьную программу, социально дезадаптированы, нуждаются в уходе со стороны. Ранняя диагностика и адекватное лечение снижают вероятность осложнений, пациенты способны обучаться в обычной школе, энцефалопатия завершается формированием минимальной мозговой дисфункции.
Диагностика
Диагностика эпилептической энцефалопатии у детей – трудоемкое комплексное обследование. Используются клинические, лабораторные и инструментальные методы:
- Осмотр врача-невролога. Специалист уточняет жалобы, собирает анамнез, оценивает наличие патологических и сформированность нормальных рефлексов, их симметричность, координацию двигательной активности.
- ЭЭГ, МРТ, УЗДГ. Инструментальные исследования позволяют детально изучить структуру, функционирование, кровоснабжение головного мозга, выявить эпиактивность.
- Беседа с врачом-психиатром. В ходе опроса специалист определяет наличие органического симптомокомплекса, характер и выраженность поведенческих, эмоциональных, когнитивных отклонений.
- Психологическое тестирование. Исследование когнитивной, эмоционально-личностной сферы показано детям с 4-5-летнего возраста. Психолог использует патопсихологические пробы, проективные методики, опросники.
- Лабораторные тесты. Анализы выполняются с целью установления причины ЭЭ, определения синдрома. Проводятся тесты на исследование метаболизма, выявление аутоантител.
Лечение эпилептической энцефалопатии у детей
Лечение подбирается индивидуально, зависит от множества факторов – возраста ребенка, степени тяжести эпилепсии, причин ее развития. Специфическая терапия базируется на применении медикаментов. Используются следующие группы препаратов:
- Противоэпилептические средства. Способствуют расслаблению мышц, устранению первичных и вторичных генерализованных судорожных припадков.
- Транквилизаторы. Подавляют возбудимость, эффективны при малых припадках.
- Ноотропы. Стимулируют активность нервных тканей, улучшают развитие памяти, внимания.
- Сосудорасширяющие препараты. Оптимизируют кровообращение, иннервацию в головном мозге.
- Аминокислоты, витамины. Стабилизируют обменные процессы в нервной ткани.
- Седативные средства. Применяются для коррекции эмоциональных нарушений.
Дополнением к медикаментозной терапии является психокоррекция когнитивных функций, логопедические занятия, массаж, лечебная физическая культура. Комплексный подход позволяет купировать основные симптомы эпилепсии, устранить осложнения (речевые, интеллектуальные, двигательные).
Прогноз и профилактика
Прогноз определяется формой заболевания, своевременностью диагностики и адекватностью терапии. Наиболее благоприятный исход отмечается при эпилептической энцефалопатии II, эпилепсии с непрерывными спайк-волнами медленного сна: происходит ремиссия приступов, когнитивные способности улучшаются, поведенческие и эмоциональные нарушения ослабевают, достигается приемлемый уровень социальной адаптации.
Профилактика эпилептической энцефалопатии осложнена, так как заболевание развивается очень рано. Снизить вероятность эпилепсии позволяет тщательная подготовка и ведение беременности: расчет рисков генетических отклонений, своевременное лечение заболеваний будущей матери, отказ от курения, употребления алкоголя.
Энцефалопатия у детей, что это такое
Медики констатируют увеличение числа больных энцефалопатией детей. Эта болезнь очень серьезная и лечить ее нужно незамедлительно. Современная комплексная терапия поможет стабилизировать состояние ребенка, снизить вероятность последствий заболевания и увеличить шансы на выздоровление.
Что это такое
Энцефалопатия — общее наименование болезней головного мозга, которые не связаны с воспалением. Это заболевание развивается по разным причинам и характеризуется повреждением мозговых клеток.
Болезнь у детей может возникнуть внутриутробно или при жизни. Вследствие этого различают две формы заболевания: приобретенную и перинатальную (врожденную).

Перинатальная энцефалопатия развивается в период от 28 недель беременности до 7 дней жизни ребенка после рождения (у недоношенных малышей до 28 суток).
Причины возникновения
Энцефалопатия у младенцев может возникнуть в период внутриутробного развития либо в процессе родов. Наиболее распространенные причины возникновения болезни у новорожденных следующие:
- недоношенность;
- наследственные болезни;
- травмы, полученные при родах;
- прием некоторых медицинских препаратов мамой;
- инфекции, возникшие при беременности;
- ранняя беременность матери;
- токсикозы беременной, угроза выкидыша или преждевременных родов;
- наркомания и алкоголизм матери;
- тяжелые болезни почек и печени;
- недостаточное поступление кислорода в головной мозг;
- высокое внутричерепное давление.
У более старших детей энцефалопатия чаще появляется в результате перенесенных инфекционных заболеваний, токсических влияний на нервную систему или травм головы.
Симптомы и признаки
После рождения за малышом нужно тщательно наблюдать, чтобы не пропустить симптомы заболевания.
Перинатальная энцефалопатия у новорожденного характеризуется следующими признаками:
- запрокидывание головки;
- беспокойство;
- рефлекторные вздрагивания;
- частый плачь;
- вялость или повышенная активность;
- испуг при включении света;
- выпучивание глаз;
- частое срыгивание;
- плохой сон.
Симптомы могут проявляться активно, а потом исчезать. Отклонения в психофизическом развитии при таких признаках болезни проявляются у 50% детей.
Резидуальная энцефалопатия очень тяжело поддается диагностике. Причиной этому является кратковременное проявление болезни у новорожденного. Рецидивы же могут наблюдаться через несколько лет. Они возникают в результате воспалительных и инфекционных заболеваний, гипертензии, черепно-мозговой травмы. Основные симптомы резидуальной энцефалопатии:
- головные боли;
- психоэмоциональная лабильность;
- тошнота;
- нарушение памяти;
- рвота;
- нарушение моторики.
На почве этой дисфункции у ребенка может развиться эпилепсия.
Билирубиновая энцефалопатия развивается очень стремительно, в результате чего не всегда удается ее вовремя обнаружить. Клинические симптомы этой болезни относятся к асфиксической и спастической фазе.
Признаки асфиксической фазы болезни у новорожденного:
- отсутствие сосательных рефлексов;
- анемия;
- задержка дыхания;
- судороги мышц;
- хрипы;
- посинение.
Лицо больного похоже на маску, в глазах испуг.
Признаки спастической фазы заболевания у ребенка:
- пронзительный крик;
- субкортикальные поражения;
- симптом Грефе;
- напряжение мышц.
При появлении описанных признаков билирубиновой энцефалопатии необходимо срочно обратиться к врачу, иначе у малыша возникнут необратимые процессы неврологического характера.
Гипоксически-ишемическую энцефалопатию возможно распознать по следующим симптомам:
- беспокойный сон;
- тремор конечностей;
- повышение рефлексов;
- тремор подбородка;
- мышечная дистония.
Недоношенные дети, страдающие этим заболеванием, подвержены эпилепсии. Часто гипоксически-ишемическая энцефалопатия приводит к мозговой водянке. В результате у ребенка наблюдается высокое внутричерепное давление и отставание в физическом и психическом развитии. Могут появиться такие симптомы, как набухание родничка и увеличение головы. Своевременное медицинское вмешательство предотвратит переход болезни в хроническую форму.
Диагностика заболевания
Диагностика позволяет установить наличие или отсутствие болезни. Энцефалопатия у детей диагностируется различными методами:
Лабораторный
- общий анализ крови;
- биохимия крови;
- оксигемометрия;
- кровь на токсины;
- общий анализ мочи;
- анализ спинномозговой жидкости.
Инструментальный
- допплерография;
- УЗИ головы;
- нейросонография;
- электроэнцефалография;
- магнитно-резонансная ангиография;
- компьютерная томография;
- реоэнцефалография.
Необходима консультация невропатолога, логопеда, офтальмолога и психолога. Точный диагноз можно установить только при полном обследовании.
Методы лечения и препараты
Больных энцефалопатией новорожденных лечат в родильном доме. В случае возникновения осложнений малыша переводят в специализированный лечебный центр. В восстановительный период ребенок чаще всего проходит лечение дома под наблюдением врачей поликлиники.
Гипоксическую энцефалопатию лечат в основном медикаментами, благотворно влияющими на мозговое кровообращение. К ним относятся:
- актовегин;
- фенилпирацетам;
- винпоцетин;
- пирацетам.
Судорожный синдром устраняют диазепамом и фенобарбиталом. Применяются также мочегонные и снижающие интоксикацию лекарства. Препараты вводятся внутривенно, внутримышечно, методом электрофореза, перорально или энтерально. Эффективным дополнительным средством лечения и профилактики заболевания может быть мануальная терапия.
При тяжелых формах билирубиновой энцефалопатии ребенку вводят плазму. Если это не помогает, то переливают кровь.
Заболевание требует продолжительного лечения и наблюдения у невропатолога. Ребенка с гипоксигенной либо ишемической энцефалопатией необходимо регулярно показывать нейрохирургу.
Энцефалопатия у детей постарше лечится следующими медикаментами:
- пантогам;
- глютаминовая кислота;
- кавинтон;
- глицин;
- стугерон;
- фенотропил;
- церебролизин.
В дополнение к лечению лекарствами назначается физиотерапия, акупунктура, мануальная терапия, лечебная физкультура, остеопатия, фитотерапия.
Эффективность лечения зависит от правильной и своевременной постановки диагноза и точного выполнения всех предписаний врачей. В этом случае у ребенка есть шанс на выздоровление без последствий в будущем.
Осложнения и последствия
В случае обширного поражения головного мозга, отсутствия терапии либо несвоевременного и неправильного лечения могут возникнуть различные осложнения и последствия:
- эпилепсия;
- неврозы;
- мигрень;
- патологии глаз;
- астенический синдром;
- гидроцефалия;
- ДЦП;
- слабоумие;
- артериальная гипертензия.
Очень важно наблюдать за ребенком и при первом же подозрении на энцефалопатию обратиться в медучреждение для полного обследования. В случае подтверждения диагноза незамедлительно начать комплексное лечение.
Энцефалопатия — тяжелое, но излечимое заболевание. Задача родителей состоит в том, чтобы не пропустить первые признаки болезни у ребенка и вовремя обратиться в медицинское учреждение. Ранняя диагностика и правильное лечение способны избавить ребенка от тяжелых последствий и привести к выздоровлению.
Типы, причины, симптомы и лечение
Энцефалопатия означает заболевание, расстройство или повреждение головного мозга. Термин относится к временным или постоянным состояниям, которые влияют на структуру или функцию мозга.
Основным симптомом энцефалопатии является изменение психического состояния человека.
Существуют различные типы энцефалопатии с различными причинами, и энцефалопатия может быть осложнением другого состояния.
В этой статье рассматриваются типы, причины и симптомы.Также обсуждается, как врачи могут лечить энцефалопатию.
Поделиться на PinterestЭнцефалопатия — это когда мозг изменяется из-за повреждения, болезни или расстройства.Слово энцефалопатия может относиться ко всем видам повреждений головного мозга и заболеваний.
Есть много типов энцефалопатии, и они могут быть сгруппированы по их причине.
В целом, энцефалопатия может возникнуть в результате травмы, инфекции или других заболеваний.
Ниже мы рассмотрим типы энцефалопатии и их причины:
Физическое повреждение
Когда энцефалопатия возникает в результате повторной травмы, она называется хронической травматической энцефалопатией.
Травма головы может привести к повреждению нервов, что влияет на работу мозга. Хроническая травматическая энцефалопатия может развиться после многочисленных травм или травм головного мозга с течением времени. Это может быть результатом ряда несчастных случаев или ударов по голове.
Люди в армии или занимающиеся контактными видами спорта могут иметь более высокий риск развития хронической травматической энцефалопатии.
Токсины
Если токсины накапливаются в крови и попадают в мозг, они могут нанести вред. Это может произойти из-за основного состояния, инфекции или воздействия токсичных химических веществ.
Существует три типа энцефалопатии, связанной с токсинами:
- Уремическая энцефалопатия : Это происходит в результате накопления уремических токсинов в крови, когда у человека есть почечная недостаточность.
- Печеночная энцефалопатия : это происходит, если заболевание печени вызывает накопление токсинов в крови человека.
- Токсическая метаболическая энцефалопатия : Это происходит, когда токсические химические вещества или химический дисбаланс, вызванный инфекцией, влияют на функцию мозга.
Высокое кровяное давление
Если человек не получает лечения от высокого кровяного давления, это может привести к отеку мозга. Когда это приводит к травме головного мозга, это называется гипертонической энцефалопатией.
Недостаток кислорода
Если мозг не получает достаточно кислорода, человек может испытывать повреждение мозга. Вызванная таким образом энцефалопатия называется гипоксической ишемической энцефалопатией.
Дефицит витамина B-1
Когда у человека дефицит витамина B-1, у него может развиться заболевание головного мозга, называемое энцефалопатией Вернике.
Дефицит витамина B-1 может быть вызван:
- расстройством, связанным с употреблением алкоголя
- недоеданием
- проблемами с поглощением пищи в кишечнике
прионными болезнями
Инфекционная энцефалопатия может быть наиболее серьезным типом. Иногда это происходит из-за редкой группы состояний, называемых прионными заболеваниями или трансмиссивными губкообразными энцефалопатиями.
Эти прогрессирующие заболевания связаны с мутацией белка, называемого прионом.
Прионные заболевания являются нейрогенеративными.Это означает, что они повреждают мозг и приводят к ухудшению или ухудшению его функций с течением времени. Главная особенность прионной болезни — крошечные отверстия в мозге, которые придают ему губчатый вид.
Примеры прионных заболеваний, которые могут привести к инфекционной энцефалопатии, включают:
Унаследованные состояния
Некоторые виды энцефалопатии связаны с генетикой, и у человека чаще развивается ее, если она есть у члена семьи.
Две унаследованные формы энцефалопатии:
- Энцефалопатия Хасимото : Это связано с аутоиммунным заболеванием, называемым болезнью Хашимото, которое поражает щитовидную железу.Точная причина Хасимото неизвестна, но врачи считают, что это наследственное.
- Глициновая энцефалопатия : Это происходит, когда в мозгу слишком много аминокислотного глицина. Это может повлиять на функцию мозга.
Энцефалопатия и энцефалит влияют на мозг, но есть существенные различия.
Энцефалит относится к воспалению в головном мозге, которое часто является результатом вирусной инфекции.
Энцефалопатия относится к постоянному или временному повреждению головного мозга, расстройству или заболеванию.Это влияет на функцию или структуру мозга и может быть дегенеративным.
Share on Pinterest Усталость, трудности с концентрацией внимания и забывчивость являются потенциальными симптомами энцефалопатии.Основным симптомом энцефалопатии является изменение психического состояния. Это может включать в себя:
- , испытывающие проблемы с сохранением бдительности
- , испытывающие проблемы с мышлением или обработкой информации
- , чувствуя смущение,
- забывчивости
- , ведущие себя из-за характера
- , испытывающие трудности с концентрацией внимания
- , чувствуя себя очень уставшими
Эти симптомы со временем может ухудшиться.Прогрессирование зависит от типа энцефалопатии и степени ее тяжести.
В дополнение к измененному психическому состоянию человек с энцефалопатией может испытывать:
- непроизвольное подергивание мышц
- непроизвольные движения глаз
- сотрясение
- мышечная слабость
- проблемы с глотанием или речью
- судороги
Если человек имеет симптомы энцефалопатии, они должны немедленно обратиться к врачу.
Врач может использовать следующее для постановки диагноза:
- анализы крови
- исследование спинномозговой жидкости
- визуальные исследования, такие как МРТ или КТ
- электроэнцефалограммы, которая представляет собой метод регистрации электрической активности мозг
Результаты этих тестов помогут врачу определить:
- , если у человека энцефалопатия
- , какой тип энцефалопатии у человека
- , что является основной причиной
После того, как врач определил причину энцефалопатия человека, они могут порекомендовать лучшее лечение.
Доктор может предложить различные лекарства, чтобы замедлить прогрессирование повреждения.
В некоторых случаях людям может потребоваться операция. Если у человека возникают судороги, врач может назначить противосудорожные препараты.
Тяжелая энцефалопатия может привести к потере сознания или коме. Если это произойдет, врач переведет человека на жизнеобеспечение, чтобы помочь ему восстановиться.
В редких случаях энцефалопатия может привести к необратимому повреждению мозга или гибели людей.
Не все формы энцефалопатии можно предотвратить.Тем не менее, человек может снизить риск следующим образом:
- , придерживаясь здоровой сбалансированной диеты
- , уменьшая потребление алкоголя
- , избегая воздействия токсичных химикатов
Энцефалопатия относится к широкому кругу состояний, которые влияют на функцию мозга В том числе повреждение головного мозга и болезни. Основным симптомом является изменение психического статуса.
Врачи часто могут лечить энцефалопатию, и многие люди полностью выздоравливают. При лечении нарушение функции мозга может быть обращено вспять.
Однако некоторые виды энцефалопатии опасны для жизни. Инфекционная энцефалопатия, вызванная прионным заболеванием, является тому примером.
По данным Центров по контролю и профилактике заболеваний (CDC), прионные заболевания встречаются редко, но они всегда приводят к гибели людей. Исследования в области лечения продолжаются.
Когда они тяжелы, все виды энцефалопатии могут быть опасными для жизни.
У некоторых людей с тяжелой энцефалопатией может развиться необратимое повреждение головного мозга.Если это произойдет, врач поддержит человека и его семью и поможет им справиться с этим заболеванием.
Врач может предоставить подробную информацию о мировоззрении человека. В некоторых случаях члены семьи могут консультироваться с врачом от имени человека.
Эпилептические энцефалопатии относятся к группе расстройств, при которых неослабная эпилептическая активность способствует тяжелым когнитивным и поведенческим нарушениям, превышающим то, что можно ожидать от одной только основной патологии, и они могут ухудшаться в течение всей патологии. время, ведущее к прогрессирующей мозговой дисфункции. Несколько синдромов были описаны на основании их электроклинических особенностей (возраст начала, тип приступа и картина ЭЭГ).В этом обзоре кратко описана клиническая оценка и лечение часто встречающихся эпилептических энцефалопатий у детей.
1. Введение
Термин «эпилептическая энцефалопатия» относится к группе нарушений, при которых неослабная эпилептическая активность способствует прогрессирующей мозговой дисфункции. Это не может быть объяснено одной только основной этиологией [1]. Это может быть прогрессивным или иметь возрастающее течение. Основная этиология разнообразна. Их клинические и электроэнцефалографические (ЭЭГ) особенности отражают специфическую возрастную эпилептогенную реакцию незрелого мозга.Различные синдромы эпилептической энцефалопатии приведены в таблице 1. В этом обзоре будет кратко обсуждаться диагностика и лечение этих синдромов в зависимости от возраста начала.
| ||||||||||||||||||||||||||
2.Ранняя детская эпилептическая энцефалопатия
Эта группа расстройств включает синдром Охтахары или раннюю детскую эпилептическую энцефалопатию (EIEE), раннюю миоклоническую энцефалопатию (EME) и частичные приступы злокачественной миграции в младенческом возрасте.
Синдром Охтахары — это разрушительная эпилепсия с началом в пределах от внутриутробного периода до 3-месячного возраста. тонические спазмы являются определяющим типом приступов, которые очень часты и возникают как в состоянии сна, так и в состоянии бодрствования.Помимо этого, могут наблюдаться частичные и редко миоклонические судороги. Интериктальная ЭЭГ показывает паттерн подавления вспышки без дифференциации сна и бодрствования. Вспышки длятся в течение 2–6 секунд, чередуясь с периодами подавления, продолжающимися в течение 3–5 секунд.
Причины этого разнородны. В большинстве случаев это связано со статическими структурными поражениями головного мозга, такими как фокальная кортикальная дисплазия, гемимегаленцефалия и синдром Айкарди [2, 3]. Было описано несколько генетических мутаций, но они не специфичны для синдрома Охтахары [4, 5].К ним относятся мутации в синтаксин-связывающем белке-1 ( STXBP-1 ) [6], родственный Aristaless гомеобокс ( ARX ) [7] и SLC25A22 -ген, кодирующий митохондриальный носитель глутамата [8]. Недавно была описана эпилептическая энцефалопатия, сходная с синдромом Отахара, которая связана с мутациями в гене KCNQ2 , который кодирует потенциал-управляемый калиевый канал Kv7.2, [9]. Хотя это состояние похоже на синдром Охтахара, тонкие различия включают прогрессирование со снижением частоты приступов при энцефалопатии KCNQ2 по сравнению с синдромом Охтахара, который часто развивается до синдрома Веста и необычных переходных аномалий формирования базальных ганглиев при энцефалопатии KCNQ2 .
Медицинское управление судорогами не приносит пользы. Диетотерапия была опробована с некоторым успехом. Исии и соавт. сообщили о благоприятном ответе на кетогенную диету у младенца мужского пола с синдромом Охтахара, у которого не было нескольких противоэпилептических препаратов [10]. Нейрохирургия иногда благоприятна в некоторых случаях пороков развития головного мозга [11]. Прогноз одинаково плохой, у выживших осталась тяжелая психомоторная отсталость. Может быть возрастная эволюция к синдрому Веста, а затем к синдрому Леннокса-Гасто.
Ранняя миоклоническая энцефалопатия проявляется в первые 3 месяца и в основном в период новорожденности. Предродовое начало известно. Видны фрагментарные, неустойчивые миоклонии, частичные припадки и реже тонические спазмы. Интериктальная ЭЭГ показывает характер подавления взрыва, более выраженный во время сна. Вспышки длятся в течение 1–5 секунд с более длительными периодами подавления (3–10 секунд). Таблица 2 показывает различия между ЭЭГ-признаками синдрома Охтахара и ранней миоклонической энцефалопатией.
| ||||||||||||||||||||||||||
Сообщено о многих из случаи семейные.Врожденные ошибки метаболизма, такие как некетотическая гиперглицинемия, органическая ацидемия, болезнь Менкеса, синдром Зеллвегера, дефицит кофактора молибдена [2], зависимость от пиридоксина [12] и генетические факторы, являются наиболее важными этиологиями. Структурные нарушения встречаются редко [2].
Эти припадки часто невосприимчивы к обычным противоэпилептическим препаратам. Следует начать последовательное терапевтическое исследование с использованием пиридоксина, фолиновой кислоты и пиридоксальфосфата [13]. С кетогенной диетой сообщалось об ограниченном успехе [14].Прогноз мрачный. ЭЭГ часто развивается в атипичную гипсаритмию, которая является переходным или мультифокальным всплеском и резкими волнами через 3-4 месяца после начала заболевания.
Диагностика этих эпилептических энцефалопатий начинается с ЭЭГ, которая должна включать состояния сна и бодрствования. Магнитно-резонансная томография мозга должна быть получена для поиска структурных дефектов. Метаболический профиль, включая аммиак крови, газ артериальной крови, лактат, тандемную масс-спектрометрию крови и анализ мочи на органическую кислоту, должен быть получен для поиска наследственных метаболических дефектов.Тестирование на STXBP1 мутации можно рассматривать у детей с синдромом Охтахара, после исключения пороков развития головного мозга или наследственных метаболических дефектов [13].
Эпилепсия младенчества с мигрирующими очаговыми припадками, — это редкая, возрастная эпилептическая энцефалопатия со злокачественным течением с началом в первые 6 месяцев. Он характеризуется периодом нормального раннего развития, за которым следует почти непрерывный мигрирующий полиморфный очаговый приступ, который трудно поддается лечению, с последующей психомоторной отсталостью и, у большинства детей, с постепенным снижением процентили окружности головы [15, 16].
Интерэктальные ЭЭГ показывают диффузное замедление фоновой активности с многоочаговыми эпилептиформными разрядами. Иктальные ЭЭГ показывают пароксизмальные разряды, происходящие в различных регионах при последовательных припадках у данного пациента. Они начинаются в одном регионе и постепенно затрагивают смежные области. Область иктального начала смещается из одного региона в другой и из одного полушария в другое с периодическим перекрытием последовательных припадков.
Этиология в значительной степени неизвестна. Мутации гена SCN1A [17, 18] и фосфолипазы C β 1 (PCB1) [19] были описаны у немногих пациентов.Припадки заметно фармакорезистентны к обычным противоэпилептическим препаратам. Бромид калия [20] и стрипентол [21] были опробованы с некоторым успехом. Кетогенная диета была неудачной [22].
3. Синдром Веста
Синдром Веста был впервые описан Вестом в 1841 году [23] и характеризуется эпилептическими спазмами или «приступами салам , гипсаритмией » на ЭЭГ, а также задержкой или регрессом развития. Типичное начало от 3 до 12 месяцев.Эпилептические спазмы представляют собой скопления внезапных, коротких (0,2–2 секунды), диффузных или фрагментарных и тонических сокращений мышц осей и конечностей. Это может сопровождаться криком, смехом или вегетативными изменениями. Это может быть сгибатель (наиболее распространенный), разгибатель, смешанный или тонкий. Они обычно происходят в состоянии возбуждения и в состоянии тревоги [24].
Гипсаритмия — это классическая межэктальальная ЭЭГ-диагностика, которая характеризуется хаотическим фоном с почти непрерывными случайными асинхронными медленными волнами высокого напряжения и всплесками, возникающими из нескольких фокусов (Рисунок 1) [25].Многие вариации были описаны [26]. К ним относятся повышенная межполушарная синхронизация, постоянная асимметрия напряжения, постоянная фокусировка аномального разряда, эпизоды генерализованного / регионального или латерализованного ослабления напряжения (рис. 2), в первую очередь высоковольтная двусторонняя асинхронная медленная волна с относительно небольшими нарушениями эпилептиформной формы. Как классическая, так и вариантная гипсаритмия имеют одинаковый прогноз. Изменение происходит из-за состояния сна, этиологии, течения заболевания и лечения.
ЭЭГ становится фрагментированной и более синхронизированной во время сна без стремительных движений глаз (NREM) и относительно нормализуется во время сна с быстрыми движениями глаз (REM). Паттерны иктальной ЭЭГ являются переменными и могут включать в себя классический электрокрементный паттерн, низковольтную генерализованную медленную волну или быструю активность с низкой амплитудой [24].
Этиология разнообразна. Синдром Веста был классифицирован классически в виде симптоматической (идентифицируемый неврологический инсульт), криптогенной (вероятно, симптоматической, но без известной этиологии) и идиопатической (нормальное преморбидное развитие и неизвестная этиология) формы.Классификация в соответствии с новой классификацией ILAE [1] показана в таблице 3. Недавно была предложена генетическая и биологическая классификация [27]. Таким образом, тщательная клиническая оценка, сопровождаемая соответствующей нейровизуализацией и генетической и метаболической обработкой, оправдана у ребенка с синдромом Веста.
| |||||||||||||||||||||||||
Гормон адренокортикотрофин (АКТГ) является препаратом выбора для краткосрочного лечения эпилептических спазмов.Низкие дозы АКТГ могут быть такими же эффективными, как и высокие дозы АКТГ [28]. Оральные стероиды также могут быть альтернативой, особенно в условиях ограниченных ресурсов [29]. Вигабатрин является препаратом второго ряда, за исключением детей с комплексом туберозного склероза, где он является предпочтительным препаратом по сравнению с АКТГ. Испытания пиридоксина и биотина всегда следует рассматривать при рефрактерных судорогах или при клинических показаниях. Кетогенная диета также оказалась полезной [30–32]. Резекционная нейрохирургия может быть оправдана в рефрактерных случаях с односторонними или очаговыми врожденными или рано приобретенными повреждениями коры [33].Тотальная каллозотомия может рассматриваться у детей с постоянными приступами капли [34].
Прогноз защищен и регулируется этиологией и лечением. Пораженные дети остаются с переменной психомоторной отсталостью, эпилепсией или психическими расстройствами [24].
4. Поздняя детская эпилептическая энцефалопатия
Эта организация была предложена Nordli et al. [35, 39]. Начало заболевания превышает один год с классическими миоклонически-тоническими приступами .Тонизирующий компонент длиннее инфантильных спазмов и короче, чем при синдроме Леннокса-Гасто. Могут быть связанные миоклонические судороги, эпилептические судороги и атонические судороги. Интериктальная ЭЭГ показывает неорганизованный высокоамплитудный медленный фон с мультифокальными шипами, более выраженными во время сна. Реакция на общепринятые противоэпилептические лекарственные средства является слабой, с некоторым ответом на гормональную терапию и кетогенную диету. Прогноз охраняется.
5. Синдром Драве
Впервые он был описан Драве в 1978 году как тяжелая миоклоническая эпилепсия младенчества (SMEI) [40].Начало заболевания обычно составляет от 5 до 8 месяцев с частыми, продолжительными лихорадочными односторонними клоническими конвульсиями с чередующимся паттерном у ранее нормального ребенка. Также могут присутствовать нефебрильные судороги. Эта стадия сопровождается появлением множественных типов приступов (миоклонических, атипичных отсутствий и сложных очаговых приступов), которые часто прогрессируют до эпилептического статуса и связанного с ним тяжелого психомоторного ухудшения. Безжалостное прогрессирование прекращается в возрасте 10–12 лет с уменьшением частоты приступов и сохраняющимися неврологическими последствиями [41].
Первоначально ЭЭГ в норме. В некоторых случаях генерализованные фотопароксизмальные реакции и ритмическая тета-активность (4-5 Гц) могут наблюдаться в центропариетальных областях и макушке. Вскоре ЭЭГ ухудшается из-за замедления фона, асимметричных пароксизмов генерализованных разрядов полиспайков / медленных волн и мультифокальных эпилептиформных аномалий. Может присутствовать чувствительность к свету, рисунку и закрытию глаза [24, 42].
У детей с пограничным SMEI или трудноизлечимой детской эпилепсией с генерализованными тоническими клоническими приступами (ICEGTCS) могут отсутствовать миоклонические судороги или генерализованная всплесково-волновая активность [43].
Мутации в гене SCN1A, кодирующем альфа-1-субъединицу натриевого канала, обнаруживаются в 70–8
.Без лечения эпилептические энцефалопатии у детей могут иметь катастрофические последствия. Лечение противоэпилептическими препаратами (AED) часто может не контролировать судороги, и даже если они это делают, эта мера является только симптоматической и не специфической. Это особенно ценно для выявления потенциальных основных условий, которые имеют конкретные методы лечения. Только у нескольких состояний есть окончательное лечение, которое потенциально может изменить естественное течение болезни.В этой статье мы обсуждаем несколько таких состояний, которые реагируют на витамин или его производные.
1. Введение
Эпилептические энцефалопатии (ЭЭ) — это состояния, при которых происходит прогрессирующая когнитивная и нейропсихологическая регрессия, обусловленная чрезмерной иктальной и межинтетальной эпилептогенной активностью во время созревания мозга [1]. Прогрессирование при таких расстройствах в основном неумолимо и приводит к необратимому повреждению развивающегося мозга. Первоначальная классификация Международной лиги против эпилепсии (ILAE) включала лишь несколько условий в соответствии со строгими критериями ЭЭ; однако в 2010 году они расширили определение до любой формы эпилепсии, которая может вызвать энцефалопатический эффект [2].Большинство из этих состояний управляются симптоматически с помощью AED; очень редко эти состояния имеют поддающиеся лечению основные причины, включая генетические, метаболические, аутоиммунные и пищевые причины. Лечение определенным витамином или производным витамина в этих конкретных случаях может остановить такое неумолимое развитие.
2. Эпилепсия, зависимая от пиридоксина (PDE)
Hunt и коллеги сообщили о первом случае трудноизлечимой эпилепсии у младенца, которого контролировал пиридоксин в 1954 году [3]. Впоследствии всплыло много анекдотических случаев заболевания [4, 5].Некоторое время предполагалось, что мутация, влияющая на глутаматдекарбоксилазу (GAD), была причиной возникновения PDE. Однако Battaglioli с коллегами показали, что мутация GAD не связана с PDE [6]. В 2006 году Mills et al. впервые сообщили, что дефицит альфа-аминоадипической полуальдегиддегидрогеназы (антикитина) из-за мутации ALDh2A7 является причиной возникновения PDE [7]. Обычно проявляется в неонатальном периоде. Пораженные новорожденные обычно проявляются в течение первых нескольких часов после рождения с приступами.Припадок развивается в эпилептический статус, несмотря на адекватное лечение AEDs. Антенатальный анамнез необычных движений плода, указывающий на внутриутробные припадки, может присутствовать, хотя это не очень распространено. Семиология судорог довольно разнообразна с очаговыми, генерализованными, миоклоническими, эпилептическими спазмами и / или смешанными припадками. ПДЭ можно легко спутать с гипоксической ишемической энцефалопатией или сепсисом в связи с возрастом возникновения и частыми проявлениями судорог [8–10]. Редко, клинические проявления могут быть отложены в более позднюю часть младенчества до 2 месяцев или старше.Опять же, у этих детей проявляется рефрактерная эпилепсия с медицинской точки зрения, которая может развиться в эпилептический статус [11–13]. У многих пациентов отмечается повышение уровня непрямого биомаркера пипеколиновой кислоты (ПА) в плазме и при СМЖ [14, 15]. Пациенты с PDE имеют повышение альфа-аминоадипического полуальдегида (AASA) в плазме, CSF и моче, что служит специфическим биохимическим маркером [15]. Тем не менее, анализ AASA еще не является коммерчески доступным. Обычно эти биохимические результаты сохраняются даже после многих лет эффективного лечения [15].Нет конкретных рентгенологических результатов, уникальных для PDE. Однако у детей с ФДЭ часто наблюдаются различные степени атрофии головного мозга, истончение мозолистого тела, мега цистерна магна, прогрессирующая гидроцефалия и очаговая дисплазия коры головного мозга. Результаты нейровизуализации не связаны с биохимическими или генетическими аномалиями [9, 16–18]. Если лечение в начале курса, МРТ головного мозга может стать нормальным [19]. МР-спектроскопия может показать снижение отношения N-ацетил-аспартата к креатину в коре головного мозга, что указывает на потерю нейронов [20].Результаты ЭЭГ неспецифичны, а отклонения варьируются от умеренно медленной фоновой активности до паттерна подавления вспышки. Между этими двумя крайностями можно обнаружить генерализованную и многоочаговую эпилептиформную активность, всплески медленных волн высокого напряжения и гипсаритмию. Пароксизмальные события и судороги часто не связаны с изменениями ЭЭГ, что указывает на то, что не все события являются эпилептическими [21, 22]. Доказано, что мутации в гене ALDH7A1 являются молекулярной причиной PDE.Этот ген кодирует белок antiquitin, альдегиддегидрогеназу (AASA), которая функционирует в пути катаболизма лизина в головном мозге. Гомозиготные или сложные гетерозиготные мутации ALDH7A1 были зарегистрированы у пациентов с неонатальным, а также с поздним началом ФДЭ [7, 15, 23–27]. Лечение заключается в начальной дозе 50-100 мг пиридоксина в / в, что может привести к драматическому контролю судорог и улучшению ЭЭГ [28]. Иногда некоторым пациентам может потребоваться до 500 мг в последовательной дозировке.Эти вмешательства должны проводиться только в условиях контролируемой интенсивной терапии, так как сообщается, что внутривенный пиридоксин вызывает редкие случаи остановки дыхания. Это должно сопровождаться поддерживающей дозой 15–18 мг / кг / день в двух разделенных суточных дозах с максимальной суточной дозой 500 мг [9, 29]. Хотя простой тест одновременной стимуляции ЭЭГ и пиридоксина для выявления улучшения может быть очень полезным, он не идентифицирует и не исключает ФДЭ. Пациент с подозрением на ФДЭ должен получать пиридоксин до тех пор, пока диагноз не будет полностью исключен путем метаболического и / или анализа ДНК [30].Периферическая невропатия и ганглионопатия дорсального корешка были отмечены как побочный эффект терапии высокими дозами пиридоксина [31, 32]. В дополнение к пиридоксину диета с ограничением лизина может оказать положительное влияние на улучшение долгосрочных результатов развития детей с ФДЭ [33].
Несмотря на то, что ранняя диагностика и лечение очень важны, у пациентов с PDE было отмечено большое разнообразие нарушений развития нервной системы, независимо от времени начала лечения, что указывает на многофакторную этиологию исхода развития.Они варьируются от выраженного языкового дефицита до когнитивной дисфункции, обсессивно-компульсивного расстройства и распространенного расстройства развития. Может наблюдаться задержка моторного развития с сопутствующим постоянным легким снижением тонуса [9, 23, 34, 35]. Общий результат в PDE все еще остается плохим, и индивидуальный результат не может быть предсказан многими оцененными характеристиками, включая время начала лечения [36]. Другими очень редкими причинами пиридоксинзависимой эпилептической энцефалопатии являются гипофосфатазия, обусловленная дефицитом тканевой неспецифической щелочной фосфатазы (TNSALP), мутация в биосинтезе якоря фосфатидилинозитол-гликан класса V (PIGV), вызывающая гиперфосфатазию, пиропоксинолин 5-го типа (гиперпролинциновый тип 5), гиперпролинциновый тип 5 (гиперпролинциновый тип 5), гиперпролинатин 5-го типа, гиперпролинзин 5-го типа, гиперпролинциновый тип 5, гиперпролинциновый тип 5, гиперпролинциновый тип 5, гиперпролинциновый тип 5, гиперпролинциновый тип 5, гиперпролинциновый тип 5, гиперпролинциновый тип 5, гиперпролинциновый тип 5, гиперпролинатин 5-го типа, гиперпролинцинация 5-го типа, гиперпрофинатин 5-го типа. дефицит [37].Все эти состояния являются аутосомно-рецессивными, а связанные судороги реагируют на пиридоксин.
3. Пиридоксаль-5-фосфат-зависимая эпилепсия
Этот синдром был впервые описан в 2002 году Куо и Ваном [38]. Недавно было показано, что мутации в гене PNPO , который кодирует пиридоксин-5′-фосфатоксидазу, являются причиной этого аутосомно-рецессивного состояния [39]. Эпилепсия, зависимая от пиридоксаль-5-фосфата (PLP), отличается от ФДЭ с отчетливыми клиническими особенностями и нейрофизиологическими проявлениями.Новорожденные, рожденные с зависимой от PLP эпилепсией, неизменно преждевременны и имеют признаки, которые имитируют органическую ацидемию сразу после рождения. Часто наблюдаются гипогликемия и лактоацидоз с трудноизлечимыми припадками. Антенатальная история судорог плода очень распространена. Семиология припадка включает клонические или миоклонические толчки и сложные глазные, лицевые или ороллингвальные движения. Эти дети не поддаются лечению AED или пиридоксином. Если не лечить, эти дети умрут или будут иметь серьезные нарушения развития нервной системы.Пострадавшие пациенты постепенно реагируют на лечение пиридоксаль-5-фосфатом [40–42]. Аминоацидограмма плазмы выявит повышенный уровень глицина и треонина. Исследования нейротрансмиттеров CSF показывают повышение уровня L-дофа и 3-метокситирозина; снижение уровня гомованиловой и 5-гидроксииндолуксусной кислот [43, 44]. Несмотря на то, что ЭЭГ является классически интерктальной, она демонстрирует характер подавления вспышки, свидетельствующий о синдроме Охтахара. Редко ЭЭГ может быть нормальной [40]. Недавно Шмитт и его коллеги сообщили, что ЭЭГ во время судорог и / или приступообразных явлений была на удивление неубедительной.Они наблюдали непрерывные или прерывистые очаговые или генерализованные выделения острых волн или ритмичные острые тета-волны во время припадков, но чаще не было заметных иктальных изменений. Они пришли к выводу, что отсутствие выделения иктальной ЭЭГ во время отчетливых пароксизмальных явлений, возможно, более наводит на мысль о PDE или PLP-зависимой эпилепсии, чем непостоянно очевидные иктальные выделения [22]. Генетически, PLP-зависимая эпилепсия связана с мутацией гена PNPO , расположенной на хромосоме 17, и наследуется по аутосомно-рецессивному типу.Большинство мутаций изменяют одну аминокислоту в ферменте пиридоксин-5′-фосфатоксидазе, нарушая его нормальную функцию. Полученный фермент не может эффективно метаболизировать пиридоксин и пиридоксамин с образованием PLP. Дефицит PLP может нарушить функцию многих других белков и ферментов [39]. Лечение пиридоксином не влияет на клинические или ЭЭГ-характеристики. Тем не менее, парентеральная PLP приводит к значительному улучшению. Типичная доза PLP составляет 30–50 мг / кг / сутки в 3-4 приема в качестве энтерального препарата [40].Ранняя диагностика и лечение являются наиболее важным предиктором результата. В нелеченных случаях отмечается высокая смертность, а выжившие остаются с плохим нейрокогнитивным исходом [40, 42].
4. Эпилепсия, реагирующая на фолиевую кислоту
Эпилепсия, реагирующая на фолиевую кислоту, также широко известна как синдром дефицита фолиевой кислоты в головном мозге. Хотя дефицит фолата в головном мозге связан с различными неврологическими состояниями, только несколько состояний реагируют на лечение фолиновой кислотой. Они обычно опосредуются либо генетическими, либо аутоиммунными механизмами и вызывают низкую концентрацию 5-метилтетрагидрофолата CSF (MTHF).Wevers и коллеги первоначально сообщили о случае тяжелой изолированной недостаточности фолата в ЦНС у пациента с медленно прогрессирующим неврологическим заболеванием и предположили нарушенную передачу фолата через сосудистое сплетение [45]. Впоследствии Ramaekers и его коллеги опубликовали подробную историю болезни, лечение и результаты лечения у больных [46, 47].
4.1. Аутоиммунные фолатные антитела
Клинические признаки и симптомы обычно начинаются в возрасте около 4 месяцев с появления раздражительности и нарушения сна.Обычно это сопровождается развитием психомоторной отсталости, судорог, дискинезии, мозжечковой атаксии и спастической диплегии. Другие признаки включают замедление роста головы на ранних стадиях расстройства. В нелеченных случаях нарушения зрения проявляются через 3 года, а нейросенсорная тугоухость — примерно через 6 лет. Приблизительно у одной трети пациентов могут развиться эпилептические спазмы, рецидивирующие миоклонически-астатические приступы, приступы отсутствия и генерализованные тонико-клонические приступы.Тридцать пять процентов пациентов также имеют расстройства аутистического спектра [46, 47]. Уровень CSF MTHF обычно низкий. Аутоантитела к фолату часто присутствуют в сыворотке крови. Интересно, что фолат эритроцитов обычно нормальный. Результаты ЭЭГ неспецифичны и варьируют от умеренного диффузного замедления, мультифокальных скачкообразных разрядов и гипсаритмического фона до электрического эпилептического статуса во сне [48].
Результаты нейровизуализации неспецифичны, и МРТ головного мозга может выявить супра- и инфратенториальную атрофию.
4.2. Мутация гена FOLR1
Это состояние связано с мутацией в гене FOLR1, расположенном на длинном плече хромосомы 11. Это приводит к нарушенному транспорту фолата в центральную нервную систему, что, в свою очередь, вызывает нарушение метаболизма миелина и нейродегенерацию. В отличие от ранних проявлений аутоиммунного фолатного антитела EE, эти дети обычно представлены в возрасте от позднего детства до восьми лет [48, 49]. У больных детей наблюдается трудноизлечимая миоклонически-астатическая, миоклоническая и генерализованная тонико-клоническая эпилепсия.Другие неврологические проявления включают атаксию, задержку развития, гипотонию и регресс вехи развития. У детей, которые появляются в конце второго десятилетия, могут проявляться признаки тяжелой полинейропатии. Эти пациенты имеют почти необнаружимые уровни CSF 5 MTHF с уменьшением концентрации CSF MTHF более чем на 80% ниже нижнего предела контрольного диапазона [50]. Наиболее распространенными результатами ЭЭГ являются диффузное замедление фоновой активности и мультифокальные всплески [49]. МРТ головного мозга чаще всего показывает замедленную миелинизацию или гипомиелинизацию белого вещества головного мозга с легкой атрофией головного мозга и очень выраженной атрофией мозжечка [49].Ген FOLR1 расположен на хромосоме 11q13.3-q14.1. Гомозиготные мутации или сложные гетерозиготные мутации приводят к аутосомно-рецессивному расстройству [49].
Оба эти состояния отвечают на фолиновую кислоту 0,5–1 мг / кг / день. Фолиевая кислота доступна в L и D изомерных формах. Было показано, что форма L-изомера является более клинически эффективной. Следует подчеркнуть, что лечение фолиевой кислотой противопоказано, поскольку оно может усугубить дефицит MTHF в СМЖ, вызывая дальнейшее клиническое ухудшение [51].Пациенты, которым поставлен диагноз и которые проходят лечение в возрасте до 6 лет, могут продемонстрировать благоприятный, а иногда и драматический ответ с выраженным неврологическим выздоровлением и прекращением судорог. Старшая группа детей старше 6 лет имеет тенденцию к более позднему ответу с неполным неврологическим восстановлением. Тем не менее, лечение фолиевой кислотой все еще полезно для предотвращения дальнейшего ухудшения у этих пациентов [51].
5. Дефицит биотинидазы
Дефицит биотинидазы — это биотин-чувствительное, аутосомно-рецессивное нейрокожное метаболическое расстройство, вызывающее множественный дефицит карбоксилазы и проявляющееся приступами, гипотонией, зрительными / слуховыми симптомами, экземой и алопецией.Фермент биотинидаза расщепляет биоцитин до биотина, который служит кофактором для пяти биотин-зависимых ферментов карбоксилазы: пируваткарбоксилазы, пропионил-КоА-карбоксилазы, бета-метилкротонил-КоА-карбоксилазы и двух изоферментов ацетил-СоА-карбоксилазы. Эти карбоксилазы играют важную роль в синтезе жирных кислот, катаболизме аминокислот и глюконеогенезе. Когда активность биотинидазы составляет 10–30% от нормальной, это называется частичным дефицитом, а когда она составляет менее 10%, это называется глубоким дефицитом [52].Глобальная заболеваемость дефицитом биотинидазы составляет 1 на 60 000 живорождений [52]. Кровное родство связано с более высокими показателями до 20% и наблюдается в таких регионах, как Турция и Саудовская Аравия [53]. Дети без лечения обычно имеют нейрокожные особенности от 2 до 5 месяцев жизни [54], хотя проявление может быть в позднем подростковом или взрослом возрасте [55]. Считается, что неврологические особенности при дефиците биотинидазы являются результатом аберрантной миелинизации. Наиболее распространенной неврологической особенностью у нелеченных пациентов являются судороги, которые встречаются у 70% детей с симптомами и тяжелым дефицитом биотинидазы [56].Они могут принимать форму тонико-клонических, миоклонических или частичных припадков или проявляться как инфантильные спазмы [56]. Гипотония является еще одним частым наблюдением у детей с дефицитом биотинидазы. Презентация в более позднем возрасте сопровождается атаксией и задержкой развития, часто с проблемами зрения и потерей слуха. Когда дети остаются бессимптомными до более позднего детства или подросткового возраста, их проявление может сопровождаться такими признаками, как быстрая потеря зрения при скотомах, невропатия зрительного нерва и спастический парапарез, что приводит к диагностической путанице с ювенильным рассеянным склерозом [57].Кожные заболевания включают атопический / себорейный дерматит, алопецию, включая выпадение бровей и ресниц, гипопигментацию кожи или волос и грибковые инфекции кожи [58–61]. Респираторные симптомы также были описаны и включают гипервентиляцию, гортанный стридор и апноэ [62]. Гипервентиляция может быть вызвана метаболическим ацидозом (см. Ниже) и может привести к коме и смерти. Скорее всего, гортанный стридор обусловлен неврологическим поражением. Лактоацидоз обычно, но не всегда, наблюдается у детей с симптомами.Гипераммонемия легкой и средней степени распространена, хотя она может отсутствовать даже у сильно пораженных детей. Наиболее полезным нарушением обмена веществ для диагностики является наличие аномальных метаболитов органических кислот в сыворотке и моче, которые повышаются вследствие дефицита митохондриальной карбоксилазы, чаще всего 3-гидроксиизовалерата [57]. Другие повышенные органические кислоты включают 3-метилкротонилглицин и метилцитрат, что указывает на возможность множественного дефицита карбоксилазы [59]. CSF лактат и пируват могут быть повышены.Уровень биотинидазы в сыворотке будет низким и подтверждает диагноз. Биотинидазную активность измеряют либо полуколичественным флуорометрическим методом с использованием биотинил-6-амидохинолина в качестве субстрата, либо полуколичественным колориметрическим методом с использованием N-биотинил-п-аминобензойной кислоты в качестве субстрата [53]. Дефицит биотинидазы также может быть продемонстрирован в лейкоцитах периферической крови, культивируемых фибробластах кожи или амниотической жидкости для пренатальной диагностики [63]. Результаты нейровизуализации включают атрофию головного мозга с вентрикуломегалией, увеличенные пространства CSF и диффузные изменения белого вещества, которые могут быть связаны с дисмиелинизацией [59, 60].Сообщалось о рецидивирующей энцефалопатии с вазогенным отеком в двустороннем путамене и хвостатых ядрах, инфра- и супратенториальной коре, а также стволе мозга и атрофии при хронических заболеваниях [64]. МР-спектроскопия может показать снижение пика NAA, повышение уровня лактата и изменение соотношения холин / креатин. Эти спектроскопические данные сходны с митохондриальными нарушениями, такими как болезнь Ли или болезнь Альпера [60]. Результаты ЭЭГ при дефиците биотинидазы включают умеренное замедление фона, ослабление фона, мультифокальные пики, согласующиеся с ранней детской энцефалопатией, паттерн подавления вспышек, асинхронность и гипсаритмия [56, 57, 59, 60].ЭЭГ может быть нормальной у пораженных детей. Исследования ERG и VEP нормальны, в то время как BAEP может показать результаты, согласующиеся с нейросенсорной тугоухостью [60]. Ген биотинидазы локализован в хромосоме 3р25. Сообщалось, что по крайней мере 150 различных мутаций связаны с дефицитом биотинидазы [62]. Лечение биотином может предотвратить симптомы, если при скрининге новорожденных обнаружен дефицит биотинидазы. Если симптомы симптоматические, улучшение наблюдается часто в течение дня после лечения. Судороги часто не отвечают на AEDs, но быстро реагируют на добавление биотина [56].Было высказано предположение, что, подобно испытаниям с пиридоксином, исследование биотина следует рассматривать у любого ребенка с плохо контролируемыми припадками [57]. Разрешение симптомов при лечении может быть полезным, часто перед лицом множества неудачных предыдущих попыток без правильного диагноза [59]. Независимо от возраста или веса, доза 5–20 мг в день оказалась эффективной [59, 65] и должна продолжаться в течение всей жизни. Несоблюдение может привести к рецидиву симптомов в течение недель или месяцев [53].Дефицит холокарбоксилазы может проявляться симптомами, подобными дефициту биотинидазы, а также реагирует на прием биотина [60].
При рутинном скрининге новорожденных на предмет выявления расстройства [66] в развитых странах случаи полного дефицита биотинидазы встречаются редко. В тех частях мира, где универсальный скрининг недоступен, врачи должны обследовать всех родственников первой степени на предмет дефицита и лечения, поскольку среди близких родственников этот показатель высок [53, 59]. Следует избегать сырых яичных белков, поскольку они содержат авидин, который связывает биотин и снижает его биодоступность [62].Большинство клинических изменений, изменений ЭЭГ и визуализации могут быть обратимыми, за исключением нейросенсорной тугоухости [67], атрофии зрительного нерва и задержки развития [53, 59, 60, 62, 68].
6. Дефицит витамина B12
Leichtenstern [69] и Lichtheim [70] дали самые ранние описания неврологических ассоциаций мегалобластной анемии как поражений [71, 72] в задних и боковых столбах спинного мозга. Термин «подострая комбинированная дегенерация пуповины» (SCD) был придуман Russell et al.[73]. Фолиевая кислота была синтезирована в 1945 году, и ее широкое использование в лечении мегалобластной анемии привело к нескольким случаям обострения неврологических осложнений. Клиническая картина дефицита витамина В12 может быть связана с анемией или с неврологическими симптомами, последний из которых обсуждается ниже. У пациентов с мегалобластной анемией частота неврологических проявлений была следующей: SCD (15%), дисавтономия, периферическая невропатия (40%) и атрофия зрительного нерва (2%).Психиатрические проявления включают изменения настроения и поведения (20%), потерю памяти и снижение когнитивных функций (25%) [74]. Периферическая невропатия проявляется как дистальная симметричная сенсорная потеря с атаксией. Преобладают такие крупные волокна, как потеря вибрации и проприоцепция. Рефлексы могут быть увеличены, нормальны или уменьшены в зависимости от степени поражения спинного мозга. Пациенты без анемии или макроцитоза, как правило, имеют наиболее тяжелые проявления нервной системы [75].
У грудных детей материнская недостаточность витамина В12 является наиболее частой причиной и проявляется у грудных детей в возрасте от 4 до 8 месяцев [76].Матери часто вегетарианцы, поскольку витамин отсутствует в растениях. Начало у детей более быстрое (в течение нескольких месяцев), чем у взрослых (в течение нескольких лет), и в основном это проявляется в центральной нервной системе [77]. У детей могут наблюдаться задержка развития нервной системы, регресс моторных вех, неспособность развиваться, раздражительность, апатия, гипотония, гиперрефлексия, тремор, хореоатетоидные движения и микроцефалия [71, 76–81]. Приступы с дефицитом витамина В12 встречаются редко, но о них сообщалось особенно у детей [78, 80, 82], включая случай синдрома Веста [83].Предполагается, что потенциальным механизмом судорог является токсичность гомоцистеина, как было показано на крысах, и у детей может быть предрасположенность из-за не полностью сформированного гематоэнцефалического барьера [84]. Судороги также могут возникать у взрослых [84, 85].
Нейротоксические механизмы дефицита витамина В12 до конца не изучены. Витамин B12 является ключевым кофактором в двух биохимических реакциях: (1) синтез метионина из гомоцистеина метионинсинтазой и (2) превращение метилмалонил-КоА в сукцинил-КоА.Следовательно, при недостатке витамина B12 происходит накопление гомоцистеина и метилмалоновой кислоты, которые могут быть измерены для диагностики дефицита витамина B12 [76]. Метилкобаламин необходим в центральной нервной системе для синтеза миелина, и считается, что дефицит вызывает дисмиелинизацию, проявляющуюся в виде диффузного вовлечения белого вещества / аксона, приводящего к энцефалопатии, миелопатии, периферической невропатии и невропатии зрительного нерва. Если уровень сывороточного витамина B12 находится в пределах низкого нормального диапазона, измерения метионина и метилмалоновой кислоты могут быть более полезными для диагностики.Кроме того, пониженный распад метилмалонил-КоА вызывает избыток пропионил-КоА, что приводит к попаданию жирных кислот с нечетной цепью в нервные оболочки [86]. Повышенная концентрация в моче метилмалоновой кислоты является наиболее важным лабораторным тестом для диагностики дефицита витамина В12 на тканевом уровне [87, 88]. У детей с энцефалопатией атрофия головного мозга отмечается при первоначальном сканировании и может улучшаться после приема витамина В12 [72, 78, 79, 89]. МРТ спинного мозга может показать гиперинтенсивность Т2 в задних колонках, что соответствует SCD [90].
ЭЭГ показывает замедление при энцефалопатии. У пациентов с судорогами могут быть эпилептические разряды в ЭЭГ, которые могут быть диффузными [78] или очаговыми [85]. Модифицированная картина гипсаритмии наблюдалась у младенца с синдромом Веста, который не реагировал на АКТГ, но отвечал на
.- Классическая неонатальная форма (наиболее распространенная). Симптомы начинаются в течение нескольких дней жизни и могут включать плохое питание, недостаток энергии (летаргия), слабый мышечный тонус (гипотония), икоту, проблемы с дыханием, судороги, икоту и кому.
- Инфантильная форма. Симптомы начинаются только после 6 месяцев, такие как умственная отсталость, аномальные движения и поведенческие проблемы
- Позднее начало: Симптомы включают стеснение или скованность ног или рук (спастическая диплегия) и потеря зрения из-за повреждения глазного нерва (атрофия зрительного нерва).
- Переходная форма. Симптомы аналогичны классической форме, но уровень глицина снижается, и симптомы со временем могут улучшиться.
Последнее обновление: 18.11.2017
,
