Беременность у женщин с резус-отрицательной кровью
Вопрос резус-конфликта при беременности – один из немногих в медицине, в котором расставлены все точки над i и разработаны не только методы диагностики и лечения, но и, что самое главное, эффективной профилактики.
История иммунопрофилактики резус-конфликта – редкий пример безоговорочного успеха в медицине. Ведь после введения комплекса профилактический мер детская смертность от осложнений резус-конфликта снизилась с 46 до1,6 на 100 тыс. детей – то есть почти в 30 раз.
Что же такое резус-конфликт, почему он возникает и что делать, чтобы свести к минимуму риск его возникновения?
Всё население планеты, в зависимости от присутствия или отсутствия на эритроцитах (красных клетках крови) белка, обозначаемого буквой «D», делится соответственно на резус-положительных и резус-отрицательных людей. По приблизительным данным резус-отрицательных европейцев около 15%.
В этом случает, при попадании эритроцитов плода в кровоток матери возникает иммунная реакция, в результате которой повреждаются эритроциты плода, у него возникает анемия и ряд других тяжелых осложнений.
При физиологической беременности эритроциты плода проникают через плаценту в I триместре у 3% женщин, во II – у 15%, в III – у 48%. Кроме того, массивный заброс происходит в родах, после прерывания беременности (аборта, выкидыша, внематочной беременности, пузырного заноса), инвазивных процедур (биопсия ворсин хориона, амниоцентез), дородовых кровотечениях при угрозе прерывания беременности.
Суммарный риск развития резус-конфликта у резус-отрицательных женщин, беременных резус-положительным плодом при отсутствии профилактики составляет около 16%. У женщин, прошедших профилактику, этот риск снижается до 0,2%.
А теперь самое интересное – в чем же заключается эта самая профилактика и что необходимо делать, чтобы держать ситуацию под контролем.
Всем женщинам, обратившимся в медицинское учреждение для постановки на учёт по беременности, а так же тем, кто обратился для прерывания нежелательной беременности, назначается анализ для определения группы крови и резус-фактора. Половым партнёрам женщин, у которых установлен отрицательный резус, так же рекомендовано пройти обследование для установления резус-принадлежности. Если по счастливому стечению обстоятельств у мужчины тоже отрицательный резус-фактор, то риск возникновения резус-конфликта отсутствует и в проведении иммунопрофилактики нет смысла.
Женщинам с резус-отрицательной кровью и резус-положительной принадлежность крови партнёра, желающим прервать нежеланную беременность, рекомендуется в течение 72 часов после прерывания сделать укол антирезусного иммуноглобулина. Механизм действия этого препарата основан на том, что введенные антитела связывают эритроциты плода, проникшие в материнский кровоток, и не допускают развитие иммунного ответа.
Резус-отрицательным женщинам, вставшим на учёт по беременности, ежемесячно назначают анализ крови на антирезусные антитела. Таким образом определяют, был ли контакт между кровью матери и плода, и среагировала ли иммунная система женщины на чужеродный белок.
Если к 28 недели в крови женщины нет антирезусных антител, её направляют на профилактическое введение антирезусного иммуноглобулина. Данная профилактика проводится с 28 по 30 неделю беременности. После этого определение антирезусных антител в крови матери не проводится.
Если же по результатам обследования у женщины до 28 недель беременности выявлены антирезусные антитела, она направляется на углублённое обследование для определения степени тяжести резус-конфликта, своевременного назначения лечения и при необходимости экстренного родоразрешения.
После рождения у ребенка резус-отрицательной женщины определяют резус-фактор. И, если малыш резус-положительный, в течение 72 часов после родов женщине так же вводят антирезусный иммуноглобулин.
Другие ситуации, требующие профилактического введения антирезусного иммуноглобулина:
- самопроизвольный выкидыш или неразвивающаяся беременность;
- внематочная беременность;
- пузырный занос;
- дородовое кровотечение при угрозе прерывания беременности;
- инвазивные внутриматочные вмешательства во время беременности.
Единственным спорным на данный момент вопросом является определение резус-фактора плода во время беременности. Для этого, начиная с 10 недель беременности, у женщины проводится забор крови, из неё выделяют генетический материал плода и на основании генетического исследования определяют резус-принадлежность будущего ребёнка.
С одной стороны, это исследование позволило бы 40% резус-отрицательных женщин, вынашивающих резус-отрицательного плода, избежать ежемесячного определения антирезусных антител и введения антирезусного иммуноглобулина.
С другой стороны, это исследование не фигурирует в официальном приказе МЗ, не входит в систему ОМС и выполняется только на платной основе.
Таким образом, на данный момент разработан четкий алгоритм ведения беременных женщин с резус-отрицательной кровью. И следование этому простому алгоритму позволит женщине родить одного, двух и более здоровых малышей.
Врач акушер-гинеколог
женской консультации №14
Хиврич Е.Б.
Антигены эритроцитов – это структурные образования различной химической природы (протеины, гликопротеины или гликолипиды), представленные на поверхности мембраны эритроцита и выполняющие различные функции (транспортную, адгезивную, структурную, ферментативную). Известно более 400 антигенов эритроцитов, объединяемых в разные генетические системы, клинически значимы из них лишь немногие. Наличие или отсутствие этих белков (фенотип эритроцитарных антигенов) преимущественно определяется наследованием от родителей и не меняется в течение жизни.  Антитела к антигенам эритроцитов системы АВ0 — иммунные антитела, которые появляются вследствие изоиммунизации при парентеральном — через кровь, поступлении в организм несовместимого в групповом отношении антигена, при иногрупной беременности, при переливании крови, несовместимой по системе АВ0. При беременности такая проблема наблюдается в том случае, если у матери I группа крови, а у отца ребенка – любая другая, то есть II(A), III(B) или IV(AB) и ребенок унаследовал группу крови отца (что касается IV(AB) группы крови, то ее наследование ребенком невозможно, у него будет либо II(A), либо III(B) группа крови). В этом случае клетки крови плода имеют определенные антигены, так что когда они попадают в материнский организм, в нем вследствие иммунной реакции против них начинают выделяться групповые антитела. Задачей таких антител является разрушение чужеродных эритроцитов и высвобождение гемоглобина. Данный процесс носит название гемолиза.  У новорожденных данный процесс чаще всего проявляется как желтуха. У новорожденных данный процесс чаще всего проявляется как желтуха.После 30-ой недели беременности женщинам, находящимся в группе риска по развитию группового конфликта, анализ крови на групповые антитела назначается с интервалом один раз в месяц. У новорожденного производится забор пуповинной крови на определение группы крови ребенка, а также на выявление гемолитической болезни (отслеживается уровень билирубина). Если гемолитическая болезнь будет подтверждена, то новорожденному потребуется помощь медиков, направленная на поддержание нормальной работы печени. При несовместимости крови донора и реципиента по антигенам и антителам неблагоприятные последствия отражаются на состоянии последнего. Для обеспечения совместимости требуется, чтобы кровь донора принадлежала к той же группе системы АВ0, что и кровь больного. Переливание крови другой группы при наличии в крови донора группового антигена, против которого в кровяном русле больного имеются антитела, приводит к несовместимости и развитию трансфузионного осложнения. Когда назначается исследование? — профилактика конфликта по системе АВО у беременных; — динамический контроль за уровнем групповых антител у беременных; — гемолитическая болезнь новорожденных; — подготовка к гемотрансфузии. |
Резус-конфликт и беременность: что делать
Для многих «разнорезусных» родителей риск резус-конфликта становится серьезным поводом для тревоги. Другие утверждают, что уже имеют резус-положительных детей, и каждый из них родился здоровым. Так почему же резус-конфликт возникает не во всех случаях? И как наверняка узнать его риск?
Что такое резус-несовместимость
Резус-фактор крови – это особый белок на поверхности красных кровяных клеток (эритроцитов).
При попадании такого белка в резус-отрицательный (Rh-) организм иммунные силы последнего вырабатывают защиту – антитела, атакующие «неприятеля» при повторной встрече с ним.
В случае беременности речь идет об антителах матери, «нападающих» на эритроциты плода. В результате чего беременность может закончиться гемолитической болезнью новорожденных (ГБН), невынашиванием или внутриутробной гибелью ребенка.
В результате чего беременность может закончиться гемолитической болезнью новорожденных (ГБН), невынашиванием или внутриутробной гибелью ребенка.
Почему «конфликт» не у всех
Для того, чтобы у матери появились резус-антитела, кровь плода должна попасть в ее кровоток в достаточном объеме.
Такая ситуация практически не возникает при здоровой беременности, и по данным статистики составляет всего около 10% случаев.
Угроза конфликта значительно возрастает, если беременности предшествовали аборты, выкидыши, угрозы прерывания с отслойкой плаценты или осложнения в предыдущих родах.
В этом случае в крови матери сначала появляются антитела класса М, которые, ввиду своих размеров, не представляют опасности для плода. IgM просто не способны проникнуть через плацентарный барьер, чего нельзя сказать о, приходящих им на смену, антителах класса G.
IgG значительно мельче своих предшественников, легко проникают к плоду и сохраняются в крови мамы на долгие годы.
Таким образом, высокий риск резус-конфликта уже при текущей беременности имеет место только у женщин с отягощенным акушерским и гинекологическим анамнезом. Тогда как в остальных случаях этот риск минимален.
Тогда как в остальных случаях этот риск минимален.
Как проверить
Всем резус-отрицательным женщинам при постановке на учет показан анализ крови на резус-фактор и группу крови.
Тот же самый анализ рекомендован и отцу ребенка.
Если, резус-фактор обоих родителей отрицательный, волноваться попросту не о чем. Но, если папа оказался «положительным» — беременная должна будет ежемесячно сдавать кровь на антирезусные антитела до 28 недель.
Если к указанному сроку антитела в крови так и не появятся, женщину направят на профилактическое введение антирезусного иммуноглобулина, и на этом поиск антител прекратится.
Введение иммуноглобулина также допустимо в первые 72 часа после родов, при рождении резус-положительного малыша, если ранее иммунизация не проводилась.
Если же антитела все же появились до 28 недель, и нарастают, беременную направят на более углубленное обследование для выяснения степени резус-конфликта, лечения и, при необходимости, экстренного родоразрешения.
Как узнать свой риск
На сегодня единственной рекомендуемой и финансируемой Минздравом мерой прогнозирования конфликта является анализ крови на антирезусные антитела.
Однако есть и другой вариант решения «задачи».
Уже с 10 (при одноплодной) и 12 недель (при многоплодной) беременности можно определить резус плода по крови матери.
Для исследования не требуется особой подготовки и практически нет противопоказаний. А его достоверность составляет 99%.
Анализ активно применяется в США, Японии и большинстве стран Западной Европы. И за время своего существования зарекомендовал себя как абсолютно безопасный и высокоэффективный.
Поделиться статьей:
Остались вопросы?Беременность при различных резус-факторах крови
Уважаемые будущие родители!
Каждый из нас в своей жизни встречался с такими понятиями, как группа крови и резус-фактор, но далеко не каждый оценивает всю важность и необходимость определения этих показателей крови во время планирования и вынашивания желанной беременности.
Для того, чтобы разобраться в данном вопросе, мы хотим представить вам необходимую информацию и рассказать о тех клинических мероприятиях, которые проводятся в нашем центре.
Резус-фактор представляет собой белок, который находится на поверхности эритроцитов (красных кровяных телец, переносящих к тканям кислород). Если этот белок отсутствует, то резус-фактор считается отрицательным. При наличии белка «резус» в крови резус-фактор считается положительным. Все мы являемся обладателями либо отрицательного, либо положительного резус-фактора.
Будущие мама и папа, как известно, могут иметь разные резус-факторы крови. Если оба из родителей резус-положительные, то и ребенок, как правило (в 75 % случаев), наследует положительный резус-фактор. При наличии резус-отрицательной крови у обоих родителей, ситуация складывается аналогично, ребенок в данном случае будет рожден с резус-отрицательным фактором крови. В случае, если у мамы положительный резус-фактор, а у отца — резус-отрицательный, никаких осложнений при беременности не возникнет.
Большого внимания заслуживают пары, где у мамы отрицательный резус-фактор крови, а у будущего папы положительный. В данной ситуации возникает риск развития резус-конфликта — несовместимости крови матери и плода.
Механизм развития резус-конфликта, как правило, основан на работе нашей иммунной системы. Организм беременной женщины с резус-отрицательной кровью, начинает вырабатывать антитела на клетки красной крови – эритроциты будущего ребенка. Но эта ситуация происходит только в том случае, если резус-фактор плода является положительным, унаследованным от отца. Именно эти антитела, проникая через плаценту, могут разрушать эритроциты будущего ребенка, и как следствие — вызывать снижение гемоглобина, интоксикацию и нарушение работы всех жизненно-важных органов и систем. Исходы течения такой беременности, чаще неблагоприятные — это угроза невынашивания, гемолитическая болезнь плода, высокие риски внутриутробной гибели ребенка, преждевременные роды и др.
Для того, чтобы избежать неблагоприятных исходов, следует придерживаться следующих правил:
- Будущие родители должны определить свою группу крови и резус-фактор до планируемого зачатия.
- Необходимо помнить, что аборты, выкидыши, переливание крови, инвазивные процедуры, могут привести к увеличению сенсибилизации (т. е. появлению иммунных антител) организма резус-отрицательной женщины.
- Если резус-фактор будущей мамы оказался отрицательным, а у отца ребенка положительным, необходимо определение титра антиэритроцитарных антител в крови беременной до 20 недель беременности 1 раз в месяц, затем 1 раз в 2 недели. Более частое определение титра антител проводиться по назначению врача в зависимости от показаний.
- По достижению срока беременности 28 недель, при отсутствии титра антител, необходимо ввести 1 дозу антирезус-Д-иммуноглобулина. Данный препарат препятствует образованию антител к резус-фактору, а значит и препятствует разрушению эритроцитов у плода.

Вследствие введения препарата в крови могут появиться специфические антитела, поэтому после введения иммуноглобулина определение антиэритроцитарных антител не проводится. Вторая доза иммуноглобулина вводится в первые 72 часа после родов, при условии, что резус-фактор ребенка является положительным. Необходимо также введение антирезусного иммуноглобулина в течение 72 часов при проведении во время беременности инвазивных процедур: биопсии хориона, биопсии плаценты, кордоценезе, амниоцентезе, и при любом неблагоприятном исходе беременности: аборте, выкидыше, внематочной беременности, пузырном заносе.
В настоящее время в Медицинской компании «Жизнь» стало возможным определение резус-фактора плода при помощи современной, неинвазивной методики по крови матери. Достоверность такого результата достаточно высока, составляет 99%. Тест позволяет не только определить на раннем сроке беременности принадлежность резус-фактора будущего малыша, но и выделить группу риска беременных по развитию резус-конфликта. Данное исследование дает возможность спрогнозировать течение беременности у резус-отрицательных женщин, своевременно выполнить профилактические мероприятия по предупреждению развития резус-конфликта и выявить точную категорию пациенток, которым необходимо исследования титра антиэритроцитарных антител на протяжении всей беременности и введение антирезусного иммуноглобулина.
Данное исследование дает возможность спрогнозировать течение беременности у резус-отрицательных женщин, своевременно выполнить профилактические мероприятия по предупреждению развития резус-конфликта и выявить точную категорию пациенток, которым необходимо исследования титра антиэритроцитарных антител на протяжении всей беременности и введение антирезусного иммуноглобулина.
Резус-конфликт
Резус-конфликт — это осложнение беременности, при котором иммунные антитела матери уничтожают эритроциты (красные кровяные клетки) плода. Происходит это в случае, если у мамы отрицательный резус, а у ребёнка положительный (унаследованный от отца). Для того, чтобы иммунные антитела образовались, необходимо попадание эритроцитов плода в кровоток матери. Это происходит во время родов, аборта, выкидыша, операции по поводу внематочной беременности. Поэтому риск развития резус-конфликта повышается при повторной беременности, а при первой бывает редко. При первой беременности может возникнуть риск данной патологии лишь в некоторых случаях: при диабете, гриппе во время беременности, преэклампсии (отеках, повышении артериального давления), а также при инвазивных методах пренатальной диагностики( кордоцентез, амниоцентез, биопсия хориона).
При планировании беременности обязательно надо паре кровь на группу крови, резус-фактор и антирезусные антитела, чтобы спрогнозировать риск. Первая беременность должна закончиться родами, поэтому необходимо использовать надежные методы контрацепции во избежание абортов. Обязательно перед беременностью паре надо обследоваться на наличие отклонений в здоровье, приводящих к прерыванию беременности или внематочной беременности. Перечень обследования подскажет врач гинеколог.
Во время беременности женщина регулярно сдаёт кровь на группу, резус-фактор и антитела, в определенные сроки проходит профилактическую десенсибилизирующую терапию. При обнаружении антирезусных антител проводится лечение под контролем УЗИ плода, показатели которого определяют объём лечения, сроки и метод родоразрешения.
Эффективным методом профилактики является введение антирезусного иммуноглобулина. Вводят его внутримышечно резус отрицательным женщинам, не имеющим антител к резусу в крови в сроке 28-30 недель в женской консультации. И в течение 48-72 часов после родов в роддоме. Этот препарат отпускается женщинам бесплатно по родовому сертификату.
И в течение 48-72 часов после родов в роддоме. Этот препарат отпускается женщинам бесплатно по родовому сертификату.
Он также эффективен при введении в течение 72 часов после аборта, выкидыша, операции по поводу внематочной беременности или после переливания резус+ крови резус отрицательной женщине. При уже случившейся сенсибилизации( то есть наличии в крови антител к резусу) данный метод неэффективен.
Резус-фактор меняться в течение жизни не может, это генетически унаследованный признак, так же, как черты лица или цвет волос. Но, существует такое явление, как слабоположительный резус. Сниженная активность нормального резус- фактора.
При таком состоянии обычные тест системы могут показывать то положительный, то отрицательный резус. Уточнить наличие слабоположительного резуса можно только специальными тест-системами, имеющимися в частных лабораториях. Тактика планирования и ведения беременности у таких женщин такая же, как при резус отрицательной принадлежности.
Антигрупповые антитела
Переливать эритроциты, плазму и особенно цельную кровь от донора к реципиенту нужно строго соблюдая совместимость по группе крови и по резус-фактору.
Определение группы крови, резус-фактора, наличие аллоиммунных антиэритроцитарных антител должно проводиться при планировании или во время беременности для выявления вероятности иммунологического конфликта матери и ребёнка, который может приводить к гемолитической болезни новорождённых. При переливании крови, если эритроциты донора несут Rh-агглютиноген, а реципиент является резус-отрицательным, может развиться несовместимость крови по резус-фактору (резус-конфликт). В этом случае у резус-отрицательного реципиента начинают вырабатываться антитела, направленные против резус-антигена, приводящие к разрушению эритроцитов. Присутствие и титр уже имеющихся в крови антител к резус-фактору и других аллоиммунных антител можно определить, указав тест «анти-Rh (титр)». Возникновение резус-конфликта и развитие гемолитической болезни новорождённых возможно в том случае, если беременная резус-отрицательна, а плод — резус-положителен. Болезнь может быть обусловлена несовместимостью плода и матери по D-резус- или АВО-антигенам, реже имеет место несовместимость по другим резус- (С, Е, с, d, e) или М-, N-, Kell-, Duffy-, Kidd-антигенам (по статистике 98% случаев гемолитической болезни новорожденных связаны с D-резус-антигеном).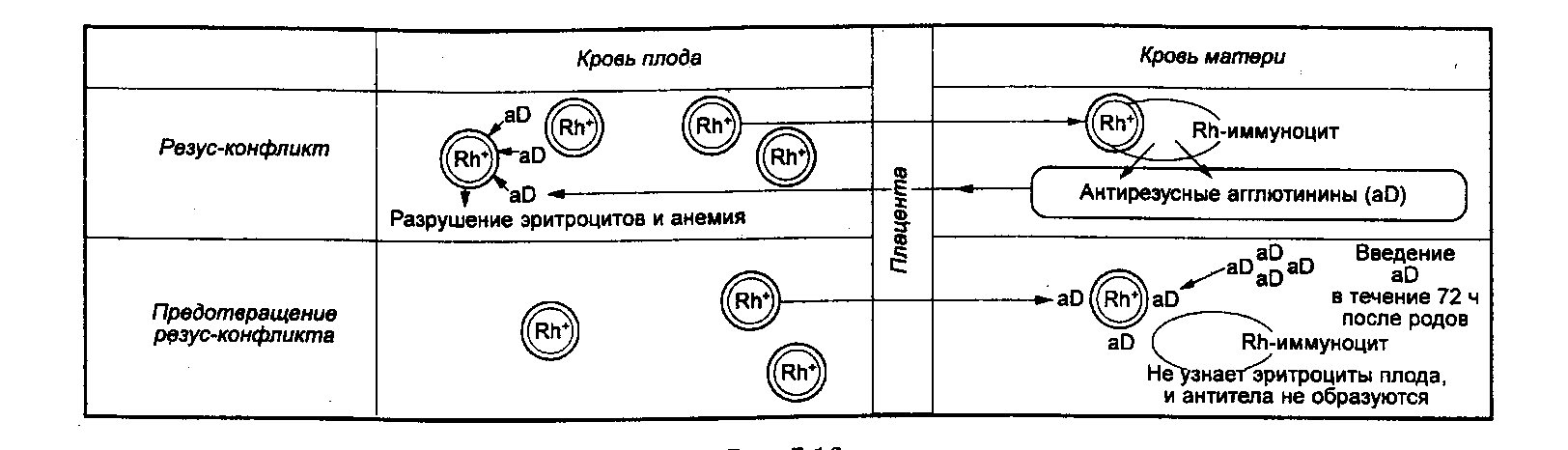 Любой из указанных антигенов, проникая в кровь резус-отрицательной матери, вызывает образование в её организме специфических антител. Последние через плаценту поступают в кровь плода, где разрушают соответствующие антигенсодержащие эритроциты.
Любой из указанных антигенов, проникая в кровь резус-отрицательной матери, вызывает образование в её организме специфических антител. Последние через плаценту поступают в кровь плода, где разрушают соответствующие антигенсодержащие эритроциты.
В случае, если у матери Rh +, а плод — резус-отрицателен, опасность гемолитической болезни для плода нет.
В настоящее время существует возможность медицинской профилактики развития резус-конфликта и гемолитической болезни новорождённых. Все резус-отрицательные женщины в период беременности должны находиться под наблюдением врача.
В случае несовместимости матери и плода по антигенам системы АВО происходит продукция антигрупповых антител класса G, которые проходят через плаценту и вызывают гемолитическую болезнь плода и новорожденного. Этот вид иммунного конфликта развивается довольно редко, наблюдается, как правило, в ситуации, когда мать имеет первую группу крови, а плод – вторую группу. Это объясняется тем, что среди групповых антигенов А и В иммуногенностью обладает только аллотип А1, а антигену В это свойство присуще слабо. Развитие межгруппового конфликта возможно не ранее 8-10 недели беременности, когда на эритроцитах плода появятся антигены А и В. Конфликт может привести к прерыванию беременности и выкидышу.
Развитие межгруппового конфликта возможно не ранее 8-10 недели беременности, когда на эритроцитах плода появятся антигены А и В. Конфликт может привести к прерыванию беременности и выкидышу.
Рекомендуется взятие крови не ранее чем через 4 часа после последнего приема пищи.
Материал для исследования: венозная кровь.
Интерпретация результатов содержит аналитическую информацию для лечащего врача. Лабораторные данные входят в комплекс всестороннего обследования пациента, проводимого врачом и не могут быть использованы для самодиагностики и самолечения.
В норме антирезусные и антигрупповые антитела в крови отсутствуют. Обнаружение антител свидетельствует о сенсибилизации к резус-антигену или другим эритроцитарным антигенам.
Ведение беременности при резус-конфликте в ЕМС
Белок, который присутствует в крови человека, называется резус-фактор. Но не у всех он есть. Поэтому у одних людей (85%) кровь резус-положительная, а у других (15%) – резус-отрицательная.
Поэтому у одних людей (85%) кровь резус-положительная, а у других (15%) – резус-отрицательная.
Этот параметр учитывается при оказании экстренной медицинской помощи, а именно при переливании крови.
Также резус-фактор очень важен при планировании беременности. Если у будущей мамы резус-отрицательный, а у отца–положительный, может возникать резус-конфликт. Такое происходит, когда плод наследует кровь от отца и материнский организм вырабатывает к ней антитела. Ситуация требует строгого контроля и лечения. В противном случае беременность может закончиться преждевременными родами или потерей малыша.
Таким пациенткам очень важно наблюдаться у акушера-гинеколога с первых недель беременности и вовремя проходить все необходимые обследования.
В каких случаях проблемы можно не бояться
- При совпадении резус-фактора у обоих родителей: у обоих положительный или, наоборот, отрицательный.
- Если у мамы кровь положительная, а у папы отрицательная.

Чтобы в будущем избежать проблем при вынашивании малыша, во время планирования беременности обязательно сдайте анализы, в том числе, на определение резус-фактора.
Получится ли родить здорового малыша при наличии резус-конфликта?
Современная медицина позволяет выносить здорового малыша даже при высоком риске появления резус-конфликта, если весь период вынашивания проходит под наблюдением опытных специалистов с постоянным контролем состояния мамы и будущего ребенка.
Акушеры-гинекологи родильного дома Европейского медицинского центра ведут беременность у пациенток с различными заболеваниями и патологическими состояниями, в том числе, при резус-конфликте.
Наши специалисты предупреждают развитие осложнений, а если пациентка обращается с уже возникшим резус-конфликтом, принимают все необходимые меры, чтобы малыш родился здоровым.
Особенности возникновения резус-конфликта
Организм женщины с отрицательной кровью впервые встречается с чужеродным для него белком в период вынашивания малыша.
Но учитывая, что в это время снижается иммунный ответ, меняется баланс гормонов, а белые кровяные тельца более медлительны, первая беременность может пройти благополучно, без резус-конфликта или с его слабой выраженностью.
Но при второй и последующих беременностях организм «помнит» чужеродный антиген, что провоцирует гораздо более быструю выработку антител. Провоцировать усиление иммунного ответа может не только первая беременность, но и проведенные ранее аборты, перенесенные выкидыши и даже переливание положительной крови.
Ведение беременности при риске резус-конфликта
Современная медицина идет на опережение, и чтобы не возникло непоправимых последствий будущей маме для профилактики вводится антирезусный иммуноглобулин – на сроках от 28 до 32 недели. В результате беременность протекает благополучно. Решение о введении иммуноглобулина принимается на основании анализов на наличие выработки антител.
Влияет ли введение иммуноглобулина на здоровье будущего малыша?
Сам иммуноглобулин не несет риска для здоровья плода. Его отсутствие напротив может привести к плохим последствиям:
Его отсутствие напротив может привести к плохим последствиям:
- У плода снижается количество красных кровяных телец, которые поставляют кислород в ткани и органы, на фоне чего развивается гипоксия. Кислородное голодание, прежде всего, влияет на состояние мозга и сердца, повышается билирубин, который вызывает интоксикацию.
- Печень и селезенка начинают вырабатывать больше эритроцитов, что вызывает патологии в их развитии.
- Из-за увеличения количества красных кровяных телец в составе крови возникает дисбаланс, что ведет к возникновению гемолитической анемии, патологий развития спинного мозга.
Диагностика резус-конфликта и особенности ведения родов
Анализ наличия антител проводится в начале беременности. При их наличии беременной показано введение иммуноглобулина. Если антитела не определяются, анализ назначается повторно через месяц.
Особенности ведения родов
Естественные роды допустимы, если на протяжении периода вынашивания организм не вырабатывал антител и нет других осложнений. Но, как правило, таким пациенткам показано кесарево сечение. Операция проводится планово на 37-38 неделе.
Но, как правило, таким пациенткам показано кесарево сечение. Операция проводится планово на 37-38 неделе.
При ухудшении состояния ребенка после родов ему может проводиться переливание резус-отрицательной крови.
Противорезусный иммуноглобулин вводится матери и после родов в течение 72 часов – это поможет предупредить появление резус-конфликта при следующих беременностях. После абортов или выкидышей женщине также нужно введение иммуноглобулина.
Преимущества ведения беременности и родов в ЕМС
Команда роддома ЕМС – доктора с международным опытом работы (США, Израиль, Европа). Многие из них руководили отделениями в ведущих родильных домах Москвы.
Специалисты ведут беременность и принимают роды у женщин с различными заболеваниями и состояниями, в том числе с резус-конфликтом.
Безопасность мамы и малыша: наличие в роддоме взрослой и детской реанимации, а также отделения патологии новорожденных. Реаниматологи оказывают помощь детям, родившимся на сроке от 22 недель с любыми видами патологии.
Реаниматологи оказывают помощь детям, родившимся на сроке от 22 недель с любыми видами патологии.
Комфорт от пребывания: к услугам молодых мам и деток послеродовые делюкс и люкс-студии и семейные апартаменты.
Rh сенсибилизация во время беременности | Мичиган Медицина
Обзор темы
Что такое резус-сенсибилизация во время беременности?
Если вы резус-отрицательный, на ваших эритроцитах нет маркера резус-фактора. В резус-положительной крови этот маркер есть. Если ваша кровь смешивается с резус-положительной кровью, ваша иммунная система будет реагировать на резус-фактор, вырабатывая антитела для его уничтожения. Этот ответ иммунной системы называется резус-сенсибилизацией.
Что вызывает резус-сенсибилизацию во время беременности?
Резус-сенсибилизация может произойти во время беременности, если вы резус-отрицательный и беременны развивающимся ребенком (плодом) с резус-положительной кровью. В большинстве случаев ваша кровь не смешивается с кровью ребенка до родов. На выработку антител, которые могут повлиять на ребенка, требуется время, поэтому во время вашей первой беременности ребенок, вероятно, не пострадает.
В большинстве случаев ваша кровь не смешивается с кровью ребенка до родов. На выработку антител, которые могут повлиять на ребенка, требуется время, поэтому во время вашей первой беременности ребенок, вероятно, не пострадает.
Но если вы снова забеременеете резус-положительным ребенком, антитела, уже находящиеся в вашей крови, могут атаковать красные кровяные тельца ребенка. Это может вызвать у ребенка анемию, желтуху или более серьезные проблемы. Это называется резус-болезнью. Проблемы будут ухудшаться с каждой резус-положительной беременностью.
Резус-сенсибилизация — одна из причин, по которой важно обратиться к врачу в первом триместре беременности. Это не вызывает никаких тревожных симптомов, и анализ крови — единственный способ узнать, что у вас это есть или что вы рискуете.
- Если вы подвержены риску, резус-сенсибилизацию почти всегда можно предотвратить.
- Если у вас уже есть сенсибилизация, лечение может помочь защитить вашего ребенка.

Кто получает резус-сенсибилизацию во время беременности?
Резус-сенсибилизация во время беременности может произойти только в том случае, если у женщины резус-отрицательная кровь и только если у ее ребенка резус-положительная кровь.
- Если мать резус-отрицательная, а отец резус-положительный, велика вероятность, что у ребенка будет резус-положительная кровь. Может возникнуть резус-сенсибилизация.
- Если у обоих родителей резус-отрицательная кровь, у ребенка будет резус-отрицательная кровь. Поскольку кровь матери и кровь ребенка совпадают, сенсибилизации не произойдет.
Если у вас резус-отрицательная кровь, ваш врач, вероятно, будет относиться к вам так, как будто кровь ребенка резус-положительная, независимо от группы крови отца, на всякий случай.
Как диагностируется резус-сенсибилизация?
Все беременные женщины сдают анализ крови при первом дородовом посещении на ранних сроках беременности. Этот тест покажет, есть ли у вас резус-отрицательная кровь и есть ли у вас резус-сенсибилизация.
Этот тест покажет, есть ли у вас резус-отрицательная кровь и есть ли у вас резус-сенсибилизация.
Если у вас резус-отрицательная кровь, но не сенсибилизированы :
- Анализ крови можно повторить между 24 и 28 неделями беременности. Если тест по-прежнему показывает, что вы не сенсибилизированы, вам, вероятно, не понадобится еще один тест на антитела до родов.(Возможно, вам придется пройти повторный анализ, если у вас есть амниоцентез, если ваша беременность превышает 40 недель или если у вас есть такая проблема, как отслойка плаценты, которая может вызвать кровотечение в матке.)
- У вашего ребенка будет анализ крови при рождении. Если у новорожденного есть резус-положительная кровь, вам нужно будет пройти тест на антитела, чтобы узнать, были ли вы сенсибилизированы во время поздней беременности или родов.
Если вы сенсибилизированы к Rh, ваш врач будет внимательно следить за вашей беременностью.У вас может быть:
- Регулярные анализы крови для проверки уровня антител в крови.

- Допплерография для проверки притока крови к мозгу ребенка. Это может показать анемию и ее серьезность.
- Амниоцентез через 15 недель для проверки группы крови и резус-фактора ребенка, а также для выявления проблем.
Как предотвратить повышение чувствительности к резусу?
Если у вас резус-отрицательная кровь, но у вас нет резус-сенсибилизации, ваш врач сделает вам одну или несколько инъекций резус-иммуноглобулина (например, RhoGAM).Это предотвращает сенсибилизацию резус-фактора почти у всех женщин, которые его используют.
Вы можете сделать прививку резус-иммуноглобулина:
- Если у вас есть такой тест, как амниоцентез.
- Примерно на 28 неделе беременности.
- После родов, если у вашего новорожденного резус-положительный результат.
Уколы действуют только в течение короткого времени, поэтому вам придется повторять эту процедуру каждый раз, когда вы забеременеете. (Чтобы предотвратить сенсибилизацию при будущих беременностях, резус-иммуноглобулин также назначают, когда у резус-отрицательной женщины выкидыш, аборт или внематочная беременность.)
(Чтобы предотвратить сенсибилизацию при будущих беременностях, резус-иммуноглобулин также назначают, когда у резус-отрицательной женщины выкидыш, аборт или внематочная беременность.)
Уколы не сработают, если у вас уже есть резус-сенсибилизация.
Как лечится?
Если вы чувствительны к резус-фактору, вам нужно будет регулярно проходить анализы, чтобы узнать, как поживает ваш ребенок. Возможно, вам также понадобится обратиться к врачу, специализирующемуся на беременностях с высоким риском (перинатологу).
Лечение ребенка основано на том, насколько серьезна потеря эритроцитов (анемия).
- Если анемия у ребенка легкая, вам просто нужно пройти больше анализов, чем обычно, во время беременности.После рождения ребенок может не нуждаться в специальном лечении.
- Если анемия ухудшается, безопаснее всего родить ребенка пораньше. После родов некоторым детям требуется переливание крови или лечение желтухи.
- При тяжелой анемии ребенку можно сделать переливание крови, пока он еще находится в матке.
 Это может помочь сохранить здоровье ребенка до тех пор, пока он или она не станет достаточно зрелым для родов. Возможно, вам сделают раннее кесарево сечение, и ребенку может потребоваться еще одно переливание крови сразу после рождения.
Это может помочь сохранить здоровье ребенка до тех пор, пока он или она не станет достаточно зрелым для родов. Возможно, вам сделают раннее кесарево сечение, и ребенку может потребоваться еще одно переливание крови сразу после рождения.
В прошлом сенсибилизация к Rh часто была смертельной для ребенка. Но улучшенное тестирование и лечение означают, что теперь большинство детей с резус-инфекцией выживают и чувствуют себя хорошо после рождения.
Причина
Резус-сенсибилизация может возникнуть, когда человек с резус-отрицательной кровью подвергается воздействию резус-положительной крови. Большинство женщин, которые становятся сенсибилизированными, делают это во время родов, когда их кровь смешивается с резус-положительной кровью их плода. После воздействия иммунная система матери вырабатывает антитела против резус-положительных эритроцитов.
Минимальное количество смешиваемой крови, вызывающее сенсибилизацию, неизвестно. К счастью, резус-сенсибилизацию почти всегда можно предотвратить с помощью инъекции резус-иммуноглобулина.
Когда иммунная система резус-отрицательного человека впервые подвергается воздействию резус-положительной крови, ему требуется несколько недель для выработки антител к иммуноглобулину M или IgM. Антитела IgM слишком велики, чтобы проникать через плаценту. Таким образом, резус-положительный плод, который первым вызывает сенсибилизацию матери, обычно не страдает.
Иммунная система, ранее сенсибилизированная резус-фактором, быстро реагирует на резус-положительную кровь, как при второй беременности резус-положительным плодом. Обычно в течение нескольких часов после воздействия резус-положительной крови образуются более мелкие иммуноглобулины G или IgG. Антитела IgG могут проникать через плаценту и разрушать эритроциты плода. Это вызывает опасный для плода резус-фактор.
Некоторые резус-отрицательные люди никогда не становятся сенсибилизированными, даже после контакта с большим количеством резус-положительной крови.Причина этого не известна.
Симптомы
Если вы уже являетесь резус-сенсибилизированным или стали резус-сенсибилизированным во время беременности, у вас не будет никаких необычных симптомов.
Проблемы плода в результате сенсибилизации по резус-фактору выявляются с помощью ультразвукового допплера, а иногда и с помощью амниоцентеза. Однако возможно, что плод с тяжелым резус-фактором будет двигаться реже, чем на более ранней стадии беременности.
Другие состояния с симптомами, похожими на резус-сенсибилизацию, включают проблемы несовместимости с другими группами крови и инфекции плода.
Что происходит
Если вы резус-отрицательный
Если вам не назначили резус-иммуноглобулин непосредственно до или после события с высоким риском, такого как выкидыш, амниоцентез, аборт, внематочная беременность или роды, у вас есть шанс стать сенсибилизированы к крови резус-положительного плода.
Если вы были резус-сенсибилизированы в прошлом
Если вы были резус-сенсибилизированы в прошлом, вы должны находиться под пристальным наблюдением во время любой беременности с резус-положительным партнером, потому что ваш плод с большей вероятностью будет иметь резус-фактор. кровь положительная.В ответ на резус-положительный плод ваша иммунная система может быстро выработать антитела IgG, которые могут проникать через плаценту и разрушать эритроциты плода. Каждая последующая беременность резус-положительным плодом может вызвать более серьезные проблемы для плода. Возникающее в результате заболевание плода (называемое резус-болезнью, гемолитической болезнью новорожденного или эритробластозом плода) может быть от легкой до тяжелой.
кровь положительная.В ответ на резус-положительный плод ваша иммунная система может быстро выработать антитела IgG, которые могут проникать через плаценту и разрушать эритроциты плода. Каждая последующая беременность резус-положительным плодом может вызвать более серьезные проблемы для плода. Возникающее в результате заболевание плода (называемое резус-болезнью, гемолитической болезнью новорожденного или эритробластозом плода) может быть от легкой до тяжелой.
- Легкая форма резус-инфекции связана с ограниченным разрушением эритроцитов плода, что может привести к легкой анемии плода.Плод, как правило, можно перенести и не требует специального лечения, но после рождения у него могут возникнуть проблемы с желтухой. Легкая форма резус-инфекции с большей вероятностью разовьется при первой беременности после того, как произошла сенсибилизация.
- Умеренный резус-инфекция предполагает разрушение большого количества эритроцитов плода. У плода может развиться увеличенная печень и может развиться анемия средней степени.
 Возможно, плод необходимо родить раньше срока, а также может потребоваться переливание крови до (в матке) или после рождения.Новорожденного с умеренным резус-фактором следует внимательно наблюдать на предмет желтухи.
Возможно, плод необходимо родить раньше срока, а также может потребоваться переливание крови до (в матке) или после рождения.Новорожденного с умеренным резус-фактором следует внимательно наблюдать на предмет желтухи. - Тяжелая форма резус-инфекции (водянка плода) включает широко распространенное разрушение эритроцитов плода. У плода развивается тяжелая анемия, увеличение печени и селезенки, повышение уровня билирубина и задержка жидкости (отек). Плоду может потребоваться одно или несколько переливаний крови до рождения. Плод с тяжелым резус-фактором, переживший беременность, может нуждаться в обмене крови. Эта процедура заменяет большую часть крови младенца донорской кровью (обычно тип O, резус-отрицательный).
- Наличие в анамнезе беременности с резус-фактором является признаком того, что вам потребуется особое лечение, если вы беременны резус-положительным плодом.
Если у вас в прошлом была резус-сенсибилизация, резус-отрицательный плод не может вызвать иммунную реакцию.
Что увеличивает ваш риск
Резус-сенсибилизация может возникнуть, когда человек с резус-отрицательной кровью подвергается воздействию резус-положительной крови. Во время беременности резус-отрицательная женщина может стать сенсибилизированной, если вынашивает резус-положительный плод.
Факторы, повышающие риск смешивания крови и сенсибилизации во время беременности:
Известно, что резус-сенсибилизация, хотя и редко, возникает после совместного использования игл между потребителями наркотиков внутривенно. Переливание резус-положительной крови резус-отрицательному человеку также может вызвать сенсибилизацию. Но это бывает крайне редко, потому что кровь всегда проверяется перед переливанием.
Когда вам следует позвонить своему врачу?
Если у вас уже есть резус-сенсибилизация и вы беременны
Ваша беременность будет находиться под пристальным наблюдением.Обсудите с врачом возможные симптомы на ранних сроках беременности. Для наблюдения за плодом потребуется повторное диагностическое обследование.
Для наблюдения за плодом потребуется повторное диагностическое обследование.
Немедленно позвоните своему врачу , если вы заметили уменьшение шевеления плода после 24–26 недель беременности.
Если у вас отрицательный резус-фактор
Немедленно позвоните своему врачу , если вы:
- Считаете, что вы были беременны и у вас был выкидыш.
- Вы беременны и попали в аварию, которая могла повредить Ваш живот.
К кому обратиться
Женщину, у которой могут быть проблемы с резус-несовместимостью или сенсибилизацией, можно вылечить:
Если вы дали положительный результат на резус-сенсибилизацию, ваша система здравоохранения или медицинский работник могут пожелать, чтобы за вами наблюдали и лечили перинатолог или акушер, который без труда вызовет перинатолога.
Экзамены и анализы
Если вы беременны, первые пренатальные анализы вам предстоит пройти в течение первого триместра. Каждая женщина сдает анализ крови при первом дородовом посещении, чтобы узнать, какая у нее группа крови. Если ваша кровь резус-отрицательная, она также будет проверена на антитела к резус-положительной крови. Если у вас есть антитела, это означает, что вы были сенсибилизированы к резус-положительной крови. Теперь антитела могут убивать резус-положительные эритроциты.
Каждая женщина сдает анализ крови при первом дородовом посещении, чтобы узнать, какая у нее группа крови. Если ваша кровь резус-отрицательная, она также будет проверена на антитела к резус-положительной крови. Если у вас есть антитела, это означает, что вы были сенсибилизированы к резус-положительной крови. Теперь антитела могут убивать резус-положительные эритроциты.
Если вы резус-отрицательный, а ваш партнер резус-положительный, ваш плод, скорее всего, будет резус-положительным.
Если вы беременны или у вас произошел выкидыш, или если у вас был плановый аборт, частичная молярная беременность или внематочная беременность, вам потребуется пройти обследование, чтобы определить, есть ли у вас сенсибилизация к резус-положительной крови.
Если у вас резус-отрицательный результат
Всем беременным женщинам на ранних сроках беременности проводится непрямой тест Кумбса.
- При первом дородовом посещении ваша кровь проверяется, чтобы определить, были ли вы ранее чувствительны к резус-положительной крови.
 Если у вас отрицательный резус-фактор и результаты теста показывают, что вы не сенсибилизированы, повторный тест может быть проведен между 24 и 28 неделями.
Если у вас отрицательный резус-фактор и результаты теста показывают, что вы не сенсибилизированы, повторный тест может быть проведен между 24 и 28 неделями. - Если результаты теста на 28 неделе показывают, что у вас не было сенсибилизации, никаких дополнительных тестов на резус-фактор до родов не проводится (за исключением таких осложнений, как отслойка плаценты).Вам также сделают прививку резус-иммуноглобулина. Это снижает ваши шансы на сенсибилизацию в последние недели беременности.
- Если у вашего новорожденного будет обнаружен резус-фактор, ваша кровь будет повторно проверена при родах с помощью непрямого теста Кумбса, чтобы определить, не были ли вы сенсибилизированы во время поздней беременности или родов. Если вы не были сенсибилизированы, вам сделают еще одну прививку резус-иммуноглобулина.
Если вы сенсибилизированы к резус-фактору
Если у вас уже есть резус-сенсибилизация или вы стали сенсибилизированы во время беременности, важно внимательно следить за тем, чтобы определить, причинен ли вред вашему плоду.
- Если возможно, отец будет проверен, чтобы определить, может ли плод быть резус-положительным. Если отец резус-отрицательный, плод резус-отрицательный и ему ничего не угрожает. Если у отца резус-положительный результат, можно использовать другие тесты, чтобы узнать группу крови плода. В некоторых медицинских центрах кровь матери может быть проверена, чтобы узнать группу крови ее плода. Это новый тест, который не является широко доступным.
- Во время беременности периодически проводится непрямой тест Кумбса, чтобы узнать, повышается ли уровень резус-положительных антител.Это типичный курс лечения для большинства сенсибилизированных женщин во время беременности.
- УЗИ плода с допплерографией кровотока в головном мозге показывает анемию плода и насколько она серьезна. В медицинском центре с допплеровскими экспертами этот тест может дать вам ту же информацию о анемии, что и амниоцентез, без каких-либо рисков.
- Амниоцентез может быть проведен для проверки околоплодных вод на наличие признаков проблем плода или для определения группы крови плода и резус-фактора.

- Забор крови плода (кордоцентез) может быть сделан для непосредственной оценки здоровья вашего плода.Эта процедура используется в ограниченном объеме, обычно для мониторинга известных проблем сенсибилизации (например, когда у матери в прошлом была гибель плода или когда другие тесты показали признаки дистресс-синдрома плода).
- Электронный мониторинг сердца плода (нестрессовый тест) может проводиться в третьем триместре для проверки состояния вашего плода. Необычный сердечный ритм плода, обнаруженный во время нестрессового теста, может быть признаком наличия у плода анемии, связанной с сенсибилизацией.
- Ультразвуковое исследование плода можно использовать по мере развития беременности для выявления проблем сенсибилизации, таких как задержка жидкости у плода (признак тяжелого резус-фактора).
Обзор лечения
Если вы сенсибилизированы к резус-фактору
Если ваша кровь резус-отрицательная и вы были сенсибилизированы к резус-положительной крови, теперь у вас есть антитела к резус-положительной крови. Антитела убивают резус-положительные эритроциты. Если вы забеременеете резус-положительным ребенком (плодом), антитела могут разрушить эритроциты вашего плода. Это может вызвать анемию.
Антитела убивают резус-положительные эритроциты. Если вы забеременеете резус-положительным ребенком (плодом), антитела могут разрушить эритроциты вашего плода. Это может вызвать анемию.
Если у вас уже есть резус-сенсибилизация и вы беременны, ваше лечение будет сосредоточено на предотвращении или минимизации вреда для плода и предотвращении ранних (преждевременных) родов.
Варианты лечения зависят от того, насколько хорошо или плохо чувствует себя плод.
- Если тестирование покажет, что у вашего плода резус-положительный результат, но антитела к резус-фактору на него лишь незначительно влияют, за вами будут внимательно наблюдать до наступления срока беременности. Ваш плод родится раньше срока, только если его или ее состояние ухудшится.
- Если тестирование покажет, что ваш плод умеренно поражен вашими резус-антителами, за состоянием вашего плода будут внимательно следить, пока его или ее легкие не станут достаточно зрелыми для преждевременных родов.
 Кесарево сечение может использоваться для быстрых родов или во избежание трудностей, связанных с началом родов раньше срока. Новорожденному со средней степенью поражения иногда требуется переливание крови сразу после рождения.
Кесарево сечение может использоваться для быстрых родов или во избежание трудностей, связанных с началом родов раньше срока. Новорожденному со средней степенью поражения иногда требуется переливание крови сразу после рождения. - Если тестирование показывает, что ваш плод серьезно поражен антителами к резус-фактору, можно сделать переливание крови до рождения (внутриутробное переливание крови плода). Это можно сделать через брюшную полость плода или непосредственно в пуповину плода. Скорее всего, потребуются преждевременные роды.Иногда требуется несколько переливаний крови для сохранения здоровья плода до тех пор, пока легкие плода не станут достаточно зрелыми, чтобы функционировать после рождения. Часто делают кесарево сечение, чтобы быстро родить ребенка. Иногда требуется переливание крови сразу после рождения.
Профилактика
Если вы резус-отрицательный и беременны
Если вы резус-отрицательная женщина и забеременели от резус-отрицательного партнера, вы не подвержены риску резус-сенсибилизации во время беременности. (Большинство медицинских работников относятся к всем беременным с отрицательным резус-фактором так, как если бы отец мог быть резус-положительным.)
(Большинство медицинских работников относятся к всем беременным с отрицательным резус-фактором так, как если бы отец мог быть резус-положительным.)
Если вы уже чувствительны к резус-фактору, ваша беременность должна находиться под тщательным наблюдением, чтобы предотвратить повреждение плода. Для получения дополнительной информации о лечении плода и новорожденного см. Обзор лечения.
Если у вас нечувствительный резус-фактор, лечение направлено на предотвращение резус-сенсибилизации во время беременности и родов. Резус-иммунный глобулин (такой как RhoGAM) является высокоэффективным средством предотвращения сенсибилизации.
- Чтобы предотвратить сенсибилизацию на поздних сроках беременности или во время родов, примерно на 28 неделе беременности вам необходимо сделать прививку резус-иммуноглобулина. Это лечение предотвращает выработку иммунной системой антител против резус-положительных красных кровяных телец вашего плода. Инъекция иммуноглобулина Rh
- также необходима, если у вас была акушерская процедура, такая как амниоцентез или внешний головной вариант.

- Если ваш новорожденный резус-положительный, вам снова введут резус-иммуноглобулин в течение 72 часов после родов.Предотвращая резус-сенсибилизацию от родов, вы защищаете своего следующего резус-положительного плода.
- Если у вашего новорожденного резус-отрицательный результат, сенсибилизации не произойдет, и лечение не потребуется.
Rh иммуноглобулин также необходим в течение 72 часов после вагинального кровотечения, выкидыша, частичной молярной беременности, внематочной беременности или аборта.
Лекарства
Использование иммуноглобулина резус-фактора эффективно для предотвращения сенсибилизации к резусу. Резус-иммунный глобулин содержит резус-антитела, полученные от доноров-людей.Это лечение предотвращает выработку антител нечувствительной резус-отрицательной матерью против резус-положительной крови ее плода.
Если необходимо родить пораженный плод младше 34 недель, матери могут быть назначены кортикостероиды (бетаметазон или дексаметазон) для ускорения развития легких плода перед преждевременными родами.
Список литературы
Консультации по другим работам
- Американский колледж акушерства и гинекологов (2017).Профилактика аллоиммунизации Rh D. Бюллетень практики ACOG № 181. Акушерство и гинекология, 130 (2): e57 – e70. DOI: 10.1097 / AOG.0000000000002232. По состоянию на 9 июля 2018 г.
- Моисей К.Дж. младший (2008 г.). Ведение резус-аллоиммунизации во время беременности. Акушерство и гинекология, 112 (1): 164–176.
- Роман А.С. (2013). Поздние осложнения беременности. В AH DeCherney et al., Eds., Current Diagnosis and Treatment Abstetrics & Gynecology, 11-е изд., Стр. 250–266. Нью-Йорк: Макгроу-Хилл.
- Целевая группа профилактических услуг США (2004 г.). Скрининг на несовместимость Rh (D). Роквилл, Мэриленд: Агентство медицинских исследований и качества. Доступно в Интернете: http://www.uspreventiveservicestaskforce.
org/uspstf/uspsdrhi.htm
Кредиты
Текущий по состоянию на: 29 мая, 2019
Автор: Healthwise Staff
Медицинский обзор:
Сара Маршалл, доктор медицины, семейная медицина,
, Кэтлин Ромито, доктор медицины, доктор медицины, семейная медицина,
E.Грегори Томпсон, врач-терапевт
Адам Хусни, врач-семейная медицина
Элизабет Т. Руссо, врач-терапевт
Киртли Джонс, врач-акушерство и гинекология
По состоянию на: 29 мая 2019 г.
Автор: Здоровый персонал
Медицинское обозрение: Сара Маршалл, доктор медицины — семейная медицина и Кэтлин Ромито — доктор медицины — семейная медицина и Э.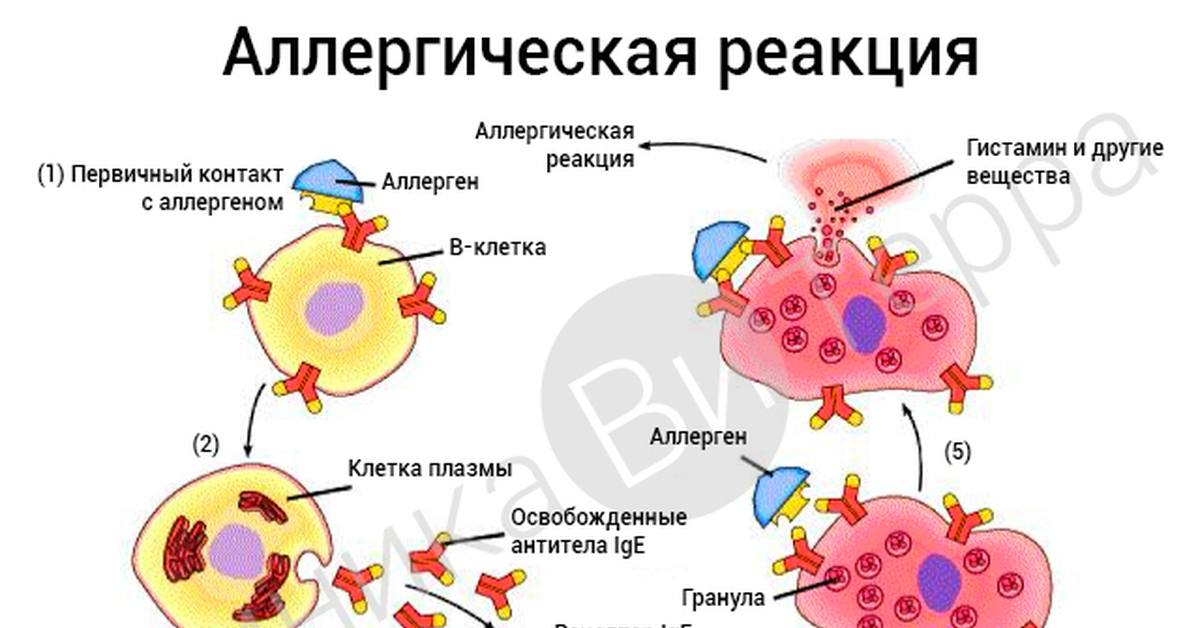 Грегори Томпсон, врач-терапевт, Адам Хусни, врач, семейная медицина, Элизабет Т. Руссо, врач-терапевт, Киртли Джонс, врач, акушерство и гинекология,
Грегори Томпсон, врач-терапевт, Адам Хусни, врач, семейная медицина, Элизабет Т. Руссо, врач-терапевт, Киртли Джонс, врач, акушерство и гинекология,
Как беременность может повлиять на прогрессирование аутоиммунных заболеваний? | Клиническая и молекулярная аллергия
Купер Г., Байнум М., Сомерс Э. Недавние исследования в области эпидемиологии аутоиммунных заболеваний: улучшенные оценки распространенности и понимание кластеризации заболеваний. J Autoimmun. 2009. 33: 197–207.
Артикул PubMed PubMed Central Google ученый
Rose NR, MacKay IR. Аутоиммунные заболевания. 5-е изд. Лондон: Elsevier Academic Press; 2006.
Google ученый
Кочи Ю. Генетика аутоиммунных заболеваний: перспективы полногеномных ассоциативных исследований. Int Immunol. 2016; 28: 155–61.
CAS Статья PubMed Google ученый
Gleicher N, Weghofer A, Barad DH. Передовая оценка влияния аутоиммунитета на репродуктивный успех женщин. J Autoimmun. 2012; 38: J74–80.
CAS Статья PubMed Google ученый
Tilburgs T, Scherjon SA, van der Mast BJ, Versteeg-VD, Voort-Maarschalk M, et al. Несоответствие HLA-C плода и матери связано с активацией децидуальных Т-клеток и индукцией функциональных Т-регуляторных клеток. J Reprod Immunol.2009. 82: 148–57.
CAS Статья PubMed Google ученый
Romagnani S. Т-клеточные ответы при аллергии и астме. Curr Opin Allergy Clin Immunol. 2001; 1: 73–8.
CAS Статья PubMed Google ученый
Харрингтон Л. Е., Хаттон Р. Д., Манган П. Р., Тернер Х., Мерфи Т. Л., Мерфи К. М., Уивер Коннектикут. Эффекторные Т-клетки CD4 +, продуцирующие интерлейкин 17, развиваются по клону, отличному от клонов Т-хелперов 1 и 2 типа.Nat Immunol. 2005; 6: 1123–32.
CAS Статья PubMed Google ученый
Аннунциато Ф., Косми Л., Сантарласки В., Магги Л., Лиотта Ф., Маззинги Б. и др. Фенотипические и функциональные особенности клеток Th27 человека. J Exp Med. 2007. 204: 1849–61.
CAS Статья PubMed PubMed Central Google ученый
Cosmi L, Maggi L, Santarlasci V, Capone M, Cardilicchia E, Frosali F, et al.Идентификация новой субпопуляции циркулирующих CD4 (+) Т-клеток памяти человека, которые продуцируют как IL-17A, так и IL-4. J Allergy Clin Immunol. 2010; 125: 222–30.
CAS Статья PubMed Google ученый
Lombardelli L, Logiodice F, Aguerre-Girr M, Kullolli O, Haller H, Casart Y, et al. Децидуальные CD4 + Т-клетки, продуцирующие интерлейкин-17, не вредны для беременности человека, если они также продуцируют интерлейкин-4. Clin Mol Allergy.2016; 14: 1. DOI: 10.1186 / s12948-016-0039-у.
Артикул PubMed PubMed Central Google ученый
Strom TB, Рой-Чодери Р., Манфро Р. , Чжэн XX, Никерсон П. У., Вуд К., Бушелл А. Парадигма Th2 / Th3 и ответ аллотрансплантата. Curr Opin Immunol. 1996; 8: 688–93.
, Чжэн XX, Никерсон П. У., Вуд К., Бушелл А. Парадигма Th2 / Th3 и ответ аллотрансплантата. Curr Opin Immunol. 1996; 8: 688–93.
CAS Статья PubMed Google ученый
Li XC, Zand MS, Li Y, Zheng XX, Strom TB.О барьерах гистосовместимости, иммунном отклонении от Th2 до Th3 и характере ответов аллотрансплантата. J Immunol. 1998. 161: 2241–7.
CAS PubMed PubMed Central Google ученый
Chen H, Wang W, Xie H, Xu X, Wu J, Jiang Z, et al. Патогенная роль ИЛ-17 на ранней стадии отторжения аллотрансплантата роговицы. Transpl Immunol. 2009; 21: 155–61.
CAS Статья PubMed Google ученый
Burns WR, Wang Y, Tang PC. Рекрутинг CXCR3 + и CCR5 + Т-клеток и продукция хемокинов, индуцируемых гамма-интерфероном, в отторжающих человеческих артериях. Am J Transplant. 2005; 5: 1226–36.
CAS Статья PubMed Google ученый
Ван С., Тай С.С., Тран Г.Т., Ходжкинсон С.Дж., Аллен Р.Д., Холл Б.М. и др. Обработка донорским ИЛ-4 индуцирует альтернативно активированные макрофаги печени и NK-клетки, экспрессирующие IDO, и способствует усвоению аллотрансплантата печени крысы.Transpl Immunol. 2010; 22: 172–8.
CAS Статья PubMed Google ученый
Graca L, Cobbolt SP, Waldmann H. Идентификация регуляторных Т-клеток в переносимых аллотрансплантатах. J Exp Med. 2002; 195: 1641–6.
J Exp Med. 2002; 195: 1641–6.
CAS Статья PubMed PubMed Central Google ученый
Зенклассен А.С., Герлоф К., Зенклассен М.Л., Ритчел С. Замбон Бертоя А., Фест С., Хонцу С., Уэха С., Мацусима К., Лебер Дж., Фольк HD.Регуляторные Т-клетки индуцируют привилегированную толерантную микросреду на границе плод-мать. Eur J Immunol. 2006; 36: 82–94.
CAS Статья PubMed Google ученый
Робертсон С.А., Принс Дж. Р., Шарки Д. Д., Молденхауэр Л. М.. Семенная жидкость и генерация регуляторных Т-клеток для имплантации эмбриона. Am J Reprod Immunol. 2013; 69: 315–30.
CAS Статья PubMed Google ученый
Lin H, Mosmann TR, Guilbert L, Tuntipopipat S, Wegmann TG. Синтез цитокинов типа Т-хелперов 2 на границе раздела матери и плода. J. Immunol. 1993; 151: 4562–73.
CAS PubMed Google ученый
Вегманн Т.Г., Лин Х., Гильберт Л., Моссманн Т.Р. Двунаправленное взаимодействие цитокинов в отношениях матери и плода: является ли успешная беременность феноменом Th3? Иммунол сегодня. 1993. 14: 353–6.
CAS Статья PubMed Google ученый
Chaouat G, Assal-Meliani A, Martal J, Raghupathy R., Elliott JF, Mosmann T. и др. IL-10 предотвращает естественную потерю плода в комбинации спаривания CBA X DBA / 2, а локальный дефект продукции IL-10 в этой склонной к аборту комбинации корректируется путем инъекции IFN-γ in vivo. J Immunol. 1995; 154: 4261–8.
J Immunol. 1995; 154: 4261–8.
CAS PubMed Google ученый
Кришнан Л., Гильберт Л.Дж., Рассел А.С., Вегманн Т.Г., Мосманн Т.Р., Белозевич М.Беременность снижает устойчивость мышей C57BL / 6 к основной инфекции лейшмании и вызывает снижение антиген-специфического ответа на IFN-гамма и повышение продукции цитокинов Т-хелперов 2. J Immunol. 1996; 156: 644–52.
CAS PubMed Google ученый
Piccinni MP, Beloni L, Livi C, Maggi E, Scarselli G, Romagnani S. Дефектная продукция как фактора ингибирования лейкемии, так и Т-хелперных цитокинов типа 2 децидуальными Т-клетками при необъяснимых повторных абортах.Nat Med. 1998; 4: 1020–4.
CAS Статья PubMed Google ученый
Lombardelli L, Aguerre-Girr M, Logiodice F, Kullolli O, Casart Y, Polgar B и др. HLA-G5 индуцирует секрецию IL-4, критическую для успешной беременности, за счет дифференциальной экспрессии рецептора ILT2 на децидуальных CD4 + Т-клетках и макрофагах. J Immunol. 2013; 191: 3651–62.
CAS Статья PubMed Google ученый
Piccinni MP, Scaletti C, Vultaggio A, Maggi E, Romagnani S. Дефектная продукция цитокинов LIF, M-CSF и Th3-типа Т-клетками на фето-материнском интерфейсе связана с потерей беременности. J Reprod Immunol. 2001; 52: 35–43.
CAS Статья PubMed Google ученый
Piccinni MP, Lombardelli L, Logiodice F, Kullolli O, Romagnani S, Le Bouteiller P.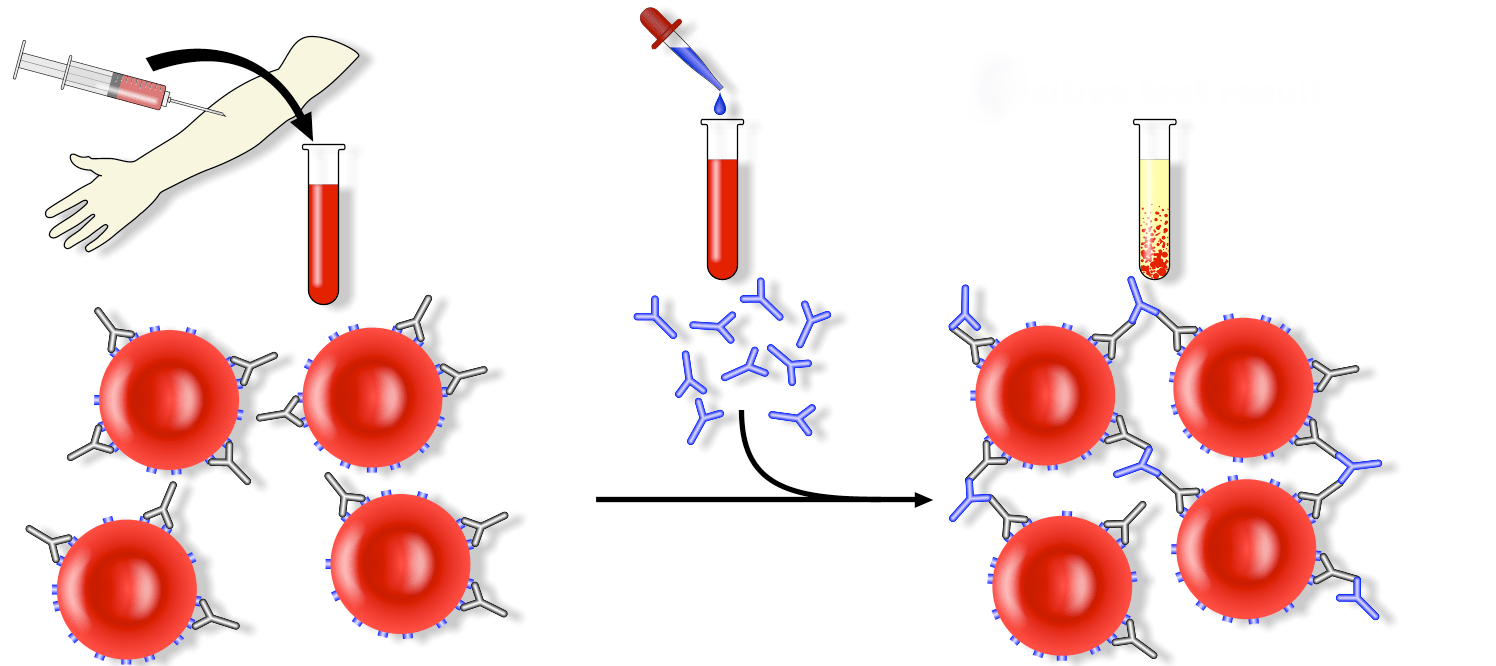 Толерантность, опосредованная Т-хелперными клетками, к фетальному аллотрансплантату при успешной беременности.Clin Mol Allergy. 2015; 13: 9. DOI: 10.1186 / s12948-015-0015-у.
Толерантность, опосредованная Т-хелперными клетками, к фетальному аллотрансплантату при успешной беременности.Clin Mol Allergy. 2015; 13: 9. DOI: 10.1186 / s12948-015-0015-у.
Артикул PubMed PubMed Central Google ученый
Пиччинни М.П., Джудизи М.Г., Бьяджиотти Р., Белони Л., Джаннарини Л., Сампоньяро С. и др. Прогестерон способствует развитию Т-хелперных клеток человека, продуцирующих цитокины Th3-типа, и способствует как продукции IL-4, так и экспрессии CD30 на мембране в установленных клонах клеток Th2. J Immunol. 1995; 155: 128–33.
CAS PubMed Google ученый
Wang WJ, Hao CF, Yi-Lin Yin GJ, Bao SH, Qiu LH, et al. Повышенная распространенность клеток Т-хелперов 17 (Th27) в периферической крови и децидуальной оболочке у пациентов с необъяснимым повторным самопроизвольным абортом. J Reprod Immunol. 2010; 84: 164–70.
J Reprod Immunol. 2010; 84: 164–70.
CAS Статья PubMed Google ученый
Накашима А., Ито М., Шима Т., Бак Н.Д., Хидака Т., Сайто С. Накопление IL-17-положительных клеток в децидуальной оболочке неизбежных абортов. Am J Reprod Immunol.2010; 64: 4–11.
PubMed Google ученый
Виткин С.С., Линьярес И.М., Бонджованни А.М., Хервей С., Скупски Д. Уникальные изменения в индуцированной инфекцией иммунной активации во время беременности. BJOG. 2011; 118: 145–53.
CAS Статья PubMed Google ученый
Raphael I, Nalawade S, Eagar TN, Forsthuber TG. Подмножества Т-клеток и их характерные цитокины при аутоиммунных и воспалительных заболеваниях.Цитокин. 2015; 74: 5–17.
Подмножества Т-клеток и их характерные цитокины при аутоиммунных и воспалительных заболеваниях.Цитокин. 2015; 74: 5–17.
CAS Статья PubMed Google ученый
Panitch HS, Hirsch RL, Schindler J, Johnson KP. Лечение рассеянного склероза гамма-интерфероном: обострения, связанные с активацией иммунной системы. Неврология. 1987. 37: 1097–102.
CAS Статья PubMed Google ученый
Фербер И.А., Брок С., Тейлор-Эдвардс С., Риджуэй В., Диниско С., Стейнман Л. и др.Мыши с нарушенным геном IFN-гамма чувствительны к индукции экспериментального аутоиммунного энцефаломиелита (EAE). J Immunol. 1996; 156: 5–7.
CAS PubMed Google ученый
Флайшон Л., Топильски И., Шосеев Д., Хершковиз Р., Файерман Э., Лево Ю., Мармор С. и др. Передний край: противовоспалительные свойства низкого уровня IFN-гамма. J Immunol. 2002; 168: 3707–11.
CAS Статья PubMed Google ученый
Рафаэли Ю., Ван Парийс Л., Александр С.И., Аббас А.К. Гамма-интерферон необходим для вызванной активацией гибели Т-лимфоцитов. J Exp Med. 2002; 196: 999–1005.
CAS Статья PubMed PubMed Central Google ученый
Mellor AL, Munn DH. Экспрессия IDO дендритными клетками: толерантность и катаболизм триптофана. Nat Rev Immunol. 2004; 4: 762–74.
CAS Статья PubMed Google ученый
Ильера В.А., Перандонес CE, Штунц Л.Л., Косилка Д.А. Младший, Эшман РФ. Апоптоз В-лимфоцитов селезенки. Регулирование протеинкиназой C и IL-4. J Immunol. 1993; 151: 2965–73.
CAS PubMed Google ученый
Swain SL, Weinberg AD, English M, Huston G. IL-4 направляет развитие Th3-подобных вспомогательных эффекторов. J Immunol. 1990; 145: 3796–806.
CAS PubMed Google ученый
Lock C, Hermans G, Pedotti R, Brendolan A, Schadt E, Garren H и др. Генный микроматричный анализ поражений рассеянного склероза дает новые цели, подтвержденные при аутоиммунном энцефаломиелите. Nat Med. 2002; 8: 500–8.
CAS Статья PubMed Google ученый
Котаке С., Удагава Н., Такахаши Н., Мацудзаки К., Ито К., Исияма С. и др. IL-17 в синовиальной жидкости пациентов с ревматоидным артритом является мощным стимулятором остеокластогенеза.J Clin Invest. 1999; 103: 1345–52.
CAS Статья PubMed PubMed Central Google ученый
Хирота К., Йошитоми Х., Хашимото М., Маеда С., Терадаира С., Сугимото Н. и др. Преимущественное привлечение CCR6-экспрессирующих клеток Th27 к воспаленным суставам через CCL20 при ревматоидном артрите и его модели на животных. J Exp Med. 2007. 204: 2803–12.
CAS Статья PubMed PubMed Central Google ученый
Wong CK, Lit LC, Tam LS, Li EK, Wong PT, Lam CW и др. Гиперпродукция IL-23 и IL-17 у пациентов с системной красной волчанкой: последствия для Th27-опосредованного воспаления в аутоиммунитете. Clin Immunol. 2008; 127: 385–93.
Гиперпродукция IL-23 и IL-17 у пациентов с системной красной волчанкой: последствия для Th27-опосредованного воспаления в аутоиммунитете. Clin Immunol. 2008; 127: 385–93.
CAS Статья PubMed Google ученый
Доро А., Белот А., Бастид Дж., Риш Б., Трескол-Бимонт М.С., Ранчин Б. и др. Интерлейкин 17 действует в синергии с фактором активации В-клеток, влияя на биологию В-клеток и патофизиологию системной красной волчанки.Nat Immunol. 2009; 10: 778–85.
CAS Статья PubMed Google ученый
Линден А., Хосино Х., Лаан М. Нейтрофилы дыхательных путей и интерлейкин-17. Eur Respir J. 2000; 15: 973–7.
CAS Статья PubMed Google ученый
Чжу С., Цянь Ю. Рецепторная система IL-17 / IL-17 при аутоиммунном заболевании: механизмы и терапевтический потенциал. Clin Sci.2012; 122: 487–511.
CAS Статья PubMed Google ученый
Haak S, Croxford AL, Kreymborg K, Heppner FL, Pouly S, Becher B и др. IL-17A и IL-17F не вносят существенного вклада в аутоиммунное нейровоспаление у мышей. J Clin исследования. 2009; 119: 61–9.
CAS PubMed Google ученый
Азизи Г., Яздани Р., Миршафи А. Клетки Th32 в аутоиммунитет: обзор современных знаний.Eur Ann Allergy Clin Immunol. 2015; 47: 108–17.
CAS PubMed Google ученый
Tian T, Yu S, Ma D. Th32 и родственные цитокины при воспалительных и аутоиммунных заболеваниях. Эксперт считает, что цели. 2013; 17: 113–25.
CAS Статья PubMed Google ученый
Мескита Д. мл., Крувинель В.М., Резенде Л.С., Мескита Ф.В., Силва Н.П., Камара Н.О. и др.Фолликулярные Т-хелперы в иммунитете и аутоиммунитете. Braz J Med Biol Res. 2016; 49: e5209. DOI: 10.1590 / 1414-431X20165209.
Артикул PubMed PubMed Central Google ученый
Мека Р.Р., Венкатеша С.Х., Дудикс С., Ачарья Б., Муджил К.Д. Модуляция аутоиммунитета, индуцированная IL-27, и ее терапевтический потенциал. Autoimmun Rev.2015; 14: 1131–41.
CAS Статья PubMed Google ученый
Weetman AP. Иммунитет, функция щитовидной железы и беременность: молекулярные механизмы. Nat Rev Endocrinol. 2010; 6: 311–8.
CAS Статья PubMed Google ученый
Де Ман Ю.А., Долхайн Р.Дж., Хейз Дж.М. Активность заболевания или ремиссия ревматоидного артрита до, во время и после беременности. Curr Opin Rheumatol. 2014; 26: 329–33.
Артикул PubMed Google ученый
Поццилли С., Пульятти М. Группа компаний ParadigMS. Обзор проблем, связанных с беременностью у пациентов с рассеянным склерозом. Eur J Neurol. 2015; 22 (Приложение 2): 34–9.
Артикул PubMed Google ученый
Айрас Л. Гормональные и связанные с полом иммунные изменения при рассеянном склерозе. Acta Neurol Scand. 2015; 132: 62–70.
CAS Статья PubMed Google ученый
Jara LJ, Medina G, Cruz-Dominguez P, Navarro C, Vera-Lastra O, Saavedra MA. Факторы риска обострения системной красной волчанки при беременности. Immunol Res. 2014; 60: 184–92.
CAS Статья PubMed Google ученый
Андерссон А., Стубелиус А., Карлссон М.Н., Энгдаль С., Эрландссон М., Гранемо Л. и др. Эстроген регулирует фенотип и локализацию Т-хелпера 17 при экспериментальном аутоиммунном артрите. Arthritis Res Ther.2015; 17:32. DOI: 10.1186 / s13075-015-0548-у.
Артикул PubMed PubMed Central Google ученый
Quintero OL, Amador-Patarroyo MJ, Montoya-Ortiz G, Rojas-Villarraga A, Anaya JM. Аутоиммунное заболевание и пол: вероятные механизмы преобладания аутоиммунитета у женщин. J Autoimmun. 2012; 38: J109–19.
CAS Статья PubMed Google ученый
Гонсалес Д.А., Диас ББ. Родригес Перес Мдел С., Эрнандес АГ, Чико Б.Н., де Леон А.С. Половые гормоны и аутоиммунитет. Immunol Lett. 2010; 133: 6–13.
PubMed Google ученый
Khosla S, Melton LJ 3rd, Atkinson EJ, O’Fallon WM. Связь уровней половых стероидов в сыворотке с продольными изменениями плотности костей у молодых и пожилых мужчин. J Clin Endocrinol Metab. 2001; 86: 3555–61.
CAS Статья PubMed Google ученый
Остенсен М. Половые гормоны и беременность при ревматоидном артрите и системной красной волчанке. Ann N Y Acad Sci. 1999; 876: 131–43.
CAS Статья PubMed Google ученый
Энгдаль С., Йохемс С., Виндаль С.Х., Бёрьессон А.Е., Ольссон С., Карлстен Х. и др. Улучшение индуцированного коллагеном артрита и иммуноассоциированной потери костной массы за счет передачи сигналов через рецептор эстрогена α, а не через рецептор эстрогена β или рецептор, связанный с G-белком 30.Ревматоидный артрит. 2010; 62: 524–33.
CAS PubMed Google ученый
Д’Элия Х.Ф., Ларсен А., Маттссон Л.А., Вальтбранд Э., Квист Дж., Меллстрём Д. и др. Влияние заместительной гормональной терапии на прогрессирование заболевания и минеральную плотность костной ткани при ревматоидном артрите. J Rheumatol. 2003. 30: 1456–63.
J Rheumatol. 2003. 30: 1456–63.
PubMed Google ученый
Rijhsinghani AG, Thompson K, Bhatia SK, Waldschmidt TJ.Эстроген блокирует раннее развитие Т-клеток в тимусе. Am J Reprod Immunol. 1996; 36: 269–77.
CAS Статья PubMed Google ученый
Straub RH. Сложная роль эстрогенов в воспалении. Endocr Rev.2007; 28: 521–74.
CAS Статья PubMed Google ученый
Leipe J, Grunke M, Dechant C, Reindl C, Kerzendorf U, Schulze-Koops H, et al.Роль клеток Th27 в аутоиммунном артрите человека. Ревматоидный артрит. 2010; 62: 2876–85.
CAS Статья PubMed Google ученый
Lélu K, Laffont S, Delpy L, Paulet PE, Périnat T, Tschanz SA, et al. Передача сигналов рецептора эстрогена α в Т-лимфоцитах необходима для опосредованного эстрадиолом ингибирования дифференцировки клеток Th2 и Th27 и защиты от экспериментального аутоиммунного энцефаломиелита. J Immunol. 2011; 187: 2386–93.
Артикул PubMed Google ученый
Plum SM, Park EJ, Strawn SJ, Moore EG, Sidor CF, Fogler WE. Модифицирующая болезнь и антиангиогенная активность 2-метоксиэстрадиола на мышиной модели ревматоидного артрита. BMC Musculoskelet Disord. 2009; 10: 46.
Артикул PubMed PubMed Central Google ученый
Xu L, Dong B, Wang H, Zeng Z, Liu W, Chen N, et al.Прогестерон подавляет ответы клеток Th27 и усиливает развитие регуляторных Т-лимфоцитов через стромальные лимфопоэтин-зависимые механизмы тимуса при экспериментальной гонококковой инфекции половых путей. Микробы заражают. 2013; 15: 796–805.
CAS Статья PubMed Google ученый
Bashyam H. Перекрестная регуляция Th2 / Th3 и открытие IL-10. J Exp Med. 2007; 204: 237.
Артикул PubMed PubMed Central Google ученый
Piccinni MP, Bani D, Beloni L, Manuelli C, Mavilia C, Vocioni F и др. Релаксин способствует превращению активированных Т-клеток человека в Th2-подобные эффекторы. Eur J Immunol. 1999; 29: 2241–7.
1999; 29: 2241–7.
CAS Статья PubMed Google ученый
Скалетти С, Вультаджо А, Магги Е, Романьани С., Пиччинни МП. Микрохимеризм и системный склероз. Int Arch Allergy Immunol. 2001; 125: 196–202.
CAS Статья PubMed Google ученый
Scaletti C, Vultaggio A, Bonifacio S, Emmi L, Torricelli F, Maggi E и др. Th3-ориентированный профиль Т-клеток потомства мужского пола, присутствующих у женщин с системным склерозом и реактивных с материнскими антигенами главного комплекса гистосовместимости. Ревматоидный артрит. 2002; 46: 445–50.
CAS Статья PubMed Google ученый
Adams Waldorf KM. Нельсон JL. Аутоиммунное заболевание во время беременности и наследие беременности в виде микрохимеризма.Иммунол Инвест. 2008; 37: 631–44. DOI: 10.1080 / 08820130802205886.
Артикул PubMed PubMed Central Google ученый
Йе Дж, Вивес-Пи М, Гиллеспи К.М. Материнский микрохимеризм: друг или враг диабета 1 типа? Химеризм. 2014; 5: 21–3.
Артикул PubMed PubMed Central Google ученый
Материнские антитела — обзор
Пренатальный
Скрининг материнских антител рекомендуется при всех беременностях.Обычно проверяют наличие материнских антител при первом дородовом посещении, а в случае отрицательного результата — повторно проверяют через 28 недель, а затем после родов. Хотя поздняя аллоиммунизация встречается редко, врач упустит возможность вмешательства, если не будет проведен скрининг на антитела между первым визитом и послеродовым периодом. Идентификация материнских антител осуществляется с помощью непрямого теста Кумбса. Уровень ответа антител указывается как величина, обратная последней пробирке для разведения, которая продемонстрировала признаки агглютинации.Например, титр 32 эквивалентен потере присутствия агглютинации после шестого разведения или 1:32. Клинически важно отметить, что существуют межлабораторные различия в уровнях титра, а также из-за несколько субъективного определения « агглютинация »также наблюдаются внутрилабораторные вариации. Это внутрилабораторное изменение всегда должно быть в пределах одного разведения, и лечащий врач должен знать, что увеличение титра с 16 до 32 может не указывать на усиление иммунного ответа матери.
Идентификация материнских антител осуществляется с помощью непрямого теста Кумбса. Уровень ответа антител указывается как величина, обратная последней пробирке для разведения, которая продемонстрировала признаки агглютинации.Например, титр 32 эквивалентен потере присутствия агглютинации после шестого разведения или 1:32. Клинически важно отметить, что существуют межлабораторные различия в уровнях титра, а также из-за несколько субъективного определения « агглютинация »также наблюдаются внутрилабораторные вариации. Это внутрилабораторное изменение всегда должно быть в пределах одного разведения, и лечащий врач должен знать, что увеличение титра с 16 до 32 может не указывать на усиление иммунного ответа матери.
Поскольку гуморальной иммунной системе требуется время для совершенствования своего ответа антител, первая пораженная аллоиммунизированная беременность отличается от последующих тем, что у них обычно более низкие титры антител, а тяжелая анемия плода может не развиться или развиться только на поздних сроках беременности. После определения наличия материнских антител необходимо обязательно оценить, находится ли плод в группе риска. Если отец гомозиготен по антигену, плод подвержен риску HDFN, но если отец гетерозиготен, существует 50% -ная вероятность того, что плод не будет подвержен никакому риску, и могут быть проведены дальнейшие исследования и мониторинг матери и плода. устранено.Правильное установление отцовства важно, так как отцовство оценивается от 2% до 5%. 23
После определения наличия материнских антител необходимо обязательно оценить, находится ли плод в группе риска. Если отец гомозиготен по антигену, плод подвержен риску HDFN, но если отец гетерозиготен, существует 50% -ная вероятность того, что плод не будет подвержен никакому риску, и могут быть проведены дальнейшие исследования и мониторинг матери и плода. устранено.Правильное установление отцовства важно, так как отцовство оценивается от 2% до 5%. 23
Если тестирование зиготности отцов показывает, что плод подвержен риску переноса антигена, вызывающего нарушение, необходимо провести генотипирование крови плода. Развитие тестирования внеклеточной ДНК (вкДНК) изменило этот подход для Rh (D) -отрицательных женщин. ВкДНК плода может быть обнаружена уже на 38-й день беременности и увеличивается по мере продвижения беременности и исчезает после родов. Статус Rh (D) плода может быть определен путем оценки последовательностей вкДНК плода в материнской плазме с использованием полимеразной цепной реакции с обратной транскриптазой (ПЦР) и имеет 99. Чувствительность 1% для определения статуса резус (D) плода в первом и втором триместре. Тестирование следует проводить после 10 недель беременности, чтобы гарантировать адекватную фракцию вкДНК плода, и рекомендуются комбинации анализов для обнаружения экзонов 4, 5, 7 и 10 гена Rh (D) . 24 Если эти экзоны отсутствуют, то определяется, что плод является Rh (D) -отрицательным, и дальнейшее тестирование не рекомендуется, если можно определить, что тестировалась вкДНК плода.Это можно сделать путем идентификации последовательности гена Y-хромосомы, обозначающей присутствие плода мужского пола, или, кроме того, можно использовать однонуклеотидный полиморфизм для определения того, что образец взят из плода. 25 Анализы для определения группы крови плода по Kell, Rh (E), Rh (C) и Rh (c) существуют, но еще не доступны в США.
Чувствительность 1% для определения статуса резус (D) плода в первом и втором триместре. Тестирование следует проводить после 10 недель беременности, чтобы гарантировать адекватную фракцию вкДНК плода, и рекомендуются комбинации анализов для обнаружения экзонов 4, 5, 7 и 10 гена Rh (D) . 24 Если эти экзоны отсутствуют, то определяется, что плод является Rh (D) -отрицательным, и дальнейшее тестирование не рекомендуется, если можно определить, что тестировалась вкДНК плода.Это можно сделать путем идентификации последовательности гена Y-хромосомы, обозначающей присутствие плода мужского пола, или, кроме того, можно использовать однонуклеотидный полиморфизм для определения того, что образец взят из плода. 25 Анализы для определения группы крови плода по Kell, Rh (E), Rh (C) и Rh (c) существуют, но еще не доступны в США.
В отсутствие тестирования вкДНК группа крови плода может быть определена с помощью ПЦР некультивируемых амниоцитов, полученных в результате амниоцентеза, проведенного после 15 недель беременности. Следует приложить все усилия, чтобы избежать трансплацентарного подхода к амниоцентезу, так как это может усилить иммунный ответ матери и повысить тяжесть аллоиммунизации. 26 Аналогичным образом, забор проб ворсинок хориона для пренатальной диагностики противопоказан беременным с риском ГБН из-за повышенного риска кровотечения у матери, связанного с процедурой.
Следует приложить все усилия, чтобы избежать трансплацентарного подхода к амниоцентезу, так как это может усилить иммунный ответ матери и повысить тяжесть аллоиммунизации. 26 Аналогичным образом, забор проб ворсинок хориона для пренатальной диагностики противопоказан беременным с риском ГБН из-за повышенного риска кровотечения у матери, связанного с процедурой.
После того, как будет определено, что плод подвержен риску ГБН, рекомендуется ежемесячно повторять непрямые тесты Кумбса.Для получения стабильных результатов следует использовать одну и ту же лабораторию, а титры, которые ниже критического порога, но повышаются, следует повторять с более короткими интервалами.
«Критический титр» определяется как титр, при котором у плода существует риск развития тяжелой анемии и водянки, и указывает, когда следует начать обследование MCA-PSV. Критический титр 16 или 32 используется для всех, кроме аллоиммунизации Келла. Из-за подавления предшественников эритроидов, присутствующего при аллоиммунизации Kell, критический титр, равный 8, должен вызывать начало оценки MCA-PSV.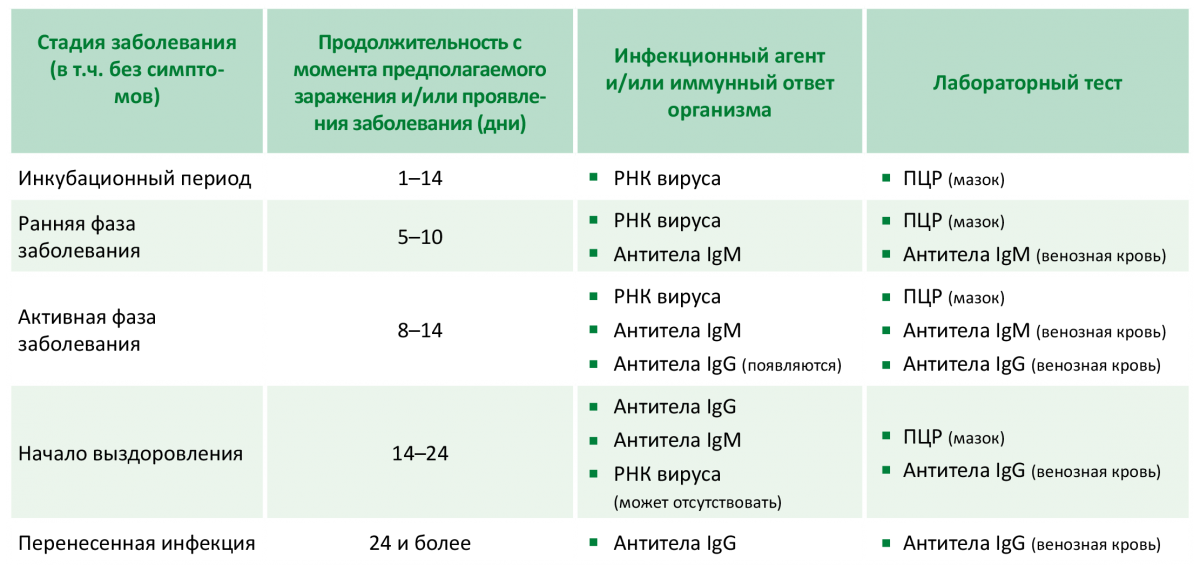 27 Начало оценки MCA-PSV следует начинать на 20 неделе беременности с первым поражением и на 18 неделе при беременности с анти-Kell. MCA-PSV увеличивается на протяжении всей беременности, и калькуляторы для определения MoM доступны на http://www.perinatology.com. Оптимальный интервал для обследований не определен, но экспертное мнение состоит в том, что обследования должны проводиться каждые 1–2 недели и могут определяться как предыдущим уровнем MCA-PSV, так и титром антител. 19 Несмотря на отсутствие исследований по валидности, типу или частоте, пренатальное тестирование рекомендуется начинать у этих пациентов на 32 неделе в сочетании с измерениями MCA-PSV. 28 У этих пациенток также должны быть запланированные роды на срок от 37 до 38 недель, в соответствии с рекомендациями Общества материнской медицины плода. 29 Измерения MCA-PSV выше 1,5 мес до 35 недель должны быть исследованы с забором крови плода с целью ее переливания, если анемия плода подтверждена.
27 Начало оценки MCA-PSV следует начинать на 20 неделе беременности с первым поражением и на 18 неделе при беременности с анти-Kell. MCA-PSV увеличивается на протяжении всей беременности, и калькуляторы для определения MoM доступны на http://www.perinatology.com. Оптимальный интервал для обследований не определен, но экспертное мнение состоит в том, что обследования должны проводиться каждые 1–2 недели и могут определяться как предыдущим уровнем MCA-PSV, так и титром антител. 19 Несмотря на отсутствие исследований по валидности, типу или частоте, пренатальное тестирование рекомендуется начинать у этих пациентов на 32 неделе в сочетании с измерениями MCA-PSV. 28 У этих пациенток также должны быть запланированные роды на срок от 37 до 38 недель, в соответствии с рекомендациями Общества материнской медицины плода. 29 Измерения MCA-PSV выше 1,5 мес до 35 недель должны быть исследованы с забором крови плода с целью ее переливания, если анемия плода подтверждена. После 35 недель родоразрешения рекомендуются, так как риск недоношенности ниже, чем у плода на этом сроке беременности.
После 35 недель родоразрешения рекомендуются, так как риск недоношенности ниже, чем у плода на этом сроке беременности.
По мере того, как врожденная иммунная система становится более эффективной, у аллоиммунизированных матерей с каждой последующей беременностью возрастает вероятность развития тяжелой гемолитической болезни.У восприимчивых плодов анемия возникает раньше, чем на предыдущих сроках беременности, при этом в отчетах о случаях тяжелой анемии отмечается начало тяжелой анемии уже через 15 недель. 30 Если это еще не сделано, при необходимости необходимо провести тест на зиготность отцов с тестированием плода, как описано ранее. Алгоритм управления аллоиммунизацией представлен на рис. 123.7.
При беременности с предшествующей потребностью во внутриматочной трансфузии (ВМИ), послеродовой обменной трансфузией или при перинатальной потере крови вследствие ГББН раннее обследование в опытном квалифицированном центре с началом еженедельной допплерографии MCA-PSV с самого раннего возраста. Рекомендуется 16 недель.Данные по ранним измерениям MCA-PSV доступны для руководства в ранних случаях тяжелого заболевания. 31 Дальнейшее ведение идентично таковому при первых пораженных беременностях, за исключением того, что в этих случаях редко бывает невозможно не выполнить IUT.
Рекомендуется 16 недель.Данные по ранним измерениям MCA-PSV доступны для руководства в ранних случаях тяжелого заболевания. 31 Дальнейшее ведение идентично таковому при первых пораженных беременностях, за исключением того, что в этих случаях редко бывает невозможно не выполнить IUT.
Пациенты с тяжелой формой ГБПН в анамнезе с потерями во втором триместре успешно лечились иммуномодуляцией, состоящей из плазмафереза с последующим еженедельным внутривенным иммуноглобулином. Это отсрочило гестационный срок, при котором необходимо начать ВМС, а также улучшило выживаемость плода. 32 В случаях, когда подозрение на тяжелую анемию возникает до 18 недель, внутрибрюшинное переливание крови (ИПТ) с иммуномодуляцией или без нее может позволить стабилизировать состояние плода до тех пор, пока не будет проведен забор крови плода и внутривенное переливание крови на сроке беременности 18–20 недель. 33 Основным ограничением эффективности ИПТ при анемии плода является наличие водянки, которая препятствует эффективному всасыванию красных кровяных телец, вторичному по отношению к нарушению лимфатической системы, связанному с водянкой.
После того, как MCA-PSV продемонстрирует признаки тяжелой анемии плода, следует провести забор крови плода с целью ее переливания, если анемия плода подтверждена. В многопрофильных центрах выживаемость новорожденных после внутрисосудистых трансфузий превосходна. Сообщалось об общей выживаемости 94% для негидропных плодов и 74% для гидропных плодов. 34 Как указывалось ранее, мы не рекомендуем выполнять ВМИ через 35 недель, так как вышеупомянутые риски перевешивают связанные с ними риски преждевременных родов.
Тест Кумбса | PeaceHealth
Обзор теста
Тесты Кумбса проводятся для обнаружения определенных антител, которые атакуют эритроциты. Антитела — это белки, вырабатываемые иммунной системой. Обычно антитела связываются с чужеродными веществами, такими как бактерии и вирусы, и вызывают их уничтожение.
Следующие условия вызывают образование антител.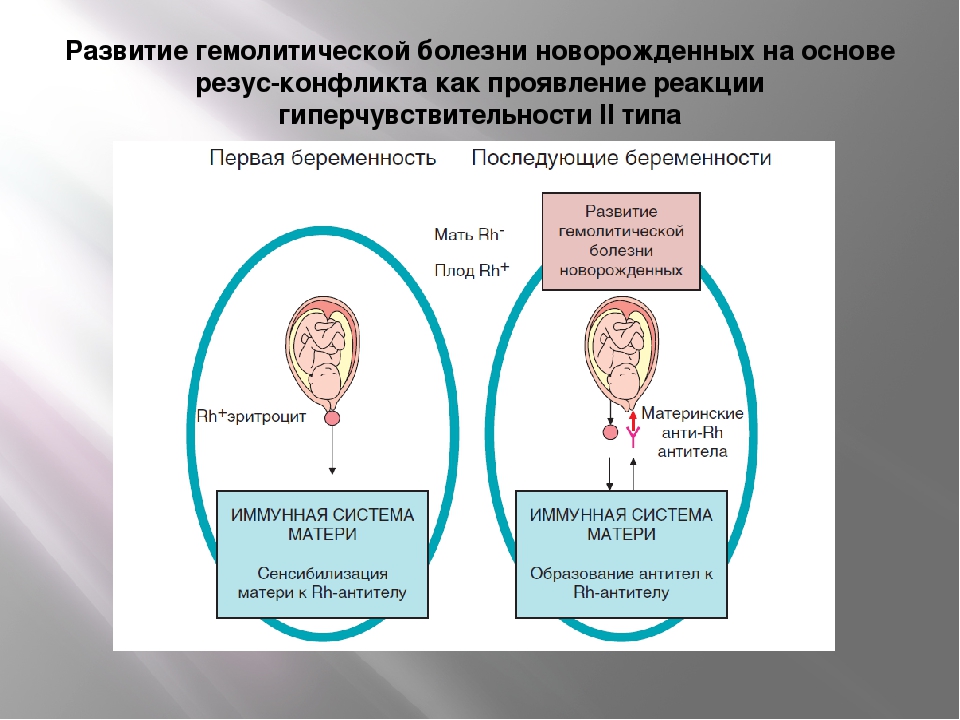
Реакция на переливание крови
Кровь человека типирована по определенным маркерам (называемым антигенами) на поверхности красных кровяных телец.Если вам сделали переливание крови, перелитая кровь должна соответствовать вашему типу. Это означает, что перелитая кровь должна содержать те же антигены, что и ваши эритроциты. Если вам сделают переливание крови с антигенами, отличными от вашей (несовместимая кровь), ваша иммунная система разрушит перелитые клетки крови. Это называется реакцией на переливание крови и может вызвать серьезное заболевание или даже смерть. Вот почему так важно соответствие группы крови.
Rh сенсибилизация
Rh — антиген.Полное название этого антигена — резус-фактор.
Если беременная женщина с резус-отрицательной кровью беременна ребенком (плодом) с резус-положительной кровью, может возникнуть резус-сенсибилизация. У ребенка может быть резус-положительная кровь, если у отца есть резус-положительная кровь. Резус-сенсибилизация происходит, когда кровь ребенка смешивается с кровью матери во время беременности или родов. Это заставляет иммунную систему матери вырабатывать антитела против красных кровяных телец ребенка при будущих беременностях. Этот ответ антител называется резус-сенсибилизацией и, в зависимости от того, когда это происходит, может разрушать эритроциты ребенка до или после его рождения.Если происходит сенсибилизация, у плода или новорожденного могут развиться проблемы от легкой до тяжелой (называемые резус-болезнью или эритробластозом плода). В редких случаях, если не лечить резус-инфекцию, плод или новорожденный может умереть.
У ребенка может быть резус-положительная кровь, если у отца есть резус-положительная кровь. Резус-сенсибилизация происходит, когда кровь ребенка смешивается с кровью матери во время беременности или родов. Это заставляет иммунную систему матери вырабатывать антитела против красных кровяных телец ребенка при будущих беременностях. Этот ответ антител называется резус-сенсибилизацией и, в зависимости от того, когда это происходит, может разрушать эритроциты ребенка до или после его рождения.Если происходит сенсибилизация, у плода или новорожденного могут развиться проблемы от легкой до тяжелой (называемые резус-болезнью или эритробластозом плода). В редких случаях, если не лечить резус-инфекцию, плод или новорожденный может умереть.
Женщина с резус-отрицательной кровью может получить прививку резус-иммуноглобулина (такого как RhoGAM), который почти всегда останавливает сенсибилизацию. Проблемы, связанные с резус-сенсибилизацией, стали очень редкими с момента появления резус-иммуноглобулина.
Аутоиммунная гемолитическая анемия
Тип гемолитической анемии, называемый аутоиммунной гемолитической анемией, — редкое заболевание, при котором вырабатываются антитела против собственных красных кровяных телец человека.
Два анализа крови могут проверить наличие антител, атакующих эритроциты: прямой тест Кумбса и непрямой тест Кумбса. Прямой тест Кумбса проводится на образце красных кровяных телец из организма. Он обнаруживает антитела, которые уже прикреплены к эритроцитам. Непрямой тест Кумбса проводится на образце жидкой части крови (сыворотки). Он обнаруживает антитела, которые присутствуют в кровотоке и могут связываться с определенными эритроцитами, что приводит к проблемам при смешивании крови.
Зачем это делается
Прямой тест Кумбса
Прямой тест Кумбса обнаруживает антитела, прикрепленные к вашим эритроцитам..gif) Антитела могут быть теми, которые вырабатывает ваш организм из-за болезни, или антителами, полученными при переливании крови.
Антитела могут быть теми, которые вырабатывает ваш организм из-за болезни, или антителами, полученными при переливании крови.
Прямой тест Кумбса также может проводиться новорожденному с резус-положительной кровью, у матери которого есть резус-отрицательная кровь. Тест показывает, вырабатывала ли мать антитела и прошли ли антитела через плаценту к ее ребенку.
Косвенный тест Кумбса
Непрямой тест Кумбса обнаруживает определенные антитела, которые находятся в жидкой части вашей крови (сыворотке). Эти антитела могут атаковать красные кровяные тельца, но не прикрепляются к вашим эритроцитам. Непрямой тест Кумбса обычно проводится для обнаружения антител в крови реципиента или донора перед переливанием.
Тест для определения резус-положительной или резус-отрицательной крови (титр резус-антител) проводится на ранних сроках беременности. Если у нее отрицательный резус-фактор, можно принять меры для защиты ребенка.
Если у нее отрицательный резус-фактор, можно принять меры для защиты ребенка.
Как подготовить
В общем, вам ничего не нужно делать до этого теста, если только ваш врач не скажет вам об этом.
Как это делается
Медицинский работник с помощью иглы берет образец крови, обычно из руки.
Сколько времени занимает тест
Проверка займет несколько минут.
Часы
Каково это
При взятии пробы крови игла может вообще ничего не чувствовать. Или вы можете почувствовать укол или ущипнуть.
Или вы можете почувствовать укол или ущипнуть.
Риски
В этом тесте очень малая вероятность возникновения проблемы. При заборе крови на месте может образоваться небольшой синяк.
Результаты
нормальный
Антитела не обнаружены. Это называется отрицательным результатом теста.
- Прямой тест Кумбса.
Отрицательный результат теста означает, что в вашей крови нет антител, прикрепленных к вашим эритроцитам.
- Косвенный тест Кумбса.
Отрицательный результат теста означает, что ваша кровь совместима с кровью, которую вы собираетесь получить при переливании. Отрицательный непрямой тест Кумбса на резус-фактор (титр резус-антител) у беременной женщины означает, что у нее не выработались антитела против резус-положительной крови ее ребенка. Это означает, что резус-сенсибилизации не произошло.
Ненормальное
- Прямой тест Кумбса.
Положительный результат означает, что в вашей крови есть антитела, которые борются с эритроцитами. Это может быть вызвано переливанием несовместимой крови. Или это может быть связано с такими состояниями, как гемолитическая анемия или гемолитическая болезнь новорожденного (HDN).
- Косвенный тест Кумбса.
Положительный результат теста означает, что ваша кровь несовместима с кровью донора и вы не можете получить кровь от этого человека.Если тест на титр резус-антител положительный у беременной или планирующей беременность женщины, это означает, что у нее есть антитела против резус-положительной крови (резус-сенсибилизация). Она будет проверена на ранних сроках беременности, чтобы проверить группу крови ее ребенка. Если у ребенка резус-положительная кровь, мать будет находиться под пристальным наблюдением на протяжении всей беременности, чтобы предотвратить проблемы с эритроцитами ребенка. Если сенсибилизации не произошло, ее можно предотвратить с помощью инъекции резус-иммуноглобулина.
Кредиты
Текущий по состоянию на: 23 сентября 2020 г.
Автор: Healthwise Staff
Медицинский обзор:
E.Грегори Томпсон, врач-терапевт,
Адам Хусни, доктор медицины, семейная медицина,
, Мартин Дж. Габика, врач-терапевт,
По состоянию на: 23 сентября 2020 г.
Автор: Здоровый персонал
Медицинское обозрение: E. Грегори Томпсон, врач внутренних болезней и Адам Хусни, доктор медицины, семейная медицина и Мартин Дж. Габика, доктор медицины, семейная медицина
[Полный текст] Иммунная система матери во время беременности и ее влияние на плод
Сара С. Морелли, 1 Мили Мандал, 2 Лаура Т. Голдсмит, 1 Банафшех Н Кашани, 1 Николас М. Понцио 3 , 4
1 Отделение акушерства, гинекологии и женского здоровья, Медицинская школа Нью-Джерси, Университет Рутгерса, Ньюарк, 2 Отделение фармакологии и токсикологии, Фармацевтическая школа Эрнеста Марио, Университет Рутгерса, Пискатауэй, 3 Кафедра патологии и лабораторной медицины, Медицинская школа Нью-Джерси, Университет Рутгерса, Ньюарк, 4 Высшая школа биомедицинских наук, Университет Рутгерса, Ньюарк, Нью-Джерси, США
Резюме: Иммунная система матери играет решающую роль в установление, поддержание и завершение здоровой беременности.Однако конкретные механизмы, используемые для достижения этих целей, недостаточно изучены. Различные клетки и молекулы иммунной системы играют ключевую роль в развитии и функционировании плаценты и плода. Эффекторные клетки иммунной системы стимулируют и ограничивают развитие плаценты. Иммунный сдвиг Т-хелпер 1 (Th2) / Т-хелпер 2 (Th3) во время беременности хорошо известен. Требуется точный баланс между провоспалительным и противовоспалительным действием. Здесь мы рассматриваем доказательства, касающиеся материнской толерантности к тканям плода и лежащих в основе клеточно-опосредованных иммунных и гуморальных (гормонов и цитокинов) механизмов.Мы также отмечаем многие безответные вопросы в нашем понимании этих механизмов. Кроме того, мы суммируем клинические проявления измененной материнской иммунной системы во время беременности, связанные с восприимчивостью к распространенным вирусным, бактериальным и паразитарным инфекциям, а также к аутоиммунным заболеваниям.
Ключевые слова: интерфейс матери и плода, иммунная система, толерантность плода, субпопуляции лимфоцитов, децидуальная оболочка, беременность
Введение
Взаимоотношения между матерью и плодом привлекали внимание иммунологов на протяжении десятилетий.Выживаемость полуаллогенного плода была использована Биллингхэмом и др. -1 в 1953 году в качестве примера иммунной толерантности к плоду со стороны материнской иммунной системы. Для объяснения этого были выдвинуты многочисленные гипотезы, связанные с плацентарной защитой плода, включая экспрессию (или отсутствие экспрессии) антигенов гистосовместимости в тканях плода, иммунную толерантность матери к антигенам плода, а также ингибирование и / или регуляцию материнских антифетальных иммунных ответов. выживаемость «иммуногенного» плода.Тем не менее, механизмы еще предстоит полностью прояснить.
Отчасти сложность изучения этих механизмов связана с различиями между видами, у которых проводятся такие исследования. Мыши используются для многих из этих исследований из-за их короткого срока беременности, относительно низкой стоимости, четко определенной генетики (включая мутантные, трансгенные и нокаутные штаммы) и доступности широкого спектра антител и реагентов для проведения иммунологических и молекулярных исследований. .Однако различия в репродуктивной системе в целом и в фето-материнско-плацентарной единице в частности, а также различия в развитии и функции иммунных элементов часто препятствуют прямому распространению результатов, наблюдаемых у мышей, на людей. Напротив, исследования, разработанные для изучения таких вопросов на людях, неэтичны, а исследования с участием нечеловеческих приматов для этих исследований поднимают аналогичные моральные проблемы и также являются чрезмерно дорогими.
Таким образом, наш обзор не предназначен для рассмотрения всех оставшихся без ответа вопросов, касающихся значения материнской иммунной системы во время беременности и ее влияния на развитие плода.Скорее, наши цели состоят в том, чтобы выявить пробелы в знаниях и понимании темы из опубликованной литературы о различных видах и признать контексты, в которых различия исключают прямое сравнение с людьми. Однако, несмотря на эти различия, исследования, проведенные на других видах, таких как грызуны, действительно служат для определения возможных стратегий решения некоторых из этих оставшихся без ответа вопросов.
Кроме того, мы применяем междисциплинарный подход как соавторы, которые привносят клинические и фундаментальные научные перспективы и опыт в репродуктивных и иммунологических дисциплинах.Таким образом, мы обращаемся к темам, связанным с определением взаимодействия матери и плода, а также со значением иммунных ответов матери в регулировании ключевых ранних событий как во время беременности (например, имплантация, ангиогенез и ремоделирование сосудов), так и в развитии иммунной системы плода. система. Затем мы рассматриваем текущее понимание материнской толерантности к тканям плода и лежащих в основе клеточных и гуморальных иммунных механизмов. Наконец, мы исследуем клинические проявления измененной иммунной системы матери во время беременности, связанные с восприимчивостью к определенным вирусным, бактериальным и паразитарным инфекциям, а также к аутоиммунным расстройствам.
Описание и определение интерфейса матери и плода
Материнский: decidua
У женщин инвазия трофобласта обширна и охватывает эндометрий, а также внутреннюю треть миометрия. 2 Чтобы приспособиться к этому, должен произойти выраженный процесс ремоделирования, вовлекающий несколько клеточных отделов матки при подготовке к имплантации, а также к установлению и поддержанию беременности. Этот процесс, децидуализация, происходит у людей на циклической основе, начиная с середины ягодичной фазы менструального цикла, независимо от беременности.Напротив, у грызунов и большинства других видов децидуализация требует наличия бластоцисты. Термин децидуальная оболочка матери, таким образом, относится к слою слизистой оболочки матки (эндометрию) после того, как он подвергся децидуализации, необходимому и сложному процессу дифференцировки с участием множества клеточных компартментов эндометрия при подготовке к имплантации эмбриона.
Паренхиматозные клеточные компартменты децидуальной оболочки матери включают железистый эпителиальный компартмент, люминальный эпителиальный компартмент, эндотелий спиральных артерий и децидуализированные стромальные клетки, все из которых претерпевают резкую трансформацию при подготовке к беременности.Железистый эпителий приобретает повышенную секреторную активность под влиянием материнского прогестерона. 3 Драматическое ремоделирование спиральных артерий происходит во время децидуализации, что более подробно обсуждается позже в этом обзоре. Стромальные фибробласты эндометрия, которые претерпевают резкую морфологическую и биохимическую дифференцировку при подготовке к имплантации и поддержанию беременности, становятся известными как децидуальные клетки или децидуализированные стромальные клетки. Децидуализированные стромальные клетки больше не имеют характерной формы веретена стромального фибробласта эндометрия и вместо этого приобрели эпителиоидный фенотип, характеризующийся прогрессивным увеличением клеток, округлением ядра и расширением грубого эндоплазматического ретикулума и комплекса Гольджи, что согласуется с превращение в секреторную клетку. 3 Основные секреторные продукты децидуализированных стромальных клеток включают пролактин и белок-1, связывающий инсулиноподобный фактор роста, — отличительные белки, широко используемые в качестве фенотипических маркеров децидуализации. 4 Эти клетки также секретируют ряд цитокинов и факторов роста (например, интерлейкин [IL] -11, эпидермальный фактор роста [EGF], гепарин-связывающий EGF-подобный фактор роста), которые дополнительно регулируют процесс децидуализации в аутокринный и / или паракринный способ. 5
В дополнение к клеточным компартментам паренхимы, составляющим децидуальную оболочку матери, в эндометрии человека на протяжении всего менструального цикла существуют различные популяции иммунных клеток.На ранних сроках беременности лейкоциты в большом количестве, составляя 30-40% всех клеток децидуального стромального компартмента человека. 6 Базальный слой эндометрия человека содержит лимфоидные агрегаты, состоящие из Т-клеток и небольшого количества В-клеток. В функциональном слое пролиферативной фазы небольшое количество маточных естественных киллеров (uNK), Т-клеток и макрофагов разбросано по стромальному компартменту. 7 Хотя количество Т-клеток и макрофагов остается в значительной степени неизменным на протяжении лютеиновой фазы и в процессе децидуализации, 7 наблюдается резкое увеличение количества постовуляций uNK-клеток, играющих критическую роль в подготовке эндометрий при беременности.Что касается популяций децидуальных иммунных клеток на ранних сроках беременности, исследования с использованием проточной цитометрии и иммуноокрашивания тканей человека демонстрируют, что большинство децидуальных лейкоцитов человека в первом триместре беременности представляют собой клетки uNK (~ 70%), за которыми следуют макрофаги (~ 20%). 8 Т-клетки составляют примерно 10–20% децидуальных лейкоцитов, а дендритные клетки (ДК) и В-клетки встречаются редко. 8 Как и у человека, uNK-клетки являются преобладающей популяцией лейкоцитов в децидуальной оболочке макака-резуса и мыши, но исследования по определению относительного количества других популяций лейкоцитов в децидуальной оболочке мыши отсутствуют.Функции каждого типа иммунных клеток на границе раздела матери и плода обсуждаются более подробно в этом обзоре, с особым вниманием к клеткам uNK.
Плод: плацента, оболочки плода (амнион и хорион)
Структурно поверхность раздела между слизистой оболочкой матки и экстраэмбриональными тканями обычно называют границей раздела матери и плода. Это представлено на рисунке 1, на котором изображены материнские иммунные клетки и трофобласт плода. 9
Рис. 1 Схематическое изображение интерфейса матери и плода человека, включая материнские иммунные клетки, такие как клетки естественных киллеров матки (uNK), макрофаги (преобладающие типы иммунных клеток) и Т-хелперные (Th) клетки, Т- цитотоксические (Tc) клетки, дендритные клетки, а также инвазивные клетки трофобласта. |
Внеэмбриональные клетки, находящиеся в непосредственном контакте с материнскими клетками, представляют собой клетки трофобласта, происходящие из слоя трофэктодермы, окружающего бластоцисту. У женщин инвазия трофобласта в спиральные артерии матери значительно увеличивает кровоток матки, приводит к прямому контакту материнской крови с клетками трофобласта плода и обеспечивает достаточную доставку питательных веществ и кислорода матери к плаценте. 10 Однако кровообращение матери и плода не смешивается. После прикрепления бластоцисты к просветному эпителию эндометрия клетки трофобласта проникают в децидуальную оболочку, как показано на рисунке 1. Трофобласт, состоящий из внутреннего слоя клеток (цитотрофобласт) и внешнего слоя клеток (синцитиотрофобласт), не дает начало самому плоду. , а скорее к плаценте и плодным оболочкам (амниону и хориону). Когда бластоциста и окружающий трофобласт вторгаются в децидуальную оболочку, один полюс бластоцисты остается ориентированным в направлении просвета эндометрия, а другой остается погребенным в децидуальной оболочке, которая разовьется в закрепляющие цитотрофобласты и ворсинчатые трофобласты, способствуя образованию плаценты, хориона , и амнион.Следует отметить видовые различия в степени инвазии клеток трофобласта, которые подробно описаны в других источниках. 11 В отличие от процесса у женщин, инвазия трофобластов минимальна у грызунов. 11,12
Значение иммунного ответа матери во время беременности
Подтипы иммунных клеток и их функциональное значение
Иммунные клетки, накапливающиеся в эндометрии человека во время децидуализации, играют важнейшие и разнообразные роли на стыке матери и плода, включая функции при имплантации, развитии плаценты и иммунитете против инфекционных заболеваний.Из всех популяций децидуальных лейкоцитов наиболее многочисленными являются фенотипически уникальные uNK-клетки. Эти клетки резко увеличиваются в количестве в эндометрии человека на 3–5-дневной постовуляции, составляя 25–40% лейкоцитов эндометрия до имплантации и ~ 70% децидуальных лейкоцитов в первом триместре. 7,8 Важно отметить, что uNK-клетки фенотипически и функционально отличаются от периферических NK-клеток. Фенотипически они идентифицируются по экспрессии маркера NK-клеток CD56, экспрессируемого в высоких концентрациях (CD56 яркий ), но у них отсутствует экспрессия CD16, обнаруживаемая в большинстве периферических NK-клеток (CD56 dim CD16 + ). 7 С точки зрения функции периферические NK-клетки CD56 dim CD16 + обладают высокой цитотоксичностью, опосредуя как естественное, так и антитело-зависимое уничтожение, тогда как uNK-клетки обладают лишь слабой цитотоксичностью и обычно не убивают клетки трофобластов. 13 Кроме того, uNK-клетки являются мощным источником иммунорегуляторных цитокинов, 14 матриксных металлопротеиназ (ММП), 15 и ангиогенных факторов. 16 Эти различные факторы опосредуют ремоделирование внеклеточного матрикса, инвазию трофобластов и ангиогенез, которые являются ключевыми процессами в плацентации и наступлении беременности на ранних сроках на границе раздела матери и плода. 17
В дополнение к uNK-клеткам, децидуальные макрофаги относительно многочисленны, составляя ~ 20% популяции децидуальных лейкоцитов человека в первом триместре. 8 При нормальной беременности большинство макрофагов на границе раздела матери и плода имеют фенотип M2 (иммуномодулирующий). 18 Присутствуют в децидуальной оболочке до появления вневорсинчатого трофобласта. 19 макрофаги играют роль в раннем ремоделировании спиральной артерии, продуцируя факторы, связанные с ремоделированием ткани (ММР-9) и ангиогенезом (фактор роста эндотелия сосудов [VEGF]). 18 Апоптоз является важным событием во время ремоделирования спиральной артерии и инвазии трофобластов, и децидуальные макрофаги фагоцитируют апоптотические клетки в реконструированной сосудистой стенке и апоптотические клетки трофобласта, тем самым предотвращая высвобождение провоспалительных веществ из апоптотических клеток в децидуальную оболочку. 20 Децидуальные макрофаги в первом триместре беременности также могут быть ответственны за ингибирование опосредованного uNK-клетками лизиса инвазивного цитотрофобласта, опосредованного децидуальной секрецией трансформирующего фактора роста-бета-1 (TGF-²1), как было продемонстрировано в исследованиях in vitro на людях. . 21 В отличие от человеческих uNK-клеток, количество которых достигает пика на 20 неделе беременности и почти отсутствует в децидуальной оболочке в срок, 12 децидуальных макрофагов присутствуют на протяжении всей беременности, но точная роль децидуальных макрофагов в конце беременность остается неизвестной. 18
Т-клеток также довольно широко распространены в децидуальной оболочке человека, составляя ~ 10–20% популяции децидуальных лейкоцитов человека, 22,23 из которых 30–45% составляют CD4 + Т-клетки и 45% — 75% — это CD8 + Т-клетки. 23 Основная функция Т-клеток в децидуальной оболочке, особенно CD4 + Т-регуляторных (Treg) клеток, обычно считается стимулированием толерантности к плоду 24 (подробно обсуждается ниже в этой статье). рассмотрение). Однако из-за того, что присутствует множество различных подмножеств Т-клеток, сложные взаимодействия Т-клеток в децидуальной оболочке полностью не определены. 25 Исследования in vitro CD8 + Т-клеток на людях, выделенных из децидуальной оболочки первого триместра, демонстрируют, что эти клетки проявляют цитотоксическую активность, а также продукцию цитокинов (преимущественно интерферон-гамма [IFN-γ] и IL-8). 26 Поскольку супернатанты децидуальных CD8 + Т-клеток увеличивают инвазивную способность вневорсинчатых клеток трофобласта in vitro, секретируемые продукты Т-клеток CD8 + могут играть роль в регуляции инвазии трофобластов, но точных медиаторов пока нет. были идентифицированы. 26
ДК, представляющие собой антигенпрезентирующие клетки, играющие важную роль в регуляции адаптивного иммунного ответа, составляют очень небольшую часть децидуальных лейкоцитов человека.Однако не существует единого специфического маркера для DCs, и поэтому их фенотипическое определение является спорным, что ограничивает существующие исследования децидуальных DCs. 27 Используя статус отрицательного по клону и статуса DR-положительного по антигену лейкоцитов человека (HLA-DR + ) в качестве комбинированного маркера для ДК, Гарднер и Моффетт 28 продемонстрировали, что децидуальные ДК составляют ~ 1% от человеческих клеток в первом триместре. децидуальные лейкоциты. Из-за редкости этой клеточной популяции функциональные исследования децидуальных ДК человека немногочисленны.Исследования in vitro на людях продемонстрировали, что децидуальные ДК, выделенные из децидуальной оболочки на ранних сроках беременности, с большей вероятностью, чем периферические ДК, направляют наивные CD4 + Т-клетки в фенотип Th3, что предполагает потенциальную роль децидуальных ДК в предотвращении Th2-опосредованного отторжения плод. 29 Децидуальные DCs, по-видимому, также регулируют функцию uNK-клеток, поскольку совместное культивирование децидуальных DC с uNK-клетками стимулирует пролиферацию и активацию uNK-клеток. 30 Функциональные исследования децидуальных ДК in vivo существуют только на мышах и являются более окончательными.Децидуальные DC-истощенные мыши обнаруживают серьезные нарушения имплантации, нарушение децидуальной пролиферации и дифференцировки, нарушение ангиогенеза, нарушение дифференцировки uNK клеток и резорбцию эмбрионов. 31,32 Следовательно, по крайней мере, у мышей децидуальные DCs играют важную роль в децидуализации и установлении и поддержании ранней беременности.
Механизмы, с помощью которых иммунные клетки (фокус: клетки uNK) регулируют ключевые ранние события в установлении беременности: имплантация, ангиогенез и ремоделирование сосудов
uNK-клетки регулируют инвазию трофобластов
Исследования, проведенные Hanna et al. 33 , предоставили убедительные доказательства того, что человеческие uNK-клетки играют роль в регуляции инвазии трофобластов.Эти исследователи продемонстрировали, что клетки uNK, выделенные из децидуальной оболочки человека в первом триместре, экспрессируют хемокины IL-8 и IFN-индуцибельный белок (IP) -10, и что очищенные инвазивные трофобласты человека экспрессируют хемокиновые рецепторы для этих лигандов: CXCR1 (рецептор IL-8). ) и CXCR3 (рецептор IP-10). Способность uNK-клеток, но не NK-клеток периферической крови, индуцировать миграцию трофобластов в анализе миграции трофобластов in vitro была значительно снижена в присутствии нейтрализующих антител к IL-8 и IP-10.Эти исследователи впоследствии провели исследования in vivo, в которых субпопуляции NK-клеток, встроенные в матригель, вводили в подкожные ткани голых мышей, а клетки трофобласта человека вводили вокруг пробки матригеля. Эти эксперименты in vivo дополнительно продемонстрировали, что маточные, но не периферические NK-клетки способствуют инвазии трофобластов, и что миграция клеток трофобласта в пробку Matrigel значительно снижается в присутствии нейтрализующих IL-8 и IP-10 антител.В целом, эти исследования продемонстрировали способность uNK-клеток положительно регулировать инвазию трофобласта, опосредованную цитокинами, производными uNK IL-8 и IP-10. 33 Однако инвазия трофобластов в децидуальную оболочку матери должна строго регулироваться. Баланс факторов, участвующих в регуляции инвазии, еще точно не определен. Чрезмерная инвазия предрасполагает к срастанию плаценты, потенциально опасному для жизни акушерскому состоянию, при котором плацента ненормально прикрепляется к миометрию матки. 34 Интересно, что человеческие uNK-клетки также обладают способностью ингибировать инвазию трофобластов, как продемонстрировано Lash et al. 35 с использованием анализов инвазии Matrigel in vitro. Эти исследователи продемонстрировали, что человеческие uNK-клетки, выделенные из децидуальной оболочки ранней беременности человека, являются источником IFN-γ, который ингибирует инвазию трофобластов за счет увеличения апоптоза вневорсинчатых клеток трофобласта и снижения секреции трофобластом MMP-2. 35 Таким образом, точный баланс, необходимый для предотвращения недостаточного или чрезмерного вторжения трофобласта на ранних сроках беременности человека, регулируется, по крайней мере частично, различными цитокинами, происходящими из человеческих uNK-клеток, присутствующих в децидуальной оболочке.
Роль uNK-клеток в ангиогенезе и ремоделировании сосудов на ранних сроках беременности
У людей должно происходить обширное ремоделирование сосудов, чтобы обеспечить возможность плацентации и установления ранней беременности, а также для удовлетворения потребностей растущего плода. Децидуальные спиральные артерии должны быть преобразованы в сосуды большего диаметра с низким сопротивлением и высоким потоком, способные транспортировать питательные вещества и кислород к плоду. 22 Кроме того, эндотелий этих сосудов заменяется вневорсинчатыми клетками трофобласта, которые мигрировали из плаценты, что позволяет отводить кровоток в пространство, окружающее ворсинчатое дерево плаценты, и тем самым обеспечивая обмен питательными веществами и газами между матерью и плодом. 36 Не только адекватное ремоделирование сосудов имеет решающее значение для установления нормальной беременности, но и аномалии этих ранних событий связаны с более поздними осложнениями беременности, такими как преэклампсия и ограничение внутриутробного развития, которые могут иметь большое влияние на здоровье плода и новорожденного . 34
Критическая роль клеток uNK в ремоделировании сосудов была продемонстрирована в исследованиях in vivo на мышах и in vitro на людях. Однако важно отметить значительные различия между видами в плане стратегий увеличения кровотока к месту материнско-плацентарного обмена.У людей происходит обширная инвазия и разрушение уже существующих артерий трофобластом. У нечеловеческих приматов, таких как макаки-резусы, происходит трофобластическая инвазия и модификация маточных артерий, но в отличие от людей, инвазия децидуальной стромы трофобластом у макак-резусов происходит лишь в минимальной степени. 12 У мышей степень проникновения трофобласта как в децидуальную строму, так и в маточные артерии еще более ограничена. 12 Таким образом, модели грызунов имеют ограниченную ценность в улучшении нашего понимания механизмов ремоделирования сосудов, которые способствуют беременности у человека.Тем не менее, есть исследования in vivo, проводимые на мышах, которые невозможно провести на людях, и доступность нечеловеческих приматов для таких исследований in vivo на ранних сроках беременности ограничена. Следовательно, большая часть существующих данных о функциях клеток uNK при ремоделировании сосудов получена из исследований на мышах.
Множественные исследования in vivo на мышах демонстрируют, что клетки uNK играют решающую роль в ремоделировании спиральных артерий эндометрия как до, так и во время беременности. Самые ранние исследования, демонстрирующие критическую роль uNK-клеток в ремоделировании сосудов во время беременности, были проведены Guimond et al, 37 , которые продемонстрировали несколько репродуктивных аномалий у мышей линии Tgµ26, дефицитных по NK-клеткам.У мышей с дефицитом NK-клеток были продемонстрированы множественные сосудистые аномалии, связанные с участками имплантации, включая утолщение среды и адвентицию, повреждение эндотелия, уменьшение размера плаценты и начало гибели плода на 10-й день беременности. Последующие исследования в той же лаборатории 38 показали, что трансплантация костного мозга от мышей с тяжелым комбинированным иммунодефицитом (у которых отсутствуют Т- и В-лимфоциты, но не NK-клетки) мышам с дефицитом NK-клеток приводила к восстановлению популяции uNK-клеток у реципиентов. , уменьшение аномалий децидуальных кровеносных сосудов, увеличение размеров плаценты и восстановление жизнеспособности плода.В целом, эти исследования убедительно подтверждают критическую роль мышиных uNK-клеток в децидуализации, плаценте и соответствующей васкуляризации мест имплантации.
Роль uNK-клеток мышей в ремоделировании и децидуализации сосудов, по-видимому, опосредуется через IFN-γ, поскольку трансгенные мыши, у которых отсутствует IFN-γ или его рецептор, не могут инициировать модификацию децидуальных артерий и проявляют некроз децидуальных клеток, а также лечение NK -дефицитные мыши с рекомбинантным IFN-γ восстанавливают децидуальную морфологию и инициируют модификацию децидуальных сосудов. 39,40 Однако, регулируют ли человеческие uNK-клетки ремоделирование децидуальных сосудов посредством IFN-γ, еще предстоит окончательно определить. Данные относительно экспрессии IFN-γ человеческими uNK-клетками противоречивы, вероятно, из-за различий в методологии исследований и статуса цитокиновой стимуляции исследуемых uNK-клеток. Доказательства продукции IFN-γ в нестимулированных клетках uNK человека ограничены, но после воздействия стимулирующих цитокинов, таких как IL-2, IL-12 или IL-15, клетки uNK человека, выделенные из децидуальной оболочки первого триместра, демонстрируют значительно повышенное содержание IFN- γ-секреция. 41,42 Кроме того, поскольку IFN-γ быстро секретируется после продуцирования, а экспрессия мРНК и белка IFN-γ человеческими uNK-клетками быстро снижается через 24–48 часов в культуре, 35 противоречивые данные относительно IFN-γ экспрессия человеческими uNK-клетками может быть связана с длительностью культивирования до измерения. В модели ранних беременностей приматов, отличных от человека, основная популяция клеток CD56 ярких uNK, выделенных из децидуальной оболочки макаки резус на ранних сроках беременности, не является источником IFN-γ. 43 Таким образом, хотя существуют убедительные доказательства в поддержку роли IFN-γ в ремоделировании децидуальных сосудов у грызунов, остается неясным, играет ли происходящий из клеток uNK IFN-γ одинаково важную роль в ремоделировании сосудов у людей и приматов.
Скорее, открытие, что человеческие uNK-клетки, выделенные из децидуальной оболочки первого триместра, являются мощным источником ангиогенных факторов ангиопоэтина (Ang) 1, Ang2, VEGF и PLGF 16,33 подтверждает важную роль этих клеток в сосудистой системе. ремоделирование, необходимое для успешной беременности человека.Функциональные исследования, проведенные Hanna et al. 33 , продемонстрировали, что человеческие uNK-клетки, выделенные из децидуальной оболочки первого триместра, являются мощными секреторами ангиогенных факторов, таких как VEGF и фактор роста плаценты (PLGF). Супернатанты, полученные из человеческих маточных (но не периферических) NK-клеток, способствовали ангиогенезу in vitro, о чем свидетельствует повышенная способность эндотелиальных клеток пуповинных сосудов человека образовывать сетчатые структуры — процесс, ингибируемый в присутствии VEGF- и PLGF-нейтрализующих белков. .Кроме того, эти исследователи 33 продемонстрировали способность uNK-клеток человека in vivo стимулировать ангиогенез и рост опухолевых клеток хориокарциномы трофобласта человека (JEG-3) при подкожном введении мышам nude. In vivo ангиогенные свойства uNK-клеток ингибировались в присутствии VEGF- и PLGF-нейтрализующего белка. Эти исследования предоставляют убедительные доказательства того, что ангиогенные свойства человеческих uNK-клеток опосредуются, по крайней мере частично, их секрецией VEGF и PLGF.
Влияние иммунного ответа матери на развитие иммунной системы плода
Убедительные клинические данные показывают, что у детей матерей, подвергшихся воздействию определенных инфекционных организмов во время беременности, значительно выше частота неврологических расстройств, 44–53 , включая шизофрению и расстройства аутистического спектра. В таких сценариях этиология этих расстройств была связана с активацией воспалительных / иммунных ответов матери (обзор Jonakait 54 и Patterson 55 ).Исследования на грызунах, в которых иммунная система матери активируется во время беременности, повторяют эти клинические данные и предоставляют проверенные мышиные модели этих заболеваний. 46,47,51,56–66 Таким образом, иммуностимуляция матери во время беременности действует как фактор риска окружающей среды, который влияет на развитие мозга и иммунной системы у потомства.
Механизмы, лежащие в основе этих явлений, были изучены в основном на моделях пренатальных грызунов, в которых беременным самкам вводили инфекционные патогены или синтетические агенты, имитирующие вирусные или бактериальные инфекции (а именно, липополисахариды и полиинозин: полицитидиловая кислота [поли (I: C) )]).Потомки таких иммуностимулированных беременных самок демонстрируют иммунную дисрегуляцию и поведенческие аномалии, а также химические и структурные аномалии мозга, которые аналогичны тем, которые наблюдаются у людей с шизофренией и расстройствами аутистического спектра. 63,67–72
Происходит временное повышение цитокинов (IL-1, IL-6, IL-12, фактор некроза опухоли альфа [TNF-α], фактор, стимулирующий колонии гранулоцитов-макрофагов) в крови и амниотической жидкости иммуностимулированных беременных самок, 73,74 , который, по-видимому, влияет на развитие иммунной системы плода, концепция, известная как «программирование плода». 75–79 Mandal et al. 73,74,80 также показали, что потомство иммуностимулированных беременных самок демонстрирует ускоренное развитие и повышенную чувствительность Th2, Th27 и субпопуляций цитотоксических эффекторных Т-клеток, что указывает на провоспалительный фенотип у этих потомков. .
Мы предположили, что внутриутробное воздействие на плод цитокинов, вызванных материнской иммунной стимуляцией, действует как «первый удар», влияющий на программирование иммунной системы плода, которое сохраняется в постнатальном периоде и в зрелом возрасте.Такие изменения нормального программирования плода приводят к развитию «провоспалительного» фенотипа, и при последующем постнатальном воздействии иммунного стимула (т. Е. Второй удар) потомство иммуностимулированных беременных самок демонстрирует усиленные ответы по сравнению с потомками забуференных фосфатом плотины, инъецированные физиологическим раствором (PBS). Такой сценарий также согласуется с концепцией «множественных ударов» психических расстройств. 81,82 В контексте нарушений развития нервной системы это будет означать, что аномалии поведения и иммунная дисрегуляция, наблюдаемые у некоторых затронутых детей, могут отражать такое измененное программирование плода, которое проявляется постнатально при встрече со вторым ударом (например, инфекцией) их ребенка. иммунная система.Мы проверили эту гипотезу на взрослых потомках иммуностимулированных беременных самок с использованием хорошо задокументированных экспериментальных моделей in vivo, которые включают активацию врожденной и / или адаптивной иммунной системы. В каждой из этих моделей взрослое потомство иммуностимулированных самок демонстрировало более устойчивый воспалительный ответ, чем взрослое потомство контрольных самок, которым вводили PBS. 73,83 Таким образом, потомство от иммуностимулированных самок демонстрирует аномалии поведения, напоминающие аномалии, наблюдаемые у людей с некоторыми нарушениями психического развития, такими как шизофрения и аутизм.В дополнение к своим поведенческим аномалиям, наши исследования показывают, что в результате внутриутробного воздействия продуктов материнской иммунной стимуляции эти взрослые потомки также демонстрируют «провоспалительный» фенотип, который дает уязвимость для развития иммуноопосредованной патологии после рождения и во взрослом возрасте. . 73,74,80
В этом отношении результаты, полученные в ходе наших исследований на мышах, предоставили научное обоснование для продолжающегося проекта трансляционных исследований, чтобы определить, задействованы ли аналогичные молекулярно-патогенные механизмы в когорте детей-аутистов, которые также демонстрируют диагностические доказательства иммунной дисрегуляции. 84 Используя ДНК, полученную из базы данных обмена генетическими ресурсами по аутизму, мы начали исследование, чтобы определить, встречаются ли полиморфизмы в выбранных генах материнских цитокинов чаще у матерей этих аутичных детей. Наши результаты показывают, что матери детей с аутизмом в этой когорте имеют значительно более высокие частоты полиморфизмов генов провоспалительных цитокинов, что обеспечивает генетическую способность более энергично реагировать на иммунную стимуляцию, производя типы и количество цитокинов, которые способствуют воспалительным реакциям.Более того, анализ предварительных данных о потомстве показывает, что аутичные дети этих матерей наследуют материнский генотип. Таким образом, результаты, полученные в результате нашего исследования экспериментальной пренатальной мышиной модели материнской иммунной стимуляции во время беременности 73 , по-видимому, имеют биологическое значение для человека.
Толерантность матери и плода
Биллингем и др. 1 в 1953 г. первыми предложили концепцию иммунной толерантности во время беременности.Они выдвинули гипотезу о том, что полуаллогенный плод может выжить благодаря регуляции иммунологических взаимодействий между матерью и плодом. Такая регуляция может быть вызвана отсутствием экспрессии антигена плода и / или функциональным подавлением материнского иммунного ответа. 1
HLA, которые экспрессируются в плодных оболочках, являются толерогенными, а не иммуногенными, 85 и экспрессия белков главного комплекса гистосовместимости (MHC) на границе раздела мать-плод жестко регулируется во время беременности. 86 Гены MHC класса I подразделяются на классы Ia и Ib. MHC класса Ia далее подразделяется на HLA-A, B и C, а класс Ib подразделяется на HLA-E, F и G. Гены HLA класса II (HLA-D) не транслируются в клетках трофобласта человека. 87 Клетки трофобласта человека экспрессируют одну молекулу MHC класса Ia (HLA-C) и все молекулы MHC класса Ib. В плаценте человека клетки трофобласта плода не экспрессируют молекулы MHC класса Ia (HLA-A и B), которые отвечают за отторжение аллотрансплантатов у людей. 88,89 Взаимодействия между HLA-C и децидуальными NK-клетками также могут вызывать инфильтрацию трофобласта в материнскую ткань. Беременности с несовпадающим HLA-C плода демонстрируют большее количество активированных Т-клеток и функциональных Treg в децидуальных тканях по сравнению с беременностями, подобранными по HLA-C. 90 Это свидетельствует о том, что при неосложненной беременности децидуальные Т-клетки распознают фетальный HLA-C на границе раздела мать-плод, но не могут вызвать деструктивный иммунный ответ. 91
Что касается беременности, то один из наиболее важных вопросов — как избежать отторжения со стороны плода и плаценты.Несмотря на то, что на протяжении всей беременности происходит постоянное взаимодействие между клетками плода и матери, плод действует как привилегированный участок, защищенный от иммунного отторжения. 91 Экспрессия молекул MHC на клетках трофобластов подавляется у большинства видов как стратегия, позволяющая избежать распознавания и разрушения материнскими иммунными клетками. 92 Лимфоциты периферической крови беременных кобыл демонстрируют пониженную способность превращаться в эффекторные цитотоксические Т-лимфоциты. 93 Это снижение аллореактивности, опосредованной Т-клетками, возвращается к норме после прерывания беременности и не наблюдается у небеременных кобыл. Кроме того, было показано, что экстракты плаценты кобыл на 80-й день подавляют пролиферацию материнских лимфоцитов, а совместное культивирование клеток трофобласта с материнскими лимфоцитами вызывает снижение пролиферации и продукции цитокинов. 94
Клеточный иммунитет: механизмы, способствующие толерантности матери и плода
Смена Th2 – Th3 при беременности
Беременность — это сложное иммунологическое состояние, при котором мать должна переносить «чужой» плод и, следовательно, требует определенной степени иммуносупрессии.С другой стороны, мать должна поддерживать достаточную иммунную функцию, чтобы бороться с инфекцией. Одним из механизмов, который играет роль в поддержании успешной беременности, является переключение с профиля цитокинов Th2 на профиль Th3. Этот переключатель более заметен на границе раздела матери и плода. Клетки Th3 накапливаются в децидуальной оболочке, а DC матки могут побуждать наивные Т-клетки превращаться в клетки Th3. 95,96 Следовательно, переключение на фенотип Th3 происходит из-за миграции клеток Th3 и индукции клеток Th3 на границе раздела матери и плода, но в системной иммунной системе изменений мало. 96 Гипотеза преобладания Th3 и подавления Th2-ответа во время беременности была предложена Wegmann et al., 97 , что подтверждается исследованиями как на мышах, так и на людях. У мышей провоспалительные цитокины IFN-γ и TNF-α или стимуляция толл-подобных рецепторов вызывают выкидыш, который может быть отменен ингибиторами цитокинов Th2 или введением противовоспалительного IL-10 (цитокина Th3). 98 Однако IFN-γ также играет важную роль в ремоделировании сосудов на ранних сроках беременности мышей.Таким образом, кажется, что иммунитет Th2-типа контролируется, чтобы избежать чрезмерной стимуляции во время беременности. Прогестерон, эстрадиол, простагландин D2 (PGD2) и лейкемический ингибирующий фактор, образующийся во время беременности, способствуют профилю Th3 и частично ответственны за смещение Th3, связанное с нормальной беременностью. 96 Однако мыши с единичным нокаутом по цитокину Th3, такие как IL-4 — / — , IL-10 — / — 99 и мыши с одиночными, двойными, тройными и учетверенными делециями гена IL-4, ИЛ-5, ИЛ-9 и ИЛ-13 имеют нормальную беременность, что позволяет предположить, что преобладающий иммунитет типа Th3 может не иметь существенного значения для успешной беременности. 100
Повышение содержания цитокинов Th3 IL-4, IL-10 и моноцитарно-колониестимулирующего фактора в периферической крови и на границе раздела матери и плода связано с успешной беременностью. Трофобласт, децидуальная оболочка и амнион вносят вклад в среду, обусловленную цитокинами Th3, за счет продукции IL-13, IL-10, IL-4 и IL-6. 101–103 Было показано, что цитотрофобласты плаценты человека продуцируют иммуносупрессивный цитокин IL-10. 101 Кроме того, макрофаги и Treg, присутствующие в децидуальной оболочке во время беременности, также продуцируют IL-10 и участвуют в поддержании иммунной толерантности к аллогенным антигенам плода. 91 Плацента также продуцирует PGD2, который может действовать как хемоаттрактант для клеток Th3 на границе раздела матери и плода через рецептор Th3 CRTh3 (молекула, гомологичная рецептору хемоаттрактанта, экспрессируемая на клетках Th3). У женщин, страдающих повторной потерей беременности, экспрессия CRTh3 + клеток ниже, чем у женщин, перенесших плановое прерывание беременности. 104 Противовоспалительные цитокины ИЛ-4 и ИЛ-10 ингибируют клетки Th2 и макрофаги, которые, в свою очередь, предотвращают отторжение аллотрансплантата плода.Кроме того, эти цитокины также ингибируют TNF-α, циклооксигеназу-2 (COX-2) и простагландин E2 в клетках, полученных из амниона, что предотвращает начало родов. 24,105–107
Роды часто связаны с провоспалительным состоянием с обратным возвратом к Th2, а не Th3. Исследования указывают на увеличение провоспалительных цитокинов Th2 и снижение цитокинов Th3 у женщин, ведущих активный период родов. Оболочки плода, миометрий, амнион, околоплодные воды и децидуальная оболочка продуцируют провоспалительные цитокины IL-1² и TNF-α в срок и могут индуцировать ядерный фактор каппа B.Этот фактор транскрипции регулирует экспрессию связанных с родом генов, таких как COX-2, IL-8 и MMP-9, и запускает каскад событий, вызывающих роды. Несмотря на провоспалительную природу цитокинов Th2, они необходимы для успешной беременности, способствуя своевременным родам. 108–110
Роль Tregs в беременности
CD4 + CD25 + Tregs представляют собой субпопуляцию Т-клеток, ответственных за поддержание иммунологической самотолерантности путем подавления самореактивных лимфоцитов зависимым от клеточного контакта образом путем продукции TGF-² и IL-10. 111,112 Tregs экспрессируют фактор транскрипции, фактор транскрипции forkhead box (FoxP3), который действует как главный регулятор их развития и функции. 113 Существует два основных подмножества Treg: естественные или тимические Treg (tTreg) и индуцированные или экстратимические / периферические Treg (pTreg). tTregs представляют собой CD4 + CD25 + Foxp3 + и экспрессируют цитотоксический Т-лимфоцит-ассоциированный антиген 4. pTregs развиваются из наивных Т-клеток после воздействия антигенов на периферии и воздействия IL-10 или TGF-² и могут быть Foxp3- или Foxp3 + . 114,115 Благодаря своей иммуносупрессивной функции, Treg также играют ключевую роль во время беременности, поддерживая толерантность матери и плода.
Несколько исследований подтвердили увеличение Tregs во время беременности в крови, лимфатических узлах и тимусе с последующим снижением, начиная с середины беременности, до тех пор, пока они не достигнут уровня небеременных в срок или вскоре после этого. Они играют решающую роль в имплантации эмбриона и в поддержании материнской иммунной толерантности к полуаллогенным антигенам плода. 116 117 Данные свидетельствуют о том, что Treg во время беременности специфичны для отцовских аллоантигенов, которые защищают плод от отторжения иммунной системой матери. 118 Экспансия Tregs в децидуальной оболочке нормальных беременных женщин подавляет материнскую активность Th2 / Th27 в отношении полуаллогенного плода. 119
Эксперименты на мышах показали повышенные уровни Treg как в сингенных, так и в аллогенных спариваниях, что указывает на независимое от аллоантигена расширение Treg. 120 Экспансия Treg, по-видимому, регулируется эстрадиолом.Это подтверждается исследованиями in vitro, которые показывают, что физиологические уровни эстрадиола не только увеличивают количество Treg, но также стимулируют превращение CD4 + CD25- Т-клеток в CD4 + CD25 + Т-клетки. 121 С другой стороны, Zhao et al. 122 не наблюдали увеличения Treg у овариэктомированных мышей. Более того, они обнаружили большее количество Treg у беременных мышей от аллогенных по сравнению с сингенными спариваниями, что указывает на участие отцовских антигенов в экспансии Treg. 122 Недавно Робертсон и др. 123 показали, что семенная жидкость может управлять расширением Treg.Следовательно, как антиген-зависимые, так и антиген-независимые механизмы, вероятно, вовлечены в экспансию Treg.
Tregs экспрессируют различные хемокиновые рецепторы, лиганды которых экспрессируются на границе раздела матери и плода, что может вносить вклад в опосредованную хемокинами миграцию Tregs в децидуальную оболочку. 120 Более того, другие иммунные клетки продуцируют большие количества CCL17, CCL4 и CCL1, 124–126 , которые могут привлекать Tregs, специфически экспрессирующие CCR4 и CCR8. 127,128 Помимо хемокин-опосредованной миграции Treg, интегрины, подобные CD62L, по-видимому, играют важную роль в миграции Treg, поскольку нейтрализация CD62L-специфических антител блокирует экспансию Treg в дренирующих лимфатических узлах и приводит к отторжению аллотрансплантата.Schumacher et al. 129 показали важность человеческого хорионического гонадотропина как одного из основных аттрактантов Tregs на границе раздела матери и плода.
Aluvihare et al. 117 впервые отметили, что Tregs увеличиваются во всех лимфоидных органах при аллогенных вязках самок мышей C57BL / 6 с самцами CBA. Они также адоптивно перенесли лимфоциты от самок BALB / c, либо аллопеременных от самцов C57BL / 6, либо синпеременных от самцов BALB / c, самкам BALB / c с дефицитом Т-клеток, которые затем были скрещены с самцами C57BL / 6.Беременность протекала нормально при переносе целых популяций лимфоцитов. Напротив, лимфоциты, лишенные Treg, приводили к резорбции плода, и происходила массивная инфильтрация Т-клеток в места имплантации. 117 Zenclussen 130 и Zenclussen et al 131 продемонстрировали полную профилактику абортов в модели естественных самопроизвольных абортов CBA × DBA / 2J путем переноса Treg от аллоиммунизированных мышей, и они также сообщили, что в Контрольные вязки CBA × BALB / c и CBA × CBA.Наконец, Chen et al. , 116, продемонстрировали, что стимуляция Tregs, либо непосредственно низкой дозой IL-2, либо косвенно с помощью Fms-родственного лиганда тирозинкиназы 3, приводила к нормальной частоте наступления беременности у мышей CBA × DBA / 2J, склонных к абортам. Все результаты этих экспериментов демонстрируют, что при аллогенных вязках Treg необходимы для предотвращения материнского иммунного ответа против плода.
Клинические проявления измененной иммунной системы при беременности
Представление о беременности как измененном состоянии подавления иммунитета хорошо задокументировано. 132–136 Беременность — это период времени, который представляет собой риск повышенной восприимчивости к инфекционным заболеваниям, и материнская иммунная система несет исключительную ответственность за защиту от инфекционных микроорганизмов и защиту плода, поскольку реакция плода и плаценты ограничена. 132,136 Иммунные сдвиги Th2 / Th3 во время беременности хорошо известны и служат платформой для дальнейшего изучения иммунной системы. 136 Это привело к уточнению нашего понимания иммунной системы и разработке новой парадигмы в отношении беременности и иммунной функции.Эта новая теория предполагает, что иммунная система во время беременности представляет собой функциональную и активную систему, в которой существует не только материнский иммунный ответ, но и фетально-плацентарный иммунный ответ, который в сочетании является мощным средством защиты как матери, так и плода. 133,136 Согласно этому понятию, иммунная система не подавляется, а находится в модулированном состоянии, и, следовательно, это объясняет, почему у беременных женщин разные ответы на различные патогены. 133 Во время этой измененной реакции в плаценте генерируются сигналы, которые модулируют материнскую иммунную систему, чтобы вести себя уникальным образом по отношению к различным микроорганизмам. 133 Хотя эти старые и новые парадигмы, касающиеся иммунологии беременности, различаются, ясно, что цель иммунной системы во время беременности — обеспечить успешное протекание беременности, при этом обеспечивая защиту матери и плода от внешних патогенов.
Эндокринная регуляция иммунных клеток
Концентрации гормонов меняются в зависимости от начала беременности, и существуют определенные колебания уровней гормонов на протяжении каждого триместра беременности.В целом считается, что гормоны беременности подавляют материнскую реакцию, одновременно способствуя развитию толерантности. 137 Считается, что гормональные сдвиги уменьшают количество DC и моноцитов, снижают активность макрофагов, блокируя при этом NK-клетки, T-клетки и B-клетки. 137 Считается, что каждый из основных гормонов, связанных с беременностью, прямо или косвенно влияет на функцию основных иммунных клеток и, таким образом, влияет на иммунную среду во время беременности. Эти изменения обсуждаются в таблице 1.
Таблица 1 Эндокринная регуляция иммунных клеток и иммунная функция |
Доказательства изменения иммунной функции во время беременности: влияние инфекционных организмов на беременность
Изменения в иммунной системе во время беременности хорошо известны, и впоследствии эти изменения приводят к повышенной восприимчивости к определенным вирусным, бактериальным и паразитарным инфекциям. 132 Считается, что эта повышенная восприимчивость является результатом подавления клеточно-опосредованного иммунитета, поскольку беременность способствует переходу от иммунной среды Th2 к Th3. 132 134 Кроме того, документально подтверждено, что инфицирование определенными патогенами приводит к тяжелым симптомам у беременных пациенток из-за этих иммунных изменений. 133,138 Однако важно отметить, что при некоторых инфекционных заболеваниях среди беременных, заболеваемость и смертность варьируются в развитых и в развивающихся странах.Например, беременные женщины с ветряной оспой в США или Канаде чувствуют себя лучше, чем женщины с диагнозом ветряная оспа в слаборазвитых странах, где ресурсы ограничены. 139 Таким образом, при оценке тяжести болезненных состояний у беременных женщин в зависимости от географического распределения может возникнуть некоторая систематическая ошибка.
В Таблице 2 приведены наиболее известные и изученные патогены, связанные с беременностью. Как видно из таблицы 2, инфекционные заболевания во время беременности связаны не только с риском для матери, но и для плода.Эти эффекты у плода возникают в результате инфекций, проникающих через плаценту, которые могут вызвать выкидыш, врожденные аномалии или даже смерть плода. 133 В результате Американский конгресс акушеров и гинекологов и Центры США по контролю и профилактике заболеваний рекомендуют вакцинировать всех женщин от гриппа и столбняка, дифтерии и коклюша (Tdap) во время беременности. 140–142 Обе эти вакцины кажутся безопасными при введении во время беременности, с небольшим количеством побочных эффектов для матери и плода. 142 143 Напротив, живые вакцины, такие как вакцина против кори, паротита, краснухи (MMR) и ветряной оспы, не рекомендуются во время беременности из-за теоретических рисков для плода. 141 142
Таблица 2 Общие инфекционные организмы при беременности |
Риск инфицирования во время беременности — серьезная проблема не только для здоровья матери, но и для потенциальных рисков для плода, которые могут иметь долгосрочные последствия. Исследования на животных показали, что плацента может вызывать синдром воспалительной реакции плода (FIRS), который с точки зрения микробиологии является диагнозом плацентарной инфекции без роста организма. 133,136 FIRS является серьезным заболеванием и приводит к увеличению циркулирующих уровней цитокинов, таких как IL-1, IL-6, IL-8 и TNF-α. 133 Было продемонстрировано, что эти воспалительные сдвиги увеличивают риск аномалий плода, таких как вентрикуломегалия или кровоизлияния. Кроме того, исследования на людях продемонстрировали связь между FIRS и развитием аутизма, шизофрении, нейросенсорных нарушений и психоза. 133,136 Эти наблюдения дополнительно подтверждают экспериментальные модели мышей, описанные ранее, в которых иммуностимуляция индуцирует высокие уровни провоспалительных цитокинов в крови и околоплодных водах беременных самок, которые, вероятно, вовлечены в этиологию нарушений нервного развития, проявляющихся у их потомства. 63,72–74 Напротив, бактериальные инфекции, которые достигают децидуальной оболочки, вызывают провоспалительную реакцию, которая приводит к развитию внутриутробных инфекций. 144 Это происходит за счет активации рецепторов распознавания образов (PRR) и повышенной секреции цитокинов, таких как IL-1 и TNF-α. 145 В совокупности они способствуют неблагоприятным исходам беременности, нарушению внутриутробного развития плода или преждевременным родам, в результате которых рождаются дети с низкой массой тела. 146 147 Таким образом, важно признать, что беременность может вызвать повышенную восприимчивость к заболеваниям, что не только влияет на материнскую заболеваемость, но и способствует пагубным долгосрочным исходам для плода и новорожденного.
Доказательства изменения иммунной функции во время беременности: влияние беременности на аутоиммунные заболевания
Как уже говорилось, беременность вызывает сдвиг с Th2- на Th3-опосредованный иммунитет, и этот сдвиг влияет на статус болезни у женщин с известными аутоиммунными заболеваниями. В общем, гормональная среда, вызванная беременностью, смещает профиль цитокинов в сторону от клеточного иммунитета (иммунитет типа Th2) и, следовательно, улучшает аутоиммунные заболевания воспалительного типа. 132 Напротив, аутоиммунные заболевания, которые опосредованы гуморально (или антителами), обостряются, поскольку беременность способствует повышению активности, связанной с Th3, а также профиля цитокинов Th3. 132 148 Подробности см. В Таблице 3.
Таблица 3 Аутоиммунные заболевания при беременности |
Заключение и перспективы на будущее
Беременность у женщин — это динамическое состояние, в котором в разных триместрах используются различные механизмы, позволяющие обеспечить успешное установление, поддержание и своевременное прерывание беременности.Механизмы, действующие на ранних сроках беременности для установления беременности, могут отличаться от тех, которые необходимы для сохранения беременности, и от тех, которые необходимы для обеспечения успешных и своевременных родов и родов. Последние данные ставят под сомнение представление о том, что беременность — это просто иммуносупрессивное состояние, защищающее аллогенный плод от атак со стороны материнской иммунной системы. Данные свидетельствуют о том, что беременность скорее может быть состоянием повышенного врожденного иммунного ответа и сниженного клеточно-опосредованного ответа. Уникальные популяции децидуальных лимфоидных клеток активно способствуют развитию плаценты и толерантности плода.Хотя был достигнут значительный прогресс в понимании функции иммунных клеток во время беременности, особенно на ранних сроках беременности, все еще остаются без ответа многие вопросы, касающиеся регуляции их пролиферации и функции эндокринными и другими факторами. Опубликованные результаты исследований на людях и животных моделей ясно показывают, что тонкий баланс между провоспалительным и противовоспалительным влиянием имеет решающее значение для успешной беременности. Таким образом, будущая задача трансляционных исследований в репродуктивной иммунологии будет заключаться в более полном определении тех факторов, которые способствуют оптимальной иммунологической среде, способствующей здоровью и развитию плода на определенных этапах беременности, чтобы затем можно было разработать основанные на фактах регулирующие терапевтические стратегии.
Благодарности
Авторы благодарят Интин Чжан за помощь в написании рукописи. Мили Мандал в настоящее время связан с онкологией, отделом исследований и разработок, GlaxoSmithKline, Колледжвилл, Пенсильвания, США.
Раскрытие информации
Авторы сообщают об отсутствии конфликта интересов в этой работе.
Список литературы
1. | Billingham RE, Brent L, Medawar PB. Активно приобретается толерантность к чужеродным клеткам. Природа .1953. 172 (4379): 603–606. |
2. | Brosens JJ, Pijnenborg R, Brosens IA. Спиральные артерии зоны соединения миометрия при нормальной и патологической беременности: обзор литературы. Am J Obstet Gynecol . 2002. 187 (5): 1416–1423. |
3. | Gellersen B, Brosens IA, Brosens JJ. Децидуализация эндометрия человека: механизмы, функции и клинические перспективы. Semin Reprod Med . 2007. 25 (6): 445–453. |
4. | Геллерсен Б., Бросенс Дж. Перекрестное взаимодействие циклического АМФ и рецептора прогестерона в эндометрии человека: децидуализация. Дж Эндокринол . 2003. 178 (3): 357–372. |
5. | Dimitriadis E, White CA, Jones RL, Salamonsen LA. Цитокины, хемокины и факторы роста эндометрия, связанные с имплантацией. Обновление Hum Reprod .2005. 11 (6): 613–630. |
6. | Lash GE, Robson SC, Bulmer JN. Обзор: функциональная роль естественных киллеров матки (uNK) в децидуальной оболочке беременности у человека на ранних сроках. Плацента . 2010; 31 (Дополнение): S87 – S92. |
7. | Кинг А. Лейкоциты матки и децидуализация. Обновление Hum Reprod . 2000. 6 (1): 28–36. |
8. | Балмер Дж. Н., Моррисон Л., Лонгфеллоу М., Ритсон А., Пейс Д.Гранулированные лимфоциты эндометрия человека: гистохимические и иммуногистохимические исследования. Репродукция Человека . 1991. 6 (6): 791–798. |
9. | Weiss G, Goldsmith LT, Taylor RN, Bellet D, Taylor HS. Воспаление при репродуктивных нарушениях. Репродукция науки . 2009. 16 (2): 216–229. |
10. | Моффетт А., Колуччи Ф. NK-клетки матки: активные регуляторы на границе раздела матери и плода. Дж. Клин Инвест . 2014; 124 (5): 1872–1879. |
11. | Моффетт А., Лок С. Иммунология плацентации у человеческих млекопитающих. Нат Рев Иммунол . 2006. 6 (8): 584–594. |
12. | Моффет-Кинг А. Естественные клетки-киллеры и беременность. Нат Рев Иммунол . 2002. 2 (9): 656–663. |
13. | Кинг А., Биркби С., Локи Ю.В.Ранние децидуальные клетки человека проявляют активность NK против линии клеток K562, но не против трофобласта первого триместра. Cell Immunol . 1989. 118 (2): 337–344. |
14. | Купман Л.А., Копков Х.Д., Рыбалов Б и др. Децидуальные естественные клетки-киллеры человека представляют собой уникальное подмножество NK-клеток с иммуномодулирующим потенциалом. J Exp Med . 2003. 198 (8): 1201–1212. |
15. | Нарус К., Лэш Г.Е., Иннес Б.А. и др.Локализация матриксной металлопротеиназы (MMP) -2, MMP-9 и тканевых ингибиторов MMP (TIMP) в естественных клетках-киллерах матки на ранних сроках беременности человека. Репродукция Человека . 2009. 24 (3): 553–561. |
16. | Lash GE, Schiessl B, Kirkley M, et al. Экспрессия ангиогенных факторов роста естественными клетками-киллерами матки на ранних сроках беременности. Дж Леукок Биол . 2006. 80 (3): 572–580. |
17. | Ягель С.Роль естественных киллерных клеток на стыке плода и матери в развитии. Am J Obstet Gynecol . 2009. 201 (4): 344–350. |
18. | Faas MM, Spaans F, De Vos P. Моноциты и макрофаги при беременности и преэклампсии. Фронт Иммунол . 2014; 5: 298. |
19. | Смит С.Д., Данк К.Э., Аплин Д.Д., Харрис Л.К., Джонс Р.Л. Доказательства участия иммунных клеток в ремоделировании децидуальных спиральных артериол на ранних сроках беременности человека. Ам Дж. Патол . 2009. 174 (5): 1959–1971. |
20. | Абрахамс В.М., Ким Ю.М., Страшевски С.Л., Ромеро Р., Мор Г. Макрофаги и клиренс апоптозных клеток во время беременности. Am J Reprod Immunol . 2004. 51 (4): 275–282. |
21. | Co EC, Gormley M, Kapidzic M, et al. Материнские децидуальные макрофаги ингибируют уничтожение инвазивных цитотрофобластов NK-клетками во время беременности человека. Биол Репрод . 2013; 88 (6): 155. |
22. | Уоллес А.Е., Фрейзер Р., Картрайт Дж. Экстраворсинчатый трофобласт и децидуальные естественные клетки-киллеры: ремоделирующее партнерство. Обновление Hum Reprod . 2012. 18 (4): 458–471. |
23. | Нэнси П., Эрлебахер А. Поведение Т-клеток на границе раздела матери и плода. Инт Дж Дев Биол . 2014. 58 (2–4): 189–198. |
24. | Piccinni MP. Толерантность к аллотрансплантату плода. Дж Репрод Иммунол . 2010. 85 (1): 71–75. |
25. | Балмер Дж. Н., Уильямс П. Дж., Лэш Дж. Э. Иммунные клетки в плацентарном ложе. Инт Дж Дев Биол . 2010. 54 (2–3): 281–294. |
26. | Scaife PJ, Bulmer JN, Robson SC, Innes BA, Searle RF. Эффекторная активность децидуальных CD8 + Т-лимфоцитов на ранних сроках беременности человека. Биол Репрод . 2006. 75 (4): 562–567. |
27. | Hsu P, Nanan RK. Врожденные и адаптивные иммунные взаимодействия на границе плод-мать при беременности здорового человека и преэклампсии. Фронт Иммунол . 2014; 5: 125. |
28. | Гарднер Л., Моффет А. Дендритные клетки децидуальной оболочки человека. Биол Репрод . 2003. 69 (4): 1438–1446. |
29. | Миядзаки С., Цуда Х., Сакаи М. и др. Преобладание Th3-промотирующих дендритных клеток в децидуальной оболочке ранней беременности человека. Дж Леукок Биол . 2003. 74 (4): 514–522. |
30. | Ласкарин Г., Редзович А., Рубеса З. и др. Настройка децидуальных естественных клеток-киллеров аутологичными дендритными клетками. Am J Reprod Immunol . 2008. 59 (5): 433–445. |
31. | Плакс В., Бирнберг Т., Беркутцки Т. и др.Маточные DCs имеют решающее значение для образования децидуальной оболочки во время имплантации эмбриона мышам. Дж. Клин Инвест . 2008. 118 (12): 3954–3965. |
32. | Крей Г., Франк П., Шайкли В. и др. Истощение дендритных клеток in vivo снижает эффективность размножения, влияя на имплантацию и раннее развитие плаценты у мышей. Дж Мол Мед (Берл) . 2008. 86 (9): 999–1011. |
33. | Hanna J, Goldman-Wohl D, Hamani Y, et al.Децидуальные NK-клетки регулируют ключевые процессы развития на стыке плода и матери человека. Нат Мед . 2006. 12 (9): 1065–1074. |
34. | Norwitz ER. Неправильная имплантация и плацентация: закладывают основу для осложнений беременности. Репродукция Биомед Интернет . 2007. 14 Спец. № 1: 101–109. |
35. | Lash GE, Otun HA, Innes BA, et al. Интерферон-гамма подавляет инвазию вневорсинчатых клеток трофобласта с помощью механизма, который включает как изменения апоптоза, так и уровни протеазы. FASEB J . 2006. 20 (14): 2512–2518. |
36. | Эрлебахер А. Иммунология взаимодействия матери и плода. Анну Рев Иммунол . 2013; 31: 387–411. |
37. | Guimond MJ, Luross JA, Wang B, Terhorst C, Danial S, Croy BA. Отсутствие естественных клеток-киллеров во время беременности мышей связано с репродуктивным нарушением у мышей TgE26. Биол Репрод . 1997. 56 (1): 169–179. |
38. | Гимонд М.Дж., Ван Б., Крой Б.А. Приживление костного мозга мышей с тяжелым комбинированным иммунодефицитом (SCID) устраняет репродуктивный дефицит у мышей tg epsilon 26 с дефицитом естественных клеток-киллеров. J Exp Med . 1998. 187 (2): 217–223. |
39. | Ashkar AA, Di Santo JP, Croy BA. Гамма-интерферон способствует инициации модификации сосудов матки, децидуальной целостности и созреванию естественных клеток-киллеров матки во время нормальной беременности мышей. J Exp Med . 2000. 192 (2): 259–270. |
40. | Monk JM, Leonard S, McBey BA, Croy BA. Индукция модификации спиральной артерии мыши рекомбинантным человеческим гамма-интерфероном. Плацента . 2005. 26 (10): 835–838. |
41. | Manaster I, Gazit R, Goldman-Wohl D, et al. Активация Notch усиливает секрецию IFN-гамма периферической кровью человека и децидуальными NK-клетками. Дж Репрод Иммунол .2010. 84 (1): 1–7. |
42. | Vigano P, Gaffuri B, Somigliana E, Infantino M, Vignali M, Di Blasio AM. Интерлейкин-10 вырабатывается естественными клетками-киллерами матки человека, но не влияет на выработку ими гамма-интерферона. Мол Хум Репрод . 2001; 7 (10): 971–977. |
43. | Дамбаева С.В., Дурнинг М., Рознер А.Е., Голос Т.Г. Иммунофенотип и цитокиновые профили децидуальных естественных клеток-киллеров CD56bright и CD56dim макаки-резуса. Биол Репрод . 2012; 86 (1): 1–10. |
44. | Croonenberghs J, Bosmans E, Deboutte D, Kenis G, Maes M. Активация системы воспалительного ответа при аутизме. Нейропсихобиология . 2002; 45: 1–6. |
45. | Дейкин Э., МакМахон Б. Вирусное воздействие и аутизм. Am J Epidemiol . 1979; 109: 628–638. |
46. | Hagberg H, Mallard C.Влияние воспаления на развитие и уязвимость центральной нервной системы: обзор. Curr Opin Neurol . 2005. 18: 117–123. |
47. | Hornig M, Weissenbock H, Horscroft N, Lipkin WI. Инфекционная модель повреждения нервной системы. Proc Natl Acad Sci . 1999; 96: 12101–12107. |
48. | Липкин В., Хорниг М. Микробиология и иммунология расстройств аутистического спектра. Новартис Найдено Symp . 2003. 251: 129–143. |
49. | Малек-Ахмади П. Цитокины и этиопатогенез общих нарушений развития. Медицинские гипотезы . 2001. 56 (3): 321–324. |
50. | Пардо К., Эберхарт К. Нейробиология аутизма. Brain Pathol . 2007. 17: 434–447. |
51. | Паттерсон П.Материнская инфекция: окно нейроиммунных взаимодействий в развитии мозга плода и психических заболеваниях. Curr Opin Neurobiol . 2002; 12: 115–118. |
52. | Коричневый AS. Пренатальная инфекция как фактор риска шизофрении. Шизофр Бык . 2006. 32 (2): 200–202. |
53. | Коричневый А.С., Деркиц Э. Пренатальная инфекция и шизофрения: обзор эпидемиологических и трансляционных исследований. Am J Psychiatry . 2010. 167 (3): 261–280. |
54. | Йонакайт Г. Влияние материнского воспаления на развитие нейронов: возможные механизмы. Инт Дж. Дев Neurosci . 2007. 25: 415–425. |
55. | Паттерсон PH. Материнская инфекция и поражение иммунной системы при аутизме. Trends Mol Med . 2011; 17: 389–394. |
56. | Белл М., Халленбек Дж. Влияние внутриутробного воспаления на развивающийся мозг крысы. J Neurosci Res . 2002; 70: 570–579. |
57. | Carvey P, Chang Q, Lipton J, Ling Z. Пренатальное воздействие липополисахарида бактериотоксина приводит к долгосрочным потерям дофаминовых нейронов у потомства: потенциальная новая модель болезни Паркинсона . Передний Biosci . 2003; 8: s826 – s837. |
58. | Fatemi SH, Earle J, Kanodia R et al. Пренатальная вирусная инфекция приводит к атрофии пирамидных клеток и макроцефалии во взрослом возрасте: последствия для генеза аутизма и шизофрении. Клин Мол Нейробиол . 2002; 22: 25–33. |
59. | Хорниг М., Сольбриг М., Хорскрофт Н., Вайссенбок Х., Липкин В. Инфекция вирусом болезни Борна взрослых и новорожденных крыс: модели нейропсихиатрического заболевания. Curr Top Microbiol Immunol .2001; 253: 157–177. |
60. | Плетников М.В., Джонс М.Л., Рубин С.А., Моран TH, Карбон КМ. Модель расстройств аутистического спектра на крысах. Влияние генетического фона на развитие повреждений мозга, вызванных вирусом болезни Борна. Ann NY Acad Sci . 2001; 939: 318–319. |
61. | Плетников М., Рубин С., Шварц Г., Моран Т., Карбон К. Персистентная инфекция мозга вирусом неонатальной болезни Борна (BDV) вызывает хронические эмоциональные нарушения у взрослых крыс. Physiol Behav . 1999; 66: 823–831. |
62. | Ши Л., Фатеми С.Х., Сидвелл Р.В., Паттерсон PH. Инфекция материнского гриппа вызывает заметные поведенческие и фармакологические изменения у потомства. Дж. Neurosci . 2003. 23 (1): 297–302. |
63. | Smith SE, Li J, Garbett K, Mirnics K, Patterson PH. Активация материнского иммунитета изменяет развитие мозга плода через интерлейкин-6. Дж. Neurosci . 2007. 27 (40): 10695–10702. |
64. | Weissenbock H, Hornig M, Hickey W., Lipkin W. Активация микроглии и апоптоз нейронов у новорожденных крыс Lewis, инфицированных борнавирусом. Brain Pathol . 2000. 10: 260–272. |
65. | Ланкастер К., Дитц Д., Моран Т., Плетников М. Аномальное социальное поведение у молодых и взрослых крыс, неонатально инфицированных вирусом болезни Борна. Behav Brain Res . 2007. 176: 141–148. |
66. | Rousset CI, Chalon S, Cantagrel S и др. Воздействие ЛПС на мать вызывает гипомиелинизацию внутренней капсулы и запрограммированную гибель клеток в глубоком сером веществе новорожденных крыс. Педиатр Рес . 2006. 59: 428–433. |
67. | Dammann O, Leviton A. Материнская внутриутробная инфекция, цитокины и повреждение головного мозга у недоношенных новорожденных. Педиатр Рес . 1997; 42: 1–8. |
68. | Конрой С.М., Нгуен В., Куина Л.А. и др. Интерлейкин-6 вызывает потерю нейронов в развивающихся культурах нейронов гранул мозжечка. Дж. Нейроиммунол . 2004. 155: 43–54. |
69. | Гилмор Дж., Фредрик Дж., Вадламуди С., Лаудер Дж. Пренатальная инфекция и риск шизофрении: IL-1beta, IL-6 и TNFalpha ингибируют развитие дендритов кортикальных нейронов. Нейропсихофармакология . 2004. 29: 1221–1229. |
70. | Нава Х., Такеи Н. Недавние успехи в моделировании иммунных воспалительных процессов при шизофрении на животных: влияние специфических цитокинов. Neurosci Res . 2006; 56: 2–13. |
71. | Samuelsson A, Jennische E, Hansson H, Holmang A. Пренатальное воздействие интерлейкина-6 приводит к воспалительной нейродегенерации в гиппокампе с дисрегуляцией NMDA / GABA (A) и нарушением пространственного обучения. Amer J Physiol Regul Integr Comp Phyusiol . 2006; 290: R1345 – R1356. |
72. | Понцио Н.М., Серватиус Р., Бек К., Марзук А., Крейдер Т. Уровни цитокинов во время беременности влияют на иммунологические профили и нейроповеденческие модели потомства. Ann N Y Acad Sci . 2007; 1107: 118–128. |
73. | Мандал М., Доннелли Р., Элкабес С. и др. Иммунная стимуляция матери во время беременности формирует иммунологический фенотип потомства. Иммунное поведение мозга . 2013; 33: 33–45. |
74. | Mandal M, Marzouk AC, Donnelly R, Ponzio NM. Иммунная стимуляция матери во время беременности влияет на адаптивный иммунитет у потомства, способствуя развитию клеток Th27. Иммунное поведение мозга . 2011; 25 (5): 863–871. |
75. | Баркер DJ. Внутриутробное программирование взрослых болезней. Мол Мед Сегодня . 1995; 1 (9): 418–423. |
76. | Бильбо С.Д., Шварц Дж. М.. Раннее программирование мозга и поведения на более позднем этапе жизни: критическая роль для иммунной системы. Front Behav Neurosci . 2009; 3: 1–14. |
77. | Barrett EG. Материнское влияние на передачу восприимчивости к астме. Pulm Pharmacol Ther . 2008. 21 (3): 474–484. |
78. | Bellinger DL, Lubahn C, Lorton D.Влияние стресса на иммунную функцию у матери и в раннем возрасте: актуальность для иммунотоксикологии. J Иммунотоксикол . 2008. 5 (4): 419–444. |
79. | Конрад М.Л., Ферстл Р., Тейх Р. и др. Передача сигналов материнского TLR необходима для защиты от пренатальной астмы непатогенным микробом Acinetobacter lwoffii F78. J Exp Med . 2009. 206 (13): 2869–2877. |
80. | Mandal M, Marzouk AC, Donnelly R, Ponzio NM.Преимущественное развитие клеток Th27 у потомства иммуностимулированных беременных мышей. Дж Репрод Иммунол . 2010. 87 (1–2): 97–100. |
81. | Кешаван М.С. Развитие, болезнь и дегенерация при шизофрении: единая патофизиологическая модель. J Psychiatr Res . 1999. 33 (6): 513–521. |
82. | Кешаван М.С., Хогарти Г.Е. Процессы созревания мозга и отсроченное начало при шизофрении. Дев Психопатол . 1999. 11 (3): 525–543. |
83. | Понцио Н.М., Мандал М., Элкабес С. и др. Провоспалительный фенотип, вызванный иммунной стимуляцией матери во время беременности. В: Фитцджеральд М., редактор. Последние достижения в лечении расстройств аутистического спектра . Том 1. Риека: Технологии; 2013: 113–141. |
84. | Раманатан М., Понцио Н., Лимсон Ф., Шах С., Фернандес Х. Регуляция материнских цитокинов в патогенезе аутизма.В: Программа и тезисы 9-го ежегодного международного совещания по исследованию аутизма; 20–22 мая 2010 г .; Филадельфия, Пенсильвания. Аннотация 136.101. |
85. | Blaschitz A, Hutter H, Dohr GHLA. Экспрессия белков класса I в плаценте человека. Ранняя беременность . 2001. 5 (1): 67–69. |
86. | Брауд В.М., Аллан Д.С., МакМайкл А.Дж. Функции неклассических молекул класса I, кодируемых MHC и не кодируемых MHC. Curr Opin Immunol . 1999. 11 (1): 100–108. |
87. | Hunt JS, Andrews GK, Wood GW. Нормальные трофобласты сопротивляются индукции HLA класса I. Дж. Иммунол . 1987. 138 (8): 2481–2487. |
88. | Hunt JS, Orr HT. HLA и распознавание матери и плода. FASEB J . 1992. 6 (6): 2344–2348. |
89. | Claas FH, Gijbels Y, van der Velden-de Munck J, van Rood JJ.Индукция невосприимчивости В-клеток к ненаследственным материнским антигенам HLA в течение жизни плода. Наука . 1988. 241 (4874): 1815–1817. |
90. | Tilburgs T, Scherjon SA, van der Mast BJ, et al. Несоответствие HLA-C плода и матери связано с активацией децидуальных Т-клеток и индукцией функциональных Т-регуляторных клеток. Дж Репрод Иммунол . 2009. 82 (2): 148–157. |
91. | Chen SJ, Liu YL, Sytwu HK.Иммунологическая регуляция во время беременности: от механизма к терапевтической стратегии иммуномодуляции. Клин Дев Иммунол . 2012; 2012: 258391. |
92. | Noronha LE, Antczak DF. Иммунные реакции матери на трофобласт: вклад лошади в иммунологию беременности. Am J Reprod Immunol . 2010. 64 (4): 231–244. |
93. | Baker JM, Bamford AI, Antczak DF.Модуляция аллоспецифических CTL-ответов во время беременности у непарнокопытных: иммунологический барьер для межвидовых спариваний? Дж. Иммунол . 1999. 162 (8): 4496–4501. |
94. | Flaminio MJ, Antczak DF. Ингибирование пролиферации и активации лимфоцитов: механизм, используемый инвазивным трофобластом лошади для ухода от материнского иммунного ответа. Плацента . 2005. 26 (2–3): 148–159. |
95. | Теллин О., Куманс Б., Зорзи В., Игута А., Хайнен Э.Переносимость фетоплацентарного «трансплантата»: десять способов прокормить ребенка в течение девяти месяцев. Curr Opin Immunol . 2000. 12 (6): 731–737. |
96. | Sykes L, MacIntyre DA, Yap XJ, Teoh TG, Bennett PR. Th2: th3-дихотомия беременности и преждевременных родов. Медиаторы воспаления . 2012; 2012: 967629. |
97. | Wegmann TG, Lin H, Guilbert L, Mosmann TR. Двунаправленное взаимодействие цитокинов в отношениях матери и плода: является ли успешная беременность феноменом Th3? Иммунол Сегодня .1993. 14 (7): 353–356. |
98. | Chaouat G, Assal Meliani A, Martal J, et al. IL-10 предотвращает естественную потерю плода в комбинации спаривания CBA × DBA / 2, а локальный дефект продукции IL-10 в этой склонной к аборту комбинации корректируется путем инъекции IFN-tau in vivo. Дж. Иммунол . 1995. 154 (9): 4261–4268. |
99. | Свенссон Л., Арвола М., Саллстрем М.А., Холмдал Р., Маттссон Р.Цитокины Th3 IL-4 и IL-10 не являются решающими для завершения аллогенной беременности у мышей. Дж Репрод Иммунол . 2001; 51 (1): 3–7. |
100. | Фэллон П.Г., Джолин Х.Э., Смит П. и др. IL-4 вызывает характерные ответы Th3 даже в сочетании с отсутствием IL-5, IL-9 и IL-13. Иммунитет . 2002. 17 (1): 7–17. |
101. | Roth I, Corry DB, Locksley RM, Abrams JS, Litton MJ, Fisher SJ.Плацентарные цитотрофобласты человека продуцируют иммуносупрессивный цитокин интерлейкин 10. J Exp Med . 1996. 184 (2): 539–548. |
102. | Jones CA, Finlay-Jones JJ, Hart PH. Цитокины типа 1 и типа 2 в децидуальной ткани человека на поздних сроках беременности. Биол Репрод . 1997. 57 (2): 303–311. |
103. | Bennett WA, Lagoo-Deenadayalan S, Brackin MN, Hale E, Cowan BD. Экспрессия цитокинов на моделях трофобласта человека, оцениваемая с помощью полуколичественной методики полимеразной цепной реакции с обратной транскрипцией. Am J Reprod Immunol . 1996. 36 (5): 285–294. |
104. | Мичимата Т., Сакаи М., Миядзаки С. и др. Уменьшение количества Т-хелперов 2 и Т-цитотоксических 2 клеток в местах имплантации происходит при необъяснимом рецидивирующем самопроизвольном аборте с нормальным содержанием хромосом. Репродукция Человека . 2003. 18 (7): 1523–1528. |
105. | Gilmour JS, Hansen WR, Miller HC, Keelan JA, Sato TA, Mitchell MD.Влияние интерлейкина-4 на экспрессию и активность эндопероксида простагландина Н-синтазы-2 в WISH-клетках, полученных из амниона. Дж Мол Эндокринол . 1998. 21 (3): 317–325. |
106. | Килан Дж. А., Сато Т. А., Митчелл Мэриленд. Сравнительные исследования влияния интерлейкина-4 и интерлейкина-13 на продукцию цитокинов и простагландина E2 клетками WISH, полученными из амниона. Am J Reprod Immunol . 1998. 40 (5): 332–338. |
107. | Гудвин В.Дж., Сато Т.А., Митчелл М.Д., Килан Дж.А. Противовоспалительное действие интерлейкина-4, интерлейкина-10 и трансформирующего фактора роста бета на клетки плаценты человека in vitro. Am J Reprod Immunol . 1998. 40 (5): 319–325. |
108. | Килан Дж. А., Марвин К. В., Сато Т. А., Коулман М., Мак-Кован Л. М., Митчелл М. Д. Обилие цитокинов в тканях плаценты: свидетельство воспалительной активации плодных оболочек при доношенных и преждевременных родах. Am J Obstet Gynecol . 1999. 181 (6): 1530–1536. |
109. | Lindstrom TM, Bennett PR. Роль ядерного фактора каппа B в человеческом труде. Репродукция . 2005. 130 (5): 569–581. |
110. | Elliott CL, Loudon JA, Brown N, Slater DM, Bennett PR, Sullivan MH. IL-1beta и IL-8 в плодных оболочках человека: изменения в зависимости от срока беременности, родов и условий культивирования. Am J Reprod Immunol . 2001. 46 (4): 260–267. |
111. | Сакагучи С., Сакагучи Н., Асано М., Ито М., Тода М. Иммунологическая самотолерантность поддерживается активированными Т-клетками, экспрессирующими альфа-цепи рецептора IL-2 (CD25). Нарушение единого механизма самотолерантности вызывает различные аутоиммунные заболевания. Дж. Иммунол . 1995; 155 (3): 1151–1164. |
112. | Кингсли К.И., Карим М., Бушелл А.Р., Вуд К.Дж.Регуляторные Т-клетки CD25 + CD4 + предотвращают отторжение трансплантата: CTLA-4- и IL-10-зависимая иммунорегуляция аллореактивов. Дж. Иммунол . 2002. 168 (3): 1080–1086. |
113. | Hori S, Nomura T, Sakaguchi S. Контроль развития регуляторных Т-клеток с помощью фактора транскрипции Foxp3. Наука . 2003. 299 (5609): 1057–1061. |
114. | Сакагучи С. Естественно возникающие регуляторные Т-клетки CD4 + для иммунологической толерантности и отрицательного контроля иммунных ответов. Анну Рев Иммунол . 2004. 22: 531–562. |
115. | Apostolou I, Sarukhan A, Klein L, von Boehmer H. Происхождение регуляторных Т-клеток с известной специфичностью к антигену. Нат Иммунол . 2002. 3 (8): 756–763. |
116. | Chen T, Darrasse-Jèze G, Bergot AS, et al. Самоспецифические Т-клетки, регулирующие память, защищают эмбрионы при имплантации мышам. Дж. Иммунол .2013. 191 (5): 2273–2281. |
117. | Aluvihare VR, Kallikourdis M, Betz AG. Регуляторные Т-клетки опосредуют материнскую толерантность к плоду. Нат Иммунол . 2004. 5 (3): 266–271. |
118. | Молденхауэр Л.М., Динер К.Р., Тринг Д.М., Браун М.П., Хейболл Д.Д., Робертсон С.А. Перекрестная презентация антигенов мужской семенной жидкости вызывает активацию Т-клеток, чтобы инициировать женский иммунный ответ на беременность. Дж. Иммунол . 2009. 182 (12): 8080–8093. |
119. | Сайто С., Накашима А., Шима Т., Ито М. Th2 / Th3 / Th27 и парадигма регуляторных Т-клеток во время беременности. Am J Reprod Immunol . 2010. 63 (6): 601–610. |
120. | Leber A, Teles A, Zenclussen AC. Регуляторные Т-клетки и их роль при беременности. Am J Reprod Immunol . 2010. 63 (6): 445–459. |
121. | Tai P, Wang J, Jin H, et al. Индукция регуляторных Т-клеток физиологическим уровнем эстрогена. J Cell Physiol . 2008. 214 (2): 456–464. |
122. | Zhao JX, Zeng YY, Liu Y. Аллоантиген плода отвечает за увеличение пула регуляторных Т-лимфоцитов CD4 (+) CD25 (+) во время беременности. Дж Репрод Иммунол . 2007. 75 (2): 71–81. |
123. | Robertson SA, Guerin LR, Bromfield JJ, Branson KM, Ahlstrom AC, Care AS.Семенная жидкость стимулирует увеличение пула регуляторных CD4 + CD25 + Т-клеток и вызывает у мышей толерантность к отцовским аллоантигенам. Биол Репрод . 2009. 80 (5): 1036–1045. |
124. | Bystry RS, Aluvihare V, Welch KA, Kallikourdis M, Betz AG. В-клетки и профессиональные APC привлекают регуляторные Т-клетки через CCL4. Нат Иммунол . 2001. 2 (12): 1126–1132. |
125. | Schaniel C, Pardali E, Sallusto F, et al.Активированные мышиные В-лимфоциты и дендритные клетки продуцируют новый хемокин СС, который избирательно действует на активированные Т-клетки. J Exp Med . 1998. 188 (3): 451–463. |
126. | Tang HL, Cyster JG. Хемокин Повышающая регуляция и активирование привлечения Т-клеток за счет созревания дендритных клеток. Наука . 1999. 284 (5415): 819–822. |
127. | Иэллем А., Мариани М., Ланг Р. и др.Уникальный профиль хемотаксического ответа и специфическая экспрессия хемокиновых рецепторов CCR4 и CCR8 регуляторными Т-клетками CD4 (+) CD25 (+). J Exp Med . 2001. 194 (6): 847–853. |
128. | Colantonio L, Iellem A, Sinigaglia F, D’Ambrosio D. Возвращающиеся в кожу CLA + Т-клетки и регуляторные CD25 + T-клетки представляют собой основные подмножества Т-клеток памяти периферической крови человека, мигрирующих в ответ согласно CCL1 / I-309. евро J Immunol . 2002. 32 (12): 3506–3514. |
129. | Schumacher A, Brachwitz N, Sohr S, et al. Хорионический гонадотропин человека привлекает регуляторные Т-клетки к границе раздела плод-мать на ранних сроках беременности человека. Дж. Иммунол . 2009. 182 (9): 5488–5497. |
130. | Zenclussen AC. CD4 (+) CD25 + Т-регуляторные клетки при беременности мышей. Дж Репрод Иммунол . 2005. 65 (2): 101–110. |
131. | Zenclussen AC, Gerlof K, Zenclussen ML, et al. Аномальная реактивность Т-клеток против отцовских антигенов при самопроизвольном аборте: адоптивный перенос индуцированных беременностью регуляторных CD4 + CD25 + Т-клеток предотвращает отторжение плода в модели аборта на мышах. Ам Дж. Патол . 2005. 166 (3): 811–822. |
132. | Джеймисон Д. Д., Тейлер Р. Н., Расмуссен С.А. Возникающие инфекции и беременность. Emerg Infect Dis . 2006. 12 (11): 1638–1643. |
133. | Мор Г., Карденас И. Иммунная система во время беременности: уникальная сложность. Am J Reprod Immunol . 2010. 63 (6): 425–433. |
134. | Muzzio D, Zygmunt M, Jensen F. Роль гормонов, связанных с беременностью, в развитии и функционировании регуляторных B-клеток. Фронт эндокринол (Лозанна) . 2014; 5: 39. |
135. | Полезе Б., Гриделет В., Араклиоти Э., Мартенс Х., Перье д’Отерив С., Гинен В. Эндокринная среда и поляризация Т-лимфоцитов CD4 во время беременности. Фронт эндокринол (Лозанна) . 2014; 5: 106. |
136. | Racicot K, Kwon JY, Aldo P, Silasi M, Mor G. Понимание сложности иммунной системы во время беременности. Am J Reprod Immunol . 2014. 72 (2): 107–116. |
137. | Шумахер А, Коста SD, Зенклассен AC. Эндокринные факторы, модулирующие иммунные реакции при беременности. Фронт Иммунол . 2014; 5: 196. |
138. | Шминки Д.Л., Гроер М. Имитация стрессовой реакции: новая гипотеза о роли врожденной иммунной системы при беременности. Медицинские гипотезы . 2014. 82 (6): 721–729. |
139. | Zhang HJ, Patenaude V, Abenhaim HA.Материнские исходы беременностей, вызванных инфекциями, вызванными вирусом ветряной оспы: популяционное исследование с 7,7 миллионами случаев госпитализации беременных. J Obstet Gynaecol Res . 2014. 41 (1): 62–68. |
140. | Американский колледж акушеров и гинекологов. Последняя информация об иммунизации и беременности: вакцинация от столбняка, дифтерии и коклюша. Заключение комитета ACOG № 566. Obstet Gynecol . 2013. 121 (6): 1411–1414. |
141. | Рабочая группа экспертов по иммунизации Американского колледжа акушеров и гинекологов (ACOG). Иммунизация и плановая акушерско-гинекологическая помощь . Вашингтон, округ Колумбия: ACOG; 2013. |
142. | Центры по контролю и профилактике заболеваний (CDC). Руководство по вакцинации беременных женщин. 2013. Консультативный комитет по практике иммунизации (ACIP) рекомендовал график иммунизации для лиц в возрасте от 0 до 18 лет .Атланта, Джорджия: CDC; 2013. |
143. | Munoz FM, Weisman LE, Read JS, et al. Оценка безопасности новорожденных от матерей, участвующих в клинических испытаниях вакцин, вводимых во время беременности. Clin Infect Dis . 2014; 59 (Приложение 7): S415 – S427. |
144. | Краус Т.А., Энгель С.М., Сперлинг Р.С. и др. Характеристика иммунного фенотипа беременности: результаты исследования вирусного иммунитета и беременности (VIP). Дж. Клин Иммунол . 2012. 32 (2): 300–311. |
145. | Радж Р.С., Бонни Э.А., Филлипп М. Грипп, иммунная система и беременность. Репродукция науки . 2014. 21 (12): 1434–1451. |
146. | Brabin BJ, Romagosa C, Abdelgalil S, et al. Больная плацента — роль малярии. Плацента . 2004. 25 (5): 359–378. |
147. | Rogerson SJ, Hviid L, Duffy PE, Leke RFG, Taylor DW.Малярия при беременности: патогенез и иммунитет. Ланцет Infect Dis . 2007. 7 (2): 105–117. |
148. | Ngo ST, Steyn FJ, McCombe PA. Гендерные различия при аутоиммунных заболеваниях. Фронт нейроэндокринола . 2014. 35 (3): 347–369. |
149. | Mjosberg J, Berg G, Jenmalm MC, Ernerudh J. FOXP3 + регуляторные Т-клетки и Т-хелперы 1, Т-хелперы 2 и Т-хелперы 17 в децидуальной оболочке ранней беременности человека. Биол Репрод . 2010. 82 (4): 698–705. |
150. | Ли Дж. Х., Ульрих Б., Чо Дж, Пак Дж., Ким Ч. Прогестерон способствует дифференцировке Т-клеток плода пуповинной крови человека в Т-регуляторные клетки, но подавляет их дифференцировку в клетки Th27. Дж. Иммунол . 2011. 187 (4): 1778–1787. |
151. | Хендерсон Т.А., Сондерс П.Т., Моффет-Кинг А., Грум Н.П., Кричли ХО. Экспрессия стероидных рецепторов в естественных киллерных клетках матки. J Clin Endocrinol Metab . 2003. 88 (1): 440–449. |
152. | Косака К., Фудзивара Х., Тацуми К. и др. Хорионический гонадотропин человека (ХГЧ) активирует моноциты для производства интерлейкина-8 по пути, отличному от системы рецепторов лютеинизирующего гормона / ХГЧ. J Clin Endocrinol Metab . 2002. 87 (11): 5199–5208. |
153. | Siewiera J, El Costa H, Tabiasco J, et al. Инфекция цитомегаловируса человека вызывает новые эффекторные функции децидуальных естественных клеток-киллеров. PLoS Pathog . 2013; 9 (4): e1003257. |
154. | Габриэль Г., Арк ПК. Секс, иммунитет и грипп. J Заразить Dis . 2014; 209 (Дополнение 3): S93 – S99. |
155. | Parboosing R, Bao Y, Shen L, Schaefer CA, Brown AS. Гестационный грипп и биполярное расстройство у взрослого потомства. JAMA Psychiatry . 2013. 70 (7): 677–685. |
156. | Brown AS, Begg MD, Gravenstein S, et al. Серологические данные о пренатальном гриппе в этиологии шизофрении. JAMA Psychiatry . 2004. 61 (8): 774–780. |
157. | Ламонт РФ, Собел Дж. Д., Кэррингтон Д. и др. Инфекция, вызванная вирусом ветряной оспы (ветряной оспы) при беременности. BJOG . 2011. 118 (10): 1155–1162. |
158. | Мандельброт Л. Ветряная оспа плода — диагностика, лечение и исход. Prenat Diagn . 2012. 32 (6): 511–518. |
159. | Baud D, Greub G. Внутриклеточные бактерии и неблагоприятные исходы беременности. Clin Microbiol Infect . 2011. 17 (9): 1312–1322. |
160. | Уильямс Д., Данн С., Ричардсон А., Фрэнк Дж. Ф., Смит МА. Динамика инвазии ткани плода Listeria monocytogenes после пероральной инокуляции беременным морским свинкам. J Food Prot . 2011. 74 (2): 248–253. |
161. | Поульсен К.П., Чупрински С.Дж. Патогенез листериоза при беременности. Anim Health Res Rev. . 2013. 14 (1): 30–39. |
162. | Ламонт РФ, Собел Дж., Мазаки-Тови С. и др. Листериоз при беременности человека: систематический обзор. Дж Перинат Мед . 2011. 39 (3): 227–236. |
163. | Rowe JH, Ertelt JM, Xin L, Way SS. Listeria monocytogenes проникновение в цитоплазму плода вызывает гибель плода, нарушая устойчивость плода, поддерживаемую Foxp3 + регуляторными Т-клетками. PLoS Pathog . 2012; 8 (8): e1002873. |
164. | Nguyen HT, Pandolfini C, Chiodini P, Bonati M. Уход за беременными женщинами при туберкулезе: систематический обзор. BMC Infect Dis . 2014; 14 (617): 1–10. |
165. | Шугарман Дж., Колвин С., Моран А.С., Окслейд О. Туберкулез во время беременности: оценка глобального бремени болезней. Ланцетный шар Здоровье . 2014; 2 (12): e710 – e716. |
166. | Бейтс М., Ахмед Ю., Капата Н., Маурер М., Мваба П., Зумла А. Перспективы лечения туберкулеза у беременных. Int J Infect Dis . 2015; 32: 124–127. |
167. | Деван П., Гомбер С., Дас С.Врожденный туберкулез: редкое проявление общего заболевания. Paediatr Int Child Health . 2014. 34 (1): 60–62. |
168. | Molina RL, Diouf K, Nour NM. Туберкулез и акушер-гинеколог: глобальная перспектива. Rev Obstet Gynecol . 2013. 6 (3–4): 174–181. |
169. | Beeson JG, Duffy PE. Иммунология и патогенез малярии при беременности. Curr Top Microbiol Immunol . 2005. 297: 187–227. |
170. | Adams Waldorf KM, McAdams RM. Влияние инфекции во время беременности на развитие плода. Репродукция . 2013; 146 (5): R151 – R162. |
171. | Li XL, Wei HX, Zhang H, Peng HJ, Lindsay DS. Метаанализ рисков неблагоприятных исходов беременности при инфекции Toxoplasma gondii . PLoS One .2014; 9 (5): e97775. |
172. | Han M, Jiang Y, Lao K, et al. sHLA-G участвует в апоптозе децидуальных естественных клеток-киллеров после инфицирования Toxoplasma gondii . Воспаление . 2014. 37 (5): 1718–1727. |
173. | Миллер Д.Х., Фазекас Ф., Монтальбан Х, Рейнгольд С.К., Трояно М. Беременность, пол и гормональные факторы при рассеянном склерозе. Мультик Склер .2014. 20 (5): 527–536. |
174. | Murase JE, Chan KK, Garite TJ, Cooper DM, Weinstein GD. Гормональное действие при псориазе при беременности и в послеродовом периоде. Arch Dermatol . 2005. 141 (5): 601–606. |
175. | Amin S, Peterson EJ, Reed AM, Mueller DL. Беременность и ревматоидный артрит: понимание иммунологии толерантности плода и контроля аутоиммунитета. Curr Rheumatol Rep .2011. 13 (5): 449–455. |
176. | Friedman DM, Duncanson LJ, Glickstein J, Buyon JP. Обзор врожденной блокады сердца. Изображения Paediatr Cardiol . 2003. 5 (3): 36–48. |
177. | Frize CJ, Williamson C. Эндокринные заболевания при беременности. Clin Med J R Coll Phys Lond . 2013. 13 (2): 176–181. |
что мы знаем о том, что происходит с вашей иммунной системой
Любое новое инфекционное заболевание представляет собой уникальную проблему для беременных во время вспышки.Влияние Sars, Zika и гриппа на беременность подчеркивает потенциальные немедленные и долгосрочные пагубные последствия для здоровья, которые вирус может иметь как для матери, так и для ребенка. Эти риски включают преждевременные роды с Sars, врожденные дефекты с вирусом Зика и повышенный риск тяжелого гриппа.
Стоит ли нам так же беспокоиться о беременности и COVID-19? Нам нужно подумать о нескольких вещах. Они делятся на две широкие области, связанные с воздействием на плод и воздействием на саму беременную.
В обоих случаях нам нужно думать о немедленных последствиях во время беременности, а также о более долгосрочных последствиях для здоровья как родителей, так и ребенка. Первые данные, которые мы имеем, показывают, что изменения в иммунной системе во время беременности могут в некоторой степени защитить от болезни.
Родитель
Ранние данные беременных женщин с COVID-19 показывают, что заболевание связано с преждевременными родами и изменениями в плаценте, которые могут отражать измененный кровоток.Это говорит о том, что между родителем и плодом действительно происходят связанные с вирусом разрывы.
Однако в этих исследованиях участвовали женщины с тяжелыми случаями заболевания. Мы очень мало знаем о влиянии легкой болезни или бессимптомной инфекции на беременность. Понимание этого имеет решающее значение, поскольку исследования показали, что бессимптомных и умеренно инфицированных беременных женщин намного больше, чем женщин, нуждающихся в госпитализации из-за COVID-19.
Это указывает на то, что беременные люди не более восприимчивы к тяжелой форме COVID-19, которая была одной из самых серьезных проблем в начале пандемии и привела к тому, что они были классифицированы как уязвимые.
Изменения в иммунной системе во время беременности могут помочь защитить от COVID-19 до и после родов. Стив Парсонс / ПенсильванияОчевидный защитный эффект беременности от тяжелого заболевания может просто отражать разные иммунные реакции на тяжелый COVID-19, наблюдаемые у мужчин и женщин, и тот факт, что в целом от этого заболевания умирает больше мужчин, чем женщин. Однако мы не видим такой же реакции во время беременности на другие вирусы, такие как грипп, что позволяет предположить, что с SARS-CoV-2 играет что-то еще.
Плод
На данный момент кажется, что плод очень хорошо защищен от передачи SARS-CoV-2 от матери к ребенку (известной как вертикальная передача), и такой переход, хотя и возможен, кажется необычным. Это может быть связано с естественными особенностями плаценты, которая производит молекулы, препятствующие связыванию вируса с плацентарными клетками. Возможно также, что плацентарные оболочки ограничивают заражение вирусом.
Конечно, изучить плаценту до родов очень сложно.Альтернативные меры, такие как анализ клеточного мусора, выделяемого из плаценты (известного как внеклеточные пузырьки), который можно найти в образце крови матери, действительно необходимы, чтобы выяснить, какие особенности плаценты могут защитить плод от инфекции и какие эффекты вирус попадает на плаценту.
Любые антитела, которые вырабатывает мать, инфицированная SARS-CoV-2, передаются плоду через плаценту (так называемый пассивный иммунитет). Это обеспечивает краткосрочную защиту от многих инфекционных агентов на последних месяцах беременности и в течение нескольких месяцев после рождения ребенка.Эти антитела также будут поступать с грудным молоком, если ребенок находится на грудном вскармливании.
Младенцы могут приобретать антитела против вирусов при грудном вскармливании. SeventyFour / ShutterstockРанние исследования, проведенные в Китае, показали, что антитела, защищающие от COVID-19, присутствуют у новорожденных женщин, у которых были такие антитела. Это подтверждает, что пассивный иммунитет, при котором ребенок в основном наследует антитела от родителя, возникает при SARS-CoV-2. Теперь нам нужны более масштабные исследования, чтобы выяснить, присутствуют ли антитела против SARS-CoV-2 в материнском молоке, чтобы лучше понять роль этих антител в нейтрализации вируса и защите ребенка.
Молекулы, отличные от антител, также могут передаваться от родителей к плоду. Беременные женщины с тяжелой формой COVID-19 имеют многие признаки воспалительной реакции, которые мы видим у других людей с аналогичными симптомами. Это включает повышенные уровни молекул, таких как интерлейкин-6 (IL-6), что указывает на активацию иммунного ответа.
Существует ряд исследований, показывающих, что активация материнского иммунитета может иметь пагубные последствия для развивающегося плода.Такая активация связана с повышенным риском респираторных, сердечно-сосудистых, нарушений развития нервной системы и других заболеваний у потомства. Еще неизвестно, окажет ли SARS-CoV-2 такое долгосрочное воздействие на здоровье этих детей.
Роль иммунной системы
В предыдущей статье мы обсуждали, как иммунная система меняется во время беременности, и, возможно, уникальные особенности этой и других динамических адаптаций, возникающих во время беременности, обеспечивают защиту от тяжелого COVID-19.
Уникальные особенности иммунной системы матери могут защитить от тяжелой формы COVID-19 до и после родов. Стив Парсонс / ПенсильванияДругие примеры возможных защитных механизмов включают различия в молекулах рецепторов, используемых SARS-CoV-2 для проникновения в клетки человека. Ангиотензин-превращающий фермент 2 (ACE2) является наиболее известным из этих вирусных рецепторов, но CD147, CD26 и другие также играют эту роль.
Все эти рецепторы претерпевают изменения во время беременности, что может способствовать устойчивости.Эти рецепторы также встречаются в виде растворимых форм, которые могут быть измерены в крови и грудном молоке, и могут действовать как рецепторы-ловушки, препятствуя связыванию вируса с клетками.
Что дальше?
Выяснение того, почему и беременный человек, и его ребенок кажутся относительно устойчивыми к тяжелым формам COVID-19, может помочь нам понять другие процессы заболевания и определить способы борьбы с ним.
Работа Системы акушерского надзора Великобритании показала, что, как и в случае с более широким населением, беременные азиатские и чернокожие женщины с большей вероятностью будут госпитализированы с инфекцией SARS-CoV-2.Поэтому нам действительно необходимо учитывать влияние этнической принадлежности и других факторов риска в наших исследованиях COVID-19 во время беременности.
Это особенно важно, поскольку эти исследования поддержат усилия по использованию любой вакцины во время беременности.
Могут ли мамы передать иммунитет от COVID-19 своим новорожденным?
Если женщина заразится COVID-19 во время беременности, может ли ее ребенок получить иммунитет к вирусу еще в утробе матери? Ранние данные намекают, что ответ положительный, но многие вопросы все еще остаются.
В новом исследовании, опубликованном 29 января в журнале JAMA Pediatrics , ученые проанализировали образцы крови более чем 1470 беременных женщин, 83 из которых дали положительный результат на антител к SARS-CoV-2, коронавирусу, вызывающему COVID-19, на момент доставки . Образцы пуповинной крови у большинства младенцев, рожденных этими женщинами, также дали положительный результат на антитела, что позволяет предположить, что у младенцев возник этот пассивный иммунитет.
Количество антител, переданных ребенку, во многом зависело от типа и количества антител, которые присутствовали у матери, и от того, когда она заразилась COVID-19 во время беременности.
«Чем больше времени между инфицированием матери и родами, тем выше передача антител», — написали в электронном письме авторы исследования доктор Карен Пуополо и доктор Скотт Хенсли из Медицинской школы Перельмана Пенсильванского университета. Эта корреляция сохранялась независимо от того, развивались ли у матери симптомы COVID-19 или оставались бессимптомными во время заражения.
Связанный: 20 самых страшных эпидемий и пандемий в истории
Перенесенные антитела могут обеспечить защиту новорожденного, но «предстоит еще работа, чтобы определить, какие уровни и типы антител необходимы для защищают новорожденных от инфекции SARS-CoV-2 и как долго эти антитела могут сохраняться в кровотоке новорожденных », — сказали авторы.По их словам, еще один большой вопрос заключается в том, насколько хорошо перенесенные антитела «нейтрализуют» коронавирус, то есть блокируют его способность инфицировать клетки.
«Мы надеемся получить эти данные», — сказал доктор Флор Муньос-Ривас, доцент кафедры детских инфекционных заболеваний Медицинского колледжа Бейлора в Хьюстоне, который не принимал участия в исследовании. По ее словам, изучая передачу антител после естественной инфекции COVID-19, мы можем собрать информацию о том, обеспечивают ли вакцины, вводимые беременным людям, аналогичную защиту новорожденным.
Ранние результаты
В новом исследовании команда специально проверила антитела, которые прикрепляются к белку шипа коронавируса, структуре, которая отрывается от поверхности вируса; Все антитела, которые команда искала, нацелены на «рецептор-связывающий домен» (RBD), часть шипа, которая напрямую связывается с рецептором или дверным проемом в клетки. Антитела RBD являются наиболее важными для нейтрализации коронавируса, сообщает Live Science ранее .
Но не все антитела к RBD могут проникать через плаценту , сказал Муньос-Ривас.Это потому, что плацента пропускает только определенные антитела, используя специальный рецептор и белок, который переносит антитела в орган. По ее словам, только маленькие Y-образные антитела, называемые иммуноглобулином G (IgG), могут вписаться в рецептор, поэтому они одни могут достигать плода и обеспечивать иммунную защиту.
Не все дети получили защиту: 72 из 83 детей, рожденных от антител-положительных матерей, имели IgG в пуповинной крови, и общее количество коррелировало с концентрацией IgG в крови их матерей.11 оставшихся младенцев с отрицательным результатом на антитела сделали это по двум причинам.
У шести матерей младенцев был относительно низкий уровень IgG, что позволяет предположить, что у них, вероятно, было «настолько рано инфицировано, что у них не было времени для выработки и переноса антител через плаценту», — говорят авторы. Либо это, либо матери просто вырабатывают меньше антител, чем в среднем, но это менее вероятный сценарий, добавили они. Матери остальных пяти младенцев дали положительный результат только на так называемые антитела IgM, которые не могут проникать через плаценту.
IgM-антитела появляются на ранней стадии инфекции, а затем исчезают, как только инфекция проходит, сказал Муньос-Ривас, поэтому пять мам, у которых был только положительный тест на IgM, были на очень ранних стадиях инфекции. Если антитела IgM появляются у плода или новорожденного, это указывает на то, что плод был непосредственно инфицирован вирусом. В этом исследовании IgM к SARS-CoV-2 не было обнаружено ни в одном образце пуповинной крови, что означает, что ни один плод не заразился COVID-19 в утробе матери.
Однако исследование не может с уверенностью сказать, что SARS-CoV-2 никогда не передается плоду до рождения, говорят авторы.
Что это означает для вакцин?
Хотя исследование показывает, что антитела IgG могут проникать через плаценту, ученым все еще необходимо определить, насколько хорошо переносимые антитела защищают от инфекции, говорят авторы.
Исследователи могут проверить, насколько хорошо антитела блокируют инфекцию, используя «тесты нейтрализации» — эксперименты, в которых они выращивают вирус в чашке с антителами и человеческими клетками, чтобы увидеть, предотвращают ли антитела инфекцию, сообщает Live Science ранее .По словам Муньос-Риваса, авторы также могут следить за младенцами, рожденными с антителами, чтобы узнать, как долго их антитела сохраняются и не заразится ли кто-нибудь из детей COVID-19.
Исследования такого рода позволят определить, чего ожидать после того, как беременная женщина заразится COVID-19; естественный иммунный ответ можно сравнить с тем, что мы наблюдаем у вакцинированных матерей и их новорожденных, сказал Муньос-Ривас.
Прямо сейчас и Центры по контролю и профилактике заболеваний (CDC) и Всемирная организация здравоохранения (ВОЗ) рекомендуют только людям с высоким риском заражения SARS-CoV-2 или высоким риском тяжелого заболевания из-за согласно медицинским показаниям , следует рассмотреть возможность вакцинации во время беременности и проконсультироваться с врачом перед вакцинацией.
При использовании других вакцин, вводимых во время беременности, таких как вакцины против столбняка и коклюша , уровни антител у новорожденных быстро падают к тому времени, когда ребенку исполняется два месяца, писал Муньос-Ривас в редакционной статье, опубликованной 29 января в . JAMA Педиатрия . Затем это снижение замедляется, и уровни антител продолжают неуклонно снижаться в течение следующих четырех-восьми месяцев.
Точно так же для вакцин COVID-19 антитела, обнаруженные в пуповинной крови, будут «отправной точкой» или пиковым количеством антител, которое получает ребенок до того, как уровни начнут падать, сказала она.Чтобы максимально увеличить количество антител, передаваемых плоду, матери, вероятно, придется подождать до второго триместра , чтобы пройти вакцинацию; По ее словам, примерно через 17 недель беременности плацента становится достаточно большой, чтобы перекачивать значительное количество антител к развивающемуся ребенку.
Хотя это обнадеживает, что материнские вакцины могут обеспечить защиту новорожденных, «от COVID, насколько нам известно на данный момент, целью будет защита матери», — сказал Муньос-Ривас.
Беременность увеличивает риск тяжелого заболевания и смерти от COVID-19, в то время как большинство новорожденных с положительным результатом теста имели легкие симптомы или не имели никаких симптомов и выздоравливали от вируса, согласно CDC .Как и в случае с инфекциями гриппа, матери оказываются особенно уязвимыми в третьем триместре и более склонны к развитию тяжелых состояний, таких как пневмония и дыхательная недостаточность, если они заразятся COVID-19 на этой стадии, сказал Муньос-Ривас.
Так что второй триместр может быть лучшим временем для вакцинации, сказала она. Таким образом, потенциальных побочных эффектов можно было бы избежать в первом триместре, когда такие состояния, как воспаление, и лихорадка, могут нарушить развитие плода, в то время как иммунная система все еще будет иметь достаточно времени, чтобы усилить свою реакцию до третьего триместра.Конечно, ученым все еще необходимо провести наблюдательные исследования и клинические испытания, чтобы определить лучшее время во время беременности для вакцинации COVID-19, сказал Муньос-Ривас.





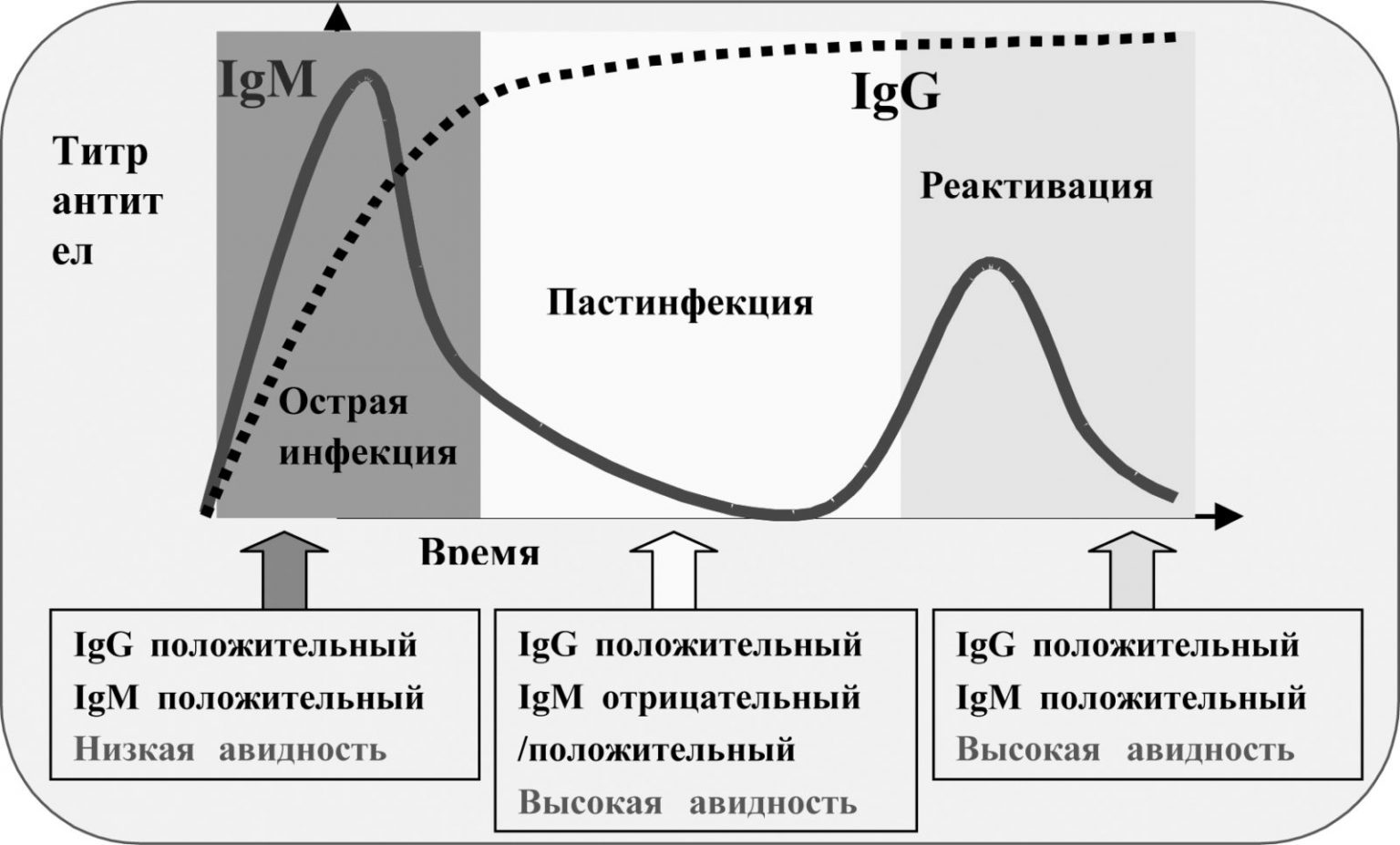

 Это может помочь сохранить здоровье ребенка до тех пор, пока он или она не станет достаточно зрелым для родов. Возможно, вам сделают раннее кесарево сечение, и ребенку может потребоваться еще одно переливание крови сразу после рождения.
Это может помочь сохранить здоровье ребенка до тех пор, пока он или она не станет достаточно зрелым для родов. Возможно, вам сделают раннее кесарево сечение, и ребенку может потребоваться еще одно переливание крови сразу после рождения. Возможно, плод необходимо родить раньше срока, а также может потребоваться переливание крови до (в матке) или после рождения.Новорожденного с умеренным резус-фактором следует внимательно наблюдать на предмет желтухи.
Возможно, плод необходимо родить раньше срока, а также может потребоваться переливание крови до (в матке) или после рождения.Новорожденного с умеренным резус-фактором следует внимательно наблюдать на предмет желтухи.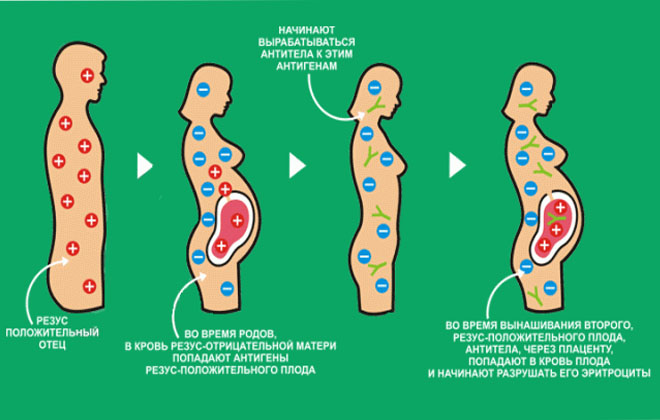 Если у вас отрицательный резус-фактор и результаты теста показывают, что вы не сенсибилизированы, повторный тест может быть проведен между 24 и 28 неделями.
Если у вас отрицательный резус-фактор и результаты теста показывают, что вы не сенсибилизированы, повторный тест может быть проведен между 24 и 28 неделями.
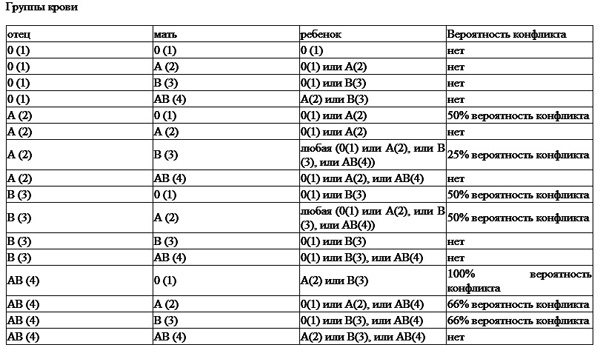 Кесарево сечение может использоваться для быстрых родов или во избежание трудностей, связанных с началом родов раньше срока. Новорожденному со средней степенью поражения иногда требуется переливание крови сразу после рождения.
Кесарево сечение может использоваться для быстрых родов или во избежание трудностей, связанных с началом родов раньше срока. Новорожденному со средней степенью поражения иногда требуется переливание крови сразу после рождения.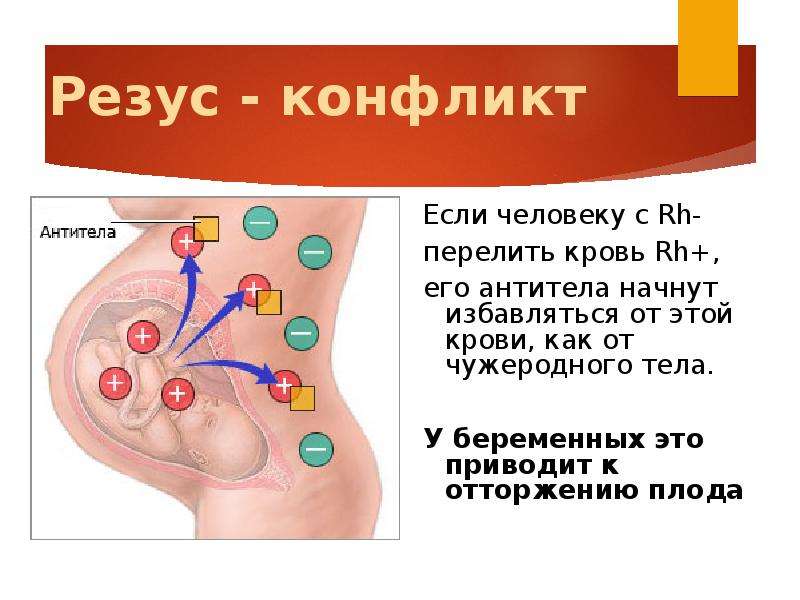
 org/uspstf/uspsdrhi.htm
org/uspstf/uspsdrhi.htm