Эрадикационная терапия хеликобактер пилори — схема и препараты
Марина Поздеева о принципах и схемах антихеликобактерной терапии
Колонизация Helicobacter pylori поверхности и складок слизистой оболочки желудка значительно затрудняет антибактериальную терапию. Успешная схема лечения основана на сочетании препаратов, которые предотвращают возникновение резистентности и настигают бактерию в различных участках желудка. Терапия должна гарантировать, что даже небольшая популяция микроорганизмов не останется жизнеспособной.
Эрадикационная терапия Helicobacter pylori включает комплекс нескольких препаратов. Распространенная ошибка, которая зачастую приводит к непредсказуемым результатам, — замена даже одного хорошо изученного препарата из стандартной схемы на другой препарат той же группы.
Ингибиторы протонной помпы (ИПП)
Терапия ИПП доказала эффективность в различных клинических исследованиях. Хотя in vitro ИПП и оказывают прямой антибактериальный эффект на H. pylori, тем не менее они не играют важной роли в эрадикации инфекции.
Механизм синергии ИПП при сочетании с противомикробными препаратами, который повышает клиническую эффективность эрадикационной терапии, полностью не установлен. Предполагается, что антисекреторные препараты группы ИПП могут способствовать повышению концентрации антимикробных средств, в частности метронидазола и кларитромицина, в просвете желудка. ИПП уменьшают объем желудочного сока, вследствие чего вымывание антибиотиков с поверхности слизистой уменьшается, и концентрация, соответственно, увеличивается. Кроме того, снижение объема соляной кислоты поддерживает стабильность антимикробных препаратов.
Препараты висмута
Висмут стал одним из первых препаратов для эрадикации H. pylori. Существуют доказательства, что висмут оказывает непосредственное бактерицидное действие, хотя его минимальная ингибирующая концентрация (МИК — наименьшее количество препарата, ингибирующее рост возбудителя) в отношении H. pylori слишком высока. Как и другие тяжелые металлы, такие как цинк и никель, соединения висмута снижают активность фермента уреазы, который принимает участие в жизненном цикле H. pylori. Кроме того, препараты висмута обладают местной антимикробной активностью, действуя непосредственно на клеточную стенку бактерий и нарушая ее целостность.
Метронидазол
H. pylori, как правило, очень чувствительны к метронидазолу, эффективность которого не зависит от pH среды. После перорального или инфузионного применения в желудочном соке достигаются высокие концентрации препарата, что позволяет достичь максимального терапевтического эффекта. Метронидазол — это пролекарство, которое в процессе метаболизма проходит активацию бактериальной нитроредуктазой. Метронидазол приводит к потере спиральной структуры ДНК H. pylori, в результате чего происходит поломка в ДНК и бактерия погибает.
NB! Результат лечения считается положительным, если результаты теста на H. pylori, проведенного не ранее 4 недель после курса лечения, будут отрицательными. Проведение теста до истечения 4 недель после эрадикационной терапии значительно повышает риск ложноотрицательных результатов. Предпочтительна отмена приема ИПП за две недели до диагностики.
 Эрадикационная терапия хеликобактер пилори: схема
Эрадикационная терапия хеликобактер пилори: схема
Кларитромицин
Кларитромицин, 14‑членный макролид, представляет собой производное эритромицина с аналогичным спектром активности и показаниями к применению. Однако в отличие от эритромицина он более устойчив к воздействию кислот и имеет более длительный период полувыведения. Результаты исследований, доказывающих, что схема тройной эрадикационной терапии хеликобактер пилори с использованием кларитромицина дает положительный результат в 90 % случаев, привели к широкому использованию антибиотика.
В связи с этим в последние годы было зафиксировано увеличение распространенности устойчивых к кларитромицину штаммов H. pylori. Нет никаких доказательств того, что увеличение дозы кларитромицина позволит преодолеть проблему антибиотикорезистентности к препарату.
Амоксициллин
Антибиотик пенициллинового ряда, амоксициллин и структурно, и по спектру активности очень близок к ампициллину. Амоксициллин стабилен в кислой среде. Препарат ингибирует синтез клеточной стенки бактерий, действует и местно, и системно после абсорбции в кровоток и последующего проникновения в просвет желудка. H. pylori демонстрирует хорошую чувствительность к амоксициллину in vitro, однако для эрадикации бактерии требуется комплексная терапия.
Тетрациклины
Точкой приложения тетрациклинов является бактериальная рибосома. Антибиотик прерывает биосинтез белка и специфически связывается с 30‑S субъединицей рибосомы, исключая добавление аминокислот к растущей пептидной цепи. Тетрациклин доказал in vitro эффективность против H. pylori и сохраняет активность при низком pH.

Показания к эрадикационной терапии
В соответствии с принципами, утвержденными в Маастрихте в 2000 году (the Maastricht 2–2000 Consensus Report), эрадикация H. pylori настоятельно рекомендуется:
- всем больным с язвенной болезнью;
- пациентам с низкодифференцированной MALT-лимфомой;
- лицам с атрофическим гастритом;
- после резекции по поводу рака желудка;
- родственникам больных раком желудка первой степени родства.
Необходимость проведения эрадикационной терапии пациентам с функциональной диспепсией, ГЭРБ, а также лицам, длительно принимающим нестероидные противовоспалительные препараты, пока остается предметом дискуссий. Доказательств того, что эрадикация H. pylori у подобных больных влияет на течение заболевания, нет. Однако хорошо известно, что у лиц с H. pylori, страдающих неязвенной диспепсией и корпус-преобладающим гастритом, повышается риск развития аденокарциномы желудка. Таким образом, эрадикацию H. pylori следует рекомендовать также и пациентам с неязвенной диспепсией, особенно если в гистологии выявляется корпус-преобладающий гастрит.
Аргумент против антихеликобактерной терапии у пациентов, принимающих НПВП, таков: организм защищает слизистую оболочку желудка от повреждающего действия лекарственных препаратов, повышая активность циклооксигеназы и синтез простагландина, а ИПП снижают естественную защиту. Тем не менее ликвидация H. pylori до назначения НПВП достоверно снижает риск язвенной болезни на фоне последующего лечения (исследование американских ученых под руководством Франсиса Чана (Francis K. Chan), опубликованное в The Lancet в 1997 году).
Эрадикационная терапия
Несмотря на применение комбинированных схем лечения, у 10–20 % пациентов, инфицированных H. pylori, не удается достичь элиминации возбудителя. Наилучшей стратегией считается подбор наиболее эффективной схемы лечения, однако не следует исключать возможность использования двух и даже более последовательных схем в случае недостаточной эффективности терапии выбора.
В случае неудачной первой попытки эрадикации H. pylori рекомендуют сразу перейти к терапии второй линии. Посев на чувствительность к антибиотикам и переход на схемы терапии спасения показан только тем пациентам, у которых терапия второй линии также не приведет к эрадикации возбудителя.

Одной из самых эффективных «схем спасения» является комбинация ИПП, рифабутина и амоксициллина (или левофлоксацина по 500 мг) на протяжении 7 дней. Исследование итальянских ученых, проведенное под руководством Фабрицио Перри (Fabrizio Perri) и опубликованное в Alimentary Pharmacology & Therapeutics в 2000 году, подтвердило, что схема с рифабутином эффективна против штаммов H. pylori, резистентных к кларитромицину или метронидазолу. Однако высокая цена рифабутина ограничивает его широкое применение.
NB! Во избежание формирования резистентности одновременно к метронидазолу и кларитромицину эти препараты никогда не комбинируют в одной схеме. Эффективность подобной комбинации очень высока, однако у пациентов, не ответивших на терапию, обычно формируется устойчивость сразу к обоим препаратам (исследование немецких ученых под руководством Ульриха Пейтца (Ulrich Peitz), опубликованное в Alimentary Pharmacology & Therapeutics в 2002 году). И дальнейший подбор терапии вызывает серьезные затруднения.
Данные исследований подтверждают, что 10‑дневная схема терапии спасения, включающей рабепразол, амоксициллин и левофлоксацин, гораздо эффективнее, чем стандартная эрадикационная терапия второй линии (исследование итальянских ученых под руководством Энрико Ниста (Enrico C Nista), опубликованное в Alimentary Pharmacology & Therapeutics в 2003 году).
www.katrenstyle.ru
Эрадикация Нelicobacter pylori – пути достижения эффективности | Лоранская И.Д., Степанова Е.В., Ракитская Л.Г., Мамедова Л.Д.
Представлены данные о хеликобактериозе, побочных эффектах эрадикационной терапии Нelicobacter (Н.) pylori, адъювантном варианте эрадикации.
Эрадикационная терапия не всегда является успешной, что сопряжено с растущей резистентностью штаммов Н. pylori к антибактериальным препаратам, а также с низкой комплаентностью пациентов, прекращением терапии из-за развития побочных эффектов. Использование пробиотических препаратов, в частности Lactobacillus (L.) reuteri, позволяет улучшить переносимость эрадикационной терапии, а также снизить количество и активность Н. pylori.
Применение штамма L. reuteri, обладающего выраженной антихеликобактерной активностью, в качестве адъюванта антихеликобактерной терапии представляется перспективным.
Н. pylori – неинвазивный микроб, колонизирующий преимущественно поверхностные слои слизистой оболочки (CO) желудка. Представляет собой грамотрицательную спиралевидную бактерию, имеющую на одном своем конце 4–5 жгутиков. Н. pylori сумел адаптироваться к резко кислой среде желудка благодаря небольшому размеру генома и способности к быстрым мутациям в неблагоприятных условиях для его жизнедеятельности. С помощью униполярно расположенных жгутиков Н. pylori перемещается в слое желудочной слизи в поисках оптимальных условий для колонизации CO желудка. При возникновении угрозы для существования спиралевидные формы Н. pylori трансформируются в кокковые, у которых резко снижен обмен веществ и редуцирована репродуктивная способность, но повышена устойчивость к неблагоприятным внешним воздействиям. Это позволяет им выжить при транзите через кишечник и сохраняться во внешней среде (в фекалиях, возможно, в почве и/или воде). Главным источником Н. pylori-инфекции является сам человек, а основным путем инфицирования – фекально-оральный; орально-оральный путь имеет вспомогательное значение [10, 23].
Попадая в желудок, бактерия продуцирует уреазу, которая расщепляет мочевину желудочного содержимого, вследствие чего образуются аммиак и СО2. Аммиак способствует защите микроба от соляной кислоты и вызывает повреждение СО желудка. Выделяя фермент муциназу, Н. pylori разрушает белок муцин, содержащийся в желудочной слизи, в результате чего создаются условия для проникновения бактерии через слой слизи и адгезии ее на эпителий СО желудка [4, 7].
В микробиоме желудка Н. pylori является «хозяином», хотя эффект его доминирования неясен [25]. Существует 196 штаммов Н. pylori [24]. Маркерами вирулентности Н. pylori могут служить такие гены, как cagА (способствующий индукции воспаления и секреции цитотоксичных веществ), vacА (продуцирующий вакуолизирующий цитотоксин), iceА (наиболее токсичен ice А1, способствующий адгезии Н. pylori на эпителиоцитах СО желудка) [5, 10].
Примерно 60% населения земного шара инфицировано H. рylori; распространена инфекция преимущественно в развивающихся странах, а также у пожилых. Длительное время остается асимптомной. Эффективной вакцины для предотвращения инфекции в настоящее время не существует [13, 28].
Н. pylori-инфекция является наиболее частой причиной (60–75%) развития неатрофического антрального гастрита, который постепенно (в течение 15–18 лет) может эволюционировать в антральный атрофический хронический гастрит, распространяться в антрокардиальном направлении, поражая фундальный отдел желудка, а в части случаев вызывать развитие мультифокального атрофического хронического гастрита, появление в СО желудка очагов кишечной метаплазии, эпителиальной дисплазии, неоплазии (предрака). С Н. рylori ассоциированы язвенная болезнь, реже – рак желудка и МАLТ-лимфома желудка [10, 23].
Протеазы, высвобождающиеся полиморфноядерными лейкоцитами в ответ на инфекцию Н. pylori, разрушают эпителий желез СО желудка, что в конце концов ведет к развитию атрофии [6, 15]. Кроме того, инфекция Н. pylori способствует выработке антител, которые перекрестно реагируют с париетальными клетками и могут вызвать их атрофию. В свою очередь, ахлоргидрия способствует размножению бактерий в желудке, трансформирующих нитраты в нитриты и приводящих к образованию N-нитрозосоединений, обладающих канцерогенными свойствами. Под действием Н. pylori изменяется баланс между процессами пролиферации и апоптоза, в результате чего нарушается физиологическая регенерация СО желудка, увеличивается образование свободных радикалов, аммиака, оксида азота, также обладающих канцерогенными свойствами. При длительном существовании инфекции Н. pylori возможны мутации гена р53, обеспечивающего противоопухолевую защиту, в результате чего могут появляться эпителиальные клетки с поврежденной ДНК и прогрессировать явления дисплазии эпителия. Инфекция Н. pylori приводит к снижению содержания аскорбиновой кислоты, β-каротина, α-токоферола, обеспечивающих противоопухолевую защиту [6, 14]. В 1994 г. Международным агентством по изучению рака (IARC) Н. pylori отнесен к канцерогенам 1 класса («определенно доказанным»). Наличие инфекции Н. pylori повышает риск развития рака желудка в 4–20 раз [6, 19].
Известно, что некоторые популяции с высоким уровнем инфицирования Н. pylori (в странах Восточной Азии) имеют высокую заболеваемость раком желудка, тогда как другие высокоинфицированные (в странах Южной и Западной Африки) имеют низкую частоту развития рака. Этот феномен назван «африканской загадкой» и может быть объяснен разностью генотипов Н. pylori, особенно cagА и vacА [25].
Основой лечения заболеваний, ассоциированных с Н. pylori, является эрадикация этой инфекции. Известно, что риск возникновения пептической язвы и рака желудка возрастает с повышением уровня инфицирования Н. pylori, следовательно, подавление Н. pylori-инфекции снижает риск этих заболеваний [20]. Кроме того, эрадикация Н. рylori признана наиболее перспективной стратегией снижения заболеваемости раком желудка [1, 21].
Последнее согласительное совещание «Маастрихт-4» (2010 г.) ограничило число применяемых схем эрадикации инфекции Н. pylori до 5:
– стандартная 3-компонентная терапия (ингибитор протонной помпы (ИПП) в стандартной дозе 2 р./сут + амоксициллин по 1000 мг 2 р./сут + кларитромицин 500 мг 2 р./сут в течение 7–14 дней;
– 4-компонентная терапия с препаратами висмута (ИПП в стандартной дозе 2 р./сут + тетрациклин 500 мг 4 р./сут + метронидазол 500 мг 3 р./сут + висмута трикалия дицитрат 120 мг 4 р./сут) в течение 10–14 дней;
– последовательная терапия (в течение первых 5 дней – ИПП в стандартной дозе 2 р./сут + амоксициллин по 1000 мг 2 р./сут, следующие 5 дней – ИПП в стандартной дозе 2 р./сут + кларитромицин 500 мг 2 р./сут + метронидазол 500 мг 3 р./сут;
– 4-компонентная терапия без препаратов висмута (ИПП в стандартной дозе 2 р./сут + амоксициллин 1000 мг 2 р./сут + кларитромицин 500 мг 2 р./сут + еще один антибактериальный препарат, например метронидазол 500 мг 3 р./сут) в течение 10–14 дней;
– 3-компонентная терапия с левофлоксацином (ИПП в стандартной дозе 2 р./сут + амоксициллин 1000 мг 2 р./сут + левофлоксацин 500 мг 2 р./сут) в течение 10–14 дней.
В зонах с низкой (<10%) резистентностью штаммов Н. pylori к кларитромицину (в России этот показатель составляет 7,6%) в качестве схемы первой линии назначают стандартную 3-компонентную терапию, последовательную или 4-компонентную терапию с препаратами висмута. В качестве схем эрадикации второй линии применяют 4-компонентную терапию с препаратами висмута, 3-компонентную терапию с левофлоксацином. Схема эрадикации третьей линии формируется с учетом результатов определения чувствительности штаммов Н. pylori к антибиотикам.
В зонах с высокой резистентностью к кларитромицину в качестве режимов эрадикации первой линии применяют 4-компонентные схемы с препаратами висмута, последовательную 4-компонентную терапию без препаратов висмута. В качестве терапии второй линии применяется 3-компонентная схема с левофлоксацином, а схема эрадикации третьей линии формируется с учетом результатов определения чувствительности Н. pylori к антибиотикам.
При наличии аллергии к пенициллину в зонах с низкой резистентностью к кларитромицину назначают схему с ИПП, кларитромицином и метронидазолом, в зонах с высокой резистентностью к кларитромицину – 4-компонентные схемы с препаратами висмута.
С целью повышения эффективности стандартной тройной терапии можно использовать следующие меры: назначение удвоенной (по сравнению со стандартной) дозы ИПП, увеличение продолжительности стандартной тройной терапии с 7 до 10–14 дней, добавление к стандартной тройной терапии висмута трикалия дицитрата, добавление к стандартной тройной терапии пробиотика Saсcharomyces boulardii и контроль за соблюдением пациентом режима приема лекарственных препаратов.
Контроль эрадикации следует проводить не ранее чем через 4 нед. после окончания терапии, используя для этого уреазный дыхательный тест (УДТ) или определение антигена в кале [6].
С открытием Н. pylori в 1983 г. австралийскими учеными B.J. Marshall и R. Warren и провозглашением стратегии на тотальную эрадикацию в соответствии с известным постулатом D.Y. Graham («хороший хеликобактер – это мертвый хеликобактер») этот процесс стал лавинообразно нарастать [10]. Однако эффективность эрадикации Н. pylori-инфекции в последние годы снизилась до 80% (а стандартная 3-компонентная схема эрадикации достигает успеха лишь у 70%) [11, 17, 28], в основном за счет увеличения резистентности штаммов Н. pylori к антибиотикам, а также нежелательных лекарственных реакций, которые приводят к низкой комплаентности, ухудшению качества жизни пациентов и самостоятельному прекращению лечения [27, 28].
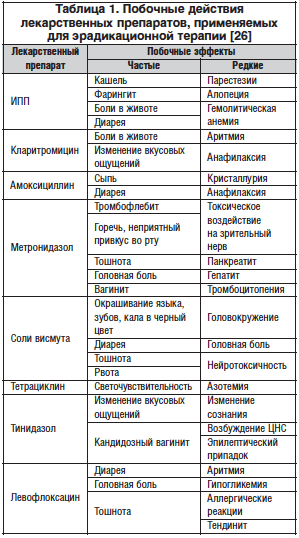
Побочные эффекты лекарственных препаратов, используемых для эрадикации Н. pylori, приведены в таблице 1.
В мире проведено более 30 исследований в период с 1993 по 2009 г., показавших общую устойчивость Н. pylori к амоксициллину, кларитромицину, метронидазолу, тетрациклину, фуразолидону, левофлоксацину. Уровни устойчивости Н. pylori к антибиотикам различны в разных странах. Частично это определяется географическими особенностями. В Европе наблюдается большая разница между южной и северной частями (например, устойчивость к кларитромицину у взрослого населения южно-европейских стран более 35%, что на 20% выше по сравнению с северными европейскими странами). В США устойчивость Н. pylori к кларитромицину составила 10–15%, к метронидазолу – 20–40%, а к амоксициллину отмечалась редко. В Китае за период с 2000 по 2009 г. уровень устойчивости Н. pylori к метронидазолу вырос с 12,8 до 56,6%, к кларитромицину – с 12,8 до 23,8%, тогда как к амоксициллину снизился с 2,1 до 0,3%. В Японии уровень устойчивости Н. pylori к кларитромицину возрос с 7 до 15,2%, к метронидазолу – до 69%, а к амоксициллину приблизился к 0%.
Главный механизм устойчивости Н. pylori – это точечные мутации бактериальной хромосомы, вследствие чего значительно изменяется фенотип бактерии. Другой предполагаемый механизм – снижение проницаемости бактериальной клетки к антибиотику. Нужно отметить, что Н. pylori заселяет труднодоступные для терапии участки СО. Первое препятствие для биодоступности антибиотика – кислота полости желудка (например, кларитромицин распадается под действием кислого желудочного содержимого и пепсина; повышение интрагастрального рН при помощи ИПП способствует положительному влиянию на эрадикацию Н. pylori). Второй барьер, который должен преодолеть антибиотик, – пристеночная слизь. Кроме того, антибактериальный препарат должен достичь высокой концентрации на достаточное время для уничтожения бактерии, где бы она ни находилась. Перспективна попытка преодолеть устойчивость Н. pylori к антибиотикам путем выявления генетических механизмов устойчивости Н. pylori [25].
Антибиотико-ассоциированная диарея (ААД) является одним из наиболее частых осложнений эрадикационной терапии, наблюдается у 5–39% пациентов в зависимости от популяции, типа антибиотика. Повышен риск развития ААД у пациентов старше 65 лет, при применении антибиотиков широкого спектра действия, у находящихся в условиях стационара [29]. Под термином «антибиотико-ассоциированная диарея» понимают необъяснимую другими причинами диарею, развившуюся в связи с приемом антибиотиков (во время их приема или в первые 2 мес., чаще в течение 2–3 нед. после окончания приема). Спектр клинических проявлений ААД широк: от легкой диареи до псевдомембранозного колита. Антибактериальные препараты способны разрушать нормальные колонии кишечной микрофлоры, изменять карбогидратный метаболизм и антимикробную активность кишки, приводя к осмотической диарее и к диарее, вызванной патогенными бактериями. Наибольший риск развития ААД наблюдается на фоне приема амоксициллина с клавулановой кислотой и цефиксима. Ампициллин, амоксициллин, клиндамицин, линкомицин, цефалоспорины II и III поколений – препараты, при приеме которых наиболее часто наблюдается ААД, ассоциированная с Clostridium difficile.
Рост устойчивости Н. pylori к антибактериальным препаратам, увеличивающиеся сроки и побочные эффекты эрадикационной терапии свидетельствуют о необходимости разработки альтернативного метода лечения и способов профилактики [3, 12]. Ряд исследований показали, что пробиотики могут использоваться и усиливать эффект эрадикационной терапии, а также повысить комплаентность пациента. Предполагались следующие эффекты пробиотиков: улучшение переносимости антибактериальной терапии и уменьшение ее побочных эффектов, повышение уровня завершенности терапии, иммуномодулирующий, антибактериальный эффекты. Указывались возможные эффекты лактобацилл: усиление защитного барьера, снижение адгезии и ингибирование роста Н. pylori за счет выработки лактата, бактериоцинов; некоторые штаммы способны ингибировать уреазу Н. pylori [20, 28].
При проведении эрадикационной терапии Н. pylori с профилактической целью и в случае появления диареи назначают пробиотики. Точный механизм антидиарейного действия пробиотиков не установлен. Данные метаанализов исследований эффективности пробиотиков, проведенных в 2010–2011 гг., показали, что применение этой группы препаратов значительно ускоряет выздоровление пациентов при лечении диареи различного генеза, в т. ч. ААД [8, 29, 30].
В схемах эрадикации вместе с антибиотиками могут применяться пробиотики как средства адъювантной терапии, что отражено в Маастрихтском соглашении [6]. При условии кислотоустойчивости штамма (доказано для Saсcharomyces boulardii, Lactobacillus ramnosus GG, L. reuteri, Lactobacillus acidophilus) пробиотики могут оказывать прямое антагонистическое действие в отношении Н. pylori, конкурировать с ним за питательные вещества и рецепторы адгезии, вырабатывать метаболиты, подавляющие рост Н. pylori (летучие жирные кислоты, молочную кислоту, перекись водорода, пироглутамат). Многие штаммы пробиотических культур вырабатывают антибактериальные субстанции, ингибирующие рост других микроорганизмов; Lactobacilli и Bifidobacteria выделяют бактериоцины, которые способны ингибировать рост Н. pylori и уменьшить его адгезию к эпителиоцитам желудка. Кроме того, пробиотики играют важную роль в стабилизации барьерной функции желудка и уменьшают воспаление его СО [20].
Группа немецких исследователей выбрала штамм L. reuteri путем скрининга сотен штаммов Lactobacilli большой коллекции культур. Этот специфический штамм принадлежит к группе Lactobacillus fermentum. L. reuteri специфически коагрегирует с Н. pylori in vitro и в искусственном желудочном соке и не оказывает негативного влияния на другие бактерии симбиотической кишечной флоры. Специфические связи закрывают поверхностные структуры Н. pylori и уменьшают его подвижность, в результате чего связанный патоген не может присоединиться к СО желудка и выводится из него [3].
L. reuteri были обнаружены как в грудном молоке человека, так и в микрофлоре желудочно-кишечного тракта. Было доказано, что штаммы L. reuteri благоприятно влияют на здоровье, в т. ч. при коликах у младенцев, желудочных расстройствах у детей и пищевой непереносимости у недоношенных детей [16].
Микробиологи из Organobalance GmbH (Германия) создали оригинальный штамм L. reuteri DSMZ17648, а затем было начато его производство в концерне Lonza Group Ltd. (Швейцария) под названием Pylopass™. Данный штамм бактерий, имеющий статус GRAS (Generally Recognized AsSafe – абсолютно безопасный), одобрен Управлением по надзору за качеством пищевых продуктов и лекарственных средств США (FDA – Foodand Drug Administration). Технология производства этого штамма принципиально отличается от производства других пробиотиков – вместо лиофильной сушки используется сушка путем распыления лактобацилл, затем они подвергаются ферментации и инактивации, после которых выдерживают изменения условий окружающей среды, в т. ч. низкие рН, и остаются высокостабильными при хранении. Данный кислотоустойчивый штамм специально «обучен» распознавать поверхностные рецепторы Н. pylori и прикрепляться к ним, создавая так называемые ко-агрегаты, которые затем естественным путем выводятся из организма. Pylopass™ коагрегирует с Н. pylori, позволяя уменьшить общую бактериальную обсемененность желудка, что снижает риск развития гастрита, язвы желудка и двенадцатиперстной кишки. Pylopass™ связывается исключительно с Н. pylori и не влияет на другую микрофлору пищеварительного тракта [9].
H. Mehling et al. провели пилотное слепое плацебо-контролируемое исследование с участием 22 H. рylori-позитивных пациентов, у которых не было гастроинтестинальных симптомов, но они имели положительный результат С13 УДТ выше порога 12‰, что указывало на умеренно высокую колонизацию Н. pylori. Уровень обсеменения Н. pylori в динамике определялся с помощью С13 УДТ после 14 дней приема препарата, а также через 6, 12 и 24 нед. после окончания приема препарата. Всем пациентам назначалась L. reuteri DSMZ17648 Pylopass™ в суточной дозе 2х1010 КОЕ, контрольную группу составили Н. pylori-позитивные волонтеры, которые получали плацебо. В опытной группе наблюдалось значительное снижение концентрации Н. pylori в динамике (р<0,05). У пациентов не было отмечено нежелательных лекарственных эффектов в течение 14 дней приема плацебо или L. reuteri DSMZ17648 Pylopass™. Результаты исследования подтвердили потенциал Pylopass™ в качестве нового способа снижения нагрузки Н. pylori [9, 22].
В 2014 г. C. Holz et al. опубликовали результаты углубленного пилотного плацебо-контролируемого исследования применения L. reuteri DSMZ17648 Pylopass™ у лиц, инфицированных Н. pylori и не имевших симптомов заболевания. Исследование 364 пациентов (из них 47 пар близнецов) показало существенное снижение уровня колонизации Н. pylori (подтвержденное С13 УДТ) после приема в течение 14 дней пищевой добавки с L. reuteri DSMZ 17648 (в ежедневной дозе 1 капсула – 2х1010 нежизнеспособных лиофилизированных клеток) [3]. С повышением уровня колонизации эффект уменьшения количества Н. pylori, вызванный приемом L. reuteri DSMZ17648 Pylopass™, оказывался сильнее. Этот эффект уменьшения количества Н. pylori продолжался и по окончании лечения. Потенциальный эффект плацебо был значительно ниже, чем действие L. reuteri DSMZ17648 Pylopass™. В ходе исследования не было зарегистрировано каких-либо изменений качества жизни, например, физической деятельности, питания или здоровья, о которых обследуемые сообщали в анкете. Никаких нежелательных лекарственных реакций не было отмечено ни в одной группе исследования [18].
Противомикробное действие объяснялось не только прямым воздействием на Н. pylori, но и снижением его уреазной активности. Авторы предположили, что уничтожение или замедление роста количественных показателей инфицирования может использоваться в качестве средства профилактики, в т. ч. долговременной (т. к. снижение уровня обсемененности Н. pylori наблюдалось еще 4–6 нед. после лечения) [3]. Это исследование подтвердило, что даже лиофилизированные клетки L. reuteri обладают выраженной антихеликобактерной активностью, что существенно облегчает условия хранения и делает данный вид пробиотика чрезвычайно перспективным. У лиц, инфицированных Н. pylori, без абсолютных показаний к эрадикации (т. е. при отсутствии пептической язвы, рака и МАLТ-лимфомы желудка) назначение L. reuteri DSMZ17648 представляется обоснованным и эффективным [2].
В конце 2014 г. в России появился продукт L. reuteri DSMZ17648 Pylopass™ под названием ХЕЛИНОРМ® в капсулах по 200 мг. Один грамм этого средства содержит около 1 трлн специально обработанных микробных клеток. Продолжительность курса терапии продуктом ХЕЛИНОРМ® составляет 4 нед. В день достаточно принимать всего 1 капсулу, которую рекомендуется проглатывать, не вскрывая, во время еды, запивая небольшим количеством воды. Благодаря высокой безопасности ХЕЛИНОРМ® может назначаться детям старше 6 лет. ХЕЛИНОРМ® можно назначать в виде монотерапии или в комплексной схеме антихеликобактерного лечения для повышения его эффективности.
Пробиотики, как правило, считаются безопасными агентами для применения, а ряд штаммов уже получили признание для использования в клинической практике. Введение безопасных пробиотиков в качестве адъюванта антихеликобактерной терапии представляется весьма перспективным. Дальнейшие исследования механизмов прямых и косвенных эффектов влияния пробиотиков на Н. pylori могут помочь не только оптимизировать лечение, но и способствовать новому пониманию некоторых аспектов патогенеза «взаимоотношений» Н. pylori с человеком. Новый продукт ХЕЛИНОРМ® используется для альтернативного лечения, не увеличивает резистентность Н. pylori к антибиотикам и снижает уровень колонизации этим бактериальным агентом [9].
www.rmj.ru
Эрадикация хеликобактер пилори — схема, терапия helicobacter pylori
Многие годы безуспешно боретесь с ГАСТРИТОМ и ЯЗВОЙ?
«Вы будете поражены, насколько просто можно вылечить гастрит и язву просто принимая каждый день…
Читать далее »
Хеликобактер Пилори – зловредная бактерия, обитающая в слизистом желудочном слое, отлично переносящая кислотность среды и активизирующаяся при стечении определенных обстоятельств. Результатом воздействия микроорганизма становятся многочисленные гастриты, язвенная болезнь и, как следствие, онкологические новообразования. Избавляться от бактерии в случае ее развития необходимо как можно быстрей. При терапии данной патологии пациенты достаточно часто сталкиваются с термином «эрадикация» и соответственно желают знать, что такое эрадикация helicobacter pylori и каковы критерии эффективности методики.
Суть эрадикационного лечения
На самом деле все просто — эрадикация Хеликобактер Пилори представляет собой совокупность традиционных и индивидуальных способов терапии, направленных на полное устранение бактерии из человеческого организма. После уничтожения вредоносного микроорганизма создаются благоприятные условия, позволяющие восстановить поврежденные ткани, заживить повреждения эрозивного характера и прочие дефекты слизистого слоя. Еще одно показание метода – исключение обострений патологии, повторного развития болезни в момент реабилитации, поскольку в этот период организм пациента ослаблен в результате длительного терапевтического курса.
Как правило, эрадикационная терапия хеликобактер пилори вне зависимости от выбранной схемы длится не дольше двух недель, сам процесс отличается малой токсичностью, при этом эффективность подхода достаточно высока. Порядка 90% пострадавших после проведения повторной диагностики ЖКТ считаются полностью выздоровевшими, поскольку симптомы, указывающие на наличие helicobacter pylori, отсутствуют.
Существует ряд требований, предъявляемых ВОЗ к эрадикации, к ним относят:
- Положительный эффект в среде пациентов должен быть не менее 80%.
- Активные терапевтические методики должны применяться не дольше двух недель.
- В схемах должны использоваться нетоксичные фармацевтические средства.
- Негативные побочные явления должны присутствовать не более, нежели у 15% пострадавших. При этом их интенсивность не должна служить поводом для прекращения терапии.
- Устойчивость бактерии к подобранным препаратам должна быть низкой.
- Способы использования препаратов должны быть достаточно простыми.
- Интервал между приемами лекарств должен быть долгим, соответственно предпочтение отдается средствам пролонгированного воздействия.
- Подобранные медикаменты должны отличаться взаимозаменяемостью.
Терапевтические схемы – первая линия
При разработке схемы эрадикации Хеликобактер Пилори могут включать назначение противомикробных препаратов, среди которых Амоксициллин, Тетрациклин, Метронидазол и прочие. Обычно для лечения назначают два препарата указанной группы. Также прописывают Рабепразол либо Эзомепразол, являющиеся ингибиторами протонной помпы и предназначенные для уменьшения объемов вырабатываемой желудочной кислоты, препараты висмута – они необходимы для устранения бактерии. Медиками разработано несколько схем для терапии Хеликобактера, их подбор проводят на основании распространенности штаммов, устойчивых к противомикробному препарату по месту проживания пациента. Первую линию эрадикации helicobacter pylori зачастую именуют трехкомпонентной линией, поскольку в процессе лечения прописывается три базовых препарата:
- Первая схема включает ИПП – обычно Омез, Омепразол и Рабепразол либо их аналоги – в сочетании с Кларитромицином и антибактериальным препаратом на усмотрение врача. Это может быть Трихопол, Амоксициллин либо Метронидазол. Все препараты принимаются на протяжении недели, однако продолжительность может возрастать до 14 суток с оглядкой на состояние пострадавшего, реакцию организма на препараты.
- Вторую схему используют при наличии атрофии слизистого слоя, ИПП не прописывают, сосредотачиваются на приеме Амоксициллина, Кларитромицина и Дицитрата висмута. Лечение длится на протяжении 10-14 суток в соответствии с состоянием пострадавшего.
- Третья схема предназначена для пожилых пациентов, эрадикация может проводиться в двух вариантах. В первом случае используют сочетание препаратов висмута с Кларитромицином и Амоксициллином, терапия длится две недели. Во втором курс составляет 28 суток, при этом применяют метод «последовательной терапии» во избежание привыкания бактерии к препаратам. Прием фармацевтических средств разносят по времени – с первого по пятый день принимают Амоксициллин с ИПП, с шестого по десятый ИПП в сочетании с Трихополом и Кларитромицином.
Терапевтические схемы – вторая линия
При назначении второй линии методики упор делают на назначение Тетрациклина. Схемы, построенные на его приеме, используют в случаях, когда первая линия не дала ожидаемого результата. В каждой назначаемой схеме используются четыре препарата:
- В первой схеме применяют блокаторы дoпаминовых рецепторов либо ИПП в сочетании с Тетрациклином, Трихополом либо Метронидазолом и препаратами висмута.
- Вторая схема включает прием ИПП, Амоксициллина, препаратов висмута и нитрофуранов.
- Третья схема – сочетание ИПП с Амоксициллином, препаратами висмута, Рифаксимином. Последний препарат является антибиотическим средством широкого спектра воздействия.
Схемы, относящиеся ко второй линии, действуют на протяжении 10-14 суток. В тех случаях, когда ожидаемый положительный эффект отсутствует, переходят к разработке схем терапии третьей линии. Перед назначением препаратов проводят исследования, определяющие чувствительность бактерии к противомикробным и противовоспалительным средствам. Вне зависимости от схемы лечение должно также включать антигистаминные и седативные препараты, витаминные комплексы. Неэффективность схем обычно наблюдается в связи с недостаточным соблюдением врачебных рекомендаций и с устойчивостью Хеликобактера к антибиотикам.
ogastrite.ru
Современные аспекты эрадикации Helicobacter pylori | #02/10
Helicobacter pylori — одна из самых распространенных инфекций в мире. Эти бактерии играют ключевую роль в развитии гастрита, язвенной болезни, В-клеточной лимфомы и рака желудка. Эрадикационная терапия считается успешной, если обеспечивает частоту излечения более 80%.
Резистентность к антибиотикам
Резистентность к антибиотикам — ведущий фактор неудачной терапии первой и второй линии. Резистентность варьирует в разных странах, есть также региональные различия (табл.). Это объясняет, почему невозможно предложить стандартизированную терапию, которая могла бы быть применена во всем мире. Кроме того, устойчивость непрерывно изменяется вследствие злоупотребления антибиотиками для лечения других заболеваний и вследствие миграции населения. Ряд авторов считают, что периодически должны проводиться исследования чувствительности к антибиотикам, чтобы использовать в лечении антибиотики с более низкой резистентностью. Консенсус Маастрихт III (2005) также подчеркивает роль устойчивости к антибиотикам при выборе терапии не только первой, но и второй линии [15]. Фактически тройная терапия, которая включает кларитромицин, должна назначаться только в тех регионах, где резистентность к этому антибиотику не превышает 15–20%. Широкое использование кларитромицина для лечения инфекций дыхательных путей, особенно у детей, и метронидазола в гинекологии и при паразитарных инвазиях в развивающихся странах увеличило первичную устойчивость H. pylori к этим двум антибиотикам. Резистентность к метронидазолу в некоторых регионах достигает 100%. В развитых странах, после проведенных исследований, в качестве замены кларитромицина и метронидазола предложены фторхинолоны, к которым H. pylori все еще имеет низкую резистентность. Однако H. pylori может легко развить устойчивость к фторхинолонам, так что они могут быть полезны только в ближайшее время.
Терапия первой линии
Следует подчеркнуть, что в связи с ростом лекарственной резистентности H. pylori к антибиотикам для эрадикации целесообразно применять оригинальные ингибиторы протонной помпы (эзомепразол) и оригинальный кларитромицин (Клацид).
Ингибиторы протонной помпы (ИПП) в основе тройной схемы были терапией первой линии в течение более десяти лет. Согласно Маастрихт III [15] традиционное лечение первой линии — ИПП (два раза в день), амоксициллин (1 г два раза в день) и кларитромицин (500 мг два раза в день) назначают в течение 10 дней. Современный метаанализ [4] продемонстрировал, что 10-дневная и 14-дневная тройная терапия давали большую частоту эрадикации, чем 7-дневный курс лечения. XXII ежегодная конференция европейской группы по изучению Helicobacter (EHSG), прошедшая в сентябре 2009 г. в г. Порту (Португалия), подтвердила лидирующие позиции тройной терапии для эрадикации H. pylori [18].
Маастрихт III (2005) рекомендовал четырехкомпонентную схему в качестве альтернативной терапии первой линии [15]. Для лечения по этой схеме используются следующие препараты: ИПП в стандартной дозе 2 раза в день + Де-нол (висмута трикалия дицитрат) 120 мг 4 раза в день + амоксициллин 1000 мг 2 раза в день + кларитромицин 500 мг 2 раза в день в течение 10 дней. С учетом роста резистентности к кларитромицину четырехкомпонентная терапия в настоящее время занимает лидирующие позиции.
В 2008 г. Европейской группой по изучению H. pylori последовательная терапия была рекомендована в качестве терапии первой линии: 5 дней — ИПП + амоксициллин 1000 мг 2 раза в день; затем 5 дней — ИПП + кларитромицин 500 мг 2 раза в день + тинидазол 500 мг 2 раза в день [20]. Исследования показывают, что последовательная терапия ведет к эрадикации в 90%, то есть превосходит эффективность стандартной тройной терапии. Частота побочных эффектов и отсутствие комплаенса при этом такие же, как при тройной терапии.
В метаанализе 10 клинических исследований 2747 пациентов [12] последовательная терапия оказалась эффективнее стандартной тройной терапии для эрадикации инфекции H. pylori у пациентов, впервые проходящих лечение. Частота эрадикации H. pylori была 93,4% (91,3–95,5%) при последовательной терапии (n = 1363) и 76,9% (71,0–82,8%) при стандартной тройной терапии (n = 1384). Большинство пациентов, включенных в эти исследования, были итальянцами, поэтому необходимо дальнейшее международное исследование. Частота эрадикации у кларитромицин-резистентных пациентов при последовательной терапии составила 83,3%, тройной терапии — 25,9% (отношение шансов (ОШ) 10,21; достоверный интервал (ДИ) 3,01–34,58; р < 0,001) [7].
Терапия второй линии
Европейское исследование показало, что комбинация ИПП (два раза в день) c левофлоксацином (500 мг два раза в день) и амоксициллином (1 г два раза в день) эффективна в качестве терапии второй линии и может иметь меньше побочных эффектов, чем традиционная квадротерапия [9]. Частота эрадикации по этой схеме в качестве терапии второй линии — 77% [8]. Схема с левофлоксацином в настоящее время занимает ведущие позиции в качестве терапии второй линии.
Квадротерапия (ИПП два раза в день, висмут 120 мг четыре раза в день, метронидазол 250 мг четыре раза в день, тетрациклин 500 мг четыре раза в день) в России не должна применяться широко в связи с тотальной резистентностью к метронидазолу.
Терапия третьей линии
XXII конференция Европейской группы по изучению H. pylori (EHSG), прошедшая в Порту (Португалия) в сентябре 2009 г., рекомендовала в качестве терапии третьей линии схему — ИПП (два раза в день), амоксициллин (1 г два раза в день) и рифабутин (150 мг два раза в день) в течение 10 дней [18]. Резистентность к рифабутину также возможна, и, поскольку он входит в терапию первой линии туберкулеза, его использование должно быть ограничено. Недавно выполнено немецкое исследование более чем у 100 пациентов с по крайней мере одной предыдущей неудачной эрадикацией и резистентностью H. pylori к метронидазолу и кларитромицину. У этих больных тройная терапия с эзомепразолом (40 мг), моксифлоксацином (400 мг) и рифабутином (300 мг 1 раз в день) в течение 7 дней дала частоту эрадикации 77,7% [21].
Дополнительная терапия
Возникновение побочных эффектов может уменьшить комплаенс пациентов и ведет к возникновению резистентности бактерий. Это стимулировало множество работ по поиску альтернативных вариантов лечения H. pylori. Недавнее исследование показало, что дополнение терапии пробиотическими штаммами Bacillus и Streptococcus faecium увеличивает комплаенс, уменьшает частоту побочных эффектов и увеличивает частоту эрадикации [10]. Наиболее изученные пробиотики — продуцирующие молочную кислоту бактерии рода Lactobacillus [14]. Пробиотики играют роль в стабилизации барьерной функции желудка и уменьшают воспаление слизистой оболочки [14]. Некоторые пробиотики, такие как Lactobacilli и Bifidobacteria, выделяют бактериоцины, которые могут ингибировать рост H. pylori и уменьшать ее адгезию к эпителиоцитам желудка [19]. Частота эрадикации при применении пробиотиков увеличивалась не всегда, но частота побочных эффектов, особенно диареи, тошноты и нарушения вкуса уменьшалась значительно [19]. Крупный метаанализ стандартной тройной терапии с пробиотиками и без них показал значительное сокращение побочных эффектов и небольшое увеличение частоты эрадикации [17]. В метаанализе 8 рандоминизированных исследований частота эрадикации H. pylori при сочетании тройной терапии с лактобактериями составила 82,26%, без пробиотиков — 76,97% (р = 0,01). Общая частота побочных эффектов не отличалась. Однако при добавлении лактобактерий уменьшалась частота диареи, вздутия живота и нарушения вкуса [22]. Таким образом, применение пробиотиков (например, Линекса) может увеличить частоту эрадикации и уменьшить побочные эффекты.
Терапия будущего
Терапевтическая вакцинация могла бы спасти миллионы жизней, была бы более рентабельна и имела бы меньшее количество потенциальных осложнений, чем назначение антимикробных средств. Первые исследования в моделях на животных продемонстрировали эффективность иммунизации и дали большие надежды на создание человеческой вакцины [1]. Однако разработка вакцины против этого уникального микроорганизма оказалась очень трудной. Первоначально полагалось, что вакцинация должна проводиться перорально, потому что H. pylori — неинвазивный патоген. Однако, из-за кислого содержимого желудка, найти вакцину, которая смогла бы пройти эту среду и сохранить эффективность, оказалось проблематично. Другая трудность развития оральных вакцин — возможность дополнительного стимулирования иммунной системы [1]. При тестировании на людях оральной терапевтической вакцины, которая состояла из рекомбинанта апоэнзима уреазы H. pylori и термолабильного токсина Escherichia coli, у большого количества пациентов возникла диарея. Однако у этих пациентов уменьшилась бактериальная нагрузка H. pylori [16]. Развитие знаний об иммуногенности H. pylori поможет в разработке коммерчески доступной вакцины.
Заключение
XXII конференция EHSG (Порту, Португалия, сентябрь 2009 г.) [18] по-прежнему рекомендует тройную терапию в течение 10 дней в качестве ведущей схемы эрадикации H. pylori. Альтернативой тройной терапии является четырехкомпонентная схема с ИПП, Де-нолом, амоксициллином и кларитромицином. Резистентность H. pylori к антибиотикам — возрастающая проблема, поэтому ее частота должна исследоваться на региональном и международном уровне. Терапия, основанная на левофлоксацине, эффективна в качестве терапии второй линии с меньшим количеством побочных эффектов в сравнении с квадротерапией. Схемы с рифабутином — терапия третьей линии в клинически сложных случаях.
Литература
Aebischer T., Schmitt A., Walduck A. K. et al. Helicobacter pylori vaccine development; facing the challenge // Int. J. Med. Microbiol. 2005. V. 295, № 3. P. 343–353.
Bang S. Y., Han D. S., Eun C. S. et al. Changing patterns of antibiotic resistance of Helicobacter pylori in patients with peptic ulcer disease // Korean J. Gastroenterol. 2007. V. 50. P. 356–362.
Boyanova L., Gergova G., Nikolov R. et al. Prevalence and evolution of Helicobacter pylori resistance to 6 antibacterial agents over 12 years and correlation between susceptibility testing methods // Diagn. Microbiol. Infect. Dis. 2008. V. 60, № 2. P. 409–415.
Calvet X., Garcia N., Lopez T. et al. A meta-analysis of shorl versus long therapy with a proton pump inhibitor, clarithromycin and either metronidazole or amoxicillin for treating Helicobacter pylori infection // Aliment. Pharmacol. Ther. 2000. V. 14, № 4. P. 603–609.
Chisholm S. A., Teare E. L., Davies K. et al. Surveillance of primary antibiotic resistance of Helicobacter pylori at centers in England and Wales over a six-year period (2000–2005) // Euro Surveill. 2007. № 12. P. E3–E4.
De Francesco V., Zullo A., Hassan С. et al. The prolongation of triple therapy for Helicobacter pylori does not allow reaching therapeutic outcome of sequential scheme: a prospective, randomised study // Dig. Liver. Dis. 2004. V. 36, № 3. P. 322–326.
Gatta L., Vakil N., Leandro G. et al. Sequential Therapy or Triple Therapy for Helicobacter pylori Infection: Systematic Review and Meta-Analysis of Randomized Controlled Trials in Adults and Children // Am. J. Gastroenterol. 2009. Oct 20. [Epub ahead of print.]
Gisbert J. P., Bermejo F., Castro-Fernandez M. et al. H. pylori Study Group of the Asociacion Espanola de Gastroenterologia. Second-line rescue therapy with levofloxacin alter H. pylori treatment failure: a Spanish multicenter study of 300 patients // Am. J. Gastroenterol. 2008. V. 103, № 1. P. 71–76.
Gisbert J. P., De la Morena F. Systematic review and meta-analysis: levofloxacin-based rescue regimens after Helicobacter pylori treatment failure // Aliment. Pharmacol. Ther. 2006. V. 23, № 1. P. 35–44.
Gotteland M., Brunser O., Cruchet S. Systematic review: are probiotics useful in controlling gastric colonization by Helicobacter pylori? Aliment. Pharmacol. Ther. 2006. V. 23, № 10. P. 1077–1086.
Hu C. T., Wu C. C., Lin C. Y. et al. Resistance rate to antibiotics of Helicobacter pylori isolates in eastern Taiwan // J. Gastroenterol. Hepatol. 2007. V. 22, № 7. P. 720–723.
Jafri N. S., Hornung C. A., Howden C. W. Meta-analysis: sequential therapy appears superior to standard therapy for Helicobacter pylori infection in patients naive to treatment // Ann. Intern. Med. 2008. V. 19, № 4. P. 243–248.
Kobayashi I., Murakami K., Kato M. et al. Changing antimicrobial susceptibility epidemiology of Helicobacter pylori strains in Japan between 2002 and 2005 // J. Clin. Microbiol. 2007. V. 45, № 10. P. 4006–4010.
Lesbros-Pantoflickova D., Corthesy-Theulaz I., Blum A. L. Helicobacter pylori and probiotics // J. Nutr. 2007. V. 137, № 8. P. 812S–818S.
Malfertheiner P., Megraud F., O’Morain C. et al. Current concepts in the management of Helicobacter pylori infection: the Maastricht III Consensus Report // Gut. 2007. V. 56, № 7. P. 772–781.
Michetti P., Kreiss C., Kotloff K. L. et al. Oral immunization with urease and Escherichia coli heat-labile enterotoxin is safe and immunogenic in Helicobacter pylori-infected adults // Gastroenterology. 1999. V. 116, № 6. P. 804–812.
Nista E. C., Candelli M., Cremonini F. et al. Bacillus clausii therapy to reduce side-effects of anti-Helicobacter pylori treatment: randomized, double-blind, placebo controlled trial // Aliment. Pharmacol. Ther. 2004. V. 20, № 6. P. 1181–1188.
O’Connor A., Gisbert J., O’Morain C. Treatment of Helicobacter pylori infection // Helicobacter. 2009. V. 14, Suppl. 1. P. 46–51.
Park S. K., Park D. I., Choi J. S. et al. The effect of probiotics on Helicobacter pylori eradication // Hepatogastroenterology. 2007. V. 54, № 6. P. 2032–2036.
Vaira D., Zullo A., Vakil N. et al. Sequential therapy versus standard triple-drug therapy for Helicobacter pylori eradication: a randomized trial // Ann. Intern. Med. 2007. V. 146, № 3. P. 556–563.
Van der Poorten D., Katelaris P. H. The effectiveness of rifabutin triple therapy for patients with difficull-to-eradicate Helicobacter pylori in clinical practice // Aliment. Pharmacol. Ther. 2007. V. 26, № 7. P. 1537–1542.
Zou J., Dong J., Yu X. Meta-analysis: Lactobacillus containing quadruple therapy versus standard triple first-line therapy for Helicobacter pylori eradication // Helicobacter. 2009. V. 14, № 5. P. 97–107.
Zullo A., Pema F., Hassan C. et al. Primary antibiotic resistance in Helicobacter pylori strains isolated in northern and central Italy // Aliment. Pharmacol. Ther. 2007. V. 25, № 6. P. 1429–1434.
В. В. Цуканов*,
О. С. Амельчугова*,
П. Л. Щербаков**, доктор медицинских наук, профессор
*НИИ медицинских проблем Севера Сибирского отделения РАМН, Красноярск
**ЦНИИ гастроэнтерологии, Москва
Контактная информация об авторах для переписки: [email protected]
Первичная резистентность к антибиотикам (%) в разных странах
Купить номер с этой статьей в pdf
www.lvrach.ru
Эрадикация хеликобактер пилори. Схемы лечения
Врач напугал фразой «эрадикация хеликобактера». Фантазия рисует белые стены операционной, стерильный инструмент и людей в масках. У меня ведь всего лишь гастрит! Или язва!
Что ожидает страдальца? Есть ли смысл опасаться слова «эрадикация» и готовится к оперативному вмешательству?
Немного о хеликобатере пилори и понятие «эрадикация»
Хеликобактер пилори — микроорганизм, который вызывает эрозийные процессы в слизистых оболочках ЖКТ.
Хеликобактер пилори – это патоген, который способен жить и размножаться в условиях агрессивного содержимого желудка человека.
Этот микроорганизм вызывает эрозийные процессы в слизистых оболочках ЖКТ. Методы определения хеликобактера в организме:
- Осмотр и опрос пациента
- Гастроскопии желудка с забором содержимого на анализ
- Анализы крови
- Иммунологические тесты
- Дыхательный тест
- ПЦР-анализы
- Бакпосевы содержимого желудка
- После подтверждения наличия патогена, врач должен принять меры по удалению патогенного микроорганизма.
Эрадикация – медицинский термин, обозначающий комплекс мероприятий, направленных на уничтожение инфекции и создания благоприятных условий для восстановления организма. Попросту говоря – это качественное лечение хеликобактерной инфекции.
Впервые методику «эрадикации» испытал на себе Берри Маршал. Ученый спровоцировал у себя воспалительный процесс в желудке, выпив выделенную культуру хеликобактер пилори. Для лечения Б. Маршал использовал сочетания метронидазола и субцитрата висмута.
Требования к эрадикации рекомендованные ВОЗ
Схемы лечения хеликобактерной инфекции разрабатывались и внедрялись в медицинскую практику в течение 30 лет.
В настоящее время используются рекомендации Маастрихт-IV от 2005 года. Критериями эффективности схемы лечения хеликобактера являются:
- Положительный результат у 80% пациентов
- Длительность активной терапии не более 14 дней
- Использование нетоксичных лекарственных препаратов
- Возникновение побочных эффектов не более чем 10–15% пациентов
- Интенсивность побочек не должна быть таковой, чтобы прекращать лечение
- Низкая резистентность хеликобактера к лекарственному препарату
- Простота использования медикаментов
- Низкая частота приема лекарственных средств. Использование препаратов пролонгированного действия
- Взаимозаменяемость медикаментозных средств в различных схемах лечения
Экономичность лечения
В методике лечения хеликобактера разработано 2 линии эрадикации.
По методике «Маастрихт-IV» разработаны 2 линии эрадикации хеликобактера. Согласно рекомендациям врачей начинают лечение по схемам первой линии.
Если же улучшение не наступает, то пациентам назначают препараты из второй линии эрадикации.
При кровотечении из язвы мероприятия «эрадикации» начинают применять после восстановления питания через рот. Контроль лечения проводится через месяц после окончания курса «эрадикации» хеликобактера.
Первая линия «эрадикации»
Эта схема называется еще «трехкомпонентной линией», так как во время лечения назначают 3 основных лекарственных препарата. Схема №1:
- Ингибиторы протонной помпы – омепразол, омез, рабепрозол и аналоги – для снижения секреции соляной кислоты. Длительность приема составляет 7 дней.
- Антибиотик кларитромицин – 7 дней.
- Антибактериальное средство по выбору врача – метронидазол, трихопол, тинидазол, амоксициллин, нифурател – 7 дней.
Длительность приема может быть увеличена от 10 дней до 2 недель в зависимости от состояния пациента, отклика организма на лечение и переносимости лекарственных препаратов.
Схема №2 применяется при подтвержденной атрофии слизистых оболочек ЖКТ. Ингибиторы протонной помпы или другие препараты, снижающие секрецию соляной кислоты, не назначаются:
- Амоксициллин
- Кларитромицин или нифурател
- Дицитрат висмута
Длительность лечение по схеме №2 составляет от 10 до 14 дней в зависимости от состояния пациента. Схема №3 предназначена для пациентов пожилого возраста. Для этой методики разработаны 2 вариации – 3а и 3б:
- Амоксициллин
- Кларитромици
- Препараты висмута
Лечение по схеме 3а проводится в течение 14 дней. Для схемы 3б требуется более длительный курс – 4 недели. Чтобы избежать привыкания патогена к лекарственному препарату используют «последовательную терапию». Она заключается в том, чтобы разнести прием медикаментозных средств во времени:
Вторая линия «эрадикации»
Тетрациклин — антибиотик используемый при второй линии эрадикации.
Схемы эрадикации второй линии используют при отсутствии эффекта от препаратов первой линии терапии. Для избавления от хеликобактера используют 4 лекарственных вещества. Схема №1:
- Ингибиторы протонной помпы или блокаторы допаминовых рецепторов
- Антибиотик «тетрациклин»
- Метронидазол или трихопол
- Препараты висмут
Схема №2:
- Ингибиторы протонной помпы
- Амоксициллин
- Препараты висмута
- Нитрофураны – нифурател или фуразолидон
Схема №3:
- Ингибиторы протонной помпы
- Амоксициллин
- Препараты висмута
- Рифаксимин – антибиотик широкого спектра действия
Все схемы «второй линии» рассчитаны на лечение в течение 10–14 дней. Если же терапия не дала положительного результата, то разрабатываются схемы «третьей линии».
Для выбора медикаментов проводятся бактериологические исследование, определяется чувствительность хеликобактера к различных антибиотикам и противовоспалительным препаратам.
Все схемы лечения дополняются антигистаминными препаратами, витаминными комплексами, седативными средствами в таблетированной или инъекционной форме.
О лечении хеликобактер пилори узнаете также и из видеоматериала:
https://www.youtube.com/watch?v=_mK79mDc7Q4
Эрадикация хеликобактера прополисом
Водный раствор прополиса отлично помогает в борьбе с хеликобактер пилори.
Эта методика запатентована в 2006 году. Авторами является группа российских ученых.
В настоящее время терапия прополисом не внесена в официальные схемы эрадикации. Исследователи настаивают на ее эффективности. Схема выглядит следующим образом:
- Водный раствор прополиса с массовой долей действующего вещества 25–30% перорально 3 раза в день до еды
- Прополис в масле – 2 раза в день
- Препарат «омепразол» в стандартной дозировке
- Длительность курса лечения колеблется от 2 до 4 недель.
Эрадикация хеликобактера народными средствами
Отвар семени льна — народное средство в лечении хеликобактера.
Препараты фитотерапии широко применяются при лечении хеликобактерной инфекции. Многие из них входят в курсы традиционной медицины и назначаются врачом. Что можно использовать во время лечения:
- Отвар семени льна – готовится по классической технологии – на 1 чайную ложку сырья 250 мл кипятка. Залить и оставить на 2 часа. Принимать слизистый настой вместе с набухшим семенем. Лен оказывает обволакивающее действие на внутреннюю оболочку желудка, препятствует раздражению участков эрозии соляной кислотой, способствует их заживлению.
- Отвар ромашки и тысячелистника, масло облепихи – они оказывают противовоспалительное и ранозаживляющее действие.
- Не применять агрессивные продукты питания и соки. Чеснок и лук, хотя и являются мощными антисептическими продуктами, при эрозийных процессах в ЖКТ запрещены.
Не назначайте себе препараты фитотерапии, другие рецепты народной медицины без консультации с лечащим врачом.
Самостоятельность во время «эрадикации» хеликобактера может окончиться прободением участка желудка или двенадцатиперстной кишки.
Питание при лечении хеликобактерной инфекции
Правильное питание является залогом успешного лечения язвы.
Правильное питание является залогом успешного лечения язвы и прочих заболеванием ЖКТ. Специализированный рацион требуется только при случаях прободения язвы или кровотечения из желудка.
В прочих случаях достаточно придерживаться принципов здорового питания. Блюда должны быть щадящей температуры. Не допускаются горячие и излишне холодные продукты питания. Придется отказаться от:
- Алкоголь
- Табак
- Жареные блюда
- Сырые овощи и фрукты в момент обострения
- Жирные бульоны и блюда на их основе
- Жирная рыба
- Копчености, в том числе колбасы и копченые сыры
- Консервация, в том числе и домашняя овощная
- Острые приправы – уксус
- Специи – перец, смеси с карри
- Грибы
- Крепкий кофе и чай
- Торты, сдоба, прочие сладости
Что должно быть на столе:
- Нежирные супы
- Хлеб только белый, лучше – сухарики домашнего приготовления
- Мясо, речная рыба
- Любые макаронные изделия без острых и жирных соусов
- Каши на воде и молоке
- Овощи – картофель, свекла, морковь, лук и чеснок только в проготовленном виде
- Ягоды и фрукты – желательно в проготовленном виде
- Фруктовые и молочные кисели
- Некрепкий чай
- Профилактические мероприятия
Инфекции проще избежать, чем лечить. Приемы профилактики следует соблюдать до знакомства с патогеном. Но и после лечения хеликобактера придется следить за собой во избежание повторения инфицирования. Что можно делать самостоятельно:
- Снизить физические контакты с незнакомыми лицами
- Забыть о вредных привычках. Алкоголь и сигареты отныне для вас под запретом
- Зубная щетка и помада – ваши и только ваши. Не давайте пользоваться этими вещами другим лицам
- Мойте руки, продукты питания перед едой
- Проходите профилактические осмотры у гастроэнтеролога после лечения
- Не занимайтесь самолечением и при первых признаках заболевания обращайтесь к врачу
Система ЖКТ – это нежная группа органов, а инфекции вездесущи. К тому же многие из них выработали иммунитет ко многим лекарственным препаратам. Заботьтесь о себе, думайте о том, что отправляете в собственный рот, и вам не придется знакомиться с термином «эрадикация» и принимать лекарственные препараты для подавления хеликобактера пилори.
Заметили ошибку? Выделите ее и нажмите Ctrl+Enter, чтобы сообщить нам.
Расскажите друзьям! Расскажите об этой статье своим друзьям в любимой социальной сети с помощью социальных кнопок. Спасибо!
Поделиться
Поделиться
Твит
Телеграм
Класс
Вотсап
pishhevarenie.com
Бактерия helicobacter pylori, эрадикация хеликобактер пилори
В последнее время словосочетание «Хеликобактер пилори» у всех на слуху – о данной бактерии слышно в рекламах фармацевтических препаратов, можно прочитать на форумах и т.д. Многие даже знают, что хеликобактер – причина большого количества желудочных проблем. Как именно влияет на наш организм эта бактерия?
Что такое Хеликобактер?
Еще около двух десятков лет тому назад лечение гастритов и язвенной болезни желудка основывалось на эмпирических данных, в большинстве своем оно было симптоматическим.
Настоящим прорывом в медицине стало повторное открытие в 1981 году микроорганизма Helicobacter pylori (HP), находящегося в слизистой желудка пациентов с хроническим антральным гастритом. Английский ученый Барри Маршал и австралийский патолог Робин Уоррен не только выделили хеликобактерии в отдельный от кампилобактера род, но и доказали их медицинское значение, за что в 2005 году получили Нобелевскую премию. Это открытие вошло в первые ряды ведущих медицинских достижений ХХ века, а эрадикация Helicobacter pylori (полное уничтожение бактерии) стала золотым стандартом лечения хеликобактер-ассоциированных патологий ЖКТ.
Доказано, что H. Pylori вызывает гастриты примерно у 30% населения, является причиной более чем 95% всех гастро-дуоденальных язв и в 65% случаев становится триггером развития рака желудка. В данный момент ведутся исследования по поводу роли хеликобактера в развитии неспецифического язвенного колита (болезни Крона), идиопатической хронической крапивницы, заболеваний печени и желчевыводящих путей.
Формы микроорганизма
 Хеликобактериальные заболевания относятся к кампилобактериозам, а сам микроорганизм выделен в отдельный род. Микробиология H. Pylori следующая: это грамотрицательная спиралевидная бактерия, до 3 мкм длиной и 0,5 мкм в диаметре. Она имеет 4–6 жгутиков и может довольно быстро передвигаться в густых питательных средах. Особенностью бактерии является то, что она микроаэрофильна, т.е. для ее нормального развития и существования необходимо небольшое количество кислорода, гораздо меньшее, чем в воздухе. HP вырабатывает окислительные ферменты, способна формировать защитную биопленку, спасающую от антител и агрессивной желудочной среды.
Хеликобактериальные заболевания относятся к кампилобактериозам, а сам микроорганизм выделен в отдельный род. Микробиология H. Pylori следующая: это грамотрицательная спиралевидная бактерия, до 3 мкм длиной и 0,5 мкм в диаметре. Она имеет 4–6 жгутиков и может довольно быстро передвигаться в густых питательных средах. Особенностью бактерии является то, что она микроаэрофильна, т.е. для ее нормального развития и существования необходимо небольшое количество кислорода, гораздо меньшее, чем в воздухе. HP вырабатывает окислительные ферменты, способна формировать защитную биопленку, спасающую от антител и агрессивной желудочной среды.
В неблагоприятных условиях хеликобактер пилори меняет спиралевидную форму на круглую, изменяя при этом также строение клеточной стенки, вследствие чего иммунная система человека не может узнать известный ранее микроорганизм. Такое явление называется бактериальной мимикрией.
Круглую форму невозможно культивировать в лабораторных условиях. Ее обнаруживают после антибиотикотерапии или по мере «старения» выращенных на питательных средах культур. Круглая форма более устойчива к антибактериальным препаратам, чем спиралевидная, она также обладает большей вирулентностью и канцерогенностью.
Причины хеликобактериоза и пути заражения
 Эпидемиология хеликобактерной инфекции довольна проста. Возбудитель – это антропоноз, т.е. вызывает заболевания только у людей. Бактерия передается через слизь и слюну. Заражение чаще всего происходит при очень тесных контактах, например, через поцелуи, общие столовые приборы, посуду, предметы гигиены. Исследования показывают, что патогенный микроорганизм может передаваться также фекально-оральным способом, но случается это реже, так как хеликобактер не может долго жить вне организма человека. Встречаются случаи передачи инфекции при эндоскопии, когда обследование проводится плохо стерилизованным прибором. Рост случаев передачи возбудителя отмечается в весенний и осенний период, что, связано с сезонными обострениями хронических гастродуоденальных патологий.
Эпидемиология хеликобактерной инфекции довольна проста. Возбудитель – это антропоноз, т.е. вызывает заболевания только у людей. Бактерия передается через слизь и слюну. Заражение чаще всего происходит при очень тесных контактах, например, через поцелуи, общие столовые приборы, посуду, предметы гигиены. Исследования показывают, что патогенный микроорганизм может передаваться также фекально-оральным способом, но случается это реже, так как хеликобактер не может долго жить вне организма человека. Встречаются случаи передачи инфекции при эндоскопии, когда обследование проводится плохо стерилизованным прибором. Рост случаев передачи возбудителя отмечается в весенний и осенний период, что, связано с сезонными обострениями хронических гастродуоденальных патологий.
Источник хеликобактериоза – больной как острой, так и бессимптомной формами болезни. Чаще всего это люди старше 60 лет. В группе риска также находятся лица с состояниями дефицита иммунитета. Бактерия продуцирует цитотоксины, которые проникают сквозь слизисто-бикарбонатный желудочный барьер и разрушают слизистую оболочку.
В большинстве случаев НР-инфекций клинические симптомы отсутствуют и патологические повреждения слизистой минимальны. Появление явных признаков заболевания происходит при развитии значительных нарушений иммунной защиты. При этом отмечается возникновение острого гастрита с выраженной воспалительной реакцией, которая затем переходит в хронический процесс.
Инфицирование H. pylori и повреждение слизистой верхнего отдела тонкого кишечника возможно только при наличии участков метаплазии желудочного эпителия. Доказана прямая связь между хроническим хеликобактериальным гастритом, возникновением язвенной болезни и даже раком желудка.
Симптомы хеликобактериоза
В зависимости от клинико-патологических особенностей заражения Helicobacter pylori появляются определенные симптомы, на основе которых ставится диагноз и назначается лечение. Инкубационный период составляет от нескольких суток до недели. Клинические проявления заболеваний, вызванных хеликобактером, не отличаются от других патологий ЖКТ.
По интенсивности симптоматики выделяют следующие формы HP-ассоциированных заболеваний:

- Бессимптомная – при хорошем иммунитете бактерия не вызывает дискомфорт и болевые ощущения, нарушения функций ЖКТ не особо заметны. Однако многолетнее течение латентного хеликобактериоза может в итоге привести к раку желудка.
- Острый гастрит или гастродуоденит. Большинство пациентов при этом жалуются на слабость, усталость, дискомфорт и боли в эпигастральной области, тошноту, изжогу, рвоту, запор или диарею, изменения аппетита. Часто проявляются также признаки вегето-сосудистой дистонии.
- Хронический антральный гастрит либо дуоденит. Во время обострения хронического процесса также доминируют диспепсический, интоксикационный и болевой синдромы.
- Язва желудка и/или двенадцатиперстной кишки. Клиническое течение болезни более тяжелое, связано с более глубоким поражением слизистой органов. Обострения случаются чаще, обычно возникают при иммунодефицитных состояниях, курении, алкоголизме, наркомании и других провоцирующих факторах. Язвенная болезнь довольно часто осложняется желудочными кровотечениями, перфорацией слизистой, пенетрацией в другие органы, рубцовыми деформациями.
- Другие, редко встречающиеся формы (хеликобактер-ассоциированный эзофагит, колит, энтерит, проктит). Обострения редких форм сопровождаются дисфагией (расстройством глотания), метеоризмом, запорами, диареей.
Даже когда человек является носителем хеликобактера, то есть инфекция протекает бессимптомно, это не следует оставлять без внимания. При благоприятных условиях, на фоне тяжелого иммунодефицита заболевание может перейти в манифестную форму.
При своевременной диагностике и адекватном лечении прогноз для жизни пациента в основном благоприятный. Летальные случаи возможны при запущенных и тяжелых осложнениях язвенной болезни.
Диагностика заболеваний
Для подтверждения клинического диагноза пользуются следующими методами диагностики Helicobacter pylori:
- бактериологическое исследование мазков-отпечатков и выявление бактерий с помощью иммунофлюоресценции или темнопольной микроскопии,
- культуральное выделение возбудителя,
- полимеразная цепная реакция (ПЦР) кала,
- биопсия тканей слизистой желудка и двенадцатиперстной кишки,
- серологические исследования биологического материала больного (крови, слюны), позволяющие обнаружить антитела к хеликобактеру,
- уреазный аэротест, при котором определенное содержание аммиака в выдыхаемом воздухе означает наличие НР у пациента.
Эффективным является изотопный анализ, основанный на определении в моче и выдыхаемом воздухе меченых изотопов мочевины.
Как бороться с НР-инфекциями?
Избавиться от бактерии следует в любом случае, поэтому эрадикационная терапия хеликобактер пилори назначается не только пациентам с острыми и хроническими формами болезни, но и носителям с бессимптомным течением.
Медикаментозное лечение
Эрадикация хеликобактер пилори основана на этиотропной (направленной на устранение причины) и патогенетической (предназначенной для коррекции функциональных нарушений) терапии. Для прямого воздействия на возбудителя при антральном гастрите назначают лекарства, способные убить бактерию, такие как Метронидазол или Тинидазол. При желудочных и дуоденальных язвах прописывают производные висмута, например, Вис-Нол, Гастро-норм, Де-Нол, Улькавис. Медикаменты для этиотропной терапии относятся к препаратам первой линии.
Вторую линию составляют патогенетические лекарственные средства. Характер течения язвенной болезни довольно длительный, с периодическими обострениями и высокой частотой рецидивов. Поэтому для патогенетического лечения с целью коррекции нарушенных функций поврежденных органов и нормализации обмена веществ показано применение ингибиторов протонной помпы (Омепразол, Нексиум) и Н2-гистаминорецепторов (Ранитидин, Фамотидин).

Медикаментозная терапия хеликобактера наиболее эффективна при назначении схемы лечения, которая также направлена на предотвращение рецидивов. При легком течении болезни может быть рекомендована тройная терапия – комбинация из трех препаратов, например, Де-Нола, Омепразола, Метронидазола. Показанием к назначению квадротерапии являются хронические и дефектные формы болезни. При этом используют комбинации следующих групп медикаментов:
- коллоидные субцитраты висмута – Де-Нол, Вис-Нол и др.,
- ингибиторы протонной помпы – Пантопразол, Омепразол,
- антибиотики и противопротозойные фармпрепараты – Метронидазол, Фазижин,
- макролиды – Аугментин, Кларитромицин.
Из противомикробных препаратов широкого спектра действия заменить макролиды способен Амоксициллин, но высокая чувствительность к его компонентам может стать причиной аллергии и, следовательно, противопоказанием.
Во время и после лечения обязателен контроль состояния кишечной микрофлоры для профилактики дисбактериоза.
Эффективным является назначение курса восстановительной терапии, включающего пробиотики (Бифи-форм), прокинетики (Домперидон), витаминные комплексы.
Использование монотерапии или неполноценных схем эрадикации ведет к быстрому развитию у H.pylori резистентности к антибиотикам и отсутствию терапевтического эффекта.
Народная медицина и Хеликобактер
Наряду с традиционной медикаментозной терапией, широко пользуется успехом лечение заболеваний ЖКТ и избавление от хеликобактера народными средствами. Но так как компоненты, используемые в рецептах домашней медицины, оказывают в основном симптоматическое действие, их лучше комбинировать с фармпрепаратами и применять только по рекомендации лечащего врача. При этом обязательно учитываются:
- возраст пациента – ребенку могут быть противопоказаны некоторые средства, подходящие для лечения взрослых,
- наиболее выраженные симптомы,
- секреторная функция желудка – она может быть нормальной, повышенной или сниженной,
- особенности клинического течения и стадия заболевания.
В дополнение к основной терапии, лечить НР-ассоциированные болезни ЖКТ можно с помощью отваров из цветков ромашки и календулы, средств на основе коры дуба, семян льна, алоэ, прополиса, таких трав, как зверобой и шалфей.
Диета при лечении хеликобактерной инфекции
Правильное, сбалансированное питание пациента – залог успеха терапии. Диета при хеликобактерных инфекциях направлена на смягчение болевых ощущений в области ЖКТ и повышение эффективности лечения. Чтобы предотвратить дальнейшее раздражение и повреждение слизистой желудка и двенадцатиперстной кишки, из рациона следует исключить продукты, стимулирующие выработку желудочного сока: копчености, пряности, жареные, жирные и соленые блюда, черный хлеб, богатые клетчаткой фрукты и овощи, кофе, алкоголь.

Пациентам рекомендована обволакивающая слизистую оболочку пища, слабо стимулирующая секреторную функцию желудка, например, перетертые супы из круп и овощей, отварная рыба, паровые котлеты, молоко, яйца, белые сухарики, некрепкий чай, щелочная вода без газа.
Соблюдение лечебного диетического питания в комплексе с терапевтическими мероприятиями приведет к более быстрому улучшению состояния пациента.
Профилактика хеликобактериоза
В качестве меры предосторожности, чтобы минимизировать риски заражения НР-инфекцией, следует должным образом соблюдать правила гигиены – не пользоваться общей посудой, тщательно мыть руки перед приемом пищи, использовать индивидуальные гигиенические средства. Профилактика заболеваний, вызванных хеликобактером, включает в себя корректировку способа жизни. Важно избегать физических и психических перегрузок, проводить санацию очагов возможной инфекции, рационально питаться.
Кроме того, при выявлении данной инфекции в семейном кругу, целесообразно провести эрадикацию всем членам семьи. Через 2–3 месяца после успешной терапии хеликобактериоза желательно снова пройти исследование, например, дыхательный тест, в качестве профилактики повторного инфицирования.
 Загрузка…
Загрузка…kardiobit.ru
Эрадикация хеликобактер пилори схема лечения
Не многие люди знают, что большая часть всех серьёзных проблем со здоровым состояниемжелудка, возникает из-за такой бактерии, как хеликобактер пилори. Самая эффективная борьба с ней – это эрадикация.
Содержание статьи
Описание хеликобактер пилори
Хеликобактер пилори представляет собой очень живучий микроорганизм. Он вполне комфортно себя ощущает в человеческом желудке, а также совершенно не боится воздействия желудочной кислоты. Он способен передвигаться по желудку и кишечнику, долгое время живя в такой среде. Хеликобактер пилори воздействует разрушительным образом на оболочку слизистой желудка, что впоследствии при отсутствии или же неправильном лечении может вызвать язву. По статистике огромное количество людей на планете заражены этой бактерией. Наибольшее зафиксированное количество язвенных болезней, вызванных хеликобактер пилори относится к 70-ым годам 20-ого века. На сегодняшний день медицина имеет высокий уровень, и такие пациенты встречаются очень редко.
Бактерия хеликобактер имеет некоторую схему строения своего организма, благодаря которой выживает в кислотной среде:
- Бактерия обладает спиралевидной формой. Это позволяет ей легко проникнуть внутрь желудка и задерживаться там на долгое время.
- Микроорганизм хеликобактер пилори не может жить, находясь за пределами организма человека. Ей достаточно небольшого количество кислорода, а также практически не нужны прочие полезные вещества.
- Уреаза – это вещество, которое выделяет бактерия для того, чтобы устранить кислоту вокруг себя. Это приводит к тому, что желудочный сок начинает вырабатываться организмом человека ещё в большей мере. Такое большое количество кислоты плохо отражается на стенках желудка, вызывая различные повреждения. К сожалению, это никак не влияет на организм хеликобактер пилори, находящийся там.
- Маленький вредитель в желудке оставляет свои отходы, что губительно влияет на здоровье человека. Организм проводит самоочистку и борется с этими продуктами жизнедеятельности, но когда у него это не получается, начинаются воспалительные процессы.
Бактерия попадает в организм человека через заражённые предметы, продукты, а так же после контакта с другим человеком (слюна и прочие жидкости, вырабатываемые организмом).
Признаки заражения и диагностика
Очень часто врачи обнаруживают хеликобактер пилори не запланировано после сбора каких-либо анализов. В таком случае пациенту не назначается схема лечения антибиотиками, так как его ничего не беспокоит. Однако, порой, когда воспаления прогрессируют, появляются болезненные ощущения. Их очень легко перепутать с симптомами при гастрите и язве.
Признаки заражения бактерией:
- Сильная боль в животе, а именно в области, где располагается желудок. Боль возникает после приёма пищи или же при её длительном неупотреблении. Обычно болевые ощущения очень резкие и долгие.
- Повышенная выработка желудочного сока влечёт за собой отрыжку и чувство изжоги. Отрыжка имеет неприятный кисловатый запах.
- Нарушается правильное функционирование кишечника, что влечёт за собой повышенное газовыделение.
- Очень часто возникают запоры или же противоположенный эффект, который отражается диареей.
Всегда, прежде чем врач назначает терапию, он должен провести множество анализов. Заражение бактерией можно диагностировать с помощью анализа крови. Самым эффективным методом, который будет способствовать лучшей схеме лечения, является сбор биологического материала. Из желудка пациента берётся образец, после чего его исследуют под микроскопом на наличие различных бактериальных заболеваний. При выявлении недуга врач для каждого пациента лично продумывает схему эрадикации.
Что подразумевает под собой процедура эрадикации
Под медицинским термином эрадикация подразумеватся комплексная терапия, которая направлена на лечение пациента от микроорганизма. Врач назначает больному целый курс лечения. Антибиотики принимаются только в экстренных ситуациях, когда случай заражения очень серьёзный. Схема терапии построена таким образом, чтобы в одно время убивать зловредные бактерии хеликобактер пилори, и восстанавливать слизистую желудка у пациента.
Некоторые люди не идут к врачу, а занимаются самолечением, употребляя различные антибиотики, не назначенные профессионалом. Такая «терапия» может повлечь за собой серьёзные последствия. Во-первых, выбранные антибиотики могут не помогать в лечении. Во-вторых, при длительном применении какого-либо препарата бактерия становится устойчива к нему, что усложняет процесс выздоровления.
У эрадикации есть свои большие плюсы:
- Схема терапии продумана и рассчитана на короткое время. Принимая нужные препараты можно избавиться от недуга за одну или же две недели.
- лечение полностью продумана врачом и побочные эффекты сводятся к минимуму. Если какой-либо из препаратов вдруг не подошёл, то его заменяют.
- Эффективность такого рода лечения очень высокая.
Эрадикацию проводят только при большой необходимости, когда процесс воспаления может повлечь за собой язву. В целом всего лишь около 15% случаев заражения хиликобактер пилори по всему миру влекут за собой язвенное заболевание желудка или кишечника.
Лечение и последствия
Схема лечения представляет собой целую терапию с использованием различных медицинских препаратов, которые способны уничтожить болезнь. Такое большое количество антибиотиков применяется потому, что каждый из них отвечает за своё поле действия. Терапия при эрадикации хиликобактер пилори включает в себя:
- Процесс обезвреживания бактерий.
- Снижение уровня выработки желудочного сока, выработку большего количества слизистых масс.
- Снятие воспаления и заживление повреждённых зон в желудке или кишечнике.
При заражении следует помнить о том, что нужно незамедлительно обращаться к врачу для назначения схемы лечения, чтобы болезнь не прогрессировала и не привела к плохим последствиям.
testanaliz.ru

