Диафрагмальные грыжи
Диафрагмальные грыжи
Общая информация
Для пациентов все случаи диафрагмальных грыж могут расти быть разделены на безопасные и потенциально опасные варианты. Безопасный вариант чаще всего представлены скользящими грыжами пищеводного отверстия диафрагмы. К опасным грыжам относят дефекты диафрагмы через который опасен ущемлениями или когда происходит перемещение больших объемов содержимого брюшной полости в грудную. Безопасные грыжи требуют наблюдения и лишь в некоторых случаях оперативного лечения. Опасные диафрагмальные грыжи нужно оперировать незамедлительно.
http://elibrary.ru/item.asp?id=20924459
Для более полной информации запишитесь на консультацию.
Чем опасна скользящая грыжа пищеводного отверстия диафрагмы.
Сама диафрагмальная грыжа в большинстве случаев безопасна. Однако диафрагмальная грыжа может способствовать развитию заброса содержимого желудка в просвет пищевода – желудочно-пищеводному (гастро-эзофагеальному рефлюксу).
Длительное воздействие кислого (из желудка) или щелочного (из двенадцатиперстной кишки) рефлюктата на пищевод приводит вначале к воспалительным изменениям (эзофагит), затем к изменениям клеток эпителия (метаплазия – пищевод Барретта), а затем к раку пищевода.
Как часто мы наблюдаем грыжи диафрагмы ГЭРБ
Грыжа пищеводного отверстия диафрагмы (ГПОД) и гастроэзофагеальная рефлюксная болезнь (ГЭРБ) являются распространенными заболеваниями в гастроэнтерологии и нередко требуют оперативного лечения. По данным обследования наличие симптомов гастроэзофагеального рефлюкса выявляется у 30-40% населения, причем до 25% пациентов данной группы нуждаются в постоянном медикаментозном, а до 15% — исключительно в хирургическом лечении.
Эндовидеохирургические вмешательства при гаcтроэзофагеальнойрефлюксной болезни и грыжах пищеводного отверстия диафрагмы.
Область пищеводно-желудочного перехода считается анатомически «неудобной», поэтому при традиционной антирефлюксной операции адекватный доступ является ключевой проблемой.
На протяжении последнего столетия методы хирургических вмешательств совершенствовались. Отечественные хирурги Ю.Е.Березов, Б.В.Петровский, Н.Н.Каншин, А.Ф.Черноусов, А.И.Горбашко, А.Г.Земляной внесли неоценимый вклад в разработку антирефлюксных операций, значительно расширив диапазон знаний в этом разделе хирургии.
Основными недостатками открытых операций являются значительное травматическое воздействие на ткани, выраженный болевой синдром в послеоперационном периоде, а также инфекционные осложнения со стороны операционных ран и образование послеоперационных грыж. Независимо от конституции пациента для обеспечения свободного доступа к диафрагмальным ножкам, пищеводу и дну желудка необходима протяженная срединная лапаротомия, нередко с удалением мечевидного отростка.
Новый этап и подъем в лечении ГПОД и ГЭРБ связан с разработкой и внедрением в клиническую практику ЭВХ технологий.
В 1991 году Nathanaon, Cuschieri и Shimi сообщили о первой лапароскопической антирефлюксной операции – гастропексия круглой связкой печени. В том же году B.Dallemagne (Бельгия) и T.Geagea (Канада) впервые произвели лапароскопическую операцию Nissen.
В том же году B.Dallemagne (Бельгия) и T.Geagea (Канада) впервые произвели лапароскопическую операцию Nissen.
С 2000 года в ряде стран среди лапароскопических вмешательств на органах брюшной полости антирефлюксные операции по частоте стали уступать только холецистэктомии.
На сегодняшний день эндовидеохирургические антирефлюксные операции получают в мире широкое распространение и являются методом выбора.
Основными преимуществами лапароскопического доступа являются: хорошая визуализация зоны вмешательства; удобство манипулирования в зоне пищеводно-желудочного перехода; малая травматичность, которая определяет отсутствие выраженного болевого синдрома в раннем послеоперационном периоде; низкий процент образования послеоперационных грыж; хороший косметический эффект; экономическая выгода, связанная с уменьшением сроков госпитализации и расхода лекарственных средств и перевязочных материалов
Показаниями к выполнению эндовидеохирургических вмешательств при ГЭРБ и ГПОД являются:
К настоящему времени сформулированы показания к оперативному лечению ГЭР. Некоторые из них требуют уточнения и дальнейшего обоснования.
Некоторые из них требуют уточнения и дальнейшего обоснования.
1. Отсутствие эффекта от консервативного лечения.
3. Необходимость длительного и интенсивного медикаментозного лечения. Молодые пациенты, страдающие гастроэзофагеальным рефлюксом, наличие которого подтверждено при обследовании, являются идеальными кандидатами для оперативного лечения. Coley и соавт. доказали значительное снижение стоимости и улучшение результатов лечения при хирургическом подходе в группе пациентов моложе 49 лет.
4. Нежелание пациента проводить длительное медикаментозное лечение по причине высокой стоимости последнего, неудобства или опасности побочных эффектов.
5. Несоблюдение пациентом режима медикаментозного лечения.
6. Эзофагит 3-4 степени, сохраняющийся после неоднократных длительных курсов консервативного лечения, в случае чередования кислого и щелочного рефлюкса. Доказано, что прием антисекреторных препаратов у данной группы пациентов неэффективен.
7. Умеренно выраженный эзофагит (1-2 степени) у пациентов с признаками механической недостаточности кардии и частыми эпизодами ГЭР.
8. Наличие аксиальной грыжи пищеводного отверстия диафрагмы с гастроэзофагеальным рефлюксом (как правило, рефрактерным к медикаментозному лечению).
9. Параэзофагеальная ГПОД, даже без признаков ГЭР.
10. Осложненное течение ГЭР, включая образование язвы, стриктуры пищевода, пищевод Баретта, тяжелые легочные осложнения.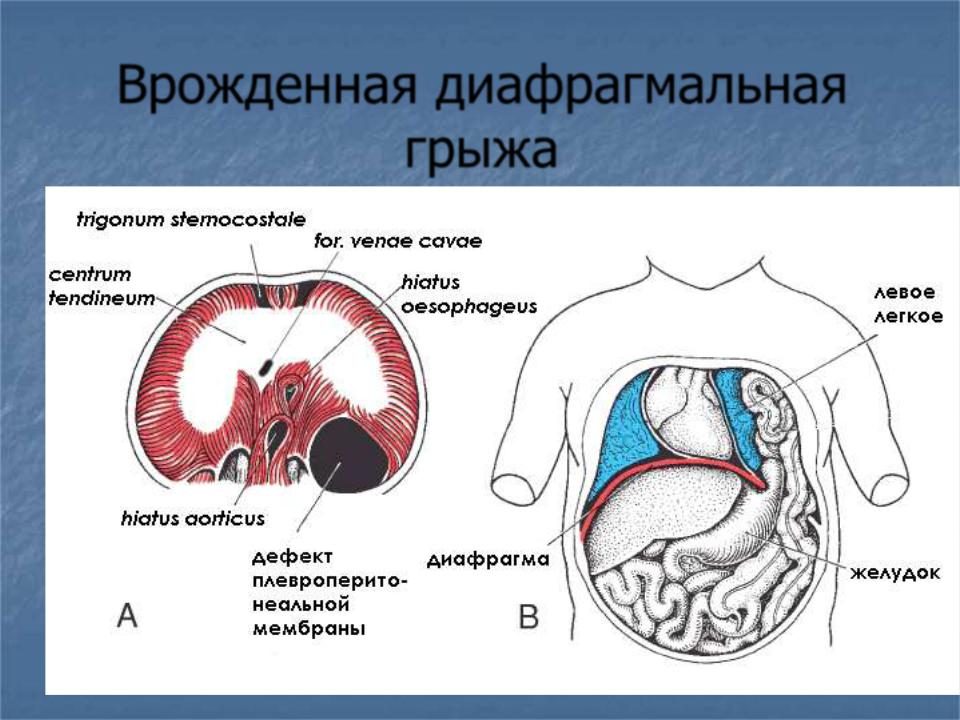
11. Выраженные респираторные проявления ГЭР, такие как аспирация, частые пневмонии, хронический ларингит. Только у 50% пациентов в этой группе отмечаются загрудинные боли, изжога или находки в ходе эндоскопического исследования. Однако комплексное обследование с использованием современных методов позволяет подтвердить наличие гастроэзофагеального рефлюкса.
12. Сопутствующие заболевания брюшной полости, требующие хирургического вмешательства.
Показания к оперативному лечению ГЭРБ могут быть несколько расширены при использовании эндовидеохирургии, как менее травматичного способа вмешательства с относительно низким риском.
В качестве основных противопоказаний к лапароскопическим вмешательствам следует рассматривать: выраженные сердечно-сосудистые нарушения; дыхательную недостаточность; нарушения свертывающей системы крови; поздние сроки беременности; перенесенные ранее операции на верхнем этаже брюшной полости.
Способы оперативного лечения при скользящих грыжах пищеводного отверстия диафрагмы
В настоящее время существует несколько методик лапароскопических антирефлюксных операций, однако способы Nissen, Dor и Toupet упоминаются и анализируются в литературе как наиболее часто используемые.
Выбор метода хирургического пособия зависит от характера основного и сопутствующих заболеваний, предпочтения хирурга, и остается одной из наиболее обсуждаемых проблем в этом разделе хирургии. Как правило, фундопликацию дополняют передней или задней круроррафией. В педиатрической практике для замещения больших грыжевых дефектов иногда используются синтетические протезы.
Результаты лечения дифрагмальных грыж (лапароскопических фундопликаций).
Наша клиника располагает опытом 238 антирефлюксных операций с применением эндовидеохирургических технологий.
Для коррекции функции желудочно-пищеводного перехода нами выполнены следующие виды ЭВХ фундопликаций: по способу Nissen 15(6,3%), по способу Toupet – 35 (14,7%), по способу Dor 188 (79%).
Средняя продолжительность ЭВХ антирефлюксной операции составляет 70-90 минут и зависит от методики фундопликации.
Интраоперационные осложнения отмечены у 5 (2,4%) пациентов (перфорация пищевода -1, повреждение селезенки — 1, повреждение плевры -1, кровотечение из ножки диафрагмы -2). Лишь в 1 наблюдении при перфорации пищевода для устранения возникшего осложнения потребовалась конверсия доступа.
В первые два дня послеоперационного периода пациент может пить. На третий день после операции разрешается прием жидкой пищи, на четвертый – мягкой. На нормальный режим питания с употреблением плотной пищи (хлеб, жесткие фрукты, овощи и др.) пациент переходит с 6-ой недели после операции.
На нормальный режим питания с употреблением плотной пищи (хлеб, жесткие фрукты, овощи и др.) пациент переходит с 6-ой недели после операции.
Обезболивающие препараты в ближайшем послеоперационном периоде используются по необходимости.
По нашему опыту, при отсутствии осложнений большинство пациентов могут быть выписаны из стационара на 3-4 день после операции.
В послеоперационном периоде мы изучили результаты лечения в сроки через 1 и 6 месяцев после операции.
Субъективно в ближайшем послеоперационном периоде у 8 (3,9%) пациентов отмечалась кратковременная дисфагия, которая самостоятельно купировалась к моменту выписки пациентов и связано, вероятно, с послеоперационным отеком в зоне вмешательства.
У одной пациентки после операции по Nissen появились признаки нарушения глотания твердой пищи, боли в эпигастрии. При эндоскопическом исследовании выявлено сужение просвета пищевода в области НПС, затрудняющее проведение эндоскопа, за счет повышенного давления фундопликационной манжеты. Больной проведено два курса эндоскопического бужирования с положительным эффектом.
Больной проведено два курса эндоскопического бужирования с положительным эффектом.
У одной больной пожилого возраста через месяц после фундопликации по Dor симультанно с холецистэктомией появились признаки выраженного гастроэзофагеального рефлюкса. При рентгеноскопии у больной выявлен рецидив грыжи пищеводного отверстия диафрагмы. Поэтому, результат лечения, признан неудовлетворительным.
В остальных случаях отмечены хорошие результаты лечения, в дополнительном медикаментозном лечении пациенты не нуждались, признаков грыжи пищеводного отверстия диафрагмы или недостаточности кардиального жома при рентгенологическом и эндоскопическом исследовании не отмечено.
Для более полной информации запишитесь на консультацию.
Ключевые слова:
диафрагмальные грыжи
лечение грыжи пищеводного отверстия диафрагмы
грыжи диафрагмы
дивертикулы пищевода
грыжи живота
инородные тела пищевода
ГЭРБ
гастроэзофагеальная рефлюксная болезнь
ахалазия кардии
стоимость лечения
новые методы
форум обсуждение
лапароскопия
Лечение диафрагмальной грыжи
Кому необходимо хирургическое лечение при грыже пищеводного отверстия диафрагмы?
Целью хирургического лечения при грыже пищеводного отверстия диафрагмы является устранение или существенное уменьшение имеющихся симптомов грыжи (изжога, дискомфорт и боль в грудной клетке, одышка, срыгивание), а так же восстановление нормальной анатомии.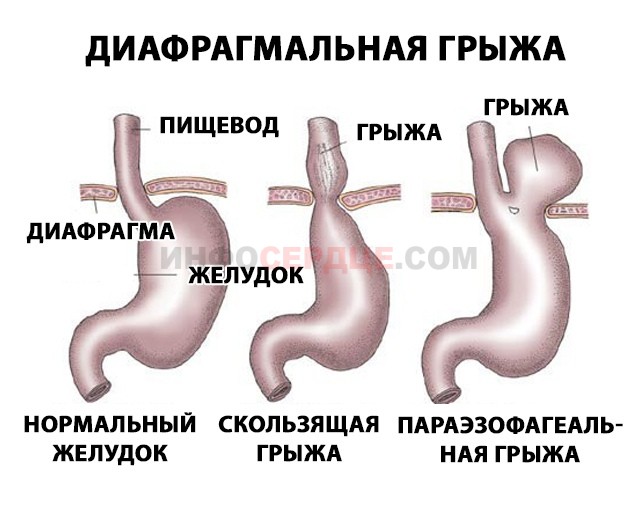
Хирургическое лечение избавляет пациента от необходимости медикаментозного лечения, повышает качество жизни, устраняет угрозу тяжелых осложнений грыжи и рефлюкса в виде ущемления, развития кровотечения, сужения пищевода и т.д., устраняет воспалительный процесс в стенке пищевода и улучшает его функцию.
Устранение грыжи пищеводного отверстия диафрагмы необходимо пациентам с околопищеводной (параэзофагеальной) грыжей из-за риска ее ущемления при наличии симптомов, а так же пациентам со скользящей грыжей пищеводного отверстия диафрагмы, имеющей выраженные клинические проявления в виде изжоги, регургитации (срыгивания) пищей и требующей постоянного медикаментозного лечения. Операция показана пациентам с диафрагмальной грыжей с такими осложнениями как язва пищевода, его сужение (стриктура), пищевод Баррета. Грыжа диафрагмы без выполнения операции с течением времени имеет тенденцию к увеличению, сдавлению легких и органов средостения, может привести к ущемлению. У пациентов с атипичными симптомами рефлюкса (рецидивы пневмонии и бронхита, ночной кашель, осиплость голоса) для доказательства связи данных симптомов с диафрагмальной грыжей необходимо проведение рН метрии до операции. При наличии мучительной изжоги у пациентов без диафрагмальной грыжи или с грыжей малых размеров для исключения ахалазии пищевода необходимо проведение манометрии пищевода до операции.
У пациентов с атипичными симптомами рефлюкса (рецидивы пневмонии и бронхита, ночной кашель, осиплость голоса) для доказательства связи данных симптомов с диафрагмальной грыжей необходимо проведение рН метрии до операции. При наличии мучительной изжоги у пациентов без диафрагмальной грыжи или с грыжей малых размеров для исключения ахалазии пищевода необходимо проведение манометрии пищевода до операции.
Рисунок — Различные типы грыжи пищеводного отверстия диафрагмы
Почему лучше выполнять операцию в клинике «Гранд Медика»?
В нашем центре используется только лапароскопический доступ, который легко переносится пациентами, позволяет быстро вернуться к привычному образу жизни и физической активности. Операции выполняет эксперт, специализирующийся на данной проблеме. Проводится диагностика и лечение короткого пищевода в сочетании с диафрагмальной грыжей. Тщательное техническое исполнение методики, зарекомендовавших себя в мире и в России является профилактикой новых патологических синдромов, связанных с операцией. Лапароскопическая фундопликация в нашем центре выполняется в варианте полной или частичной фундопликации («короткий мягкий» Ниссен, методика Тупе). При повторных операциях по поводу диафрагмальной грыжи мы выполняем симметричную фундопликацию по А.Ф. Черноусову, при необходимости выполняем удлинение пищевода.
Тщательное техническое исполнение методики, зарекомендовавших себя в мире и в России является профилактикой новых патологических синдромов, связанных с операцией. Лапароскопическая фундопликация в нашем центре выполняется в варианте полной или частичной фундопликации («короткий мягкий» Ниссен, методика Тупе). При повторных операциях по поводу диафрагмальной грыжи мы выполняем симметричную фундопликацию по А.Ф. Черноусову, при необходимости выполняем удлинение пищевода.
Рисунок — Фундопликация по Ниссену и ушивание ножек диафрагмы (схема)
Применение лучших методик фундопликации, избирательная постановка сетки, соблюдение показаний, поиск и сбережение нервов во время операции позволяет избавить от имеющихся симптомов пациентов с любым типом дифрагмальной грыжи, включая гигантские грыжи с полной миграцией желудка в средостение.
У пациентов с укорочением пищевода, для профилактики осложнений и снижения угрозы рецидива грыжи – одномоментно с удалением грыжи, фундопликацией, выполняем удлинение пищевода по Коллису-Ниссену.
Рисунок — Удлинение пищевода за счет стенки желудка – операция Коллиса-Ниссена (схема)
Пациентам, имеющим патологическое (морбидное) ожирение с индексом массы тела более 35 кг/м2 в сочетании с грыжей пищеводного отверстия диафрагмы имеющей выраженные клинические проявления, согласно существующим международным клиническим рекомендациям, целесообразно выполнение бариатрического вмешательства (шунтирование желудка или продольная гастропластика).
Для профилактики рецидива диафрагмальной грыжи у пациентов с гигантскими грыжами, атрофией (истончением) ножек диафрагмы и, как правило с ожирением, при лапароскопии может быть установлена необходимость постановки сетки – в варианте циркулярной или U-пластики. Для этого в нашем центре вынужденно используется макропористая полипропиленовая сетка с размером ячейки 1,5 мм и более, которая быстро интегрируется в ткани и не имеет тенденции к сморщиванию. Использование подобной сетки сокращает число рецидивов диафрагмальной грыжи в 5-7 раз в отдаленных сроках и сопровождается осложнениями менее чем у 1% пациентов (миграция сетки в просвет пищевода).
Использование подобной сетки сокращает число рецидивов диафрагмальной грыжи в 5-7 раз в отдаленных сроках и сопровождается осложнениями менее чем у 1% пациентов (миграция сетки в просвет пищевода).
Рисунок — Фундопликация по Ниссену в сочетании с U-пластикой грыжи сеткой (схема)
Отличные и хорошие отдаленные результаты хирургического лечения грыжи пищеводного отверстия диафрагмы, отсутствие рецидива грыжи на сроках пять и более лет наблюдают у 80-85%, отсутствие рефлюкса – у 87-92% пациентов после лапароскопической операции.
Диафрагмальная грыжа
Симптомы диафрагмальной грыжи
Проявление диафрагмальных грыж обусловлено перемещением в грудную клетку органов брюшной полости, их перегибом в грыжевых воротах, а также сдавлением легкого и смещением средостения в здоровую сторону. Симптомы зависят от того, какие органы были вовлечены в патологический процесс. При грыже пищеводного отверстия диафрагмы больные жалуются на изжогу, отрыжку, боли в верхней части живота, грудной клетке и подреберье, одышку и сердцебиение после приема пищи, особенно обильной. Натощак, как правило, этих явлений не наблюдается. У некоторых больных после еды возникает рвота, приносящая облегчение. Характерными симптомами являются ощущаемые больными звуки «бульканья и урчания» в грудной клетке.
При грыже пищеводного отверстия диафрагмы больные жалуются на изжогу, отрыжку, боли в верхней части живота, грудной клетке и подреберье, одышку и сердцебиение после приема пищи, особенно обильной. Натощак, как правило, этих явлений не наблюдается. У некоторых больных после еды возникает рвота, приносящая облегчение. Характерными симптомами являются ощущаемые больными звуки «бульканья и урчания» в грудной клетке.
Диагноз грыжи пищеводного отверстия диафрагмы
Устанавливают на основании жалоб, анамнеза, осмотра и инструментальной диагностики, основными методами которой являются: компьютерная томография с использованием водорастворимого йодсодержащего препарата, полипозиционная рентгеноскопия пищевода и желудка при помощи контрастирования йодсодержащим веществом, эзофагогастродуоденоскопия.
Осложнения грыжи пищеводного отверстия диафрагмы
Чаще всего бывает рефлюкс-эзофагит, эрозийный эзофагит (эрозии в пищеводе), пищевод Баррета, пептическая язва пищевода, при длительном течении которой может произойти рубцовый стеноз (сужение) пищевода. Ущемление грыжи в пищеводном отверстии диафрагмы, что свою очередь может привести к очень серьезным последствиям (некрозу внутренних органов).
Ущемление грыжи в пищеводном отверстии диафрагмы, что свою очередь может привести к очень серьезным последствиям (некрозу внутренних органов).
Лечение грыжи пищеводного отверстия диафрагмы
На первом этапе совместно с гастроэнтерологом применяются препараты для уменьшения желудочной секреции и снижения кислотной активности желудочного содержимого, нормализации желудочно-кишечного тракта. Показаниями к оперативному лечению являются отсутствие эффекта от консервативного лечения и развитие осложнений. В настоящее время существуют два основных метода хирургического лечения диафрагмальной грыжи (фундопликация по Nissen, фундопликация по Toupe), которые выполняются лапароскопическим способом. Своевременно выполненная операция избавляет пациента от вынужденного постоянного приема лекарственных препаратов, отказа от приема пищи (ввиду наличия рвоты) и возможных осложнений, которыми чревата запущенная форма диафрагмальной грыжи. После перенесенной операции пациент забывает о дискомфорте и продолжает вести нормальный образ жизни.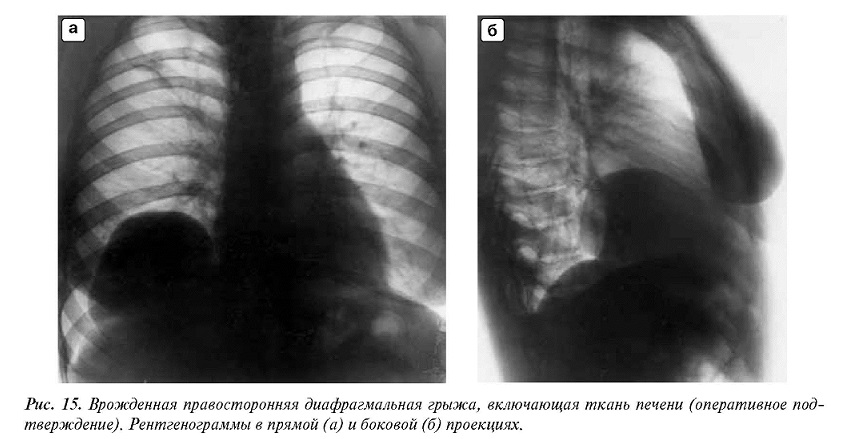
Диафрагмальная грыжа
Что такое диафрагмальная грыжа и как она образуется?
Под грыжей обычно понимают смещение части органа в соседнюю полость. При диафрагмальной грыже происходит смещение части пищевода или желудка в грудную полость.
Диафрагма является важной мышцей, участвующей в дыхании. Она разделяет грудную и брюшную полости. Диафрагма состоит из связок и тканей, которые по тем или иным причинам (чаще всего наследственным) обладают повышенной эластичностью. Диафрагма открывается в трех местах — область пищевода, главной артерии и большой полой вены. Повышенная эластичность и частичная открытось диафрагмы являются факторами риска для появления грыжи. Иногда грыжа возникает из-за беременности, ожирения и тяжелых физических нагрузок.
Каковы симптомы диафрагмальной грыжи?
Типичными симптомами диафрагмальной грыжи являются изжога, отрыжка, боли в грудной клетке, верхней части живота, часто бывает одышка и сильное сердцебиение. Следует также обратить внимание, если вы ощущаете урчание в области грудной клетки. Следствием диафрагмальной грыжи бывает заболевание, которое называется рефлюкс-эзофагит. Оно имеет те же самые симптомы и требует серьезного наблюдения.
Следствием диафрагмальной грыжи бывает заболевание, которое называется рефлюкс-эзофагит. Оно имеет те же самые симптомы и требует серьезного наблюдения.
Какие методы диагностики существуют, чтобы выявить диафрагмальную грыжу?
После клинической беседы с гастроэнтерологом, как правило, назначается гастроскопия — эндоскопическое обследование пищевода и желудка. На сегодняшний день данное обследование является самым эффективным средством диагностики диафрагмальной грыжи. Оно является абсолютно безболезненным и не причиняет никаких неприятных ощущений, т.к. проводится под легким нарком (под седацией).
Каковы методы лечения и необходима ли операция?
В зависимости от размера грыжи назначается терапия — консервативная или оперативное вмешательство. Маленькие грыжи не являются показанием для операции. В данном случае пациенту необходимо придерживаться щадящей диеты и, при наличии жалоб, принимать препараты для уменьшения желудочной секреции и снижения кислотности желудочного сока.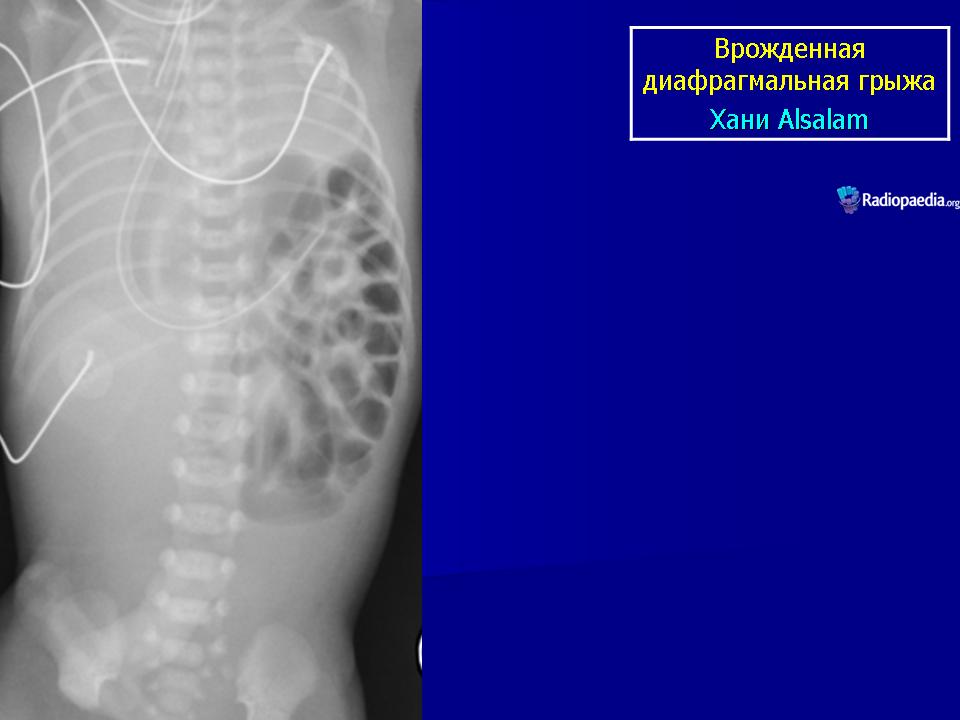 Не рекомендуется поднимать тяжести и заниматься тяжелой физической работой. Если диафрагмальная грыжа достигает больших размеров и пациент имеет жалобы, то ее необходимо оперировать. В частной клинике «Дёблинг» проводятся лапароскопические операции по устранению диафрагмальных грыж. Это небольшое оперативное вмешательство, которое почти всегда является мини-инвазивным. Суть операции диафрагмальной грыжи — восстановление первоначального анатомического состояния внутренних органов и закрытие образовавшегося при грыже отверстия.
Не рекомендуется поднимать тяжести и заниматься тяжелой физической работой. Если диафрагмальная грыжа достигает больших размеров и пациент имеет жалобы, то ее необходимо оперировать. В частной клинике «Дёблинг» проводятся лапароскопические операции по устранению диафрагмальных грыж. Это небольшое оперативное вмешательство, которое почти всегда является мини-инвазивным. Суть операции диафрагмальной грыжи — восстановление первоначального анатомического состояния внутренних органов и закрытие образовавшегося при грыже отверстия.
Могут ли возникнуть осложнения после такой операции?
Осложнения могут возникнуть после любого оперативного вмешательства. Это встречается крайне редко, но пациент несомненно должен знать о них. Есть риск кровотечения, послеоперационных болей, инфекций, тромбозов, тошнота, потеря аппетита, поносы, запоры и др. Обычно такая операция переносится довольно легко, и симптомы заболевания после операции пропадают.
Как долго длится восстановительный период после операции?
В больнице пациент проводит обычно 3 дня, после выписки необходимо придерживаться диеты и избегать тяжелых нагрузок примерно 4 — 6 недель.
Вы также можете пройти диагностику ГЭРБ в частной клинике «Дёблинг»: предложения по диагностике
Диафрагмальные грыжи в плановой торакальной хирургии
Среди неопухолевых заболеваний грыжи диафрагмы различного этиопатогенеза являются наиболее распространенным патологическим процессом этого органа. Они могут возникать в результате недоразвития диафрагмы, ее травматического повреждения, а также из-за различного рода воспалительных и дегенеративных изменений. Диафрагмальные грыжи (ДГ) представляют собой неоднородную группу заболеваний, и различные их виды могут существенно отличаться друг от друга по клиническим проявлениям и способам лечения. Ситуация усугубляется еще и за счет того факта, что лечением этих больных занимаются врачи различных специальностей. Разнообразные размеры и локализация грыжевых ворот, а также симптомы ущемления выпавших органов приводят к самым различным вариантам течения заболевания ― от бессимптомных форм до выраженной клинической картины. Единого мнения в отношении диагностических алгоритмов, а также сроков и способа хирургического лечения ДГ в настоящее время нет. В последние годы в литературе появляются работы, посвященные как первичному устранению дефекта диафрагмы, так и использованию различных синтетических и биологических материалов. Дискуссионными остаются вопрос показаний к аллопластике диафрагмы и преимущества того или иного материала.
Единого мнения в отношении диагностических алгоритмов, а также сроков и способа хирургического лечения ДГ в настоящее время нет. В последние годы в литературе появляются работы, посвященные как первичному устранению дефекта диафрагмы, так и использованию различных синтетических и биологических материалов. Дискуссионными остаются вопрос показаний к аллопластике диафрагмы и преимущества того или иного материала.
Цель нашего исследования ― на основании изучения результатов хирургического лечения пациентов с грыжами слабых зон диафрагмы и посттравматическими ДГ уточнить показания к различным вариантам операций.
Материал и методы
В период с 1963 по 2016 г. были пролечены 36 пациентов с Д.Г. Возраст больных варьировал от 17 до 68 лет и в среднем составил 47,4 года. Большинство (83%) пациентов оперировали в трудоспособном возрасте (от 18 до 60 лет). Женщин было 23 (63,9%), мужчин ― 13 (36,1%).
У 27 (75%) больных диагностировали грыжи слабых зон диафрагмы, у 9 (25%) ― посттравматические грыжи. В последних случаях грыжи диагностировали в отдаленном периоде после травмы. Среди грыж слабых зон диафрагмы преобладали грыжи Морганьи ― 12 (33,3%), грыжи Ларрея и Богдалека встречались реже ― у 9 (25%) и 6 (16,7%) пациентов соответственно (см. таблицу). Вид диафрагмальной грыжи и ее локализация (n=36)
В последних случаях грыжи диагностировали в отдаленном периоде после травмы. Среди грыж слабых зон диафрагмы преобладали грыжи Морганьи ― 12 (33,3%), грыжи Ларрея и Богдалека встречались реже ― у 9 (25%) и 6 (16,7%) пациентов соответственно (см. таблицу). Вид диафрагмальной грыжи и ее локализация (n=36)
Посттравматическая диафрагмальная грыжа (ПДГ) у 6 (62,5%) пациентов возникла после автотравмы, кататравмы ― у 2 (25) больных и проникающего колото-резаного ранения у 1 (12,5%) больного. При этом диагноз длительное время не был установлен. Так, у 8 (88,9%) из 9 пациентов грыжу выявили только спустя несколько лет, а у 1 пострадавшего после проникающего ранения грудной клетки ― даже через 20 лет.
Достаточно часто ДГ протекали без симптомов. Так, у 9 (25%) пациентов заболевание диагностировали только по наличию патологической тени в проекции диафрагмы и средостения при проведении диспансеризации, при профилактическом рентгенологическом обследовании органов грудной клетки. Клинические проявления грыж слабых зон диафрагмы и ПДГ были схожи. Наиболее часто пациенты ― 14 (38,9%) человек ― жаловались на одышку различной степени выраженности. Реже отмечались умеренная боль и ощущение тяжести в соответствующей половине грудной клетки ― у 10 (27,8%), а также неприятные ощущения в области сердца ― у 7 (19,4%), кашель ― у 6 (16,7%) пациентов. Диспепсические проявления, связанные с дислокацией желудка, отмечены только у 2 (5,6%) больных с посттравматическими грыжами левого купола диафрагмы.
Клинические проявления грыж слабых зон диафрагмы и ПДГ были схожи. Наиболее часто пациенты ― 14 (38,9%) человек ― жаловались на одышку различной степени выраженности. Реже отмечались умеренная боль и ощущение тяжести в соответствующей половине грудной клетки ― у 10 (27,8%), а также неприятные ощущения в области сердца ― у 7 (19,4%), кашель ― у 6 (16,7%) пациентов. Диспепсические проявления, связанные с дислокацией желудка, отмечены только у 2 (5,6%) больных с посттравматическими грыжами левого купола диафрагмы.
Как правило, физикальное обследование пациентов было малоинформативным. Основным методом диагностики заболеваний диафрагмы остается лучевой, что касается и выявления ее грыж. На рентгенограмме органов грудной клетки определяли дополнительную тень различных размеров, располагающуюся в переднем кардиодиафрагмальном углу при парастернальных грыжах, позвоночно-диафрагмальном углу ― при грыжах Богдалека и проекции купола диафрагмы ― при посттравматических грыжах. С появлением высокоразрешающей компьютерной томографии (КТ) последняя стала методом выбора, и ее выполнили всем пациентам.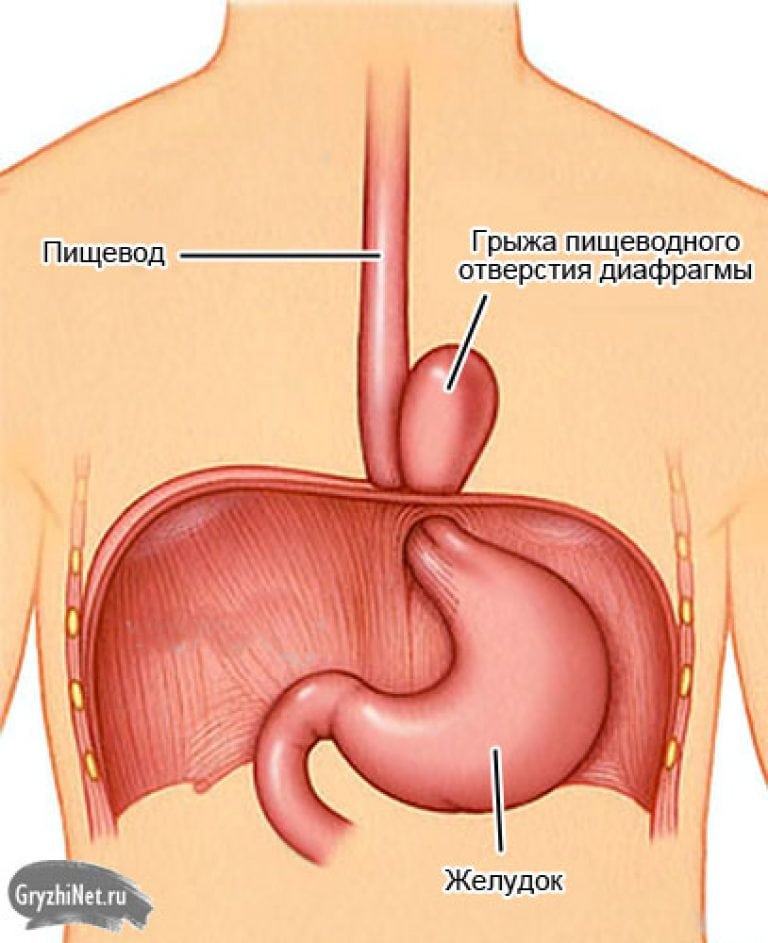 Это позволило исключить онкологические заболевания диафрагмы и средостения, а также подтвердить наличие диафрагмального дефекта и уточнить характер грыжевого содержимого. В качестве дополнительного метода пациентам выполняли ультразвуковое исследование (УЗИ), позволяющее в ряде случаев визуализировать печень и петли кишок, переместившихся через дефект диафрагмы в грудную клетку.
Это позволило исключить онкологические заболевания диафрагмы и средостения, а также подтвердить наличие диафрагмального дефекта и уточнить характер грыжевого содержимого. В качестве дополнительного метода пациентам выполняли ультразвуковое исследование (УЗИ), позволяющее в ряде случаев визуализировать печень и петли кишок, переместившихся через дефект диафрагмы в грудную клетку.
Диагноз ДГ установили до операции у 26 (72,2%) больных. У 9 (25%) пациентов, не имеющих жалоб и оперированных до появления КТ (в нашем исследовании ― до 1980 г.), диагноз установили только после торакотомии. Основу диагностики у последних больных составляло стандартное рентгенологическое исследование, а операцию выполняли в связи с подозрением на опухоль средостения. Введение в протокол обследования больных мультиспиральной компьютерной томографии (МСКТ) позволило в дальнейшем безошибочно диагностировать Д.Г. При этом показанием к оперативному лечению при грыжах слабых зон диафрагмы служили большой размер грыжи с компрессионным синдромом и наличие клинических проявлений заболевания.
У большинства (32) больных в качестве оперативного доступа использовали торакотомию. Лишь у 2 пациентов с грыжами Морганьи использовали лапаротомию, а 1 больному с грыжей Ларрея операцию произвели через стернотомный доступ. Применение сетчатого эндопротеза для укрепления диафрагмы потребовалось 2 пациентам.
Торакотомный доступ выполняли в шестом или седьмом межреберье. При парастернальных грыжах в переднем кардиодиафрагмальном углу обнаруживали грыжевой мешок. Последний вскрывали, и его содержимое перемещали обратно в брюшную полость. Грыжевой мешок иссекали, а пластику диафрагмы осуществляли первичным швом. Край диафрагмы подшивали к надкостнице реберной дуги. При грыжах Богдалека через дефект диафрагмы во всех случаях пролабировала забрюшинная клетчатка. При этом погрузить ее обратно в забрюшинное пространство не удалось. Клетчатку частично резецировали, после чего освободившиеся края диафрагмы сшивали между собой.
При посттравматических грыжах в плевральной полости выявляли спаечный процесс.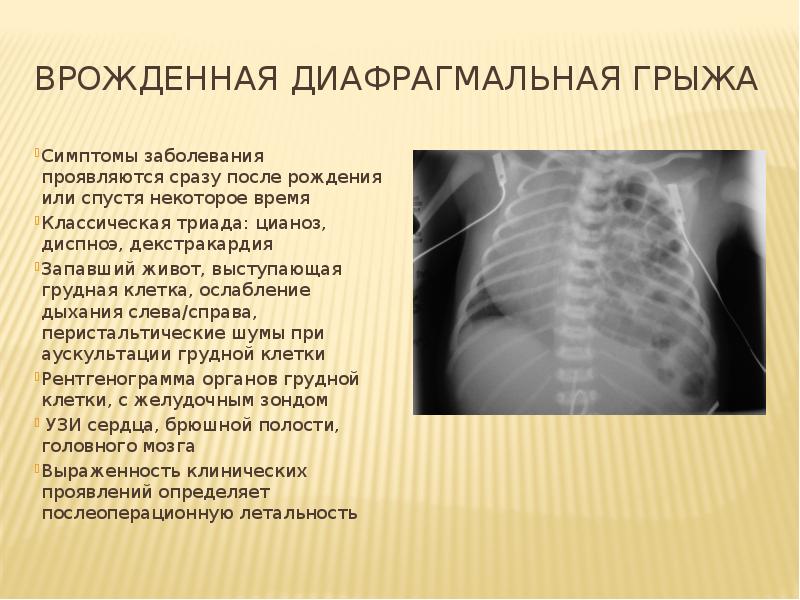 Его выраженность значительно варьировала, но всегда оставалась возможность пересечь спайки и мобилизовать содержимое плевральной полости и верхних отделов живота. После мобилизации краев диафрагмы переместившиеся в плевральную полость органы возвращали в анатомическую позицию. В подавляющем большинстве случаев дефект диафрагмы устранили первичным швом. Для этого использовали отдельные нерассасывающиеся швы (в последние годы ― пролен 0−0) на атравматической игле. В 2 случаях при обширных посттравматических дефектах левого купола диафрагмы, когда площадь дефекта диафрагмы превышала 25 см3, использовали полипропиленовую сетку.
Его выраженность значительно варьировала, но всегда оставалась возможность пересечь спайки и мобилизовать содержимое плевральной полости и верхних отделов живота. После мобилизации краев диафрагмы переместившиеся в плевральную полость органы возвращали в анатомическую позицию. В подавляющем большинстве случаев дефект диафрагмы устранили первичным швом. Для этого использовали отдельные нерассасывающиеся швы (в последние годы ― пролен 0−0) на атравматической игле. В 2 случаях при обширных посттравматических дефектах левого купола диафрагмы, когда площадь дефекта диафрагмы превышала 25 см3, использовали полипропиленовую сетку.
Операции по поводу ДГ в условиях специализированного отделения достаточно безопасны. Все оперированные больные были выписаны. Послеоперационные осложнения возникли у 4 (11,1%) пациентов, в том числе у 2 человек, которым использовали синтетический сетчатый эндопротез. У этих больных в ближайшие сутки после удаления дренажей диагностировали скопление жидкости на стороне операции, что потребовало пункции с хорошим окончательным эффектом.
Отдаленные результаты изучили путем анкетирования. Учитывая, что период исследования охватывает значительный период времени, отдаленный результат удалось проследить у 15 пациентов в сроки от 6 мес до 17 лет. У всех пациентов, которые до операции предъявляли жалобы на одышку, в отдаленном периоде отмечено значимое уменьшение ее степени. Каких-либо других жалоб, согласно анкетированию, у больных не было. При контрольном рентгенологическом обследовании ни у одного пациента рецидива ДГ не отмечено.
Операции на диафрагме в структуре хирургических болезней делают относительно редко. Число подобных пациентов остается небольшим, за исключением больных с грыжей пищеводного отверстия диафрагмы. В литературе имеется множество классификаций Д.Г. Однако в клинической практике, на наш взгляд, удобно пользоваться классификацией, предложенной Б.В. Петровским, где все ДГ делят на 2 больших класса: травматические и нетравматические [3]. В свою очередь нетравматические ДГ разделяют на врожденные ДГ, грыжи слабых зон диафрагмы и атипичной локализации, грыжи естественных отверстий диафрагмы (см.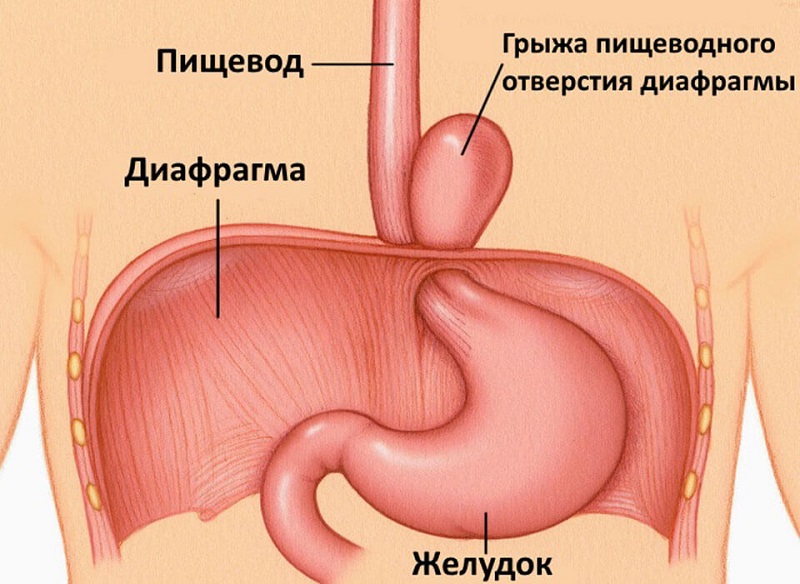 рис. 1). Рис. 1. Слабые места диафрагмы. 1 ― грудино-реберный треугольник; 2 ― пояснично-реберный треугольник.
рис. 1). Рис. 1. Слабые места диафрагмы. 1 ― грудино-реберный треугольник; 2 ― пояснично-реберный треугольник.
Грыжа пищеводного отверстия диафрагмы является наиболее часто встречающейся ДГ у взрослых. Выделение этих грыж в отдельную группу оправдано особенностями диагностики и тактики лечения. Традиционно лечением подобных пациентов занимаются абдоминальные хирурги, и этому вопросу посвящено большое число соответствующих исследований. Грыжи слабых анатомических зон диафрагмы и посттравматические дефекты являются наиболее часто встречающимся заболеванием диафрагмы в практике торакального хирурга.
Эмбриональное недоразвитие мышечной части диафрагмы приводит к формированию слабого места, а провоцирующие факторы, повышающие внутрибрюшное давление, способствуют развитию грыжевого мешка [6, 18, 25, 38, 39, 63]. Наиболее актуальные из них ― повышенная физическая нагрузка, ожирение, беременность. Нарушение формирования передней части плевроперитонеальной мембраны приводит к формированию дефекта в костостернальном треугольнике (см. рис. 2). Рис. 2. Схема формирования парастернальной диафрагмальной грыжи (схема).
рис. 2). Рис. 2. Схема формирования парастернальной диафрагмальной грыжи (схема).
Впервые грыжу этой локализации описал G. Morgagni в 1761 г. [52]. В литературе можно встретить различные названия ДГ данного типа. Некоторые авторы присваивают им имя Ларрея, другие используют для правосторонних грыж термин «грыжа Морганьи», а для левосторонних ― «грыжа Ларрея». Также применяют такие термины, как «субкостостернальная грыжа», «ретрокостоксифоидальная грыжа», «ретростернальная грыжа», «парастернальная грыжа» или просто «передняя диафрагмальная грыжа» [58]. Передние Д.Г. ― наиболее редкий тип, составляющий лишь около 3% от общей численности пациентов с подобными заболеваниями. T. Comer и O. Clagett описали всего 54 (3%) случая грыж данной локализации в серии из 1750 пациентов с ДГ, обобщив опыт клиники Майо (США) [19]. Аналогичные данные получил и S. Harrington, который сообщил о 14 среди 534 пациентов [33]. Около 90% передних ДГ локализуются справа, у 8% больных носят двусторонний характер, и только 2% ДГ ― левосторонние. Среди наших пациентов передняя ДГ отмечалась у 21 человека, что составило самую многочисленную группу. Среди них дефект диафрагмы располагался справа у 12 больных, у 9 ― слева. Двустороннее поражение не наблюдалось. M. Aghajanzadeh [7], соглашаясь с большим числом авторов [35, 42, 60, 63, 73], отмечает более высокую заболеваемость у женщин и лиц с избыточной массой тела. В отличие от грыж Богдалека, грыжи Морганьи и Ларрея, как правило, являются истинными и имеют грыжевой мешок, содержимым которого могут быть большой сальник, толстая кишка или желудок [73]. У всех наших пациентов грыжи данной локализации носили истинный характер, а наиболее часто в грыжевом мешке обнаруживали большой сальник. У большинства пациентов жалоб не было, и заболевание обнаружили лишь при рутинном рентгенологическом исследовании [73]. С другой стороны, J. Horton [35], проанализировав 298 случаев грыж Морганьи и Ларрея, упоминавшихся в литературе с 1951 по 2006 г., отмечал, что только в 28% ДГ были действительно бессимптомны, остальные же пациенты имели клинические проявления, из которых наиболее частыми являлись респираторные симптомы.
Среди наших пациентов передняя ДГ отмечалась у 21 человека, что составило самую многочисленную группу. Среди них дефект диафрагмы располагался справа у 12 больных, у 9 ― слева. Двустороннее поражение не наблюдалось. M. Aghajanzadeh [7], соглашаясь с большим числом авторов [35, 42, 60, 63, 73], отмечает более высокую заболеваемость у женщин и лиц с избыточной массой тела. В отличие от грыж Богдалека, грыжи Морганьи и Ларрея, как правило, являются истинными и имеют грыжевой мешок, содержимым которого могут быть большой сальник, толстая кишка или желудок [73]. У всех наших пациентов грыжи данной локализации носили истинный характер, а наиболее часто в грыжевом мешке обнаруживали большой сальник. У большинства пациентов жалоб не было, и заболевание обнаружили лишь при рутинном рентгенологическом исследовании [73]. С другой стороны, J. Horton [35], проанализировав 298 случаев грыж Морганьи и Ларрея, упоминавшихся в литературе с 1951 по 2006 г., отмечал, что только в 28% ДГ были действительно бессимптомны, остальные же пациенты имели клинические проявления, из которых наиболее частыми являлись респираторные симптомы. Принимая во внимание редкость грыж данной локализации и трудность диагностики, достаточно проблематично выделить преобладающий симптом или группу симптомов. Передние Д.Г. могут сопровождаться неспецифичными симптомами: дискомфортом в эпигастральной области, давящей болью за грудиной, тошнотой, запорами и др. [7, 13, 37]. Эти положения также подтверждены собственными данными. У 6 (28,6%) пациентов клинических проявлений заболевания не было, а у 15 (71,4%) диагностировали различные неспецифические респираторные симптомы. Редко у больных могут возникать симптомы, связанные с ущемлением содержимого грыжевого мешка, кишечной непроходимостью, а также перфорацией полого органа [38, 44]. Эти случаи требуют экстренных оперативных вмешательств, а их предоперационная диагностика затруднена. Подобных пациентов в плановой торакальной хирургии мы не наблюдали.
Принимая во внимание редкость грыж данной локализации и трудность диагностики, достаточно проблематично выделить преобладающий симптом или группу симптомов. Передние Д.Г. могут сопровождаться неспецифичными симптомами: дискомфортом в эпигастральной области, давящей болью за грудиной, тошнотой, запорами и др. [7, 13, 37]. Эти положения также подтверждены собственными данными. У 6 (28,6%) пациентов клинических проявлений заболевания не было, а у 15 (71,4%) диагностировали различные неспецифические респираторные симптомы. Редко у больных могут возникать симптомы, связанные с ущемлением содержимого грыжевого мешка, кишечной непроходимостью, а также перфорацией полого органа [38, 44]. Эти случаи требуют экстренных оперативных вмешательств, а их предоперационная диагностика затруднена. Подобных пациентов в плановой торакальной хирургии мы не наблюдали.
Входными воротами при грыжах заднего отдела диафрагмы является щелевидный пристеночный дефект в пояснично-реберном отделе. В 1848 г.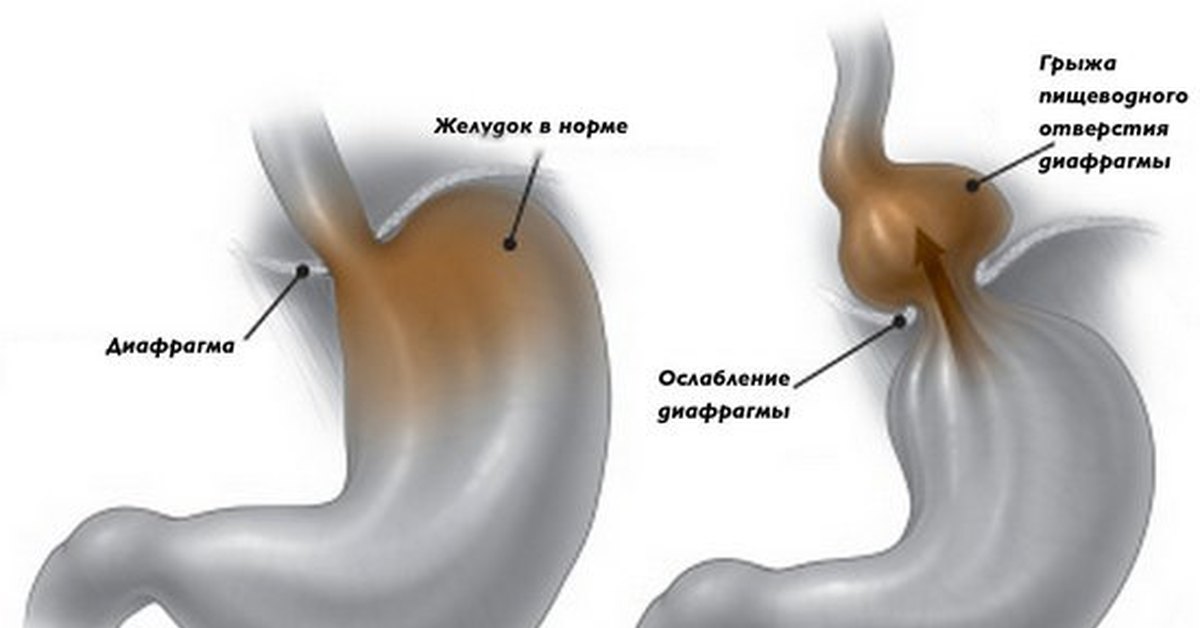 V. Bochdalek сообщил о 2 больных с врожденной ДГ, которая, как он считал, была вызвана разрывом мембраны в люмбокостальном треугольнике [16]. С тех пор врожденные грыжи заднего отдела диафрагмы принято называть грыжами Богдалека. У взрослых пациентов грыжи этой локализации диагностируют крайне редко, и они, как правило, являются случайными находками в силу более частого бессимптомного течения. Среди 6 пациентов с грыжами Богдалека, наблюдаемых нами, 3 (50%) не имели жалоб. Оценить истинную распространенность грыж Богдалека среди взрослого населения проблематично. Так, M. Mullins [53], основываясь на большом ретроспективном исследовании более чем 13 тыс. КТ, указывает на распространенность этого заболевания в 0,17%. Другие исследования с использованием МСКТ демонстрируют более высокую частоту в пределах 6―12% [8, 76]. В 70―80% грыжи Богдалека встречаются слева из-за раннего закрытия правого плевроперитонеального канала и протективного действия печени. В то же время M. Mullins [53] наблюдал правосторонние заднелатеральные грыжи в 68%, а двусторонние ― в 14%.
V. Bochdalek сообщил о 2 больных с врожденной ДГ, которая, как он считал, была вызвана разрывом мембраны в люмбокостальном треугольнике [16]. С тех пор врожденные грыжи заднего отдела диафрагмы принято называть грыжами Богдалека. У взрослых пациентов грыжи этой локализации диагностируют крайне редко, и они, как правило, являются случайными находками в силу более частого бессимптомного течения. Среди 6 пациентов с грыжами Богдалека, наблюдаемых нами, 3 (50%) не имели жалоб. Оценить истинную распространенность грыж Богдалека среди взрослого населения проблематично. Так, M. Mullins [53], основываясь на большом ретроспективном исследовании более чем 13 тыс. КТ, указывает на распространенность этого заболевания в 0,17%. Другие исследования с использованием МСКТ демонстрируют более высокую частоту в пределах 6―12% [8, 76]. В 70―80% грыжи Богдалека встречаются слева из-за раннего закрытия правого плевроперитонеального канала и протективного действия печени. В то же время M. Mullins [53] наблюдал правосторонние заднелатеральные грыжи в 68%, а двусторонние ― в 14%.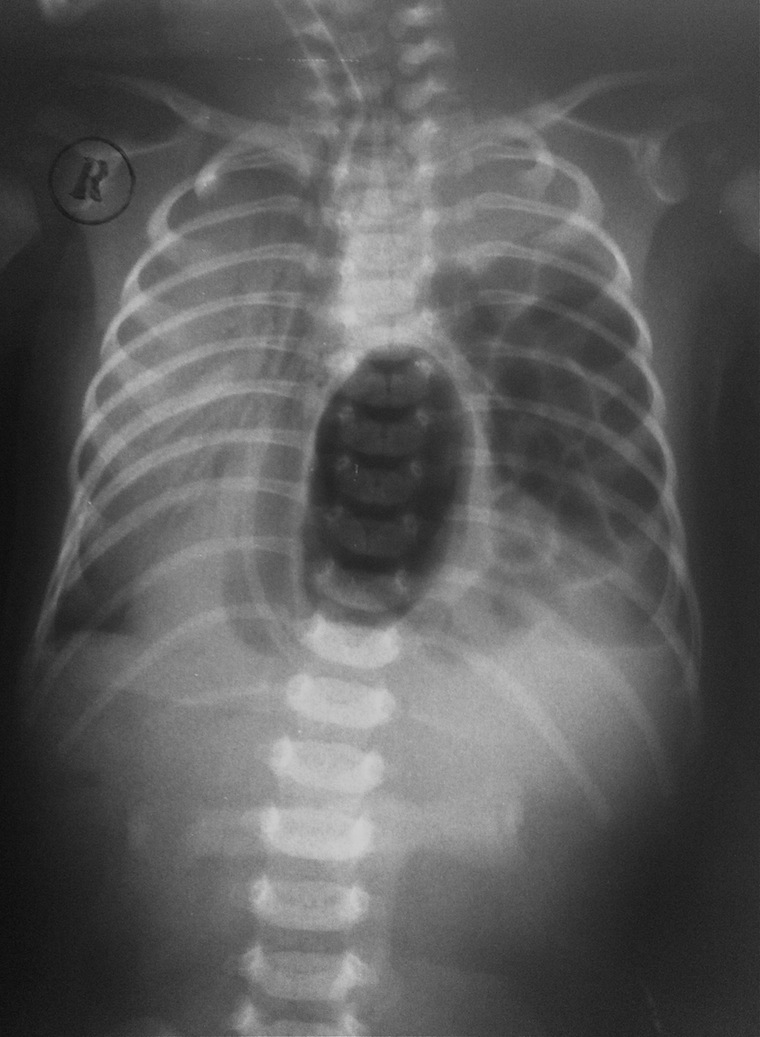 Дефект может иметь различные размеры, и чем меньше дефект, тем лучше бывает выражен мышечный валик из остатков диафрагмы по ее реберному краю. Обычно валик хорошо выражен у заднего края реберной дуги и исчезает в боковой ее части. Грыжевой мешок обычно отсутствует, и органы брюшной полости непосредственно проникают в плевральную полость [17]. В редких случаях (15―20%) они могут быть отделены от легкого остатками париетальной плевры или брюшины (переходная форма грыжи). Мы наблюдали 2 пациентов с правосторонней локализацией грыжи Богдалека и 4 ― с левосторонней. При этом все грыжи были ложными (т.е. не имели грыжевого мешка). Чаще всего в плевральную полость смещаются селезенка, большой сальник, толстая и тонкая кишка, реже, обычно при больших дефектах, ― желудок и часть левой доли печени. В литературе описаны случаи расположения в грыжевом мешке почки, аппендикса [20]. В отличие от новорожденных, у которых грыжа Богдалека обычно больших размеров, и дыхательные и сердечно-сосудистые расстройства возникают уже в первые часы после рождения, у взрослых она чаще протекает бессимптомно [46].
Дефект может иметь различные размеры, и чем меньше дефект, тем лучше бывает выражен мышечный валик из остатков диафрагмы по ее реберному краю. Обычно валик хорошо выражен у заднего края реберной дуги и исчезает в боковой ее части. Грыжевой мешок обычно отсутствует, и органы брюшной полости непосредственно проникают в плевральную полость [17]. В редких случаях (15―20%) они могут быть отделены от легкого остатками париетальной плевры или брюшины (переходная форма грыжи). Мы наблюдали 2 пациентов с правосторонней локализацией грыжи Богдалека и 4 ― с левосторонней. При этом все грыжи были ложными (т.е. не имели грыжевого мешка). Чаще всего в плевральную полость смещаются селезенка, большой сальник, толстая и тонкая кишка, реже, обычно при больших дефектах, ― желудок и часть левой доли печени. В литературе описаны случаи расположения в грыжевом мешке почки, аппендикса [20]. В отличие от новорожденных, у которых грыжа Богдалека обычно больших размеров, и дыхательные и сердечно-сосудистые расстройства возникают уже в первые часы после рождения, у взрослых она чаще протекает бессимптомно [46]. O. Temizöz [76] указывает на преобладание бессимптомного течения заболевания у лиц женского пола. В ряде случаев возникают гастроинтестинальные симптомы, связанные прежде всего с ущемлением и нарушением проходимости органа, попавшего в грыжевой мешок. Реже диагностируют респираторные симптомы [12, 31, 45, 75]. Характерно, что эти проявления заболевания могут быть преходящими, а содержимое грыжевого мешка периодически самостоятельно вправляться в брюшную полость [57].
O. Temizöz [76] указывает на преобладание бессимптомного течения заболевания у лиц женского пола. В ряде случаев возникают гастроинтестинальные симптомы, связанные прежде всего с ущемлением и нарушением проходимости органа, попавшего в грыжевой мешок. Реже диагностируют респираторные симптомы [12, 31, 45, 75]. Характерно, что эти проявления заболевания могут быть преходящими, а содержимое грыжевого мешка периодически самостоятельно вправляться в брюшную полость [57].
Основу инструментального обследования при грыжах слабых зон диафрагмы составляют лучевые методы ― рентгенография, КТ, а также магнитно-резонансная томография (МРТ), которые позволяют уточнить локализацию и размеры диафрагмального дефекта, а также состав грыжевого содержимого и состояние переместившихся органов. Главным признаком как истинной, так и ложной ДГ, определяемым всеми лучевыми методами, служит появление в грудной полости патологического образования. Структура тени зависит от содержимого грыжи, в которой может оказаться практически любой орган брюшной полости. Соответственно на рентгенограммах и компьютерных томограммах в грудной полости могут обнаруживать петли кишок, содержащие газ, раздутый газом желудок или однородную тень паренхиматозного органа. Рентгенологическая картина может иметь непостоянный характер, что связано с изменением положения и величины газовых пузырей, количества грыжевого содержимого. С целью уточнения содержимого грыжи полезны рентгеноконтрастные методы. Контрастирование желудка и кишечника позволяет определить в составе грыжи полый орган, внутривенная урография ― почку, а сцинтиграфия ― печень или селезенку. Когда же в состав грыжи входит только сальник, то тень образования однородная, и приходится ее дифференцировать от других патологических образований средостения. В этом случае более информативны КТ и МРТ, позволяющие более детально оценить структуру образования.
Соответственно на рентгенограммах и компьютерных томограммах в грудной полости могут обнаруживать петли кишок, содержащие газ, раздутый газом желудок или однородную тень паренхиматозного органа. Рентгенологическая картина может иметь непостоянный характер, что связано с изменением положения и величины газовых пузырей, количества грыжевого содержимого. С целью уточнения содержимого грыжи полезны рентгеноконтрастные методы. Контрастирование желудка и кишечника позволяет определить в составе грыжи полый орган, внутривенная урография ― почку, а сцинтиграфия ― печень или селезенку. Когда же в состав грыжи входит только сальник, то тень образования однородная, и приходится ее дифференцировать от других патологических образований средостения. В этом случае более информативны КТ и МРТ, позволяющие более детально оценить структуру образования.
ПДГ возникают в результате перемещения органов брюшной полости в грудную клетку через дефект диафрагмы, образовавшийся в результате различного рода повреждений. Травмы грудной клетки и живота сопровождаются повреждением диафрагмы в 0,5―30%. До 40―62% случаев повреждения диафрагмы в остром периоде травмы остаются незамеченными [1, 2, 5, 68].
Травмы грудной клетки и живота сопровождаются повреждением диафрагмы в 0,5―30%. До 40―62% случаев повреждения диафрагмы в остром периоде травмы остаются незамеченными [1, 2, 5, 68].
R. Sennertus в 1541 г. [65] впервые описал ПДГ при аутопсии пациента с проникающим ранением, нанесенным с целью суицида. Несколько позже Ambroise Pare [30] подробно описал это заболевание по результатам аутопсии французского солдата, погибшего от ущемленной ДГ через 8 мес после ранения. Первое успешное устранение ПДГ принадлежит Riolfi, который в 1886 г. ликвидировал дефект диафрагмы с проникшим в плевральную полость большим сальником [34]. Чаще повреждения диафрагмы возникают при закрытых травмах, связанных с падением с высоты или со сдавлением, а также при проникающих ранениях [27]. По данным разных авторов, повреждения диафрагмы диагностируются у 1―5% с закрытой травмой пострадавших в ДТП и у 10―15% с проникающими ранениями грудной клетки [22, 29, 47, 70]. Из 9 пациентов с посттравматическими грыжами, наблюдаемых нами, у 6 была предшествующая автотравма, у 2 ― падение с высоты, и у 1 больного заболевание возникло после проникающего колото-резаного ранения. Консервативное ведение пациентов с закрытой травмой живота в условиях отсутствия гемодинамических нарушений, а также недостаточность и несвоевременность диагностики в остром периоде приводят к отсроченному обнаружению повреждений диафрагмы в 30―50% случаев [22]. Согласно другой гипотезе, поздняя диагностика повреждений диафрагмы обусловлена тем, что травмированная диафрагмальная мышца может сохранять свою барьерную функцию, и посттравматическая грыжа развивается лишь некоторое время спустя [27, 72].
Консервативное ведение пациентов с закрытой травмой живота в условиях отсутствия гемодинамических нарушений, а также недостаточность и несвоевременность диагностики в остром периоде приводят к отсроченному обнаружению повреждений диафрагмы в 30―50% случаев [22]. Согласно другой гипотезе, поздняя диагностика повреждений диафрагмы обусловлена тем, что травмированная диафрагмальная мышца может сохранять свою барьерную функцию, и посттравматическая грыжа развивается лишь некоторое время спустя [27, 72].
Посттравматическая послеоперационная диафрагмальная грыжа является редким осложнением в торакальной и абдоминальной хирургии. Развитие данного вида грыжи может быть обусловлено неадекватным устранением дефекта диафрагмы после резекции или нераспознанным ее повреждением в ходе операции. В литературе описаны примеры посттравматической послеоперационной диафрагмальной грыжи после эзофагэктомии, гастрэктомии, лапароскопической холецистэктомии, нефрэктомии, лобэктомии и др. [10, 21, 62, 74]. Можно встретить и казуистические случаи спонтанного повреждения диафрагмы, повлекшие за собой развитие ДГ.
Можно встретить и казуистические случаи спонтанного повреждения диафрагмы, повлекшие за собой развитие ДГ.
ПДГ слева встречаются в 3 раза чаще, чем справа, вследствие большей уязвимости левого купола диафрагмы к травме и отсутствия протективного действия печени [61]. G. Voeller предположил, что по этим же причинам правосторонние посттравматические грыжи чаще остаются нераспознанными [78]. По данным других авторов, частота правосторонних и левосторонних посттравматических грыж примерно одинакова, что подтверждается результатами аутопсий [61, 64]. Эти же авторы полагают, что более тяжелые травмы связаны с повреждением правого купола диафрагмы, и не все пациенты доживают до момента диагностики [61, 64]. При проникающих колото-резаных ранениях повреждение диафрагмы обычно носит левосторонний характер в силу того, что наносящий травму человек чаще является правшой, в то время как при огнестрельных ранениях число правосторонних и левосторонних повреждений примерно одинаково. Реже встречаются двусторонние посттравматические грыжи [4]. Таких пациентов мы не наблюдали. Обычно при ПДГ нет грыжевого мешка, и они могут быть отнесены к «ложным грыжам». Развитие истинной ДГ возможно при повреждении только плевры и мышечного слоя диафрагмы, что происходит крайне редко. В этом случае неповрежденная брюшина с течением времени растягивается и образует грыжевой мешок. Как правило, при этом сращения между грыжевым мешком и его содержимым не выражены.
Таких пациентов мы не наблюдали. Обычно при ПДГ нет грыжевого мешка, и они могут быть отнесены к «ложным грыжам». Развитие истинной ДГ возможно при повреждении только плевры и мышечного слоя диафрагмы, что происходит крайне редко. В этом случае неповрежденная брюшина с течением времени растягивается и образует грыжевой мешок. Как правило, при этом сращения между грыжевым мешком и его содержимым не выражены.
Повреждение диафрагмы может быть установлено как в момент травмы, так и многие годы и даже десятилетия спустя. Так, G. Shreck и соавт. [70] описали случай диагностики ПДГ спустя 20 лет после травмы, а S. Singh и соавт. [71] ― и вовсе через 50 лет. Чаще диагноз устанавливается в течение первых 3 лет после травмы [66]. У наших пациентов ПДГ диагностировали в течение 4 лет после травмы за исключением 1 пациента с предшествующим ранением грудной клетки, у которого ДГ обнаружена спустя 20 лет. В обзоре 980 пациентам с повреждениями диафрагмы, приведенном R. Shah и соавт. [68], диагноз установили до операции в 43,5%, во время операции ― в 41,3% и в отдаленном периоде ― в 14,6%.
Размеры дефекта диафрагмы при ПДГ разнятся в зависимости от механизма повреждения и могут варьировать от небольшого отверстия до широкого дефекта, занимающего практически весь купол диафрагмы. При закрытых повреждениях дефект может располагаться в любом отделе диафрагмы, в том числе в области ее прикрепления; при этом размер дефекта, как правило, превышает 10 см. При проникающих ранениях дефект диафрагмы чаще не превышает 2 см. С течением времени из-за внутрибрюшного давления и постепенного растяжения небольшие дефекты могут увеличиваться в размерах. Грыжевой дефект, как правило, имеет округлую или щелевидную форму с рубцовыми краями, напоминающими фиброзное кольцо. Довольно часто, особенно в случае длительно существующих грыж, имеются сращения краев дефекта с прилежащими органами.
Повреждение ствола или крупных ветвей диафрагмального нерва приводит к параличу всей или части диафрагмы и, в дальнейшем, к развитию дистрофических изменений мышцы, что проявляется ее истончением и потерей функции.
В 1974 г. O. Grimes [29] выделил 3 периода в клиническом течении ПДГ: острый, латентный и обструктивный. Острый период непосредственно связан с моментом травмы и продолжается вплоть до формирования диафрагмального дефекта. В латентном периоде происходит постепенное перемещение органов брюшной полости в грудную клетку. Обструктивный период характеризуется появлением клинических симптомов непроходимости и ишемии органов, вышедших через дефект диафрагмы.
Клинические проявления ПДГ весьма разнообразны и зачастую являются следствием сердечно-легочных или желудочно-кишечных нарушений. Длительное время ДГ могут протекать бессимптомно, а клинические проявления присоединяются лишь через несколько лет или в случае развития осложнений [5]. Возникающие симптомы напрямую зависят от органа, который выходит через грыжевой дефект. Зависимость клинических проявлений от степени наполнения желудочно-кишечного тракта также имеет важное диагностическое значение. В случае развития ущемленной ПДГ в нижних отделах грудной клетки или верхних отделах живота возникает резкая боль, к которой может присоединиться картина кишечной непроходимости и дисфагии в случае ущемления желудка и кишечника.
Стандартная рентгенография грудной клетки является начальным методом диагностики внутригрудных повреждений. Однако ее чувствительность при ПДГ составляет 46% при левосторонней локализации и лишь 17% при локализации справа [26]. Асимметрия куполов диафрагмы, изменение высоты стояния и характера контура диафрагмы являются первыми признаками повреждения диафрагмы, а появление полого органа выше уровня диафрагмы или обнаружение назогастральной трубки в желудке, расположенном в плевральной полости, и вовсе подтверждают диагноз. Несмотря на недостаточную чувствительность рентгенографии в остром периоде травмы, в случае с диагностикой ПДГ в отдаленном периоде чувствительность этого метода может достигать 100% [69].
МСКТ позволяет повысить чувствительность рентгенологического метода до 61―90% [14]. По данным K. Killeen и соавт. [40], чувствительность МСКТ в остром периоде травмы составила 78% при травмах левого купола диафрагмы и 50% в случае правосторонних повреждений. В то время как при рентгенографическом исследовании могут отсутствовать специфические изменения, КТ позволяет непосредственно визуализировать дефект диафрагмы, его расположение и размеры, а также детализировать органы, вышедшие в плевральную полость. A. Desir и B. Ghaye [23] описали 19 различных симптомов, определяемых при К.Т. Несмотря на все разнообразие рентгенологических признаков, авторами подчеркивается, что ни один из них по отдельности не может служить основанием для установления диагноза ДГ, и лишь тщательный анализ каждого из выявляемых симптомов может привести к точной диагностике.
A. Desir и B. Ghaye [23] описали 19 различных симптомов, определяемых при К.Т. Несмотря на все разнообразие рентгенологических признаков, авторами подчеркивается, что ни один из них по отдельности не может служить основанием для установления диагноза ДГ, и лишь тщательный анализ каждого из выявляемых симптомов может привести к точной диагностике.
МРТ также может быть использована для установления диагноза ПДГ. Неоспоримым преимуществом этого метода является высокое контрастное разрешение, которое позволяет дифференцировать диафрагму от прилежащих структур. Это особенно полезно в спорных случаях и при правосторонней локализации грыжи.
УЗИ не является методом выбора. Однако иногда оно позволяет визуализировать флотирующий лоскут поврежденной диафрагмы, а также пролабирующую через дефект диафрагмы в плевральную полость печень при правосторонней локализации.
До настоящего времени спорным остается вопрос тактики ведения пациентов с Д.Г. При ПДГ высокий уровень развития таких грозных осложнений, как ущемление и кишечная непроходимость, диктует необходимость хирургического лечения в случае как симптомного, так и бессимптомного течения [7, 49, 77]. Сообщения об осложненном течении грыж слабых анатомических зон диафрагмы крайне редки, чего нельзя сказать о посттравматических. КТ высокого разрешения позволяет достоверно установить диагноз до операции у большинства больных. Вопрос необходимости оперативного лечения при отсутствии каких-либо клинических проявлений рядом авторов подвергается сомнению [12, 17]. Показания к операции в этих случаях представляются абсолютными при больших размерах грыжи и наличии клинических проявлений.
Сообщения об осложненном течении грыж слабых анатомических зон диафрагмы крайне редки, чего нельзя сказать о посттравматических. КТ высокого разрешения позволяет достоверно установить диагноз до операции у большинства больных. Вопрос необходимости оперативного лечения при отсутствии каких-либо клинических проявлений рядом авторов подвергается сомнению [12, 17]. Показания к операции в этих случаях представляются абсолютными при больших размерах грыжи и наличии клинических проявлений.
Существует разница в оценках относительно преимуществ того или иного хирургического доступа при коррекции грыж слабых анатомических зон диафрагмы. Ряд авторов предпочитают трансторакальный [9, 19, 39, 46, 67] или трансабдоминальный [6, 15, 51, 59, 79] доступ, другие отстаивают эндоскопические вмешательства [24, 36, 60]. Трансабдоминальный доступ предпочтителен для большинства хирургов. Лапаротомия в отличие от трансторакального доступа позволяет осмотреть обе стороны диафрагмы. Так, G. Bentley и J. Lister [59] описали случай повторного оперативного вмешательства по поводу кишечной непроходимости после ранее выполненного торакотомного доступа. После лапаротомии они обнаружили двусторонний дефект диафрагмы с ущемлением кишки на противоположной стороне от торакотомии. Для тех пациентов, которые ранее перенесли оперативные вмешательства на брюшной полости, трансторакальный доступ выглядит предпочтительней. Однако в случае подозрения на ущемление полого органа трансабдоминальный доступ обеспечивает лучшие условия для выполнения всех этапов операции, в том числе резекции некротизированного участка кишки или желудка [79]. Некоторые авторы связывают лапаротомный доступ с ростом послеоперационной летальности, что легко объяснимо большим числом ургентных случаев грыж Морганьи, подвергшихся коррекции этим доступом [35]. Y. Karamustafaoglu [38] предлагает использование альтернативного лапаротомного субкостального доступа. При этом он отмечает, что данный доступ обладает всеми преимуществами традиционной верхнесрединной лапаротомии.
С момента первого упоминания G. Kuster и соавт. [43] лапароскопического доступа большим числом хирургов накоплен опыт его использования. Предоставляя аналогичный обзор, лапароскопический доступ обладает всеми преимуществами малотравматичного вмешательства в виде уменьшения болевого синдрома, снижения частоты раневых осложнений, ранней реабилитации пациентов. Кроме того, лапароскопия может быть использована с диагностической целью при неуточненном диагнозе и наличии неспецифических гастроинтестинальных симптомов.
Грыжевой мешок, как правило, имеет плотные сращения с окружающими тканями, а его объем значительно превышает размеры диафрагмального дефекта. Поэтому разделение сращений и выделение диафрагмального дефекта зачастую представляет собой нелегкую задачу. Сторонники трансторакального доступа сходятся во мнении, что он позволяет более тщательно и безопасно выделить грыжевой мешок, особенно у пациентов с избыточной массой тела. D. Kilic [39] подчеркивает, что трансторакальный доступ обеспечивает полный контроль при выделении грыжевого мешка, особенно из перикардиальных сращений, разделение которых может привести к катастрофическому результату. В случае не уточненного до операции диагноза трансторакальный доступ также является предпочтительным, особенно при подозрении на грыжу внутригрудной локализации. В нашем исследовании диагноз до операции не был установлен у 9 (25%) пациентов, и они были оперированы с подозрением на новообразование средостения. Большинство из них оперировали в период отсутствия МСКТ.
В последнее время стало появляться все больше публикаций об удачном опыте торакоскопической коррекции. По мнению S. Nakashima [55], торакоскопический доступ должен рассматриваться как приоритетный, так как при минимальной травматичности он обеспечивает безопасное выполнение всех этапов операции. При этом возможны затруднения с погружением органов брюшной полости в анатомическую позицию при гигантских дефектах. Торакотомия и трансабдоминальные доступы могут рассматриваться в качестве дополнительных в случае необходимости. В литературе описаны примеры использования субксифоидального доступа в дополнение к торакоскопическому по аналогии со способом, предложенным T. Mineo и соавт. [48] при двустороннем метастатическом поражении легких. V. Ambrogi [9], обобщая 20-летний опыт использования трансторакального доступа, указывает на использование в последние годы торакоскопического доступа с ручной поддержкой из трансксифоидального доступа.
Однако наряду с неоспоримыми преимуществами трансторакальный доступ имеет ряд недостатков. Необходимость однолегочной вентиляции, дренирования плевральной полости, а также невозможность ревизии диафрагмы с противоположной стороны не позволяют отнести этот доступ в разряд универсальных.
Кроме традиционных трансабдоминального и трансторакального доступов в литературе можно встретить единичные упоминания и других доступов. F. Paris и соавт. [59] впервые предложили использовать субксифоидальный доступ, который позволяет выделить грыжевой мешок без вскрытия брюшной и плевральной полостей, а в случае необходимости может быть расширен до торакотомии. На возможность использования трансстернального доступа указал I. Nenekidis [56], описывая симультанное устранение грыжи Морганьи у пациента со стенозом аортального клапана. K. Moghissi [50] предложил абдоминомедиастинальный доступ, включающий верхнесрединную лапаротомию и нижнесрединную стернотомию. При этом автор подчеркивает, что таким образом может быть расширен лапаротомный доступ в случае больших размеров грыжевого мешка и его расположения с обеих сторон диафрагмы. Однако широкого распространения в клинической практике данные доступы не получили и используются лишь в исключительных случаях.
При длительно существующих ПДГ многие авторы сходятся во мнении, что торакотомный доступ является предпочтительным из-за удобства выделения органов брюшной полости из плевральных сращений, что зачастую бывает затруднительным из абдоминального доступа, особенно справа. Вместе с тем вопрос выбора оптимального доступа в этой ситуации остается открытым. Сопоставление торакального и абдоминального доступов в ретроспективном анализе J. Murray [54] не показало каких-либо значимых преимуществ того или иного варианта. Автор указывает на возможность эффективного и безопасного устранения ПДГ через лапаротомию. Реже прибегают к комбинированному доступу. Описаны примеры успешного использования лапароскопического и торакоскопического доступов, а также их комбинации.
Остается открытым вопрос о необходимости резекции грыжевого мешка при истинных грыжах. Сторонники выполнения этого этапа операции полагают, что тем самым снижается риск развития резидуальных кист и рецидива заболевания [44]. Однако известно, что разделение сращений грыжевого мешка с окружающими структурами и его резекция могут потенциально привести к массивному пневмомедиастинуму, повреждению легкого или перикарда. Описаны случаи фатального пневмоперикарда, возникшего в результате резекции грыжевого мешка [11]. Развитие же резидуальных кист происходит не всегда, на что указывает исследование, в котором отмечена редукция грыжевого мешка при КТ грудной клетки на 30-е сутки после операции [53].
В отличие от выбора оперативного доступа взгляды на способ устранения дефекта диафрагмы менее противоречивы. Как правило, диафрагмальный дефект слабой зоны имеет щелевидную форму и небольшие размеры, а его устранение возможно простым ушиванием, что подтверждается большим числом работ [7, 38, 39, 73]. При ПДГ дефект диафрагмы также удается устранить первичным швом, даже при больших размерах. С этой целью используется как рассасывающийся, так и нерассасывающийся шовный материал. Тип используемого шовного материала рядом авторов рассматривается как один из факторов возможного развития рецидива грыжи. Однако число работ, посвященных лечению рецидива ПДГ, крайне мало. Так, в обоих случаях рецидивов, описанных в исследовании W. Hanna и соавт. [32], первичное устранение дефекта проводилось рассасывающимся материалом, в то время как при использовании нерассасывающихся нитей авторы указывают на отсутствие рецидивов. M. Kitada и соавт. [41] описали аналогичный случай рецидива ПДГ после ее первичного устранения с использованием рассасывающегося шовного материала. Мы рекомендуем применять нерассасывающийся материал. Некоторые авторы отмечают, что дефекты более 20―30 см3 нуждаются в устранении с применением укрепляющих материалов [53]. С этой целью могут быть использованы различные синтетические материалы, такие как полипропилен (Marlex), политетрафторэтилен (Gore-Tex), полиэтилентерефталат (Dacron). Также описаны случаи применения биологических материалов ― бычьего или свиного ксеноперикарда, различных мышечных и фасциальных лоскутов [41]. Каждый из этих материалов обладает рядом индивидуальных преимуществ и недостатков. R. Gonzalez [28], сравнив использование рассасывающихся и нерассасывающихся эндопротезов, указывает на то, что рассасывающийся материал обеспечивает более надежное и естественное укрепление тканей с меньшей воспалительной реакцией. Однако стоит отметить, что в литературе отсутствуют ретроспективные и проспективные исследования, посвященные той или иной технике устранения диафрагмального дефекта, а большинство работ представлены единичным случаем или небольшими сериями пациентов. В целом использование укрепляющих материалов сопряжено с риском их дислокации и более высоким уровнем инфекционных осложнений [60]. Однако единого мнения в отношении способа устранения дефекта и используемого для этого материала нет.
Таким образом, в плановой торакальной хирургии большая часть операций на диафрагме выполняется по поводу грыж слабых анатомических зон диафрагмы
Диафрагмальная грыжа лечение в Израиле, стоимость и отзывы в Ассуте
Диафрагмальная грыжаДиафрагмальная грыжа, лечение в Израиле в медицинском центре ASSUTA Express Medical: лучшие врачи, инновационная аппаратура, цены без посредников.
Диафрагмальная грыжа – патология диафрагмы, вследствие которой органы, локализованные в брюшинном пространстве, попадают в грудную клетку. Заболевание характеризуется болями в груди. Согласно статистике, данная патология встречается в 10% случаев диагностирования всех видов грыж. Диафрагмальная грыжа, лечение которой проводит гастроэнтеролог и хирург, требует ранней диагностики, чтобы избежать тяжелых последствий.
Наибольшую угрозу здоровью и жизни человека представляют диафрагмальные грыжи больших размеров, через отверстия которых внутренние органы из брюшины могут попадать в грудную клетку. Данная патология приводит к нарушению функционирования многих органов и систем, сопровождается тяжелой клинической картиной. Различают следующие виды грыж диафрагмы:
- Скользящего типа – наиболее распространенный вид патологии, связанный со слабостью сфинктера пищевода. При наличии данной грыжи часть желудка способна мигрировать в грудную полость и беспрепятственно возвращаться обратно. Вследствие таких «передвижений» желудка, этот тип грыжевого образования получил свое название «скользящий».
- Параэзофагеального типа – размещается в левой части, сам мешок грыжи закрывается брюшиной, именно в ней начинают происходить патологические процессы. Попадая в отверстие в диафрагме, часть желудка остается там. Со временем такая патология может привести к нарушению работы внутренних органов, развивается кишечная непроходимость, защемляются нервы.
Методы лечения диафрагмальной грыжи в Израиле
Лечение грыжи в клиниках Израиля проводится на новейшем медицинском оборудовании и высококвалифицированными врачами, что способствует проведению операций с минимальными рисками осложнений. Диафрагмальную грыжу лечат лапароскопическим малоинвазивным методом. Исключение – осложнения с ярко выраженной симптоматикой, представляющие собой угрозу здоровью и жизни человека, в таких случаях проводится открытая хирургическая операция.Лапароскопия в лечении диафрагмальной грыжи подразумевает прокол брюшной стенки в нескольких местах для введения специального прибора, оснащенного на конце камерой, и хирургических инструментов. Цель лапароскопии – восстановить диафрагмальную целостность и вернуть на место внутренние органы, которые были смещены через отверстие. Плюс малоинвазивного метода лечения диафрагмальной грыжи, проводимой в израильских клиниках, заключается в безопасности метода, отсутствии рисков осложнений, нет необходимости в продолжительном нахождении пациента в стационаре.
Лечение грыжи в клиниках Израиля проводится на новейшем медицинском оборудовании и высококвалифицированными врачами, что способствует проведению операций с минимальными рисками осложнений. Диафрагмальную грыжу лечат лапароскопическим малоинвазивным методом. Исключение – осложнения с ярко выраженной симптоматикой, представляющие собой угрозу здоровью и жизни человека, в таких случаях проводится открытая хирургическая операция.
Причины возникновения и симптомы диафрагмальной грыжи
Диафрагма – это мышца, служащая перегородкой между брюшной полостью и грудной клеткой, принимает участие в дыхательном акте, увеличивает грудину в объеме, чтобы на вдохе легкие могли полноценно расправиться. Причины развития грыжи диафрагмы следующие:
- недоразвитость развития диафрагмы во время формирования плода в утробе матери
- травмы грудной клетки
- повышенное внутрибрюшное давление (возникает по причине частых запоров, при многоплодном зачатии, частой родовой деятельности)
- заболевания желудочно-кишечного тракта (язва, эзофагит, панкреатит)
- возраст пациента от 60 лет и старше
Существует вероятность генетической наследственности грыжи диафрагмы. Приобретенное заболевание возникает, преимущественно, по причине сильных повреждений грудной клетки.
Степень выраженности симптоматической картины зависит от стадии развития заболевания, размера грыжи и наличия сопутствующих заболеваний. Клинические признаки патологии следующие:
- болевой синдром в грудине, возникающий, в основном, после еды
- проблемы с дыханием
- гипоксия (кислородное голодание)
- сердечная недостаточность
- нарушение кровообращения
- дискомфорт в грудной клетке
- изжога
- неприятное дыхание
- нарушение стула (частые запоры)
Признаки диафрагмальной грыжи у маленьких детей такие:
- частое срыгивание
- синий цвет кожи
- раздражительность, плаксивость
- нарушение сна
Лучшие врачи- Общие хирурги Израиля
Методы диагностики диафрагмальной грыжи в Израиле
Диафрагмальная грыжа требует немедленной диагностики и проведения хирургической операции. Только ранняя диагностика поможет вовремя обнаружить заболевание на ранних стадиях его развития, провести соответствующее лечение и избежать тяжелых осложнений. В израильских клиниках применяются такие методы диагностики:
УЗИВ том числе и плода в утробе матери, если существует риск развития внутриутробной грыжи
Визуализационные методы исследованияРентген с контрастом, магнитно-резонансная томография, КТ.
Индивидуальный план диагностикиКак приехать к нам на лечение в Израиль
1
Подать заявку на сайте или связаться с нами любым удобным для Вас способом
Подать заявку2
Медицинский координатор свяжется с Вами для сбора анамнеза и уточнения деталей приезда
3
Врач клиники составит для вас индивидуальную медицинскую программу
4
Координатор сообщает стоимость лечения в клинике и помогаем с заказом билетов и арендой апартаментов
5
Высылаем приглашение из клиники «Ассута» и расписание прохождения консультаций и процедур
Обзорная экскурсия по ТЕЛЬ-АВИВУВ подарок
Отзывы о лечении в клинике ассута
Виталий С.Пациент:Виталий С.
Возраст:59
Страна:Россия
С начала приезда и до конца нашего лечения нас сопровождали добрые и отзывчивые люди. Во время всех процедур нас сопровождали и отвечали на все вопросы и пожелания.
Мы благодарны за успешное лечение.
Всем счастья и всех благ.
С уважением, Виталий Середов
10. 09. 2017СветланаПациент:Светлана
Возраст:45
Страна:Россия
Всё прошло очень хорошо, замечательное сопровождение и волшебник доктор Лаксман.
Всем огромная благодарность за содействие и теплый прием.
Спасибо!!!
17. 03. 2018Грыжи пищеводного отверстия диафрагмы — Клиника 29
Грыжа пищеводного отверстия диафрагмы или диафрагмальная грыжа возникает, если через пищеводное отверстие диафрагмы (отверстие, через которое пищевод из грудной полости проникает в брюшную) брюшная часть пищевода, часть желудка или брюшная часть пищевода вместе с частью желудка смещается в грудную полость. Иногда через пищеводное отверстие диафрагмы в грудную полость могут смещаться и другие органы, расположенные в полости живота.
Причиной диафрагмальной грыжи бывает повышенная эластичность тканей ограничивающих пищеводное отверстие диафрагмы, связки между диафрагмой и пищеводом, одной из ножек диафрагмы. Повышенная эластичность отверстия диафрагмы может быть врожденной. Иногда встречается аномалия развития — так называемый «короткий пищевод с грудным желудком», но чаще грыжа возникает в течение жизни пациента под воздействием условий, способствующих повышению внутрибрюшного давления. Это тяжелый физический труд, ожирение, асцит (накопление жидкости в брюшной полости), эндокринные заболевания. Иногда к грыже пищеводного отверстия диафрагмы приводит беременность. Имеет значение ослабление и истончение связок и соединительной ткани с возрастом.
В начале заболевания смещение органов полости живота в грудную полость возникает периодически, под воздействием физических нагрузок, кашля, рвоты, переедания и т.д. Затем такое выпадение становится более частым или постоянным.
Чаще всего встречается грыжа аксиальная или скользящая. При этом в пищеводное отверстие диафрагмы выпадает брюшная часть пищевода или конечный отдел пищевода с частью желудка.
Симптомы
Одной из самых распространенных жалоб является изжога (возникает в следствии рефлюкса желудочного содержимого в пищевод). При грыже ПОД изжога чаще возникает ночью или после еды. Так же изжога может возникнуть после физической нагрузки, при этом часто сопровождается болью.
Боль при грыже пищеводного отверстия диафрагмы возникает у 40 – 50% пациентов. Боль бывает довольно интенсивной, ощущается загрудинно, имеет жгучий характер и, поэтому, нередко путается пациентами с болью при стенокардии. Боль при грыже пищевода чаще всего связана с наклонами, физической нагрузкой и усиливаются в положении лежа. Боль при грыже пищеводного отверстия диафрагмы часто сопровождается с забросом пищи в пищевод и. При перемене положения тела боль часто стихает.
Следующим частым симптомом грыжи пищеводного отверстия диафрагмы является отрыжка. Отрыжка — непроизвольное внезапное выделение газов через рот из желудка или пищевода, иногда с примесью содержимого желудка, встречается у 30 — 73% больных. Отрыгивание происходит желудочным содержимым или воздухом. Отрыжке, как правило, предшествует чувство распирания в подложечной области. Данное состояние возникает после еды или во время разговора. Прием спазмолитиков бывает неэффективным, облегчение приносит лишь отрыжка значительным количеством пищи.
Затруднение при прохождении пищи по пищеводу при грыже пищеводного отверстия диафрагмы носит перемежающийся характер. Часто провоцируется приемом очень холодной или наоборот очень горячей пищей, а также нервными перегрузками. Постоянный характер затруднений прохождения пищи по пищеводу должен насторожить в отношении осложнений.
Осложнением грыжи пищеводного отверстия диафрагмы чаще всего бывает рефлюкс-эзофагит, но может развиться пептическая язва пищевода, при длительном течении которой в свою очередь может произойти рубцовый стеноз (сужение) пищевода. Встречаются острое и хроническое кровотечение из пищевода, перфорация пищевода или ущемление грыжи в пищеводном отверстии диафрагмы.
Диагноз грыжи пищеводного отверстия диафрагмы устанавливают при рентгеновском исследовании. Часто бывает достаточно обычной рентгеноскопии пищевода и желудка при помощи контрастирования барием. Для уточнения диагноза проводят эзофагогасроскопию.
Лечение грыжи пищеводного отверстия диафрагмы.
Назначается диета с дробным питанием небольшими порциями, лечение запоров. Обязательно используется лечебная физкультура. Выполнение определенных упражнений позволяет избежать смещения желудка. Применяются препараты для уменьшения желудочной секреции и снижения кислотной агрессивности желудочного содержимого, нормализации дискинезий желудочно-кишечного тракта.
Возникновение осложнений грыжи пищеводного отверстия диафрагмы является показанием для назначения оперативного лечения.
фактов о диафрагмальной грыже | CDC
Диафрагмальная грыжа — это врожденный дефект, при котором имеется отверстие в диафрагме.
Что такое диафрагмальная грыжа?
Диафрагмальная грыжа — это врожденный дефект, при котором имеется отверстие в диафрагме (большой мышце, отделяющей грудную клетку от брюшной полости). Органы в брюшной полости (например, кишечник, желудок и печень) могут двигаться через отверстие в диафрагме вверх, в грудную клетку ребенка. Когда орган проталкивается через отверстие, это называется грыжей.Диафрагмальная грыжа может препятствовать полному развитию легких ребенка, вызывая затруднения дыхания у ребенка при рождении.
Сколько детей рождается с диафрагмальной грыжей?
По оценкам исследователей, в США примерно 1 из 3600 детей рождается с диафрагмальной грыжей. 1 Около половины всех новорожденных с диафрагмальной грыжей также имеют другие заболевания, включая врожденные дефекты головного мозга, сердца и кишечника. 2
Причины и факторы риска
Хотя причины диафрагмальной грыжи у большинства младенцев неизвестны, исследователи полагают, что некоторые случаи диафрагмальной грыжи могут быть вызваны аномалиями в генах ребенка.
Понимание факторов, которые чаще встречаются у младенцев с врожденным дефектом, поможет нам больше узнать о причинах. CDC финансирует Центры исследования и профилактики врожденных дефектов, которые участвуют в крупных исследованиях, таких как Национальное исследование по профилактике врожденных дефектов (NBDPS; 1997-2011 гг.) И Исследование врожденных дефектов для оценки воздействия беременных (BD-STEPS; началось с родов) в 2014 г.), чтобы понять причины и риски врожденных дефектов, таких как диафрагмальная грыжа.
Если вы беременны или собираетесь забеременеть, поговорите со своим врачом о способах повышения ваших шансов на рождение здорового ребенка.
Диагностика
Во время беременности проводятся скрининговые тесты для выявления врожденных дефектов и других состояний. Врачи обычно могут диагностировать диафрагмальную грыжу еще до рождения ребенка. Врачи используют ультразвук, чтобы сделать снимок диафрагмы и легких для поиска аномалий.
В некоторых случаях УЗИ при беременности не выявляют диафрагмальную грыжу.Однако после рождения ребенка врачи могут диагностировать заболевание, заметив, что у ребенка проблемы с дыханием. Рентген грудной клетки может показать, что органы, обычно находящиеся в брюшной полости, находятся в груди, а легкие выглядят меньше, чем обычно, или смещены в сторону.
Ведение и лечение
Операция необходима для восстановления диафрагмальной грыжи вскоре после рождения ребенка. После операции ребенку потребуется постоянная помощь, чтобы дышать, пока легкие не восстановятся и не расширятся.
Список литературы
- Май, CT, Isenburg JL, Canfield MA, Meyer RE, Correa A, Alverson CJ, Lupo PJ, Riehle ‐ Colarusso T, Cho SJ, Aggarwal D, Kirby RS.Национальные популяционные оценки основных врожденных дефектов, 2010–2014 гг. Исследование врожденных пороков. 2019; 111 (18): 1420-1435.
- Pober BR, Russell MK, Ackerman KG. Обзор врожденной диафрагмальной грыжи. 1 февраля 2006 г. [Обновлено 16 марта 2010 г.]. В: Pagon RA, Adam MP, Ardinger HH, et al., Редакторы. GeneReviews® [Интернет]. Сиэтл (Вашингтон): Вашингтонский университет, Сиэтл; 1993-2016 гг. Доступно по адресу: http://www.ncbi.nlm.nih.gov/books/NBK1359/external icon
Изображения являются общественным достоянием и, следовательно, свободны от каких-либо ограничений авторских прав.В порядке любезности мы просим, чтобы поставщик контента (Центры по контролю и профилактике заболеваний, Национальный центр по врожденным порокам и нарушениям развития) был указан и уведомлен о любом публичном или частном использовании этого изображения.
Изображения являются общественным достоянием и, следовательно, свободны от каких-либо ограничений авторских прав. В порядке любезности мы просим, чтобы поставщик контента (Центры по контролю и профилактике заболеваний, Национальный центр по врожденным порокам и нарушениям развития) был указан и уведомлен о любом публичном или частном использовании этого изображения.
Врожденная диафрагмальная грыжа (ВДГ) | Детская больница Филадельфии
При CDH отверстие в диафрагме позволяет органам брюшной полости перемещаться в грудную клетку во время развития плода. Там они могут переполнять сердце и легкие и препятствовать нормальному росту легких. © CHOP / CFDT Врожденная диафрагмальная грыжа (ВГД) возникает, когда диафрагма, мышца, отделяющая грудную клетку от брюшной полости, не может закрыться во время внутриутробного развития. Это отверстие позволяет содержимому брюшной полости (желудка, кишечника и / или печени) перемещаться в грудную клетку, влияя на рост и развитие легких.Легкие будут меньше, чем ожидалось (гипоплазия легких), и будут иметь менее развитые кровеносные сосуды. Это вызывает повышенное кровяное давление в легких (легочная гипертензия).
CDH — одна из наиболее распространенных серьезных врожденных аномалий, встречающаяся у 1 из каждых 2,500–3,000 живорождений. CDH может возникать слева или справа, а редко — с обеих сторон. Новорожденным с CDH потребуется немедленная помощь при родах, поэтому важен ранний и точный диагноз.
Причина CDH неизвестна.Обычно CDH является изолированной находкой, хотя может возникать вместе с сердечным заболеванием или генетической аномалией, которая может привести к дополнительным осложнениям.
Левая CDH показывает печень (выделено) и грыжу кишечника в грудную клетку плода. © CHOP / CFDT CHOP участвует в активных исследовательских проектах, стремясь лучше понять ассоциации и причины CDH. Генетические исследователи используют новаторские методы, чтобы попытаться найти потенциальную генетическую этиологию CDH.Выявление генетической причины (-ов) CDH позволит нашим врачам лучше управлять семьями с пострадавшим ребенком и консультировать их.
CDH обычно выявляется при обычном пренатальном УЗИ. Сонограф может заметить желудок, кишечник или печень в груди вашего ребенка там, где должны быть легкие. Сердце ребенка также может быть оттеснено в сторону дополнительными органами в груди.
Пренатальное ультразвуковое исследование, показывающее, что CDH следует дополнительно обследовать в центре плода с большим объемом.
Если вы выберете Центр диагностики и лечения плода при Детской больнице Филадельфии (CHOP), вы сначала поговорите со знающим координатором фетальной терапии или консультантом по генетическим вопросам, который ответит на ваши вопросы и назначит всестороннюю однодневную оценку. Более 1609 пациентов с CDH были направлены в нашу команду, опыт, который дает нам уникальные возможности для оценки и лечения диагноза вашего ребенка.
Наша команда преданных своему делу специалистов по визуализации использует самые передовые методы пренатальной визуализации и самые современные технологии для сбора подробной информации о диагнозе вашего ребенка.
Эти специализированные тесты помогают нам определить, какая сторона диафрагмы поражена CDH (левая, правая или обе), какие органы находятся в грудной клетке (желудок, кишечник и / или печень), а также измерить легкие. как можно повлиять на ребенка после рождения.
Определение степени тяжести CDH перед родами
Эта сверхбыстрая МРТ плода подтверждает грыжу печени в груди. Самый надежный прогноз тяжести CDH — это расположение печени.Когда печень находится вверху грудной клетки, наблюдается более выраженная гипоплазия легких (маленькие легкие). Степень гипоплазии легких можно предсказать по измерениям, полученным во время УЗИ плода и МРТ.
- Отношение площади легких к окружности головы (LHR)
- Отношение площади легких к окружности головы соответствует ожидаемому (LHR O / E)
- Общий объем легких соответствует ожидаемому (MRI O / E)
Хотя эти расчеты дают оценку объема (размера) развивающихся легких, они не могут предсказать степень легочной гипертензии, которая влияет на то, насколько хорошо легкие будут работать после рождения. (Для врачей: диагностический прибор CDH)
Левая CDH или правая CDH: в чем разница?
Приблизительно у 83% детей с ХДГ имеется дефект левой диафрагмы. Левосторонняя CDH допускает возможность перемещения желудка, кишечника, а иногда и печени (грыжи) в грудную клетку ребенка.
Остальные 17% детей с ХДГ имеют дефект правой части диафрагмы. Правосторонняя CDH почти всегда позволяет печени перемещаться в грудную клетку.
Чтобы поставить точный диагноз, важно посетить центр терапии плода с многопрофильной командой, имеющей опыт в оценке беременностей, затронутых CDH. Это важный шаг в определении доступных вариантов лечения и обеспечении наилучших результатов для вашего ребенка.
После завершения всех исследований наша команда под руководством специалиста по медицине матери и плода и детского хирурга, имеющих опыт ведения беременных, затронутых CDH, встречается с вами и вашей семьей.Вместе мы изучаем изображения и результаты тестов, обсуждаем диагноз, объясняем варианты лечения и возможные результаты и отвечаем на любые ваши вопросы.
Обычно вас будут осматривать каждые четыре недели для последующего наблюдения до более поздних сроков беременности, когда вас чаще будут осматривать акушерская бригада, имеющая опыт ведения беременных, затронутых CDH, и возглавляемая специалистом по медицине матери и плода. Во время последующего ультразвукового исследования будут обновлены измерения легких, будет внимательно наблюдаться рост вашего ребенка и будет измеряться количество околоплодных вод вокруг ребенка.Еженедельное тестирование начинается в 34 недели для тщательного наблюдения за благополучием плода.
В настоящее время переселение необходимо, если вы живете более чем в часе езды от нашего центра. Вам нужно будет переехать раньше, если вы перенесете дородовое вмешательство, если вокруг вашего ребенка образуется излишняя жидкость (многоводие) или если есть признаки преждевременных родов. Это гарантирует, что вы будете поблизости в случае, если роды начнутся или будут указаны раньше, чем ожидалось. Наши социальные работники помогут согласовать варианты жилья с учетом потребностей вашей семьи.
Посмотрите видео, чтобы проследить путь одной семьи от пренатальной диагностики CDH до выписки домой и узнать больше о том, почему так важно обращаться за помощью в опытный центр CDH.
Фетоскопическая эндолюминальная окклюзия трахеи (FETO) — это операция на плоде, которая может улучшить результаты у детей с тяжелыми случаями CDH.
В тяжелых случаях CDH может привести к серьезным заболеваниям и смерти при рождении. Для этих младенцев лечение до рождения может позволить легким достаточно вырасти до рождения, чтобы эти дети могли выжить и развиваться.Ваш врач по материнско-фетальной медицине и детский хирург обсудят с вами этот вариант лечения во время вашего обследования, чтобы определить, подходит ли он для вашего ребенка.
Здоровье ребенка, рожденного с CDH, может неожиданно измениться, поэтому крайне важно рожать в больнице, где будет оказана послеродовая помощь и где все аспекты специализированной помощи будут немедленно доступны в одном месте.
С CDH вы можете рассчитывать на роды на сроке 38–39 недель.Большинство детей с CDH рождаются естественным путем, если нет акушерских показаний для кесарева сечения. Медицинская бригада матери и плода обсудит с вами варианты родов. Вы будете рожать ребенка в специальном семейном отделении CHOP Garbose Family Special Delivery Unit (SDU), специально разработанном для того, чтобы мать и ребенок находились вместе в одной больнице и избежать транспортировки хрупких младенцев.
Во время родов о вашем ребенке заботятся в соседней палате, где бригада стабилизации новорожденных и новорожденных и хирургическая бригада новорожденных, включая неонатологов, медсестер передового хирургического профиля, неонатальных и хирургов, неонатальных хирургических медсестер и респираторных терапевтов, ждут стабилизации Ваш ребенок.
Вашему ребенку немедленно наденут дыхательную трубку и подключат к вентилятору (дыхательному аппарату). У них также будет трубка, помещенная в нос (NG) или рот (OG) в желудок, чтобы поддерживать его в сжатом состоянии, чтобы у легких было место для расширения во время дыхания. Ребенку будут лечить с помощью «мягкой вентиляции», которая представляет собой специализированную технику оказания поддержки дыханию младенцам с CDH.
В кровеносные сосуды пуповины ребенку также будут вставлены специальные линии для контроля различных уровней в крови и обеспечения жидкости и лекарств.При необходимости в руки или ноги ребенка будут помещены дополнительные внутривенные линии. Как только состояние ребенка стабилизируется, бригада доставит его к вам, прежде чем доставить в отделение интенсивной терапии новорожденных / младенцев (N / IICU) для дальнейшего ухода.
Родители — важная часть команды ребенка. У вас будет круглосуточный доступ к вашему ребенку во время его пребывания в N / IICU, и мы максимально поощряем ваше присутствие и взаимодействие с ним.
Для детей, рожденных с CDH, каждая мелочь имеет значение и может повлиять на результат.Важно, чтобы ваш ребенок лечился командой, имеющей опыт ухода за детьми с CDH.
В CHOP мы ежегодно наблюдаем почти 50 детей с CDH — больше, чем кто-либо в США. Наша бригада неонатальных хирургов — единственная бригада такого рода в мире, которая работает вместе с 2004 года. разработан нашей опытной многопрофильной командой.
Помимо хирургического вмешательства, лечение CDH вашего ребенка может включать специальное оборудование, такое как осцилляторный вентилятор, аппарат искусственного кровообращения (ЭКМО) или оксид азота.Даже если они не нуждаются в этих возможностях, важно, чтобы они имели немедленный доступ, когда это необходимо.
БЕЗ ИОИТ для младенцев с CDH
Ваш ребенок будет помещен в N / IICU, где первоначальная цель — сохранить ребенка как можно более стабильным. Свет будет приглушен; шум и манипуляции будут сведены к минимуму, чтобы оптимизировать работу маленьких легких ребенка, которые сильно реагируют на стимуляцию из-за связанной с ним легочной гипертензии.
Если ребенок плохо реагирует на первоначальную вентиляцию, режим вентиляции можно изменить на высокочастотную колебательную вентиляцию (HFOV), которая обеспечивает вдох и давление иначе, чем обычный вентилятор.
ЭКМО
Если ребенок нестабилен, он может перейти на экстракорпоральную мембранную оксигенацию (ЭКМО).
ECMO позволяет легким отдыхать, в то время как машина берет на себя функцию сердца и легких, доставляя кислород ребенку и удаляя углекислый газ, отходы дыхания.
Центр ЭКМО при CHOP был назначен центром передового опыта Организацией экстракорпоральной жизнеобеспечения с 2008 года. С момента открытия в 1990 году у нас было более 1500 случаев ЭКМО, и мы оказали помощь почти 250 детям с CDH.
Врожденная герниопластика диафрагмальной грыжи
Хирургическое лечение CDH после родов зависит от индивидуального прогресса вашего ребенка в дни после рождения.
Многопрофильная бригада под руководством детского хирурга и неонатолога определит сроки восстановления дефекта диафрагмы. По нашему опыту, лучше подождать, пока легкие не проявят меньшее сопротивление из-за легочной гипертензии и ребенок не перейдет из ЭКМО. Наша опытная команда использует различные лекарства и ингаляционную терапию для улучшения этого процесса.
Младенцы с CDH чрезвычайно чувствительны к шуму и движениям, поэтому хирургическое восстановление CDH часто выполняется в N / IICU. Когда наступает время ремонта, хирургическая бригада превращает прикроватную тумбочку вашего ребенка в операционную. Это избавляет ребенка от дополнительного стресса, связанного с транспортировкой.
Вашему ребенку будет сделана общая анестезия, и он будет находиться под наблюдением детского анестезиолога. Разрез делается чуть ниже грудной клетки ребенка, грудные органы направляются обратно в брюшную полость, а отверстие в диафрагме зашивается.Пространство, созданное в груди, позволяет легким продолжать расти.
Для младенцев с большими дефектами или полностью лишенными диафрагмы отверстие закрывают пластырем GORE-TEX® или мышечным лоскутом. По мере роста вашего ребенка врачи будут регулярно контролировать состояние пластыря, чтобы убедиться, что он не поврежден.
Хирургическое лечение врожденной диафрагмальной грыжи (ВДГ)
Осторожно вернув печень, желудок и кишечник на место, хирурги восстанавливают отверстие в диафрагме, наложив швы для сшивания мышц.
Часто пластырь Gore-Tex используется для закрытия больших отверстий.
1 из 1
Восстановление после операции CDH
Ваш ребенок оправится после операции и начнет процесс отлучения от аппарата ИВЛ. Когда ребенок будет готов, постепенно начнется кормление грудным молоком или смесью через трубку NG или OG. После удаления дыхательной трубки логопед и консультант по грудному вскармливанию будут работать с вашим ребенком, чтобы начать кормление через рот.
Продолжительность пребывания вашего ребенка в больнице от рождения до выписки в значительной степени зависит от тяжести CDH вашего ребенка и его реакции на лечение. Когда младенцы получают комплексную медицинскую помощь, социальные работники и психологи помогают членам семьи пережить все взлеты и падения.
Как только ваш ребенок будет выписан домой, мы назначим ему дальнейшее наблюдение в рамках нашей Программы легочной гипоплазии (PHP). Ваш ребенок встретится с несколькими специалистами в одном месте, чтобы контролировать и лечить любые потребности, связанные с CDH.Узнайте больше о долгосрочном уходе, предоставляемом нашей командой PHP.
Долгосрочное наблюдение группы экспертов важно для обеспечения наилучшего клинического ухода за вашим ребенком. Уникальная программа по лечению легочной гипоплазии (PHP) Детской больницы Филадельфии обеспечивает комплексное междисциплинарное наблюдение за детьми с хронической гипоплазией легких. Команда состоит из врачей общей хирургии, развивающей педиатрии, пульмонологии, кардиологии, психологии, диетологии, аудиологии, социальных служб и других по мере необходимости.
PHP отслеживает почти 600 детей с CDH в школьном возрасте. Первоначальное наблюдение со стороны PHP будет организовано, когда ваш ребенок будет находиться в N / IICU. Назначения составлены с учетом потребностей вашего ребенка, но обычно назначаются в 6 месяцев, 12 месяцев, 2 года, 4,5 года и 6 лет, а затем каждые 2 года по мере необходимости. Запись на прием рассчитана на посещение нескольких специалистов за один день.
CHOP стремится к всесторонней оценке на протяжении всей жизни вашего ребенка, чтобы мы могли постоянно улучшать уход и понимать долгосрочные результаты.
Большинство детей с CDH, за которыми ухаживает CHOP, достигают ожидаемых этапов роста и развития к детскому саду. Некоторым детям потребуется постоянная поддержка через PHP для оптимизации результатов. Наша команда готова помочь вам на каждом этапе пути.
Врожденная диафрагмальная грыжа: MedlinePlus Genetics
Врожденная диафрагмальная грыжа имеет множество различных причин. У 10-15% пострадавших это состояние проявляется в виде расстройства, поражающего многие системы организма, которое называется синдромом.Синдром Доннаи-Барроу, синдром Фринса и мозаичный синдром Паллистера-Киллиана — это одни из нескольких синдромов, при которых может возникнуть врожденная диафрагмальная грыжа. Некоторые из этих синдромов вызваны изменениями в отдельных генах, а другие — хромосомными аномалиями, которые влияют на несколько генов.
Около 25 процентов людей с врожденной диафрагмальной грыжей, не связанной с известным синдромом, также имеют аномалии одной или нескольких основных систем организма. Пораженные системы организма могут включать сердце, мозг, скелет, кишечник, гениталии, почки или глаза.У этих людей множественные аномалии, вероятно, являются результатом общего основного нарушения в развитии, которое затрагивает более чем одну область тела, но конкретный механизм, ответственный за это нарушение, неясен.
Приблизительно от 50 до 60 процентов случаев врожденных диафрагмальных грыж являются изолированными, что означает, что у пораженных людей нет других серьезных пороков развития.
Более 80 процентов людей с врожденной диафрагмальной грыжей не имеют известного генетического синдрома или хромосомных аномалий.В этих случаях причина состояния неизвестна. Исследователи изучают изменения в нескольких генах, участвующих в развитии диафрагмы, как возможные причины врожденной диафрагмальной грыжи. Некоторые из этих генов являются факторами транскрипции, которые предоставляют инструкции по созданию белков, которые помогают контролировать активность определенных генов (экспрессию генов). Другие предоставляют инструкции по созданию белков, участвующих в структуре клеток или перемещении (миграции) клеток в эмбрионе. Факторы окружающей среды, влияющие на развитие до рождения, также могут увеличивать риск врожденной диафрагмальной грыжи, но эти факторы окружающей среды не были идентифицированы.
Диафрагмальные грыжи | Отделение хирургии Колумбийского университета
Что такое диафрагмальные грыжи?
Диафрагмальные грыжи возникают при слабости или раскрытии диафрагмы, листовой мышцы, которая расположена под легкими и обычно отделяет грудную полость (где находятся легкие и сердце) от брюшной полости. Если в диафрагме есть отверстие, содержимое брюшной полости — таких органов, как желудок, кишечник, селезенка или печень — может прорваться через отверстие и появиться в грудной полости, что требует неотложной хирургической помощи.
Диафрагмальные грыжи часто называют в честь их местоположения. Грыжа Морганьи расположена ближе к передней части, где толстая кишка или сальник наиболее подвержены риску продвижения через грыжу в грудную полость. В случае грыжи Бохдалека, расположенной ближе к спине, почка подвергается большему риску.
Каковы причины диафрагмальных грыж?
Как правило, диафрагмальные грыжи возникают при рождении как порок развития, но могут возникнуть во взрослом возрасте из-за травмы или травмы.Врожденные диафрагмальные грыжи связаны с генетическими заболеваниями, такими как врожденные пороки сердца и синдром Дауна.
Каковы симптомы диафрагмальной грыжи?
Некоторые диафрагмальные грыжи могут протекать бессимптомно. Когда симптомы действительно возникают, они включают:
- Затрудненное дыхание
- Учащенное дыхание
- Гоночный пульс
- Пониженный аппетит
Как диагностировать диафрагмальные грыжи?
Диафрагмальные грыжи можно увидеть на обычных изображениях, таких как рентген, ультразвук, МРТ и компьютерная томография.Тесты, измеряющие газы крови, помогают дополнительно оценить, насколько хорошо функционируют легкие.
Как лечить диафрагмальную грыжу?
Хирургическое лечение грыжи является наиболее распространенным методом лечения, при котором грыжа закрывается швами для восстановления целостности диафрагмы и предотвращения попадания органов брюшной полости в грудную полость.
Следующие шаги
Если вам нужна помощь по поводу диафрагмы, мы готовы помочь. Позвоните по телефону (212) 305-3408 для существующих пациентов, (212) 304-7535 для новых пациентов или запросите онлайн-запись, чтобы начать работу сегодня.
Сопутствующие услуги
Связанные темы
Диафрагмальные грыжи: основы практики, анатомия, патофизиология
Irish MS, Holm BA, Glick PL. Врожденная диафрагмальная грыжа. Исторический обзор. Клин Перинатол . 1996 г., 23 (4): 625-53. [Медлайн].
Ladd WE, Gross RE. Врожденная диафрагмальная грыжа. N Engl J Med . 1940. 223: 917-25.
KOOP CE, JOHNSON J.Трансторакальная пластика диафрагмальной грыжи у младенцев. Энн Сург . 1952 Декабрь 136 (6): 1007-11. [Медлайн].
Иритани И. Экспериментальное исследование эмбриогенеза врожденной диафрагмальной грыжи. Анат Эмбриол (Берл) . 1984. 169 (2): 133-9. [Медлайн].
Гупта В.С., Хартинг MT. Врожденная легочная гипертензия, связанная с диафрагмальной грыжей. Семин Перинатол . 2019 30 июля 151167. [Medline].
Койвусало А.И., Пакаринен М.П., Линдаль Х.Г., Ринтала Р.Дж.Кумулятивная частота значительного гастроэзофагеального рефлюкса у пациентов с врожденной диафрагмальной грыжей — систематическое клиническое, pH-метрическое и эндоскопическое катамнестическое исследование. Дж. Педиатр Хирургия . 2008 Февраль 43 (2): 279-82. [Медлайн].
Glick PL, Pohlson EC, Resta R, Payne C, Mosbarger H, Luthy DA и др. Альфа-фетопротеин материнской сыворотки является маркером аномалий плода в детской хирургии. Дж. Педиатр Хирургия . 1988, 23 января (1, часть 2): 16-20. [Медлайн].
Janssen DJ, Tibboel D, Carnielli VP, van Emmen E, Luijendijk IH, Darcos Wattimena JL, et al. Размер пула сурфактанта фосфатидилхолина у новорожденных с врожденной диафрагмальной грыжей, требующей ЭКМО. Дж. Педиатр . 2003 Март 142 (3): 247-52. [Медлайн].
Лотце А., Найт Г. Р., Андерсон К. Д., Халл В. М., Уитсетт Дж. А., О’Доннелл Р. М. и др. Терапия сурфактантом (берактантом) у младенцев с врожденной диафрагмальной грыжей на ЭКМО: свидетельство стойкого дефицита сурфактанта. Дж. Педиатр Хирургия . 1994 29 марта (3): 407-12. [Медлайн].
Торфс С.П., Карри С.Дж., Бейтсон Т.Ф., Оноре Л.Х. Популяционное исследование врожденной диафрагмальной грыжи. Тератология . 1992 Декабрь 46 (6): 555-65. [Медлайн].
Michikawa T, Yamazaki S, Sekiyama M, Kuroda T., Nakayama SF, Isobe T, et al. Потребление матери витамина А во время беременности было обратно пропорционально связано с врожденной диафрагмальной грыжей: японское исследование окружающей среды и детей. Br J Nutr . 2019 2. 1-18 сентября. [Медлайн].
Shanmugam H, Brunelli L, Botto LD, Krikov S, Feldkamp ML. Эпидемиология и прогноз врожденной диафрагмальной грыжи: популяционное когортное исследование в Юте. Врожденные дефекты Res . 2017 г. 1. 109 (18): 1451-1459. [Медлайн].
Кларк Р. Х., Хардин В. Д. мл., Хиршль Р. Б., Яксич Т., Лалли К. П., Лангхэм М. Р. мл. И др. Текущее хирургическое лечение врожденной диафрагмальной грыжи: отчет Исследовательской группы по врожденной диафрагмальной грыже. Дж. Педиатр Хирургия . 1998 июл.33 (7): 1004-9. [Медлайн].
Downard CD, Jaksic T, Garza JJ, Dzakovic A, Nemes L, Jennings RW и др. Анализ повышения выживаемости при врожденной диафрагмальной грыже. Дж. Педиатр Хирургия . 2003 май. 38 (5): 729-32. [Медлайн].
Дариэль А., Розе Дж. К., Пилокет Х., Подевин Г., Французская исследовательская группа CDH. Влияние профилактической фундопликации на выживаемость без нарушения роста левой врожденной диафрагмальной грыжи, требующей пластыря. Дж. Педиатр . 2010 Октябрь 157 (4): 688-90, 690.e1. [Медлайн].
Кавахара Х., Окуяма Х., Нос К., Накаи Х., Йонеда А., Кубота А. и др. Физиологическая и клиническая характеристика гастроэзофагеального рефлюкса после пластики врожденной диафрагмальной грыжи. Дж. Педиатр Хирургия . 2010 декабрь 45 (12): 2346-50. [Медлайн].
Фриск В., Якобсон Л.С., Унгер С., Трахсел Д., О’Брайен К. Долгосрочные исходы нервного развития у выживших врожденных диафрагмальных грыж, не получавших экстракорпоральную мембранную оксигенацию. Дж. Педиатр Хирургия . 2011 июл. 46 (7): 1309-18. [Медлайн].
Тонкс А., Уайлдс М., Сомерсет Д.А., Дент К., Абхьянкар А., Багчи И. и др. Врожденные пороки развития диафрагмы: результаты Регистра врожденных аномалий Вест-Мидлендс с 1995 по 2000 год. Prenat Diagn . 2004 24 августа (8): 596-604. [Медлайн].
Кипфмюллер Ф., Шредер Л., Мелаку Т., Гейпель А., Берг С., Гембрух У. и др. Прогнозирование ЭКМО и смертности новорожденных с врожденной диафрагмальной грыжей с использованием шкалы SNAP-II. Клин Падиатр . 2019 30 сентября. [Medline].
Fauza DO, Wilson JM. Врожденная диафрагмальная грыжа и связанные с ней аномалии: частота возникновения, идентификация и влияние на прогноз. Дж. Педиатр Хирургия . 1994 29 августа (8): 1113-7. [Медлайн].
Танака Т., Инамура Н., Исии Р., Каятани Ф., Йонеда А., Тазуке Ю. и др. Оценка диастолической функции с использованием деформации диастолической стенки (DWS) до и после радикальной операции по поводу врожденной диафрагмальной грыжи. Педиатр Хирург Инт . 2015 31 октября (10): 905-10. [Медлайн].
Britto IS, Sananes N, Olutoye OO, Cass DL, Sangi-Haghpeykar H, Lee TC и др. Стандартизация сонографических измерений отношения легких к голове при изолированной врожденной диафрагмальной грыже: влияние на воспроизводимость и эффективность для прогнозирования результатов. Дж. Ультразвуковое лечение . 2015 окт. 34 (10): 1721-7. [Медлайн].
Usui N, Kitano Y, Okuyama H, Saito M, Morikawa N, Takayasu H и др.Надежность соотношения поперечной площади легкого и грудной клетки как прогностический параметр у плодов с врожденной диафрагмальной грыжей. Педиатр Хирург Инт . 2011, 27 января (1): 39-45. [Медлайн].
Kido S, Hidaka N, Sato Y, Fujita Y, Miyoshi K, Nagata K и др. Повторная оценка соотношения поперечной площади легких и грудной клетки непосредственно перед рождением для прогнозирования послеродовых краткосрочных исходов у плодов с изолированной левосторонней врожденной диафрагмальной грыжей: анализ единого центра. Congenit Anom (Киото) . 2018 май. 58 (3): 87-92. [Медлайн].
Bagolan P, Casaccia G, Crescenzi F, Nahom A, Trucchi A, Giorlandino C. Влияние текущего протокола лечения на исход врожденной диафрагмальной грыжи высокого риска. Дж. Педиатр Хирургия . 2004 г., 39 (3): 313-8; обсуждение 313-8. [Медлайн].
Шахматы пр. Влияние щадящей вентиляции на выживаемость при врожденной диафрагмальной грыже. Педиатрия .2004 г., 113 (4): 917. [Медлайн].
Reyes C, Chang LK, Waffarn F, Mir H, Warden MJ, Sills J. Отсроченное восстановление врожденной диафрагмальной грыжи с ранней высокочастотной колебательной вентиляцией во время предоперационной стабилизации. Дж. Педиатр Хирургия . 1998 июл. 33 (7): 1010-4; обсуждение 1014-6. [Медлайн].
Ng GY, Дерри К., Марстон Л., Чоудхури М., Холмс К., Калверт С.А. Уменьшение количества повреждений легких, вызванных вентилятором, улучшает исход при врожденной диафрагмальной грыже? Педиатр Хирург Инт . 2008 24 февраля (2): 145-50. [Медлайн].
Bos AP, Tibboel D, Hazebroek FW, Molenaar JC, Lachmann B, Gommers D. Заместительная терапия сурфактантом при врожденной диафрагмальной грыже высокого риска. Ланцет . 1991 16 ноября. 338 (8777): 1279. [Медлайн].
Glick PL, Leach CL, Besner GE, Egan EA, Morin FC, Malanowska-Kantoch A, et al. Патофизиология врожденной диафрагмальной грыжи. III: Экзогенная сурфактантная терапия для новорожденных из группы высокого риска с CDH. Дж. Педиатр Хирургия . 1992, 27 июля (7): 866-9. [Медлайн].
Colby CE, Lally KP, Hintz SR, Lally PA, Tibboel D, Moya FR и др. Заместительная сурфактантная терапия на ЭКМО не улучшает исход у новорожденных с врожденной диафрагмальной грыжей. Дж. Педиатр Хирургия . 2004 ноябрь 39 (11): 1632-7. [Медлайн].
Karamanoukian HL, O’Toole SJ, Glick PL. «Современные» стратегии ведения плода и новорожденного с врожденной диафрагмальной грыжей. Дж Перинатол . 1996 март-апрель. 16 (2 пт 2 вс): S40-7. [Медлайн].
Scaife ER, Johnson DG, Meyers RL, Johnson SM, Matlak ME. Расщепленный мышечный лоскут брюшной стенки — простой способ без использования сетки для лечения большой диафрагмальной грыжи. Дж. Педиатр Хирургия . 2003 Декабрь 38 (12): 1748-51. [Медлайн].
Окадзаки Т., Хасэгава С., Урушихара Н., Фукумото К., Огура К., Минато С. и др. Лоскут фасции Тольдта: новый метод лечения больших диафрагмальных грыж. Педиатр Хирург Инт . 2005 21 января (1): 64-7. [Медлайн].
Масумото К., Нагата К., Сузаки Р., Уэсуги Т., Такахаши Ю., Тагучи Т. Эффективность восстановления диафрагмы с использованием лоскута брюшной мышцы у пациентов с рецидивирующей врожденной диафрагмальной грыжей. Дж. Педиатр Хирургия . 2007 декабрь 42 (12): 2007-11. [Медлайн].
Окадзаки Т., Окавада М., Исии Дж., Кога Х., Мияно Г., Дои Т. и др. Интраоперационная вентиляция при торакоскопической пластике неонатальной врожденной диафрагмальной грыжи. Педиатр Хирург Инт . 2017 Октябрь 33 (10): 1097-1101. [Медлайн].
Gander JW, Fisher JC, Gross ER, Reichstein AR, Cowles RA, Aspelund G, et al. Раннее рецидивирование врожденной диафрагмальной грыжи чаще после торакоскопической пластики, чем после открытой пластики: единичное институциональное исследование. Дж. Педиатр Хирургия . 2011 июл. 46 (7): 1303-8. [Медлайн].
Окадзаки Т., Нисимура К., Такахаши Т., Сёдзи Х., Симидзу Т., Танака Т. и др. Показания к торакоскопической пластике врожденной диафрагмальной грыжи у новорожденных. Педиатр Хирург Инт . 2011 27 января (1): 35-8. [Медлайн].
Теруи К., Нагата К., Ито М., Ямото М., Сираиси М., Тагучи Т. и др. Хирургические подходы при неонатальной врожденной диафрагмальной грыже: систематический обзор и метаанализ. Педиатр Хирург Инт . 2015 31 октября (10): 891-7. [Медлайн].
Тайсон А.Ф., Сола Р. мл., Арнольд М. Р., Коспер Г. Х., Шульман А. М.. Сравнение торакоскопической и открытой пластики врожденной диафрагмальной грыжи: обзор одного третичного центра. J Laparoendosc Adv Surg Tech A . 2017 27 ноября (11): 1209-1216. [Медлайн].
Wilson JM, Bower LK, Lund DP. Эволюция техники пластики врожденных диафрагмальных грыж на ЭКМО. Дж. Педиатр Хирургия . 1994 29 августа (8): 1109-12. [Медлайн].
Гривелл Р.М., Андерсен К., Додд Дж. М.. Пренатальные вмешательства при врожденной диафрагмальной грыже для улучшения результатов. Кокрановская база данных Syst Rev . 2015 27 ноя.CD008925. [Медлайн].
Seravalli V, Jelin EB, Miller JL, Tekes A, Vricella L, Baschat AA. Фетоскопическая окклюзия трахеи для лечения неизолированной врожденной диафрагмальной грыжи. Пренат Диагностика . 2017 окт.37 (10): 1046-1049. [Медлайн].
Лалли К.П., Баголан П., Хози С., Лалли П.А., Стюарт М., Коттен С.М. и др. Кортикостероиды для плода с врожденной диафрагмальной грыжей: можем ли мы показать пользу ?. Дж. Педиатр Хирургия .2006 апр. 41 (4): 668-74; обсуждение 668-74. [Медлайн].
Beurskens LW, Tibboel D, Lindemans J, Duvekot JJ, Cohen-Overbeek TE, Veenma DC, et al. Ретиноловый статус новорожденных связан с врожденной диафрагмальной грыжей. Педиатрия . 2010 Октябрь 126 (4): 712-20. [Медлайн].
Major D, Cadenas M, Fournier L, Leclerc S, Lefebvre M, Cloutier R. Статус ретинола новорожденных с врожденной диафрагмальной грыжей. Педиатр Хирург Инт . 1998 13 октября (8): 547-9. [Медлайн].
Льюис Н.А., Холм Б.А., Россман Дж., Шварц Д., Глик П.Л. Позднее введение дородового витамина А способствует структурному созреванию легких и улучшает вентиляцию в модели врожденной диафрагмальной грыжи ягненка. Педиатр Хирург Инт . 2011 27 февраля (2): 119-24. [Медлайн].
Льюис Н.А., Холм Б.А., Шварц Д., Соколовски Дж., Россман Дж., Глик П.Л. Антенатальный прием витамина А снижает повреждение легких, вызванное вентиляцией, на модели врожденной диафрагмальной грыжи ягненка. Азиатский J Surg . 2006 июл.29 (3): 193-7. [Медлайн].
Бабюк Р.П., Тебо Б., Грир Дж. Снижение частоты возникновения диафрагмальной грыжи, вызванной нитрофеном, благодаря витамину А и ретиноевой кислоте. Am J Physiol Lung Cell Mol Physiol . 2004 г., май. 286 (5): L970-3. [Медлайн].
St Peter SD, Valusek PA, Tsao K, Holcomb GW 3rd, Ostlie DJ, Snyder CL. Осложнения со стороны брюшной полости, связанные с типом пластики врожденной диафрагмальной грыжи. J Surg Res . 2007 15 июня. 140 (2): 234-6. [Медлайн].
[Рекомендации] Канадская врожденная диафрагмальная грыжа, коллаборативная, Пулигандла П.С., Скарсгард Э.Д., Оффринга М., Адатиа I, Бэрд Р. Диагностика и лечение врожденной диафрагмальной грыжи: руководство по клинической практике. CMAJ . 2018 29 января. 190 (4): E103-E112. [Медлайн]. [Полный текст].
Врожденная диафрагмальная грыжа | Johns Hopkins Medicine
Что такое врожденная диафрагмальная грыжа?
Врожденная диафрагмальная грыжа (ВГД) возникает, когда есть отверстие в диафрагме, которая представляет собой тонкий слой мышцы, отделяющий грудную клетку от брюшной полости.Когда этот промежуток образуется во время развития плода в утробе матери, кишечник, желудок или даже печень могут перейти в грудную полость. Наличие этих органов брюшной полости в груди ограничивает пространство для легких и может привести к респираторным осложнениям. Поскольку CDH заставляет легкие расти в сжатом состоянии, некоторые аспекты их функции могут развиваться нормально только после рождения ребенка.
Врожденная диафрагмальная грыжа и гипоплазия легких
Ребенок с CDH может страдать от формы недоразвитых легких, известной как легочная гипоплазия.
Когда возникает гипоплазия легких, возникают отклонения, которые влияют на:
До рождения плацента берет на себя все функции легких, поэтому плод может расти в утробе матери, не страдая от низкого уровня кислорода ( гипоксемия ). Однако после рождения ребенок зависит от функции легких, и если их недоразвитие серьезное, потребуются методы искусственной вентиляции легких. CDH может появляться на левой, правой или, реже, на обеих сторонах груди.CDH встречается примерно у 1 из 2500 живорождений.
Врожденная диафрагмальная грыжа | Вопросы и ответы с доктором Йеной Миллер
Доктор Джена Миллер рассказывает о лечении и уходе, предоставляемом Центром терапии плода Джона Хопкинса для будущих матерей, у детей которых диагностирована врожденная диафрагмальная грыжа (ВДГ). Она обсуждает, как это диагностируется, варианты лечения и последующего наблюдения.
Что вызывает CDH?
У растущего эмбриона диафрагма полностью формируется к 10 неделе беременности. Однако в случае CDH процесс, который приводит к образованию диафрагмы, нарушается. Как только в диафрагме появляется отверстие, содержимое брюшной полости может попасть в грудную клетку. Это называется грыжей . Поскольку активность плода и дыхательные движения становятся более частыми и интенсивными по мере продолжения беременности, размер грыжи может колебаться или увеличиваться.
Иногда причиной CDH является проблема с хромосомами ребенка или генетическое заболевание. В этом случае у ребенка могут быть дополнительные проблемы со здоровьем или аномалии органов. В других случаях CDH может возникать без идентифицируемой генетической причины. Это называется изолированным CDH , и в этих обстоятельствах основное внимание уделяется степени гипоплазии легких, вызванной этим дефектом. Чтобы определить, изолирован ли CDH, и предоставить наиболее точную информацию о заболевании, требуется генетическое тестирование.
Диагностика CDH
Обнаружение CDH может произойти во время обычного ультразвукового исследования, которое может выявить избыток околоплодных вод и / или брюшного содержимого в грудной полости плода. Чтобы подтвердить пренатальный диагноз CDH, врачи могут провести очень подробное ультразвуковое исследование, провести тестирование хромосом плода и измерить размер его легких. Во время ультразвукового исследования врачи сосредотачиваются на конкретных результатах, которые могут указывать на наличие синдрома. Генетическое тестирование проводится амниоцентезом.
Затем измеряется размер легких и сравнивается с ожидаемым размером на данном этапе беременности. Это можно сделать путем измерения отношения площади легких к окружности головы (LHR) или сравнения наблюдаемого / ожидаемого LHR (o / e LHR). Также важно определить, переместилась ли печень в грудную клетку. Основываясь на этих измерениях, специалисты Центра терапии плода Джонса Хопкинса могут классифицировать тяжесть CDH как легкую, среднюю или тяжелую. Для получения наиболее точной оценки используются специальные методы визуализации, включая магнитно-резонансную томографию (МРТ).
Врожденная диафрагмальная грыжа также может быть диагностирована после рождения — часто, если у новорожденного возникают проблемы с дыханием.
Лечение CDH
После родов ребенку с CDH может быть сделана операция по закрытию дефекта. Однако операция после родов не устраняет уже возникшее повреждение легких. По этой причине при некоторых беременностях рекомендуются терапевтические процедуры для плода. Эти процедуры могут помочь уменьшить количество повреждений легких, которые могут возникнуть во время беременности.Цель лечения плода — обратить вспять некоторые повреждения легких, вызванные сдавлением легких.
Лечение плода при CDH
Фетоскопическая окклюзия трахеи (FETO) : Легкие плода производят жидкость, которая покидает тело через рот ребенка. Если этот отток жидкости заблокирован, ей некуда деваться, и она будет опухать в пораженном легком. Когда это происходит в течение четырех-пяти недель, легкое расширяется и его функция улучшается.Этот тип закупорки может быть достигнут путем временной блокировки дыхательного горла плода (трахеи) баллоном на некоторое время. Это делается путем проведения оперативной фетоскопии, известной как FETO. Считается, что FETO работает, увеличивая созревание легких и обращая вспять некоторые повреждающие эффекты CDH на функцию легких.
Наблюдение за плодом и планирование родов : высока вероятность того, что ребенку с CDH станет хуже до предполагаемой даты родов.Часть комплексного плана лечения будет включать тщательный мониторинг плода и матери, чтобы избежать серьезного ухудшения состояния плода и определить обстоятельства и сроки для оптимальных родов.
Врожденная диафрагмальная грыжа (ВДГ) | Центр лечения плода UCSF
Что такое CDH?
смотреть видео
Широкая плоская мышца, разделяющая грудную и брюшную полости, называется диафрагмой. Диафрагма формируется, когда плод находится на 8 неделе беременности.Когда он не формируется полностью, образуется дефект, называемый врожденной диафрагмальной грыжей (ВГД). Это отверстие в мышце между грудью и животом.
Большинство CDH находятся на левой стороне. Отверстие позволяет содержимому брюшной полости (желудка, кишечника, печени, селезенки и почек) подниматься в грудную клетку плода. Грыжа этих органов брюшной полости в грудную клетку занимает это пространство и препятствует увеличению легких до нормального размера. Это может повлиять на рост обоих легких.Результат этого называется гипоплазией легких.
Находясь в матке, плод не нуждается в легких, чтобы дышать, поскольку эту функцию выполняет плацента. Однако, если после рождения ребенка легкие станут слишком маленькими, ребенок не сможет обеспечить себя достаточным количеством кислорода, чтобы выжить.
Каков исход для плода с CDH?
смотреть видео
CDH имеет широкий диапазон тяжести и исходов. В лучшем случае некоторые младенцы очень хорошо переносят послеродовое лечение, хирургическое вмешательство и уход в отделении интенсивной терапии.В самых тяжелых случаях некоторые из них не выживут, как бы мы ни старались. А в середине, некоторые будут жить нормально, в то время как другим будут тяжелые времена и могут быть некоторые недостатки, начиная от легких проблем с обучением до проблем с дыханием и ростом. Состояние ребенка после рождения определяется тем, насколько хорошо легкое растет до рождения и его функцией.
Плоды в лучшем конце спектра имеют отличный шанс вести совершенно нормальный образ жизни. Они не требуют специального дородового ведения с точки зрения сроков или типа родов, но должны доставляться в перинатальный центр с отделением интенсивной терапии уровня III с поддержкой неонатальной и детской хирургии.Место родов очень важно, потому что транспортировка этих младенцев после рождения может быть опасной для младенца. Младенцы все еще нуждаются в ремонте отверстия диафрагмы после рождения и будут находиться в отделении интенсивной терапии в течение нескольких недель. Несмотря на то, что легкие не имеют нормального размера при рождении, они способны расти и адаптироваться в течение многих лет, поэтому эти дети могут вести нормальный активный образ жизни без ограничений.
С другой стороны, младенцы с тяжелой формой CDH и очень маленькими легкими могут иметь тяжелые проблемы после рождения, и некоторые из них не выживают.Чтобы выжить, этим младенцам требуется очень квалифицированная интенсивная терапия — такие вещи, как высокочастотная или колебательная вентиляция, вдыхание оксида азота и, в некоторых случаях, экстракорпоральная мембранная оксигенация (ЭКМО). ЭКМО обеспечивает временную поддержку при легочной недостаточности за счет циркуляции крови ребенка через аппарат сердечно-легочного типа. Это может спасти жизнь, но его можно использовать только ограниченное время.
Младенцы с CDH должны быть доставлены в опытный перинатальный центр третичного уровня с возможностью ЭКМО. Операция по восстановлению диафрагмальной грыжи после рождения не является экстренной и обычно проводится, когда состояние ребенка стабилизируется, обычно в течение первой недели жизни.После ремонта этим малышам потребуется интенсивная поддержка в течение многих недель или даже месяцев. Даже когда CDH тяжелый, более 70% детей могут быть спасены с помощью интенсивной поддержки. Однако могут возникнуть долгосрочные проблемы со здоровьем, связанные с дыханием, кормлением, ростом и развитием.
Насколько серьезна диафрагмальная грыжа у моего плода?
смотреть видео
Чтобы определить серьезность состояния вашего плода, важно собрать информацию с помощью различных тестов и определить, есть ли какие-либо дополнительные проблемы.Эти тесты вместе с рекомендациями экспертов важны для вас, чтобы вы могли принять наилучшее решение о правильном лечении.
Сюда входят:
- Тип дефекта — его отличие от других подобных проблем.
- Степень тяжести дефекта — является ли дефект вашего плода легкой или тяжелой.
- Сопутствующие дефекты — это другая проблема или группа проблем (синдром).
Амниоцентез и / или микрочип может быть рекомендован для тестирования хромосом.Сонография — лучший инструмент для визуализации, но он зависит от опыта и знаний врача. В некоторых случаях может использоваться магнитно-резонансная томография (МРТ). Многие проблемы впервые обнаруживаются во время рутинных процедур скрининга, проводимых в кабинете вашего врача (амниоцентез, скрининг материнской сыворотки, рутинная сонография). Однако для всесторонней оценки обычно требуется специализированный перинатальный / неонатальный центр с опытом лечения сложных и редких проблем плода. Мы можем вместе с вашим врачом подобрать вам удобный центр.
Тщательная и точная пренатальная оценка [сонограмма уровня II, эхокардиограмма, иногда магнитно-резонансная томография (МРТ)] может помочь нам предсказать до рождения тяжесть CDH. Один из наиболее важных вопросов — убедиться, что нет других врожденных дефектов (например, проблем с сердцем), которые могут повлиять на исход и варианты лечения.
Основные факторы при определении степени серьезности
Когда CDH является единственной проблемой, мы узнали, что серьезность и, таким образом, исход определяется двумя факторами: 1) положением печени и 2) соотношением легких к голове или LHR.Положение печени относится к тому, была ли какая-либо часть печени грыжа или поднята в грудь плода. Плоды с печенью вверх в грудной клетке имеют более тяжелую форму CDH и более низкую выживаемость. У большинства пациентов с CDH, которых мы обследуем, некоторая часть грыжи печени попадает в грудную клетку. Отношение легких к голове, или LHR, представляет собой численную оценку размера легких плода, основанную на измерении количества видимых легких. Высокие значения LHR, превышающие 1,0, связаны с лучшими результатами.
Плоды без грыжи печени в грудную клетку (печень вниз) обычно имеют менее тяжелую форму CDH и, следовательно, лучший прогноз. По нашему опыту оценки многих сотен пациентов с CDH, эти пациенты чувствуют себя хорошо после рождения. Мы, конечно, рады, когда можем предсказать хороший результат. После рождения этим младенцам по-прежнему потребуется специализированный уход. Мы рекомендуем рожать этих детей в ближайшем будущем в центре с отделением интенсивной терапии, детской хирургией и отделением ЭКМО.
Плоды с грыжей печени в грудную клетку и соотношением головки легкого менее 1,0 имеют более тяжелую форму CDH. Мы можем предсказать, что им будет очень трудно после рождения. Большинству из них может помочь интенсивная терапия очень высокого уровня, и может потребоваться ЭКМО. Однако очень интенсивная терапия, необходимая в наиболее тяжелых случаях, может привести к осложнениям и долгосрочным проблемам, включая затруднения с дыханием и кормлением.
Несмотря на то, что вам может быть дан прогноз тяжести CDH, пока ребенок точно не родится, не существует теста, который можно было бы выполнить во время беременности, который мог бы предсказать функцию легких.Как функция легких вашего ребенка будет определена только после его рождения.
Что я могу сделать во время этой беременности?
смотреть видео
Для тех семей, которые решают продолжить беременность, наиболее важным следующим шагом является точная пренатальная диагностика тяжести состояния, которая определяет доступные варианты дородового ведения. Если ваш плод находится в лучшем конце спектра, наиболее важный выбор — где родить ребенка.
Время и тип доставки не сильно повлияют на результат, но место доставки, безусловно, будет. Семьи захотят разработать план родоразрешения и послеродового ухода со своим акушером / перинатологом, неонатологом и детскими хирургами, чтобы стабилизировать состояние ребенка и лечить его в одном центре.
Для плодов середины спектра место родов становится еще более важным. Эти дети будут нуждаться в очень интенсивной поддержке после рождения и должны быть доставлены в центры с большим опытом и возможностями ЭКМО.ЭКМО — это аппарат искусственного кровообращения, который обеспечивает ребенка кислородом, когда легкие не могут этого сделать. Это лекарственная терапия, которую можно использовать в течение ограниченного времени, обычно до двух недель.
Тщательное планирование и координация сроков родов необходимы, чтобы избежать ситуаций повышенного риска, таких как роды в одной больнице, а затем необходимость транспортировки тяжелобольного ребенка в специализированный центр.
Вмешательство плода
смотреть видео
Плоды в самом тяжелом конце спектра с повышенной печенью и LHR менее 1.0 могут быть кандидатами на пренатальное вмешательство. Более двух десятилетий мы работали над способами улучшения результатов для этих плодов, заставляя легкие расти до рождения, чтобы их было достаточно во время родов. Наиболее многообещающим является использование фетальной хирургии FETENDO, а именно фетоскопическая временная окклюзия трахеи для увеличения легкого плода.
Находясь в матке, легкие плода постоянно выделяют жидкость, которая выходит через рот в околоплодные воды.Когда трахея заблокирована, эта жидкость остается в легких. По мере накопления легочная жидкость расширяет легкие, стимулирует их рост и выталкивает содержимое брюшной полости (печень, кишечник) из груди в брюшную полость. Цель этого лечения — родить ребенка с достаточно большими легкими, чтобы обеспечить ребенку достаточное количество кислорода.
Минимально инвазивная хирургия: окклюзия трахеи
смотреть видео
FTC в UCSF уже давно является мировым лидером в лечении CDH.Мы получили одобрение (исключение для исследуемого устройства) на использование нового медицинского устройства для окклюзии трахеи при тяжелой CDH. У нас есть единственный значительный опыт окклюзии трахеи в Соединенных Штатах, поскольку в прошлом мы провели проспективное рандомизированное исследование, спонсируемое NIH и опубликованное в New England Journal of Medicine. Хотя мы не обнаружили разницы между группой с окклюзией трахеи и контрольной группой, мы многому научились из испытания. Мы предлагаем окклюзию трахеи избранной группе пациентов, которые, по нашему мнению, потенциально могут извлечь наибольшую пользу из этой процедуры.
Используя только крошечный разрез в замочной скважине в матке матери и матери, и крошечный съемный баллон помещают в трахею плода. Когда легкое плода вырастет, баллон можно снять или спустить, чтобы ребенок мог родиться нормально. Как введение, так и удаление трахеального баллона происходит до рождения; в результате в большинстве случаев матери могут родить естественным путем без необходимости процедуры EXIT. Мы считаем, что эта более минимально инвазивная стратегия позволит матерям дольше оставаться беременными и избежать осложнений преждевременных родов, связанных с предыдущими попытками окклюзии трахеи.
Кто является кандидатом на баллонную окклюзию трахеи?
Баллонная окклюзия трахеи предлагается только тем пациентам, у плода которых имеется наиболее тяжелая форма врожденной диафрагмальной грыжи. Мы определили эту группу как: 1) часть печени переместилась в грудную полость плода и 2) измеренное легкое на правой стороне (не на стороне грыжи) маленькое и имеет соотношение легкого к голове ( LHR) меньше или равно 1,0.
Для того, чтобы быть рассмотренным для вмешательства на плод, вы должны сначала пройти амниоцентез, чтобы определить, что у плода нет хромосомных проблем.Результаты этого теста обычно занимают 7-10 рабочих дней.
Критерии включения | Критерии исключения |
|
|
* Правосторонние грыжи могут соответствовать критериям для сострадательного использования трахеального баллона
Если вы соответствуете всем этим критериям и хотите, чтобы у вас была диагностирована окклюзия трахеи, вам необходимо поехать в Сан-Франциско для официального обследования.Формальная оценка между 22 и 26 неделями беременности будет включать в себя: УЗИ (для определения положения печени и LHR) и ECHO (УЗИ сердца для исключения любых отклонений), а также консультации ряда членов нашего Центра лечения плода. бригада (хирург, социальный работник, перинатолог, медсестра и т. д.).
Операция баллонной окклюзии трахеи
Если вы считаете себя кандидатом на окклюзию трахеи, и вы решили пройти эту процедуру, операция окклюзии трахеи будет выполнена между 26 и 28 неделями беременности.Процедура требует пребывания в больнице на ночь. После выписки из больницы вам нужно будет остаться в Сан-Франциско, пока баллон находится в трахее вашего плода. Обычно это длится 4-6 недель. В это время вам нужно будет еженедельно проходить УЗИ и посещать врача. Через 4-6 недель вы снова попадете в больницу на ночь, чтобы удалить баллон из трахеи плода. Если процедуры будут успешными, вы сможете вернуться домой, чтобы продолжить беременность и родить ребенка.
Требование предварительного разрешения на страхование
И оценка, и операции должны быть санкционированы вашей страховой компанией. Большинство страховых компаний оплатили эту процедуру своим застрахованным. Вам следует связаться со своей страховой компанией, чтобы узнать, требуется ли предварительная авторизация. Мы можем предоставить вам коды диагностики и процедур.
За дополнительной информацией обращайтесь в наш центр.
Что будет после рождения?
смотреть видео
Младенцы с CDH должны быть доставлены в специализированный перинатальный центр с отделением интенсивной терапии высокого уровня и детской хирургией.Хотя у некоторых младенцев будет очень благоприятный прогноз (LHR> 1,4), они все равно будут нуждаться в интенсивной терапии высокого уровня, и о них должны заботиться неонатологи и хирурги в ICN, имеющие опыт высокочастотной и колебательной вентиляции, ингаляции оксида азота и особенно экстракорпоральной мембранная оксигенация (ЭКМО). До рождения невозможно сказать, какая поддержка потребуется ребенку после рождения. Младенцы с CDH, известные до рождения, не должны быть доставлены в учреждение, не способное оказать всю необходимую поддержку, поскольку транспортировка больного ребенка может быть опасной.
Младенцы с CDH должны быть доставлены в «установку», где неонатологи забирают ребенка у акушеров и немедленно обеспечивают жизнеобеспечение — дыхание, кислород, внутривенное введение жидкостей и т. Д. По мере необходимости. Реакция ребенка будет определять количество необходимой поддержки дыхания, от небольшого количества кислорода до дыхательного аппарата и ЭКМО.
Серьезность проблемы с легкими также будет определять курс лечения в отделении интенсивной терапии — опять же, от хирургического вмешательства в первый день и дома через несколько недель до полной поддержки, включая ЭКМО, хирургическое восстановление (иногда проводится, пока ребенок находится в состоянии покоя). на ЭКМО), а затем месяцы очень интенсивной поддержки перед отъездом домой.
Долгосрочный результат зависит от тяжести CDH и потребности в очень интенсивной поддержке.
Долгосрочные осложнения CDH
Как выздоравливает ребенок с врожденной диафрагмальной грыжей после рождения, определяется многими факторами. Младенцы, перенесшие более тяжелую CDH, могут столкнуться с проблемами, которые могут включать легкие проблемы с обучением, заболевания дыхания, потерю слуха и проблемы роста.
Осложнения могут включать:
- Рецидив CDH — Некоторым детям требуется последующая операция (и) для восстановления рецидива CDH.Часто это связано с тяжестью ХДБ при рождении
- Респираторные заболевания — Младенцы с CDH часто страдают респираторными проблемами из-за нарушения роста легких (гипоплазия легких), которое возникает до рождения. Некоторым детям может потребоваться дополнительный кислород дома. Некоторые дети легко утомляются во время упражнений или имеют респираторные проблемы, такие как астма, которые улучшаются с помощью дыхательных препаратов.
- Респираторно-синцитиальный вирус (RSV ) — RSV — это вирус простуды, который каждую зиму заражает множество людей.Дети с CDH не имеют нормального развития легких и более восприимчивы к инфекциям RSV.
- Легочная гипертензия — Новорожденные с CDH могут иметь легочную гипертензию (ограничение кровотока в легких), которая сохраняется в течение от нескольких недель до, в редких случаях, многих месяцев после рождения.
- Желудочно-кишечные проблемы
- Питание и отвращение к ротовой полости — Некоторые дети с CDH легко устают, поскольку они тяжело работают, чтобы дышать, поэтому им трудно принимать все, что им нужно, через рот.
- Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) — Дети с ХРБ часто страдают гастроэзофагеальной рефлюксной болезнью (ГЭРБ), при которой содержимое их желудка отталкивается или возвращается из желудка в пищевод. Поскольку ГЭРБ так часто встречается у пациентов с ХДГ, большинство пациентов с ХДБ в течение некоторого времени принимают антирефлюксные препараты. В тяжелых случаях может быть рекомендована операция по фундопликации.
- Боль в животе и аппендицит — Дети с CDH имеют атипичное положение кишечника, потому что кишечник, который находился в грудной клетке, вручную перемещали в брюшную полость.Это важно знать, если у вашего ребенка появятся боли в животе и есть подозрение на аппендицит. Приложение может находиться в другом положении, и медицинская бригада должна знать об этом.
- Запор — По неизвестным причинам дети с CDH часто страдают от запора. Это облегчается с помощью обычных педиатрических слабительных.
- Непроходимость кишечника — Операция по перемещению органов вашего ребенка из груди в брюшную полость может иногда вызывать спайки или рубцовую ткань в брюшной полости, которые могут перегибать кишечник.Этот перегиб блокирует ток жидкости в кишечнике. Это называется непроходимостью кишечника.
- Проблемы с развитием скелета
- Сколиоз — У детей с CDH по мере роста может развиться сколиоз или искривление позвоночника. Это может быть связано с различиями в размерах легких на двух сторонах грудной клетки у детей с CDH.
- Деформация грудной клетки грудной клетки — У некоторых детей с CDH может развиться депрессия грудины или грудины.Это называется грудной клеткой.
- Проверка слуха — Дети, которым была проведена интубация на аппарате искусственной вентиляции легких с дополнительным кислородом, которые получали несколько лекарств или лечили ЭКМО, подвержены риску потери слуха. Рекомендуется регулярно проверять слух.
- Задержка развития — Дети, которые были больны и госпитализированы на длительный срок, подвержены риску задержки нормального развития. Важно как можно раньше выявлять задержку в развитии.
Для получения дополнительной информации о долгосрочном соблюдении требований CDH и уходе на дому посетите UCSF Pediatric Surgery: CDH
Клиника UCSF LIFE, долгосрочное лечение CDH
Клиника LIFE — это многопрофильная программа, которая является частью педиатрической хирургии UCSF, в которой участвует команда специалистов, в которую входят гастроэнтерологи, неонатологи, пульмонологи, диетологи и группа разработчиков педиатрии, возглавляемая службой детской хирургии. Пациенты, посещаемые в клинике LIFE. Дети варьируются от младенцев до подростков с CDH и другими врожденными дефектами.
Предвидение и лечение проблем со здоровьем, связанных с CDH и другими врожденными дефектами, является основным направлением работы клиники LIFE. Контролируя или предотвращая эти проблемы, наши пациенты могут жить более комфортно, оставаться здоровыми и наслаждаться лучшим качеством жизни. Мы считаем, что сведение к минимуму хронических заболеваний и связанных с ними нарушений помогает нашим пациентам LIFE максимизировать свои возможности.
Запись на прием в клинику LIFE
Для получения дополнительной информации о нашей клинике посетите Клинику UCSF LIFE.Чтобы узнать, имеет ли ваш ребенок право на лечение в клинике UCSF LIFE, позвоните по телефону 415-476-2538
.Текущее исследование CDH
смотреть видео
Центр лечения плода UCSF находится в авангарде исследований по лечению плода с момента его основания. Первая в мире открытая хирургия плода была проведена в UCSF более 3 десятилетий назад, и мы продолжаем посвящать себя исследованиям и инновациям.
- Влияние окклюзии трахеи на рост и развитие легких плода
- Техника временной окклюзии трахеи
- Разработка моделей мелких животных
- Влияние окклюзии трахеи на выработку сурфактанта
- Оптимальные сроки и продолжительность окклюзии трахеи
- Прогностические показатели CDH плода: соотношение головки легкого (LHR)
- Влияние пренатальной окклюзии трахеи на рост легких a и дифференциация на модели врожденной диафрагмальной грыжи у крыс — Исследование, анализирующее использование хирургии плода при использовании окклюзии трахеи при лечении CDH
Группы поддержки и другие ресурсы
- Херувимы — Ассоциация CDH по исследованию, защите и поддержке.Информация, форумы, блоги участников и многое другое.
- Дыхание надежды — борется с раком легких путем финансирования инновационных исследований и повышения осведомленности посредством обучения и поддержки пациентов.
- March of Dimes — Исследователи, волонтеры, педагоги, аутрич-работники и правозащитники работают вместе, чтобы дать всем младенцам шанс на борьбу
- «Исследование врожденных дефектов у детей» — служба родительской сети, объединяющая семьи, у которых есть дети с такими же врожденными дефектами.
