ГЛИЦИСЕД инструкция по применению, цена в аптеках Украины, аналоги, состав, показания | GLICISED таблетки компании «Киевмедпрепарат»
глицин — заменимая аминокислота (естественный метаболит), является нейромедиатором тормозного типа действия и регулятором метаболических процессов в ЦНС, уменьшает психоэмоциональное напряжение, повышает умственную работоспособность, оказывает нейропротекторное, антистрессовое, седативное действие, улучшает метаболические процессы в тканях мозга, нормализует сон, снижает токсическое действие алкоголя. Не вызывает привыкания.
Легко проникает в большинство биологических жидкостей и тканей организма, в том числе в головной мозг. Быстро расщепляется в печени глициноксидазой до воды и углекислого газа. Накопления глицина в тканях не происходит.
функциональные и органические заболевания нервной системы (неврозы, неврозоподобные состояния, вегетососудистая дистония, последствия нейроинфекции, черепно-мозговой травмы, перинатальные и другие формы энцефалопатии, в том числе алкогольного генеза), сопровождающиеся повышенной возбудимостью, эмоциональной нестабильностью, снижением умственной работоспособности, нарушением сна.
Ишемический инсульт и нарушения мозгового кровообращения.
В качестве вспомогательного средства при лечении алкоголизма.
лекарственное средство Глицисед применяют в таблетках или в форме порошка после измельчения таблетки трансбукально (путем размещения за щекой или в ротовой полости) или сублингвально (под язык). Таблетку держат во рту до полного растворения.
Детям в возрасте старше 3 лет, подросткам, взрослым при снижении умственной работоспособности Глицисед назначают по 1 таблетке (100 мг) 2–3 раза в сутки в течение 14–30 дней.
Максимальная суточная доза — 300 мг.
Детям в возрасте старше 3 лет и взрослым с повышенной возбудимостью, эмоциональной лабильностью назначают по 1 таблетке 2–3 раза в сутки, курс лечения — 7–14 дней. При необходимости курс терапии повторяют.
При нарушениях сна назначают по 50–100 мг за 20 мин до сна или непосредственно перед сном.
При ишемическом мозговом инсульте и нарушениях мозгового кровообращения назначают 1 г препарата ретробукально или сублингвально (при необходимости таблетку растереть) в течение первых 3–6 ч после развития инсульта, далее — в течение 1–5 дней по 1 г/сут, затем в течение 6–30 сут — по 1–2 таблетки 3 раза в сутки.
При лечении алкоголизма назначают как вспомогательное средство по 1 таблетке 2–3 раза в сутки в течение 14–30 дней. При необходимости курс лечения повторяют 4–6 раз в год.
индивидуальная непереносимость препарата и повышенная чувствительность к отдельным его компонентам; артериальная гипотензия. Детский возраст до 3 лет.
обычно препарат хорошо переносится. При индивидуальной повышенной чувствительности возможно развитие аллергических реакций, а также сыпи, зуда, крапивницы, ринита, першения в горле, конъюнктивита, слабости.
Со стороны ЖКТ возможно развитие диспептических явлений, в том числе боль в эпигастрии, тошнота.
Со стороны нервной системы отмечали единичные случаи снижения концентрации внимания, головной боли, напряженности, раздражительности.
у пациентов, склонных к артериальной гипотензии, необходимо контролировать уровень АД и в случае необходимости проводить коррекцию дозы препарата — Глицисед назначают в низких дозах и при условии регулярного контроля АД. При снижении АД ниже обычного уровня прием лекарственного средства прекращают.
При снижении АД ниже обычного уровня прием лекарственного средства прекращают.
Применение в период беременности и кормления грудью. Влияние Глициседа на организм в период беременности или кормления грудью детально не исследовали, поэтому применение препарата не рекомендуется.
Дети. Препарат применяют у детей в возрасте старше 3 лет.
Способность влиять на скорость реакции при управлении транспортными средствами или работе с другими механизмами. Необходимо соблюдать осторожность при управлении транспортными средствами или работе с другими механизмами, а также занятии потенциально опасными видами деятельности.
Глицисед снижает токсичность противосудорожных, антипсихотических лекарственных средств, антидепрессантов. При сочетании со снотворными, транквилизаторами и антипсихотическими препаратами усиливается эффект торможения ЦНС.
о клинических проявлениях передозировки сведений нет.
в оригинальной упаковке при температуре не выше 25 °С.
Дата добавления: 02.04.2021 г.
Параоксифенилглицин — Вики
| Параоксифенилглицин | |
|---|---|
| Систематическое наименование | N-(4-гидроксифенил)-аминоуксусная кислота |
| Традиционные названия | n-оксифениламиноуксусная кислота, n-оксифенилглицин параоксифенилглицин, глицин-фото |
| Хим. формула | C8H9NO3 |
| Рац. формула | С6H4(OH)(NH-CH2COOH) |
| Состояние | твёрдое |
| Молярная масса | 167,16 г/моль |
| Температура | |
| • плавления | 245-247 °C |
| • разложения | 248 °C |
Рег. номер CAS номер CAS | 122-87-2 |
| PubChem | 67149 |
| Рег. номер EINECS | 204-580-8 |
| SMILES | |
| InChI | |
| ChEBI | 55443 |
| ChemSpider | 60494 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Параоксифенилглицин (n-оксифенилглицин, N-(4-гидроксифенил)-глицин, n-оксифениламиноуксусная кислота) — органическое соединение, производное 4-аминофенола в котором один из атомов водорода в аминогруппе замещён на радикал гликолевой кислоты. Имеет химическую формулу С6H4(OH)(NH-CH2COOH). Применяется как проявляющее вещество в фотографии.
Торговые названия: глицин-фото, амфолит, кодурол, мазанол[1].
История
Синтезирован и предложен в качестве фотографического проявляющего вещества в 1891 году немецким химиком А. Богишем, работавшем на фабрике Гауффа. В том же году им также был получен и запатентован в этих же целях метол[2][3].
Богишем, работавшем на фабрике Гауффа. В том же году им также был получен и запатентован в этих же целях метол[2][3].
Промышленное производство глицина «фото» в СССР было начато в 1960 году и практически прекращено в 1990-е годы[источник не указан 728 дней].
Свойства
При комнатной температуре мелкие белые (бесцветные) кристаллы в форме тонких пластинок, напоминающих слюду. При нагревании разлагается. Трудно растворим в воде и спирте, легко растворим в растворах сульфита, в щелочах и кислотах
Процесс хорошего растворения в щелочах обусловлен образованием щелочной соли 4-оксифениламиноуксусной кислоты[5].
4-Оксифенилглицин относится к фотографическим проявляющим веществам, в составе проявителей показывает хотя и медленное, но сильное проявление, очень стоек к воздушному окислению и почти не образует вуали и пятен. По чувствительности к бромидам составы с ним примерно аналогичны гидрохиноновым проявителям[5][3].
Может использоваться в фотографических составах как единственное проявляющее вещество, давая при этом изображение тёплой тональности на некоторых видах фотографических бумаг. Однако обычно применяется в смеси с другими проявляющими веществами. Например, для получения эффективных медленноработающих мелкозернистых проявителей его смешивают с 1,4-фенилендиамином[3].
Являясь восстановителем, в открытой посуде медленно окисляется кислородом воздуха, поэтому рекомендуется хранить вещество в стеклянной посуде с притёртой пробкой. С целью замедлить разложение при доступе воздуха, глицин-фото стабилизируют дисульфитом натрия (пиросульфит, метабисульфит). Такая добавка использовалась при фасовке в полиэтиленовые пакетики для розничной продажи.
Характерная реакция: в щелочной среде при добавлении раствора азотнокислого молибдена даёт синее окрашивание[6].
Производные
Если заместитель в аминогруппе 4-оксифенилглицина замещается фенильной группой, то проявляющая способность соединения исчезает, однако при наличии амино- и гидроксогрупп в этой входящей фенильной группе, проявляющая способность восстанавливается и такие производные могут даже превзойти исходный 4-оксифенилглицин по активности. Например, к очень активным проявляющим веществам относятся 4-дигидроксидифениламин и 4-аминогидроксидифениламин
Например, к очень активным проявляющим веществам относятся 4-дигидроксидифениламин и 4-аминогидроксидифениламин
Заменой карбоксильной группы на сульфогруппу было синтезировано производное проявляющее вещество с химической формулой OH-C6H4-NH-CH2-SO3H, получившее название «эврикин» (англ. Eurikine). Оно использовалось в виде натриевой соли, что давало лучшую растворимость, чем у 4-оксифенилглицина[5].
Еще одним производным, решающим ту же проблему плохой растворимости стал запатентованный в 1913 году в Германии 4-оксифенилметилглицин. Это соединение имело лучшую растворимость, чем 4-оксифенилглицин и позволяло получать сильные концентраты проявителей, выглядевшие как прозрачные растворы. Это проявляющее вещество также работает быстрее глицина-фото, но медленнее чем метол. Влияние температуры на него оказалось примерно таким же, как и на глицин-фото, но бромиды, накапливающиеся в растворе оказывают значительно меньший эффект, что также является плюсом. 4-Оксифенилметилглицин синтезируется способом, аналогичным 4-оксифенилглицину, реакцией монохлоруксусной кислоты, но не с 4-аминофенолом, а с метолом[7][8].
4-Оксифенилметилглицин синтезируется способом, аналогичным 4-оксифенилглицину, реакцией монохлоруксусной кислоты, но не с 4-аминофенолом, а с метолом[7][8].
4-Оксифенилметилглицин
Получение
Параоксифенилглицин получают из монохлоруксусной кислоты и 4-аминофенола[4].
Нормативный документ, использовавшийся в СССР при производстве глицина-фото: ТУ 6-17-1019-78[9].
Применение
Основное применение — в фотографии в качестве проявляющего вещества. Проявители на основе глицина дают мало вуали, мелкое «аккуратное» зерно и используются для медленного проявления.[1] Проявляющие свойства глицина сильно зависят от температуры и pH. Чтобы ускорить процесс проявки, в глициновые проявители добавляют щёлочь и повышают температуру раствора.
Проявленное изображение имеет нейтрально-серый тон, хорошую проработку в деталях, глубокие тени имеют насыщенный чёрный («бархатный») цвет.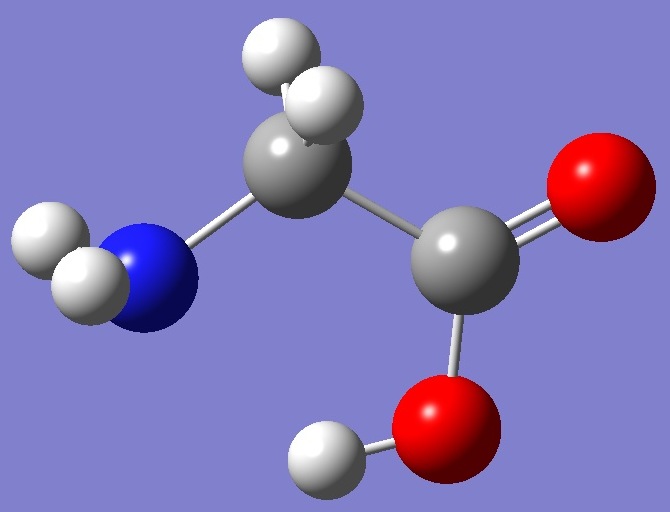
Готовый проявитель хорошо сохраняется.
Глициновые проявители очень чувствительны к следам тиосульфата натрия (снижает проявляющую способность).
Также применялся при окрашивании газетной бумаги в желтые и оранжевые оттенки[10].
Примечания
- ↑ 1 2 Химия для фотографа — Глицин, параоксифенилглицин, амфолит
- ↑ Современный метол (элон) имеет другое химическое строение, чем упоминаемый здесь ранний метол (метол Гауффа), применявшийся примерно до Первой мировой войны. Современный метол предложен братьями Люмьер и А. Сейвитцем вместе с другими производными 4-аминофенола.
- ↑ 1 2 3 Haist, 1979, с. 179.
- ↑ 1 2 Глицин — статья из Большой советской энциклопедии (3-е издание)
- ↑ 1 2 3 4 5 Glafkides, 1958, с.
 123.
123. - ↑ Нитрата молибдена не существует, а описываемый факт копируется источниками из старой литературы начала XX века. При растворении молибдена в азотной кислоте образуется молибденовая кислота, которая может реагировать с различными восстановителями с образованием молибденовых синей, что не является характерной реакцией на 4-оксифенилглицин.
- ↑ Вентцель, 1930, с. 257—258.
- ↑ Anilin-Fabrication.
- ↑ Надпись на фабричной упаковке Глицин-фото пр-ва Шосткинского завода химреактивов
- ↑ Технический словарь. Т. II.
Литература
- Артоболевский И. И. Политехнический словарь. — М.: Советская энциклопедия, 1977. — 608 с.
- Вентцель Ф. Фото-химическая промышленность. Производство и переработка фото-химических препаратов. — Л.: Научное химико-техническое издательство НТУ ВСНХ СССР, 1930.
- Шрайнер Р., Фьюсон Р. Систематический качественный анализ органических соединений = The Systematic Identification of Organic Compounds.
 A Laboratory Manual. Ralph L. Shriner Professor of Organic Chemistry The State University of Iowa, Reynold C. Fuson Professor of Organic Chemistry The University of Illinois. Third Edition. 1948. New York / Перевод с английского М. Е. Манденова. Под редакцией М. С. Рождественского и Г. И. Чернова. — М.: Издательство иностранной литературы, 1950. — 374 с. Архивная копия от 6 марта 2016 на Wayback Machine
A Laboratory Manual. Ralph L. Shriner Professor of Organic Chemistry The State University of Iowa, Reynold C. Fuson Professor of Organic Chemistry The University of Illinois. Third Edition. 1948. New York / Перевод с английского М. Е. Манденова. Под редакцией М. С. Рождественского и Г. И. Чернова. — М.: Издательство иностранной литературы, 1950. — 374 с. Архивная копия от 6 марта 2016 на Wayback Machine - Яштолд-Говорко В. А. Фотосъемка и обработка. Съемка, формулы, термины, рецепты, химикаты. — Издание второе, стереотипное. — М.: Искусство, 1965. — С. 404. — 444 с. — (илл.).
- Glafkides P. Photographic chemistry (англ.). — London: Fountain Press, 1958. — Vol. 1.
- Haist G. M. Modern Photographic Processing (англ.). — New York, Chichester, Brisbane, Toronto: John Whiley and sons, 1979. — Vol. 1. — (Photographic science and technology and graphic arts). — ISBN 0-471-02228-4.
Ссылки
Врачи выложили в сеть список препаратов, которые ничего не лечат
1. АРБИДОЛ
АРБИДОЛ
Действующее вещество: умифеновир.
Другие наименования: «Арпетолид», «Арпефлю», «ОРВИтол НП», «Арпетол», «Иммустат».
Советское изобретение 1974 года, не признанное Всемирной организацией здравоохранения. Клинические испытания препарата при заболеваниях человека проводились только в СНГ и Китае.
Это якобы противовирусный препарат с иммуномодулирующим эффектом для лечения множества самых различных заболеваний, включая грипп, однако его эффективность до сих пор не доказана.
2. ЭССЕНЦИАЛЕ
Действующее вещество: полиенилфосфатидилхолин.
Другие наименования: «Эссенциале форте», «Эссенциале Н», «Эссенциале форте Н».
Этот популярный препарат для защиты печени, как и все прочие так называемые«гепатопротекторы», никак не защищает печень. Научные исследования не обнаружили положительного эффекта при приёме «Эссенциале», зато обнаружили кое-что другое: при острых и хронических вирусных гепатитах он может способствовать усилению застоя жёлчи и активности воспаления.
По сути, это пищевая добавка.
3. ПРОБИОТИКИ
Действующее вещество: живые микроорганизмы.
Популярные препараты: «Хилак форте», «Ацилакт», «Бифилиз», «Лактобактерин», «Бифиформ», «Споробактерин», «Энтерол».
Мало того, что эффективность пробиотиков не доказана; судя по всему, большинство микроорганизмов, содержащихся в этих препаратах, ещё и не являются живыми. Дело в том, что процесс пакетирования уничтожает 99% всех потенциально полезных бактерий и спор. С тем же успехом можно выпить стакан кефира. В Европе и США пробиотики не назначают.
4. МЕЗИМ ФОРТЕ
Действующее вещество: панкреатин.
Другие наименования: «Биофесталь», «Нормоэнзим», «Фестал», «Энзистал», «Биозим», «Вестал», «Гастенорм», «Креон», «Микразим», «Панзим», «Панзинорм», «Панкреазим», «Панцитрат», «Пензитал», «Уни-Фестал», «Энзибене», «Эрмиталь».
По данным исследований, панкреатин может быть эффективен разве что при несварении желудка. Диабет, панкреатит, грыжа и настоящие расстройства пищеварительного тракта он не лечит.
5. КОРВАЛОЛ
Действующее вещество: фенобарбитал.
Другие наименования: «Валокордин», «Валосердин».
Фенобарбитал является опасным барбитуратом с ярко выраженным наркотическим действием.
При регулярном употреблении в больших дозах вызывает серьёзные неврологические и когнитивные нарушения (расстройства кратковременной памяти, нарушения речи, шаткость походки), подавляет сексуальную функцию, из-за чего он и запрещён к ввозу в США, ОАЭ и многие страны Европы.
6. ПИРАЦЕТАМ
Другие наименования: «Луцетам», «Мемотропил», «Ноотропил», «Пиратропил», «Церебрил».
Как и все прочие ноотропные препараты, известен в основном в СНГ. Эффективность пирацетама не доказана, зато есть данные о нежелательных побочных эффектах. В большинстве развитых стран не зарегистрирован.
7. ЦИННАРИЗИН
Действующее вещество: дифенилпиперазин.
Другие наименования: «Стугезин», «Стугерон», «Стунарон».
Циннаризин в настоящее время производится в основном в Бангладеш, тогда как на Западе его запретили к использованию ещё 30 лет тому назад. Почему? Список побочных эффектов занял бы слишком много места, поэтому упомянем лишь, что употребление циннаризина может привести к острой форме паркинсонизма.
Почему? Список побочных эффектов занял бы слишком много места, поэтому упомянем лишь, что употребление циннаризина может привести к острой форме паркинсонизма.
8. ВАЛИДОЛ
Действующее вещество: ментиловый эфир изовалериановой кислоты.
Другие наименования: «Валофин», «Ментовал».
Устаревший препарат с недоказанной эффективностью. Ни в коем случае не полагайтесь на него при проблемах с сердцем! Он ничего не даёт, а при инфаркте каждая минута на счету!
9. НОВО-ПАССИТ
Действующее вещество: гайфенезин.
Этот якобы антиксиолитический препарат содержит множество разных травяных экстрактов, но его единственное действующее вещество является отхаркивающим средством.
Оно часто входит в состав препаратов от кашля, но никак не может оказывать успокоительного эффекта, приписываемого «Ново-пасситу».
10. ГЕДЕЛИКС
Другие наименования: «Гедерин», «Гелисал», «Проспан».
Национальный институт здравоохранения США провёл масштабное исследование и пришёл к следующему выводу: несмотря на популярность, экстракт листьев плюща неэффективен в лечении кашля.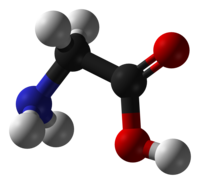 Выпейте чаю с лимоном, что ли.
Выпейте чаю с лимоном, что ли.
11. ГЛИЦИН
Глицин — это вообще не лекарство, а простейшая аминокислота. По сути, это очередная биоактивная добавка, не приносящая организму ни вреда, ни пользы. Клиническая эффективность глицина не то что не доказана, но даже и не исследована.
12. СИНУПРЕТ
Действующее вещество: экстракт лекарственных растений.
Другие наименования: «Тонзипрет», «Бронхипрет».
Популярный в Германии фитопрепарат, эффективность которого подтверждается лишь исследованиями, проведёнными компанией-производителем. Вы можете приготовить его дома, заварив корень горечавки, цветки первоцвета, щавель, цветки бузины и вербену. Видите, какая экономия!
13. ТРОКСЕВАЗИН
Действующее вещество: флавоноид рутина.
Другие наименования: «Троксерутин».
Эффективность подтверждена только двумя российскими исследованиями, которые жёстко критиковались западными учёными. По мнению последних, «Троксевазин» оказывает лишь едва заметное действие на организм.
14. ЛЮБАЯ ГОМЕОПАТИЯ
Действующее вещество: отсутствует.
Популярные препараты: «Анаферон», «Антигриппин», «Афлубин», «Вибуркол», «Галстена», «Гингко Билоба», «Мемория», «Окулохеель», «Палладиум», «Пумпан», «Ременс», «Ренитал», «Сальвия», «Тонзипрет», «Траумель», «Успокой», «Энгистол»… тысячи их!
Перечисляя псевдолекарственные препараты было бы нечестно не упомянуть о гомеопатических средствах.
Пожалуйста, запомните раз и навсегда: гомеопатические средства в принципе НЕ СОДЕРЖАТ никаких действующих веществ. Они не оказывают ни малейшего влияния ни на организм человека, ни на бактерии, вирусы и болезни, которые призваны лечить.
Эффективность гомеопатии не отличается от эффективности плацебо, чем она и является.
вики | этимология, перевод, ассоциации
Предполагаем, что ~ 50000 лет назад у людей уже был протоязык с короткими словами:ку/ко —
кто(кум, компьютер, коммуна, комар),
м —
может(компакт=ко[кто]+м[может]+пакт[упаковать], команда, комфорт),
ант —
там/вон(константа=ко[кто]+н/м[может]+ст[оставаться]+ант[там]+а, анти=ант[туда]+иа[иди], коммерсант = ко[кто]+м[может]+мерс[обмениваться]+ант[там]),
ст —
остановиться(стоп, статика, стоянка),
тр/тер —
через(терапия, матерь, паттерн),
ма —
рука/руки(мама=ма[рука]+ма[рука], матерь=ма[рука]+тер[через], материал=ма[рука]+тер[через]+ия[идёт]+ал/уль[всегда], матёрый, мах),
па/фа —
еда(папа, падаль, пост, палео),
уль —
всегда/все/всё(циркуль = цирк[круг]+уль[всегда], ультиматум, ультра, улица=уль[все]+лица[лица], улика=уль[всё]+ия[ведёт]+к(а)[к кому-то], улей=уль[всё]+лей[лей], сосулька=с+ось[со стержня]+уль[всё время]+к[капает]),
ар —
оружие(армия, норма, оружие, комар)
иа/ия —
идти(Россия, терапия),
про —
за/впереди(провокатор, проформа, прокурор)
be/бы —
быть(bio=be[быть]+ia[двигаться], быль)
ав/ay —
птица(авиа = ав[птица]+ия(а)[идёт],авария = ав[птица]+ар[оружие]+ия(а)[идёт] (то есть сбивание птицы оружием))
и т. д.
д.Современные слова включают в себя эти слова-протоосновы. Нужно научиться видеть эти слова-протоосновы внутри современных слов, чтобы получить новое понимание, построить новые ассоциации и облегчить запоминание иностранных слов.
We assume that ~ 50000 years ago humans had a proto-language. The words of the proto-language were short: st — to stop, tr / ter — through, ia — to go, ma — hand / hands, fa/pa — food, etc. Many modern words are composed of these proto-words.
АКВИОН
• 13 витаминов + 9 минералов.
• При повышенных физических, умственных и эмоциональных нагрузках.
• Для нормализации сна и настроения.
• Без консервантов, искусственных красителей, ароматизаторов.
Форма выпуска: 30 жевательных таблеток массой 0,9 г.
- Рекомендации по применению: Детям от 7 до 14 лет по 1 таблетке 1 раз в день во время еды.
 Таблетки следует разжевать.
Таблетки следует разжевать.
- Активные компоненты в 1 таблетке:
- Витамины
- Витамин D3 – 5 мкг (50 %)
- Витамин Е (ТЭ) – 2,35 мг (20–24 %)*
- Витамин С – 25 мг (36–42 %)*
- Витамин В1 – 0,44 мг (34–40 %)*
- Витамин В2 – 0,45 мг (30–38 %)*
- Витамин В3 – 5 мг (28–33 %)*
- Витамин В5 – 1,2 мг (34–40 %)*
- Витамин В6 – 0,6 мг (35–40 %)*
- Витамин В9 – 80 мкг (20–40 %)*
- Витамин В12 – 0,6 мкг (20–30 %)*
- Витамин К1 – 15 мкг (19–25 %)*
- Биотин – 12,5 мкг (50–63 %)*
- Бета-каротин – 1,5 мг (30 %)
- Микро- и макроэлементы
- Хром – 5 мкг (20–33 %)*
- Селен – 12,5 мкг (31–42 %)
- Медь – 0,3 мг (38–43 %)*
- Йод – 50 мкг (33–42 %)*
- Железо – 6 мг (40–50 %)
- Цинк – 3 мг (25–30 %)
- Кальций – 90 мг (8 %)
- Магний – 22,5 мг (8–9 %)*
- Другие вещества
- Глицин – 100 мг (3 %)
- __________________
- *В зависимости от возраста и пола ребенка.

СГР № RU.77.99.11.003.R.000006.01.20 от 09.01.2020 г.
* НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ.
Миотонический синдром — лечение, симптомы, причины, диагностика
Миотония это не заболевание, а симптом группы мышечных нарушений, для которых характерно нарушение способности мышцы к релаксации после сокращения. У большинства людей миотоническая атака имеет временный характер и проявляется выраженной скованностью, которая возникает после выполнения определенного вида движений. Невозможность сжатых мышц расслабиться и трудности при вставании из сидячего положения являются наиболее частыми проявлениями миотонической атаки.
Длительность миотонической атаки может быть продолжительностью от секунд до минут и по интенсивности колебаться от небольшого дискомфорта до выраженного нарушения двигательных возможностей. Как правило, миотоническая атака возникает после интенсивной физической нагрузки или после длительного периода отдыха, но иногда возникает как реакция на низкие температуры или даже резкий звук.
Как правило, миотоническая атака возникает после интенсивной физической нагрузки или после длительного периода отдыха, но иногда возникает как реакция на низкие температуры или даже резкий звук.
При миотонии идет вовлечение только скелетной мускулатуры, выполняющей произвольные движения. Таким образом, миотоническая атака может возникнуть только при выполнении осознанных движений, но не поражает мышцу сердца или мышечные структуры пищеварительного тракта. В зависимости от типа и серьезности миотония может возникнуть в ногах, лице, руках, в плечах, стопе, в мышцах век глаз и даже способности говорить четко.
Как правило, миотонические синдромы являются генетически детерминированными и могут быть у любого человека. Миотонические нарушения могут быть как у женщин, так и мужчин и в любом возрасте могут быть симптомы миотонических атак. В зависимости от выраженности миотонических симптомов первые признаки этих нарушений могут появиться в подростковом возрасте или у взрослых. Наследование миотонических синдромов происходит двумя путями аутосомально-доминантным генетическим паттерном или аутосомально-рецессивным генетическим паттерном.
Наследование миотонических синдромов происходит двумя путями аутосомально-доминантным генетическим паттерном или аутосомально-рецессивным генетическим паттерном.
Аутосомально доминантное наследование
Нарушения, связанные с аутосомально-доминантным наследованием обычно проявляется в каждом поколении без исключений. Аутосомальный означает то, что генетическая ошибка может располагаться на любой хромосоме, в каждой клетке организма, за исключением половых хромосом. Доминантный означает, что достаточно одного родителя носителя дефектного гена для передачи заболевания по наследству. И так как нарушения могут передаваться любым родителем, то любой ребенок от родителя с генетическим дефектом имеет 50% шанс наследовать это нарушение. Выраженность нарушения и возраст дебюта могут варьировать в зависимости от конкретного индивидуума.
Аутосомально-рецессивное наследование
При аутосомально-рецессивном наследовании заболевание появляется в одном поколении и обычно без наличия семейного анамнеза этого состояния. Оба родителя могут быть носителями этого гена. Носитель дефектного гена может не отмечать какой-либо симптоматики. Рецессивность означает то, что для проявления этого гена и заболевания необходимо, чтобы у обоих родителей был дефектный ген. Дети обоего пола могут наследовать дефектный ген по этому типу наследования. При каждой беременности у 25 % детей есть вероятность наследования дефектного гена от обоих родителей. Если ребенок наследует дефектный ген от одного родителя, то он будет носителем дефектного гена, но, скорее всего, проявляться это симптомами не будет. В 50% случаев ребенок будет носителем гена. В то же время вероятность того, что ребенок не наследует дефектный ген и не будет носителем и не будет иметь клиническую манифестацию, составляет 25%.
Оба родителя могут быть носителями этого гена. Носитель дефектного гена может не отмечать какой-либо симптоматики. Рецессивность означает то, что для проявления этого гена и заболевания необходимо, чтобы у обоих родителей был дефектный ген. Дети обоего пола могут наследовать дефектный ген по этому типу наследования. При каждой беременности у 25 % детей есть вероятность наследования дефектного гена от обоих родителей. Если ребенок наследует дефектный ген от одного родителя, то он будет носителем дефектного гена, но, скорее всего, проявляться это симптомами не будет. В 50% случаев ребенок будет носителем гена. В то же время вероятность того, что ребенок не наследует дефектный ген и не будет носителем и не будет иметь клиническую манифестацию, составляет 25%.
Виды миотоний
Миотония конгенита
Миотония конгенита наиболее часто встречающаяся непрогрессирующая форма миотонического синдрома и вызвана мутацией гена, отвечающего за натриевые ионные каналы мышц.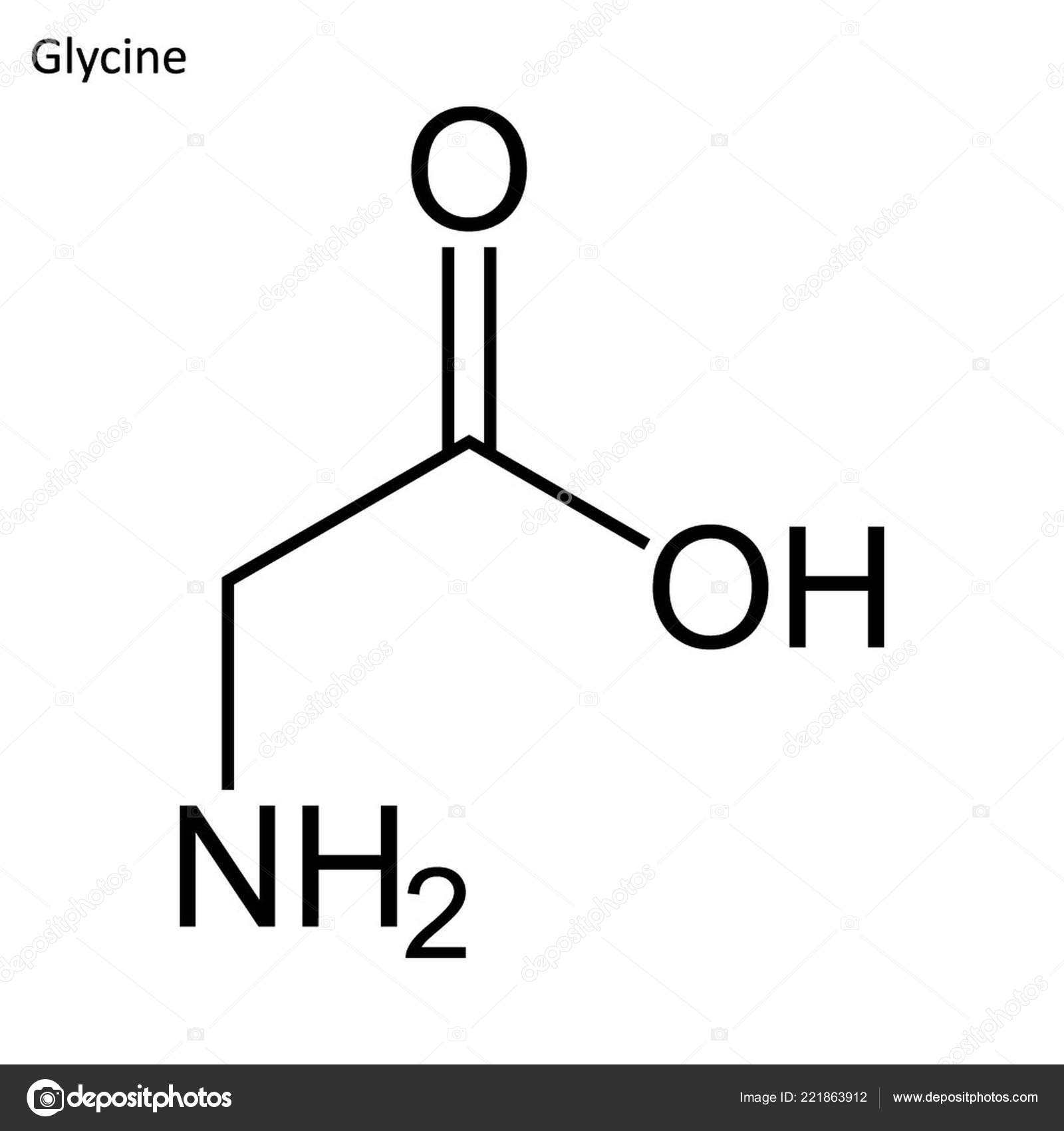 Эта форма миотонии не оказывает влияние на продолжительность жизни и имеет незначительное влияние на структуру тела или рост опорно-двигательного аппарата. Существует две формы миотонии конгенита в зависимости от типа наследования.
Эта форма миотонии не оказывает влияние на продолжительность жизни и имеет незначительное влияние на структуру тела или рост опорно-двигательного аппарата. Существует две формы миотонии конгенита в зависимости от типа наследования.
Частой и довольно тяжелым типом миотонии конгенита является генерализованная миотония Бейкера, и наследование этого заболевания происходит по аутосомально-рецессивному типу. Дебют этой формы миотонии бывает в детстве или раннем подростковом возрасте, но иногда при тяжелом течение дебют может быть и в раннем детском возрасте. Симптоматика может нарастать прогрессивно, в течение нескольких лет после постановки диагноза или постепенно нарастать до достижения пациентом двадцатилетнего возраста.
Аутосомально — доминантная форма наследования называют болезнью Томсена. Заболевание названо в честь датского врача Асмуса Юлиуса Томсена у которого было это заболевание и который проследил наличие этого заболевания в своей семье. Симптомы миотонии Томсена, как правило, значительно мягче, чем при миотонии Бейкера и хотя дебют заболевания бывает раньше, и первые признаки становятся заметными в раннем детстве и иногда при рождении. В редких случаях симптомы могут быть незначительными, в течение многих лет после постановки диагноза.
В редких случаях симптомы могут быть незначительными, в течение многих лет после постановки диагноза.
Основным симптомом обеих заболеваний является генерализованная миотония, вызванная произвольными движениями. Как правило, такая симптоматика провоцируется значительной физической нагрузкой или наоборот длительным периодом отдыха и мышечной релаксации. Миотония более выражена в ногах, что вызывает затруднения при ходьбе и иногда даже падения. Также миотонией бывают охвачены мышцы плечевого пояса и головы, что может вызвать затруднения при хватании предметов, жевании или мигании. В редких случаях при миотонии Бейкера может быть обездвиживающая слабость, появляющаяся после миотонической атаки.
После миотонической атаки при обоих типах миотонии снять скованность можно с помощью повторных движений в скованных мышцах. Как правило, скованность увеличивается после нескольких первых сокращений заинтересованных мышц, а затем после пяти сокращений миотоническая скованность исчезает, что позволяет восстановить нормальную работу мышц на определенный промежуток времени. Это эффект называется эффектом разминки (разогрева) и позволяет людям с миотонией заниматься тяжелыми физическими нагрузками и силовыми видами спорта.
Это эффект называется эффектом разминки (разогрева) и позволяет людям с миотонией заниматься тяжелыми физическими нагрузками и силовыми видами спорта.
И хотя миотония конгенита не оказывает значительного влияния формирование опорно-двигательного аппарата, в то же время миотония влияет на размер определенных мышц. Обе миотонии Бейкера и Томсена могут вызывать необычное увеличение размеров скелетных мышц, особенно в области ног ягодиц, но также и в области рук плеч и мышц спины. Такое увеличение может считаться мышечной гипертрофией и иногда такие пациенты выглядят как настоящие атлеты. При миотонии Бейкера гипертрофия мышц более выражена, чем при миотонии Томсена.
Парамиотония конгенита
Эта миотония является редкой патологией, связанной нарушением натриевых каналов и передающаяся по аутосомно-доминантному типу. Этот тип миотонии не сокращает продолжительность жизни, и интенсивность миотонии сохраняется стабильной в течение жизни. Дебют заболевания возникает в период между рождением и ранним детским возрастом. Характерным симптомом парамиотонии конгенита является генерализованная миотоническая скованность, которая в большей степени поражает руки и лицо, а также области шеи и руки. Так же, как и при других непрогрессирующих миотониях, парамиотония конгенита провоцируется интенсивными произвольными нагрузками, а в некоторых случаях провоцируются низкой температурой. Во многих случаях, миотонические атаки индуцированные холодом и связанную с ними мышечную скованность можно снять теплом.
Характерным симптомом парамиотонии конгенита является генерализованная миотоническая скованность, которая в большей степени поражает руки и лицо, а также области шеи и руки. Так же, как и при других непрогрессирующих миотониях, парамиотония конгенита провоцируется интенсивными произвольными нагрузками, а в некоторых случаях провоцируются низкой температурой. Во многих случаях, миотонические атаки индуцированные холодом и связанную с ними мышечную скованность можно снять теплом.
Атаки миотонической скованности часто сопровождаются обездвиживающей слабостью в заинтересованных зонах. Слабость может быть более длительной, чем эпизод миотонической скованности, ослабляя мышцы на период от нескольких минут до нескольких часов. Но слабость не характерна для парамиотонии конгенита. Кроме того, в отличие от других непрогрессирующих форм миотонии, для парамиотонии не характерно наличие эффекта разминки, при котором происходит снижение скованности после нескольких сокращений мышц. Наоборот, миотоническая скованность обычно увеличивается после продолжающейся активности мышц, что еще больше снижает двигательную активность. Этот феномен обычно называют парадоксальной миотонией.
Этот феномен обычно называют парадоксальной миотонией.
Синдром Шварц Джемпела
Синдром Шварц — Джемпела является наиболее тяжелой формой непрогрессирующей миотонии. Это очень редкий тип миотонии передается по аутосомально-рецессивному типу. Дебют заболевания возникает или сразу после рождения или через небольшое время после рождения. Характер и интенсивность симптоматики могут иметь индивидуальные особенности. Одним из главных симптомов является миотоническая скованность, наиболее выраженная в лице и бедрах. При этой миотонии имеется тенденция к падениям нарушениям речи и лицевым изменениям. Как и при миотонии конгенита дополнительные сокращения мышц вызывают эффект разминки и снижают скованность. Но эффект разминки имеет незначительную степень, а некоторых случаях отсутствует. Для синдрома Шварца-Джемпела характерны различные скелетные деформации. Эти деформации к проблема роста организма и, как правило, это проявляется уменьшением роста, а также аномалиям лица, что придает лицу маскообразную форму.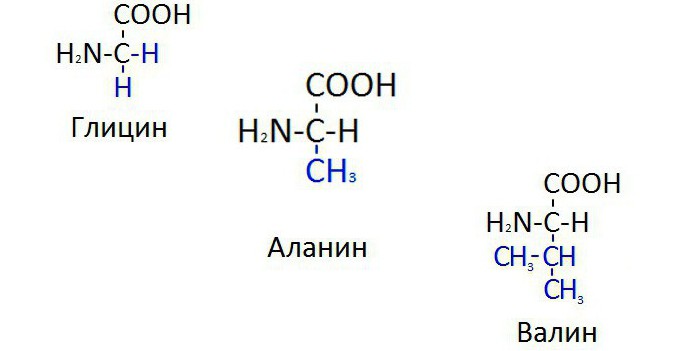 Другие симптомы включают гипертрофированные бедра, атрофированные плечевой пояс и длительные мышечные подергивания, а иногда и нарушения интеллектуальной сферы.
Другие симптомы включают гипертрофированные бедра, атрофированные плечевой пояс и длительные мышечные подергивания, а иногда и нарушения интеллектуальной сферы.
Причина синдрома Шварца-Джемпела не известна. Не исключается, что этот вид миотонии является разновидностью мышечных нарушений, а также возможно иметь связь с нарушениями в нервной системе или является сочетанием нарушениям в мышцах и нервах.
Диагностика
Даже на основании физикального обследования врач может провести определенные диагностические тесты, такие как миотоническая реакция на нагрузку, воздействие холодом или другие стимуляции. Но очень важно диффенцировать эти миотонии с прогрессирующими заболеваниями, такими как миотонические дистрофии. И для дифференциального диагноза необходимы специальные методы исследования. Эти исследования включают проведение ЭМГ, который позволяет определить электрическую активность мышечных ткани; лабораторные исследования (анализы крови и анализ ДНК) биопсию мышц, которая бывает иногда необходима для окончательного диагноза мышечного заболевания.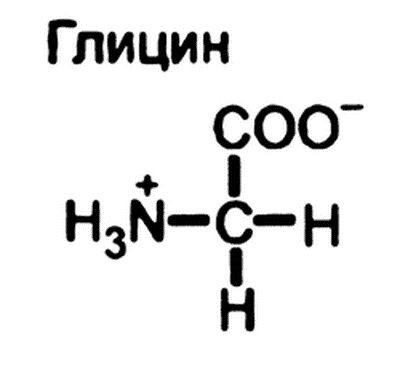
Лечение
В настоящее время не существует методов лечения, позволяющих избавиться полностью от какого либо миотонического синдрома. Лечение носит симптоматический характер. Если миотонические атаки становятся интенсивными, возникает необходимость применения медикаментов, позволяющих снизить симптоматику. Наиболее известным препаратом является мексилитен, а также такие препараты как гуанин, прокаинамид, тегретол, фенитоин. Но все эти препараты имеют массу побочных эффектов и поэтому их длительное употребление не желательно. Наиболее оптимально, когда пациент знает провоцирующие миотонические атаки факторы и старается по возможности избегать провоцирующих ситуаций, а после атак дает возможность мышцам восстановиться с помощью отдыха.
Школа биомедицинских наук вики
Из Вики Школы биомедицинских наук
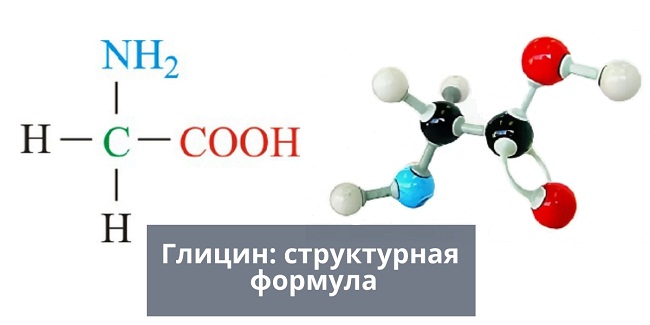
Глицин — одна из 20 аминокислот. Его трехбуквенный код — Gly, а его однобуквенный код — G. Это самая простая и мельчайшая аминокислота с атомом водорода в качестве боковой цепи — это означает, что глицин — единственная аминокислота, у которой нет хирального атома углерода [1] , поэтому он не образует стереоизомеров, поэтому не будет иметь L- или D-конфигураций.
Глицин действует вне клетки. Он играет жизненно важную роль в центральной нервной системе, так как действует как нейротрансмиттер в химических синапсах [2] .
Глицин имеет два атома водорода, прикрепленных к альфа-углероду, и находится в гибких участках белков из-за его короткой боковой цепи [3] [4] . Глицин слишком гибкий, он может исказить альфа-спираль [5] .
История и этимология
Глицин был открыт в 1820 году Анри Браконно, когда он гидролизовал желатин путем кипячения его с серной кислотой [6] .Первоначально он назвал его «сахар желатина» [7] , но студент Либиха показал, что он содержит азот, и Берцелиус переименовал его в «глицин» [8] . Название происходит от греческого слова γλυκύς «сладкий вкус» [9] (которое также связано с приставками глико- и глюко-, такими как гликопротеин и глюкоза). Другое раннее название глицина было «гликоколл» [10] [11] .
Список литературы
- ↑ Прив.-доз. Б. Кирсте. (23.01.1998).Глицин. Доступно: http://www.chemie.fu-berlin.de/chemistry/bio/aminoacid/glycin_en.html. Последний доступ 23.11.2010.
- ↑ Молекулярная биология клетки, 4-е издание, 2002 г., Брюс Альбертс, Александр Джонсон, Джулиан Льюис, Мартин Рафф, Кейт Робертс и Питер Уолтер. Стр.764
- ↑ http://www.acnp.org/g4/gn401000008/default.htm
- ↑ Берг, Дж. М., Тимочко, Дж. Л., и Страйер, Л. (2002). Биохимия (5-е изд.). Нью-Йорк: W.H. Freeman
- ↑ https://fold.it/portal/node/2000954
- ↑ Р.Х.А. Плиммер (1912) [1908]. R.H.A. Плиммер; F.G. Хопкинс, ред. Химический состав белков. Монографии по биохимии. Часть I. Анализ (2-е изд.).
- ↑ Маккензи, Колин (1822). Тысяча опытов в химии: с иллюстрациями природных явлений; и практические наблюдения за производственными и химическими процессами, которые в настоящее время проводятся для успешного выращивания полезных искусств. Сэр Р.
 Филлипс и компания.
Филлипс и компания. - ↑ Най, Мэри Джо (1999). Перед большой наукой: стремление к современной химии и физике, 1800-1940 гг.Издательство Гарвардского университета. ISBN 9780674063822.
- ↑ «глицин». Оксфордские словари. Проверено 6 декабря 2015.
- ↑ Идэ, Аарон Дж. (1970). Развитие современной химии. Курьерская корпорация. ISBN 9780486642352.
- ↑ https://fold.it/portal/node/2000954
Некетотическая гиперглицинемия: MedlinePlus Genetics
Некетотическая гиперглицинемия — это заболевание, характеризующееся аномально высокими уровнями молекулы, называемой глицином, в организме (гиперглицинемия).Избыток глицина накапливается в тканях и органах, особенно в головном мозге. У больных есть серьезные неврологические проблемы.
Некетотическая гиперглицинемия бывает двух форм: тяжелой и ослабленной. Обе формы обычно начинаются вскоре после рождения, хотя в некоторых случаях признаки и симптомы могут проявиться в первые несколько месяцев жизни. Только ослабленная форма начинается позже в младенчестве. Формы различаются серьезностью признаков и симптомов. Чаще встречается тяжелая некетотическая гиперглицинемия.Больные младенцы испытывают сильную сонливость (вялость), которая со временем ухудшается и может привести к коме. У них также может быть слабый мышечный тонус (гипотония) и опасные для жизни проблемы с дыханием в первые дни или недели жизни. У большинства детей, переживших эти ранние признаки и симптомы, развиваются трудности с кормлением, аномальная жесткость мышц (спастичность), глубокая умственная отсталость и приступы, которые трудно контролировать. Большинство пораженных детей не достигают нормальных этапов развития, таких как питье из бутылки, сидение или хватание предметов, и со временем они могут потерять приобретенные навыки.
Только ослабленная форма начинается позже в младенчестве. Формы различаются серьезностью признаков и симптомов. Чаще встречается тяжелая некетотическая гиперглицинемия.Больные младенцы испытывают сильную сонливость (вялость), которая со временем ухудшается и может привести к коме. У них также может быть слабый мышечный тонус (гипотония) и опасные для жизни проблемы с дыханием в первые дни или недели жизни. У большинства детей, переживших эти ранние признаки и симптомы, развиваются трудности с кормлением, аномальная жесткость мышц (спастичность), глубокая умственная отсталость и приступы, которые трудно контролировать. Большинство пораженных детей не достигают нормальных этапов развития, таких как питье из бутылки, сидение или хватание предметов, и со временем они могут потерять приобретенные навыки.
Признаки и симптомы ослабленной формы некетотической гиперглицинемии сходны с симптомами тяжелой формы заболевания, но менее выражены. Дети с ослабленной некетотической гиперглицинемией обычно достигают определенных этапов развития, хотя навыки, которые они достигают, сильно различаются.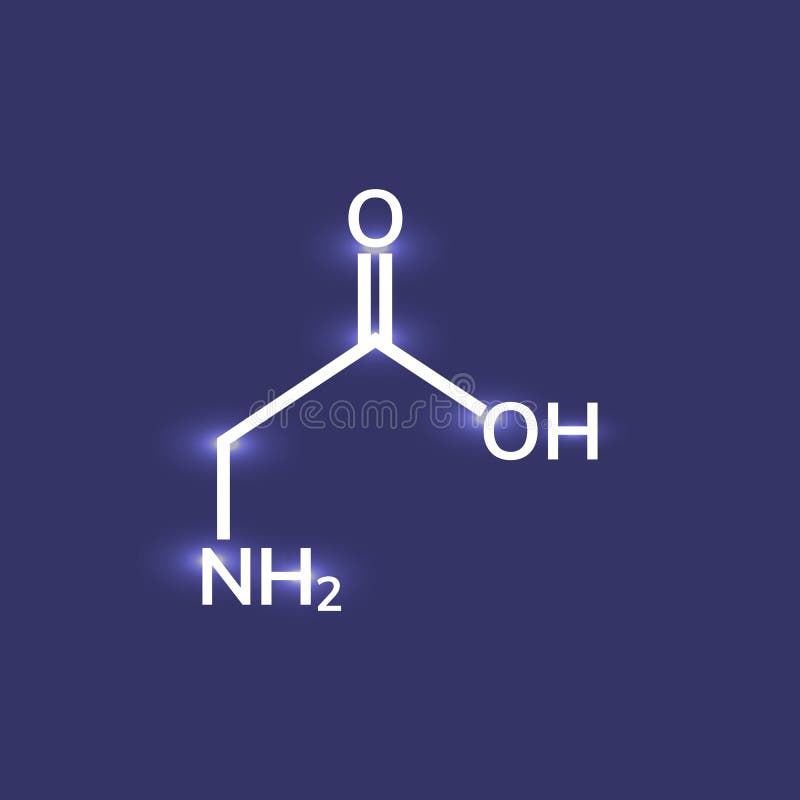 Несмотря на задержку развития, многие затронутые дети со временем учатся ходить и могут общаться с другими, часто используя язык жестов. У некоторых пострадавших детей развиваются судороги; если они присутствуют, судороги обычно легкие и поддаются лечению.Другие особенности могут включать спастичность, непроизвольные подергивания (хорея) или гиперактивность.
Несмотря на задержку развития, многие затронутые дети со временем учатся ходить и могут общаться с другими, часто используя язык жестов. У некоторых пострадавших детей развиваются судороги; если они присутствуют, судороги обычно легкие и поддаются лечению.Другие особенности могут включать спастичность, непроизвольные подергивания (хорея) или гиперактивность.
Люди с некетотической гиперглицинемией также могут иметь определенные изменения в головном мозге, которые можно увидеть с помощью магнитно-резонансной томографии (МРТ). Например, у детей с тяжелой формой заболевания ткань, соединяющая левую и правую половины мозга (мозолистое тело), меньше среднего размера.
Химия: глицин — HandWiki
| Имена | |||
|---|---|---|---|
| Другие названия 2-аминоэтановая кислота, гликоколл | |||
| Идентификаторы | |||
| Сокращения | Gly , G | ||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| Лекарственный банк | |||
| Номер ЕС | |||
| КЕГГ | |||
| UNII | |||
| |||
| Недвижимость | |||
| C 2 H 5 NO 2 | |||
| Молярная масса | 75. 067 г · моль −1 067 г · моль −1 | ||
| Внешний вид | Белое твердое вещество | ||
| Плотность | 1,1607 г / см 3 [2] | ||
| Точка плавления | 233 ° С (451 ° F, 506 К) (разложение) | ||
| 24,99 г / 100 мл (25 ° C) [3] | |||
| Растворимость | растворим в пиридине умеренно растворим в этаноле не растворим в эфире | ||
| Кислотность (p K a ) | 2.34 (карбоксил), 9,6 (амино) [4] | ||
| -40,3 · 10 −6 см 3 / моль | |||
| Фармакология | |||
| 1 = код ATC}} | B05CX03 (ВОЗ) | ||
| Опасности | |||
| Смертельная доза или концентрация (LD, LC): | |||
| 2600 мг / кг (мышь, перорально) | |||
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| Y проверить (что такое YN ?) | |||
| Ссылки на инфобокс | |||
Глицин (символ Gly или G ; [5] ) [6] — это аминокислота, которая имеет один атом водорода в качестве боковой цепи. Это простейшая аминокислота (поскольку карбаминовая кислота нестабильна) с химической формулой NH 2 -CH 2 -COOH.Глицин — одна из протеиногенных аминокислот. Он кодируется всеми кодонами, начинающимися с GG (GGU, GGC, GGA, GGG). Глицин является неотъемлемой частью образования альфа-спиралей во вторичной структуре белка из-за своей компактной формы. По той же причине это самая распространенная аминокислота в тройных спиралях коллагена. Глицин также является тормозным нейротрансмиттером — вмешательство в его высвобождение в спинном мозге (например, во время инфекции Clostridium tetani) может вызвать спастический паралич из-за несдерживаемого мышечного сокращения.
Глицин — бесцветное кристаллическое вещество со сладким вкусом. Это единственная ахиральная протеиногенная аминокислота. Он может вписаться в гидрофильную или гидрофобную среду благодаря минимальной боковой цепи, состоящей только из одного атома водорода. Ацильный радикал — , глицил, .
История и этимология
Глицин был открыт в 1820 году французским химиком Анри Браконно, когда он гидролизовал желатин путем кипячения его с серной кислотой. [7] Первоначально он называл его «сахаром из желатина», [8] [9] , но французский химик Жан-Батист Буссинго показал, что он содержит азот. [10] Американский ученый Эбен Нортон Хорсфорд, в то время ученик немецкого химика Юстуса фон Либиха, предложил название «гликоколл»; [11] [12] Однако шведский химик Берцелиус предложил более простое название «глицин». [13] [14] Название происходит от греческого слова γλυκύς «сладкий вкус» [15] (которое также связано с префиксами гликопротеин и глюко- , например, гликопротеин и глюкоза ).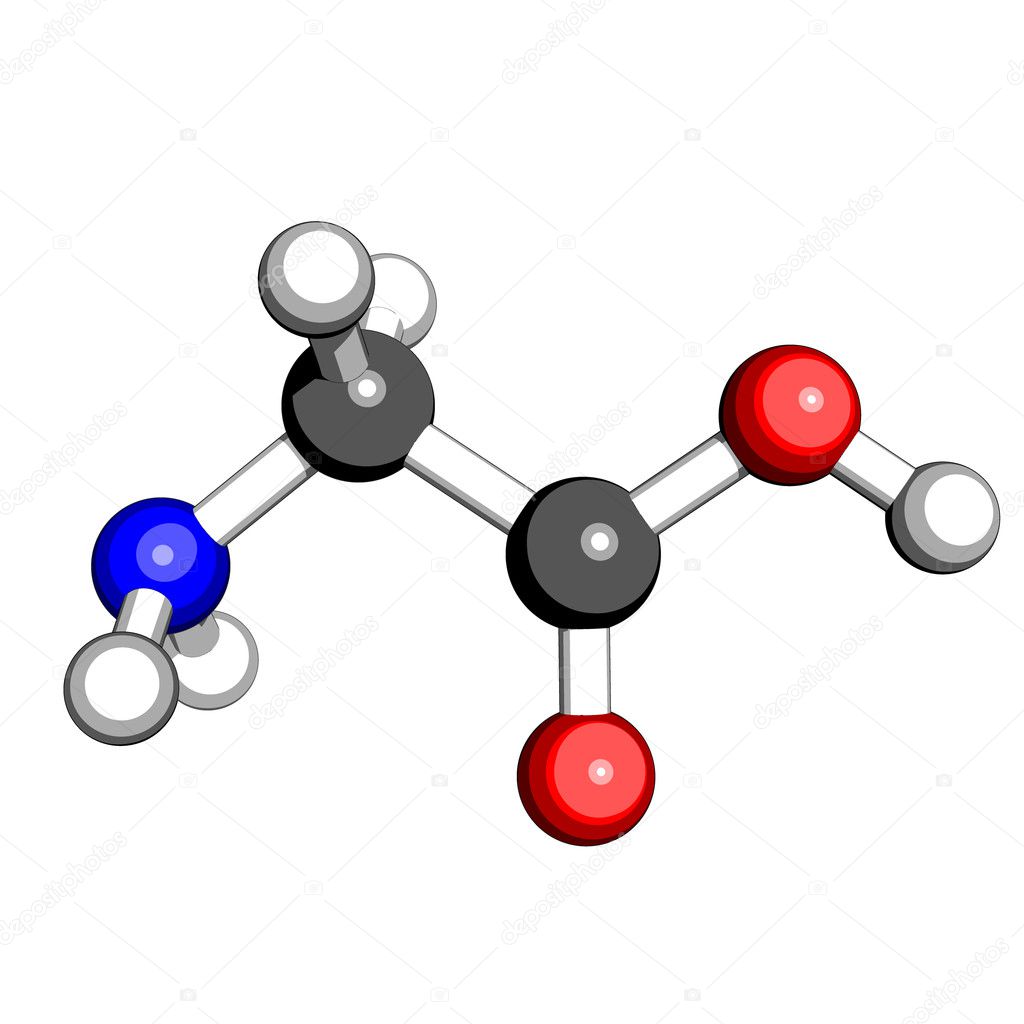 В 1858 году французский химик Огюст Каур определил, что глицин является амином уксусной кислоты. [16]
В 1858 году французский химик Огюст Каур определил, что глицин является амином уксусной кислоты. [16]
Производство
Хотя глицин можно выделить из гидролизованного белка, он не используется в промышленном производстве, поскольку его удобнее производить химическим синтезом. [17] Двумя основными процессами являются аминирование хлоруксусной кислоты аммиаком с получением глицина и хлорида аммония, [18] , и синтез аминокислот по Стрекеру, [19] , который является основным методом синтеза в Соединенных Штатах. и Япония. [20] Таким способом ежегодно производится около 15 тысяч тонн. [21]
Глицин также образуется в качестве примеси при синтезе ЭДТА, возникающей в результате реакций сопутствующего аммиака. [22]
Химические реакции
Наиболее важны его кислотно-основные свойства. В водном растворе сам глицин является амфотерным: при низком pH молекула может быть протонирована с p K a около 2,4, а при высоком pH она теряет протон с p K a около 9.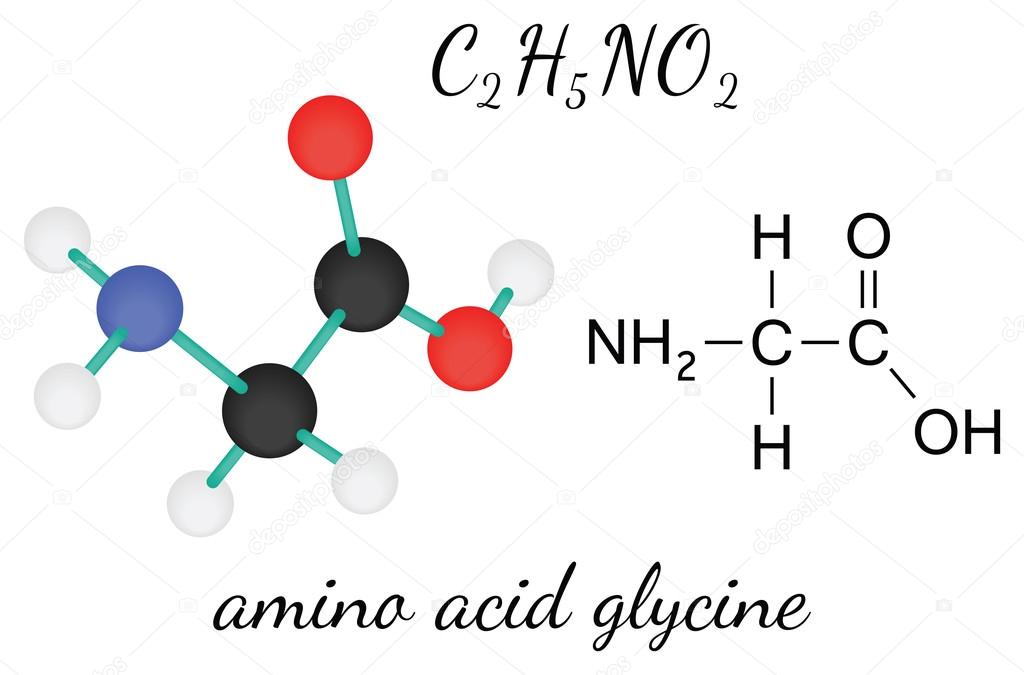 6 (точные значения p K a зависят от температуры и ионной силы).
6 (точные значения p K a зависят от температуры и ионной силы).
Глицин действует как бидентатный лиганд для многих ионов металлов. Типичным комплексом является Cu (глицинат) 2 , то есть Cu (H 2 NCH 2 CO 2 ) 2 , который существует как в цис-, так и в транс-изомерах.
Как бифункциональная молекула, глицин вступает в реакцию со многими реагентами. Их можно разделить на реакции с N-центром и с карбоксилатным центром.
Амин претерпевает ожидаемые реакции. С помощью хлорангидридов получают амидокарбоновую кислоту, такую как гиппуровая кислота [23] и ацетилглицин. [24] С помощью азотистой кислоты получают гликолевую кислоту (определение Ван-Слайка). С метилиодидом амин становится кватернизованным с образованием бетаина, природного продукта:
- H 3 N + CH 2 COO — + 3 CH 3 I → (CH 3 ) 3 N + CH 2 COO — + 3 HI
Глицин конденсируется с самим собой с образованием пептидов, начиная с образования глицилглицина:
- 2 H 3 N + CH 2 COO — → H 3 N + CH 2 CONHCH 2 COO — + H 2 O 0 глицина или глицилглицина дает 2,5-дикетопиперазин, циклический диамид.

Метаболизм
Биосинтез
Глицин не является необходимым для питания человека, так как он биосинтезируется в организме из аминокислоты серина, которая, в свою очередь, является производной 3-фосфоглицерата, но метаболическая способность к биосинтезу глицина не удовлетворяет потребность в синтезе коллагена. [25] У большинства организмов фермент серингидроксиметилтрансфераза катализирует это преобразование через кофактор пиридоксальфосфата: [26]
- серин + тетрагидрофолат → глицин + N 5 , N 10 -метилентетрагидрофолат + H 2 O
В печени позвоночных синтез глицина катализируется глицином (синтез глицина также катализируется глицином). фермент расщепления).Это преобразование легко обратимо: [26]
- CO 2 + NH + 4 + N 5 , N 10 -метилентетрагидрофолат + NADH + H + ⇌ Глицин + тетрагидрофолат + NAD +
05
- Глицин + тетрагидрофолат + NAD + ⇌ CO 2 + NH + 4 + N 5 , N 10 -метилентетрагидрофолат + NADH + H +
- ↑ The Merck Index: Encyclopedia of Chemicals, Drugs, and Biologicals (11-е изд.), Merck, 1989, ISBN 0911 X, 4386.
- ↑ Справочник по химии и физике , CRC Press, 59-е издание, 1978 г.
- ↑ «Растворимости и плотности». Prowl.rockefeller.edu. http://prowl.rockefeller.edu/aainfo/solub.htm.
- ↑ Dawson, R.M.C., et al., Data for Biochemical Research , Oxford, Clarendon Press, 1959.
- ↑ «Номенклатура и символика аминокислот и пептидов».
 Совместная комиссия IUPAC-IUB по биохимической номенклатуре.1983. http://www.chem.qmul.ac.uk/iupac/AminoAcid/AA1n2.html.
Совместная комиссия IUPAC-IUB по биохимической номенклатуре.1983. http://www.chem.qmul.ac.uk/iupac/AminoAcid/AA1n2.html. - ↑ «Глицин | Определение глицина на английском языке по Оксфордским словарям». https://en.oxford dictionaries.com/definition/glycine.
- ↑ Плиммер, R.H.A. (1912). Плиммер, R.H.A .. изд. Химический состав белков . Монографии по биохимии. Часть I. Анализ (2-е изд.). Лондон: Лонгманс, Грин и Ко .. стр. 82. https://books.google.com/?id=7JM8AAAAIAAJ&pg=PA112. Проверено 18 января 2010 года.
- ↑ Браконно, Анри (1820). «Sur la conversion des matières animales en nouvelles elements par le moyen de l’acide sulfique» (на французском языке). Анналы химии и физики . 2-я серия 13 : 113–125. https://babel.hathitrust.org/cgi/pt?id=hvd.hx3dvk;view=1up;seq=119. ; см. стр. 114.
- ↑ Маккензи, Колин (1822) (на английском языке). Тысяча экспериментов в химии: с иллюстрациями природных явлений; и практические наблюдения за производственными и химическими процессами, осуществляемыми в настоящее время для успешного выращивания полезных искусств… .
 Сэр Р. Филлипс и компания. п. 557. https://archive.org/details/onethousandexpe01mackgoog.
Сэр Р. Филлипс и компания. п. 557. https://archive.org/details/onethousandexpe01mackgoog. - ↑ Буссинго (1838). «Sur la композиция du sucre de gélatine et de l’acide nitro-saccharique de Braconnot» (на французском языке). Comptes Rendus 7 : 493–495. https://babel.hathitrust.org/cgi/pt?id=mdp.3
35450702;view=1up;seq=515. - ↑ Horsford, E.N. (1847). «Гликоколл (желатиновый сахар) и некоторые продукты его разложения». Американский журнал науки и искусства .2-я серия 3 : 369–381. https://babel.hathitrust.org/cgi/pt?id=hvd.32044102
4;view=1up;seq=381. - ↑ Ihde, Aaron J. (1970) (на английском языке). Развитие современной химии . Курьерская корпорация. ISBN 9780486642352. https://books.google.com/?id=89BIAwAAQBAJ&pg=PA167.
- ↑ Берцелиус, Иаков (1848). Jahres-Bericht über die Fortschritte der Chemie und Mineralogie (Годовой отчет о достижениях химии и минералогии) . об.47 . Тюбиген (Германия): Laupp.
 п. 654. https://books.google.com/?id=mDc4AQAAIAAJ&dq=%22glycin%22&pg=PA654#v=onepage. С п. 654: «Er hat dem Leimzucker als Basis den Namen Glycocoll gegeben.… Glycin genannt werden, und diesen Namen werde ich anwenden.» (Он [то есть, американский ученый Эбен Нортон Хорсфорд, в то время ученик немецкого химика Юстуса фон Либиха] дал название «гликоколл» основанию Leimzucker [сахар из желатина].Это название не благозвучно и, помимо недостатка, противоречит названиям остальных баз. Он состоит из γλυχυς (сладкого) и χολλα (животного клея). Поскольку эта органическая основа — единственная [одна], имеющая сладкий вкус, то ее можно гораздо короче назвать «глицин», и я буду использовать это название.)
п. 654. https://books.google.com/?id=mDc4AQAAIAAJ&dq=%22glycin%22&pg=PA654#v=onepage. С п. 654: «Er hat dem Leimzucker als Basis den Namen Glycocoll gegeben.… Glycin genannt werden, und diesen Namen werde ich anwenden.» (Он [то есть, американский ученый Эбен Нортон Хорсфорд, в то время ученик немецкого химика Юстуса фон Либиха] дал название «гликоколл» основанию Leimzucker [сахар из желатина].Это название не благозвучно и, помимо недостатка, противоречит названиям остальных баз. Он состоит из γλυχυς (сладкого) и χολλα (животного клея). Поскольку эта органическая основа — единственная [одна], имеющая сладкий вкус, то ее можно гораздо короче назвать «глицин», и я буду использовать это название.)- ↑ Най, Мэри Джо (1999) (на английском языке). До появления большой науки: в поисках современной химии и физики, 1800-1940 гг. . Издательство Гарвардского университета. ISBN 9780674063822. https: // books.google.com/?id=qKjxtZvnBKQC&pg=PA141.

- ↑ «глицин». http://oxforddoxaries.com/definition/american_english/glycine.
- ↑ Каур, А. (1858). «Recherches sur les acides amidés» (на французском языке). Comptes Rendus 46 : 1044–1047. https://babel.hathitrust.org/cgi/pt?id=umn.31951d00008355e;view=1up;seq=1050.
- ↑ Окафор, Ндука (2016-03-09) (на англ. Яз.). Современная промышленная микробиология и биотехнология . CRC Press. ISBN 9781439843239.https://books.google.com/?id=PTm1CwAAQBAJ&pg=PA385.
- ↑ Ingersoll, A. W .; Бэбкок, С. Х. (1932). «Гиппуровая кислота». Органический синтез 12 : 40. http://www.orgsyn.org/demo.aspx?prep=cv2p0328. ; Коллективный том , 2 , стр. 328
- ↑ Wiley (2007-12-14) (на английском языке). Kirk-Othmer Food and Feed Technology, 2 Volume Set . Джон Вили и сыновья. ISBN 9780470174487. https://books.google.com/?id=f—1V1ftgtsC&pg=PA38.
- ↑ «Глициновая конференция (предварительная)». USITC.
 http://www.usitc.gov/trade_remedy/731_ad_701_cvd/investigations/2007/glycine_from_india_japan_korea/preterior/DOC/Glycine%20Conference%20%28prelim%29.wpd.
http://www.usitc.gov/trade_remedy/731_ad_701_cvd/investigations/2007/glycine_from_india_japan_korea/preterior/DOC/Glycine%20Conference%20%28prelim%29.wpd.- ↑ 21,0 21,1 21,2 Драуз, Карлхайнц; Грейсон, Ян; Климанн, Аксель; Криммер, Ханс-Петер; Лойхтенбергер, Вольфганг и Векбекер, Кристоф (2007). «Энциклопедия промышленной химии Ульмана». Энциклопедия промышленной химии Ульмана .Вайнхайм: Wiley-VCH.
- ↑ Харт, Дж. Роджер (2005). «Энциклопедия промышленной химии Ульмана». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. DOI: 10.1002 / 14356007.a10_095.
- ↑ Ingersoll, A. W .; Бэбкок, С. Х. (1932). «Гиппуровая кислота». Org. Synth. 12 : 40. DOI: 10.15227 / orgsyn.012.0040.
- ↑ Herbst, R.M .; Шемин, Д. (1939). «Ацетилглицин». Org. Synth. 19 : 4. DOI: 10.15227 / orgsyn.019.0004.
- ↑ Meléndez-Hevia, E; Де Пас-Луго, П; Корниш-Боуден, А; Карденас, М.
 Л. (декабрь 2009 г.). «Слабое звено в метаболизме: метаболическая способность для биосинтеза глицина не удовлетворяет потребность в синтезе коллагена». Журнал биологических наук 34 (6): 853–72. DOI: 10.1007 / s12038-009-0100-9. PMID 20093739.
Л. (декабрь 2009 г.). «Слабое звено в метаболизме: метаболическая способность для биосинтеза глицина не удовлетворяет потребность в синтезе коллагена». Журнал биологических наук 34 (6): 853–72. DOI: 10.1007 / s12038-009-0100-9. PMID 20093739.- ↑ 26,0 26,1 26,2 26,3 26,4 26,5 26.6 Nelson, David L .; Кокс, Майкл М. (2005), Principles of Biochemistry (4-е изд.), Нью-Йорк: W. H. Freeman, стр. 127, 675–77, 844, 854, ISBN 0-7167-4339-6
- ↑ 27,0 27,1 Хан Р.Г. (1993). «Дозозависимый период полувыведения глицина». Урологическое исследование 21 (4): 289–291. DOI: 10.1007 / BF00307714. PMID 8212419.
- ↑ ACS Chem Biol. 2010 Aug 20; 5 (8): 787–795. DOI: 10.1021 / cb100096f
- ↑ Шпак, Пол (2011).«Химия и ультраструктура костей рыб: значение для тафономии и анализа стабильных изотопов». Журнал археологических наук 38 (12): 3358–3372.
 DOI: 10.1016 / j.jas.2011.07.022. https://uwo.academia.edu/PaulSzpak/Papers/827788/Fish_Bone_Chemistry_and_Ultrastructure_Implications_for_Taphonomy_and_Stable_Isotope_Analysis.
DOI: 10.1016 / j.jas.2011.07.022. https://uwo.academia.edu/PaulSzpak/Papers/827788/Fish_Bone_Chemistry_and_Ultrastructure_Implications_for_Taphonomy_and_Stable_Isotope_Analysis.- ↑ «Последние разработки в рецепторах NMDA». Китайский медицинский журнал. 2000. http://www.cmj.org/Periodical/paperlist.asp?id=LW7347&linkintype=pubmed.
- ↑ «Данные о безопасности (MSDS) глицина». Лаборатория физической и теоретической химии Оксфордского университета. 2005. http://physchem.ox.ac.uk/MSDS/GL/glycine.html.
- ↑ «Глицин из Японии и Кореи». Комиссия по международной торговле США. Январь 2008 г. http://www.usitc.gov/publications/701_731/pub3980.pdf.
- ↑ Casari, B.M .; Mahmoudkhani, A.H .; Лангер, В. (2004). «Повторное определение цис--аквабис (глицинато-κ 2 N, O ) меди (II)». Acta Crystallogr. E 60 (12): m1949 – m1951. DOI: 10.1107 / S1600536804030041.
- ↑ Stahl, Shannon S .; Альстерс, Пол Л. (2016-07-13) (на английском языке).
 Жидкофазный аэробный окислительный катализ: промышленное применение и академические перспективы . Джон Вили и сыновья. ISBN 97835276
Жидкофазный аэробный окислительный катализ: промышленное применение и академические перспективы . Джон Вили и сыновья. ISBN 97835276. https://books.google.com/?id=z5-tDAAAQBAJ&pg=PA268. - ↑ Kvenvolden, Keith A .; Лоулесс, Джеймс; Перинг, Кэтрин; Петерсон, Этта; Флорес, Хосе; Поннамперума, Кирилл; Каплан, Исаак Р.; Мур, Карлтон (1970). «Доказательства наличия внеземных аминокислот и углеводородов в метеорите Мерчисон». Nature 228 (5275): 923–926. DOI: 10.1038 / 228923a0. PMID 5482102. Bibcode: 1970Natur.228..923K.
- ↑ «Строительный блок жизни, найденный на комете — Thomson Reuters 2009». Рейтер. 18 августа 2009 г. https://www.reuters.com/article/scienceNews/idUSTRE57H02I200
. - ↑ Европейское космическое агентство (27 мая 2016 г.). «Комета Розетты содержит ингредиенты для жизни».http://sci.esa.int/rosetta/57858-rosettas-comet-contains-ingredients-for-life/.
- ↑ «Строгая попытка проверить межзвездный глицин». Astrophys J 619 (2): 914–930.
 2005. DOI: 10.1086 / 426677. Бибкод: 2005ApJ … 619..914S.
2005. DOI: 10.1086 / 426677. Бибкод: 2005ApJ … 619..914S.- ↑ Персонал. «Органическая молекула, похожая на аминокислоту, найдена в созвездии Стрельца, 27 марта 2008 г. — Science Daily». https://www.sciencedaily.com/releases/2008/03/080326161658.htm.
- ↑ Национальная база данных по питательным веществам, стандартная ссылка .Министерство сельского хозяйства США. http://www.nal.usda.gov/fnic/foodcomp/search/. Проверено 7 сентября 2009.
Дополнительная литература
Внешние ссылки
Рецептор
(лиганды)GlyR - Положительные модуляторы: Спирты (например, брометон, хлорбутанол (хлоретон), этанол (спирт), трет -бутанол (2M2P), трибромэтанол, трихлорэтанол, трифторэтанол)
- Алкилбензолсульфонат
- Анандамид
- Барбитураты (например,g.
 , пентобарбитал, тиопентал натрия)
, пентобарбитал, тиопентал натрия) - Хлорметиазол
- Д12-116
- Дигидропиридины (например, никардипин)
- Этомидат
- Составные части женьшеня (например, гинзенозиды (например, гинсенозид-Rf))
- Глутаминовая кислота (глутамат)
- Ивермектин
- Кетамин
- Нейроактивные стероиды (например, альфаксолон, прегненолон (элтанолон), прегненолона ацетат, минаксолон, ORG-20599)
- Закись азота
- Пенициллин G
- Пропофол
- Тамоксифен
- Тетрагидроканнабинол
- Triclofos
- Тропеи (e.g., атропин, бемесетрон, кокаин, LY-278584, трописетрон, затосетрон)
- Летучие вещества / газы (например, хлоралгидрат, хлороформ, десфлуран, диэтиловый эфир (эфир), энфлуран, галотан, изофлуран, метоксифлуран, севофлуран, толуол, трихлорэтан (метилхлороформ), трихлорэтилен)
- Ксенон
- Цинк
- Антагонисты: 2-аминострихнин
- 2-нитрострихнин
- 4-фенил-4-формил-N-метилпиперидин
- αEMBTL
- Бикукуллин
- Бруцин
- Какотелин
- Кофеин
- Колхицин
- Колубрин
- Цианотрифенилборат
- Дендробин
- Diaboline
- Эндоканнабиноиды (например,g.
 , 2-AG, анандамид (AEA))
, 2-AG, анандамид (AEA)) - Габоксадол (THIP)
- Гельсемин
- iso-THAZ
- Изомасляная кислота
- Изонипекотиновая кислота
- Изострихнин
- Лауданозин
- N-метилбикукуллин
- N-метилстрихнин
- N, N-диметилмускимол
- Нипекотиновая кислота
- Питразепин
- Псевдострихнин
- Хинолины (например, 4-гидроксихинолин, 4-гидроксихинолин-3-карбоновая кислота, 5,7-CIQA, 7-CIQ, 7-TFQ, 7-TFQA)
- RU-5135
- Sinomenine
- Стрихнин
- Тиоколхикозид
- Тутин
NMDAR Транспортер
(блокираторы)скелетных.png — Викиучебники, открытые книги для открытого мира
Сводка
АнглийскийОписаниеGlycine-skeletal.  png
pngČeština: Zjednodušený racionální konstituční vzorec glycinu
Источник Собственная работа Автор Benjah-bmm27 Разрешение
(Повторное использование этого файла)Public domainPublic domainfalsefalse Это произведение было передано в общественное достояние его автором, Benjah-bmm27 .Это применимо во всем мире. В некоторых странах это может быть невозможно по закону; в таком случае:
Benjah-bmm27 предоставляет любому право использовать это произведение для любых целей , без каких-либо условий, если только такие условия не требуются по закону.Добавьте однострочное объяснение того, что представляет собой этот файл
История файла
Щелкните дату / время, чтобы просмотреть файл в том виде, в каком он был в тот момент.

Дата / время Миниатюра Размеры Пользователь Комментарий текущий 15:51, 21 марта 2006 г. 1,396 × 743 (12 КБ) Benjah-bmm27 Использование файла
Этот файл используется на следующих 2 страницах:
- Введение в молекулярную биологию / Функции и структура белков
- Принципы биохимии / Аминокислоты и белки
Глобальное использование файлов
Этот файл используют следующие другие вики:
- Использование на ар.wikipedia.org
- Использование на bg.wikipedia.org
- Использование на bs.wikipedia.org
- Использование на cs.wikipedia.org
- Использование на da.wikipedia.org
- Использование на el.wikipedia.org
- Использование на en.wikipedia.org
- Использование на en.wikiversity.org
- Использование на fa.
 wikipedia.org
wikipedia.org - Использование на fi.wikipedia.org
- Использование на fr.wikipedia.org
- Использование на fr.wikibooks.org
- Использование в гл. Википедии.org
- Использование на he.wikipedia.org
- Использование на id.wikipedia.org
- Использование на it.wikipedia.org
- Использование на it.wikibooks.org
- Использование на ja.wikipedia.org
- Использование на ja.wikibooks.org
- Использование на lt.wikipedia.org
- Использование на oc.wikipedia.org
- Использование на ro.wikipedia.org
- Использование на ru.wiktionary.org
- Использование на sh.wikipedia.org
- Использование на sk.wikipedia.org
- Использование на сл.wikipedia.org
- Использование на sr.wikipedia.org
- Использование на su.wikipedia.org
- Использование на ta.wikipedia.org
- Использование на uk.wikipedia.org
- Использование на vls.
 wikipedia.org
wikipedia.org - Использование на yo.wikipedia.org
- Использование на zh-min-nan.wikipedia.org
- Использование на zh.wikipedia.org
Мутация D614G в шиповом белке SARS-CoV-2 снижает выделение S1 и увеличивает инфекционность
Lizhou Zhang 1 # , Cody B Jackson 1 # , Huihui Mou 1 # , Amrita Ojha 1 , Erumbi S Rangarajan 2 , Tina Izard 2 , Michael Farzan 1 Choe 1 *
1 Департамент иммунологии и микробиологии, Исследовательский институт Скриппса, Юпитер, Флорида 33458, США
2 Департамент интегративной структурной и вычислительной биологии, Исследовательский институт Скриппса
, Юпитер, Флорида 33458
# внесло равный вклад
* Переписка: hchoe @ scripps.edu; [email protected]РЕФЕРАТ
Изоляты коронавируса 2 SARS (SARS-CoV-2), кодирующие мутацию D614G в белке вирусного шипа (S), со временем преобладают в регионах, где он обнаружен, что означает, что это изменение усиливает передачу вируса.
 Поэтому мы сравнили функциональные свойства белков S с аспарагиновой кислотой (S D614 ) и глицином (S G614 ) в остатке 614. Мы наблюдали, что ретровирусы, псевдотипированные S G614 , инфицировали клетки, экспрессирующие ACE2, заметно более эффективно, чем с S D614 .Эта большая инфекционность коррелировала с меньшим выделением S1 и большим включением S-белка в псевдовирион. Аналогичные результаты были получены с использованием вирусоподобных частиц, продуцируемых с помощью белков SARS-CoV-2 M, N, E и S. Однако S G614 не связывал ACE2 более эффективно, чем S D614 , и псевдовирусы, содержащие эти S-белки, нейтрализовались с сопоставимой эффективностью плазмой выздоравливающих. Эти результаты показывают, что S G614 более стабилен, чем S D614 , что согласуется с эпидемиологическими данными, предполагающими, что вирусы с S G614 передаются более эффективно.
Поэтому мы сравнили функциональные свойства белков S с аспарагиновой кислотой (S D614 ) и глицином (S G614 ) в остатке 614. Мы наблюдали, что ретровирусы, псевдотипированные S G614 , инфицировали клетки, экспрессирующие ACE2, заметно более эффективно, чем с S D614 .Эта большая инфекционность коррелировала с меньшим выделением S1 и большим включением S-белка в псевдовирион. Аналогичные результаты были получены с использованием вирусоподобных частиц, продуцируемых с помощью белков SARS-CoV-2 M, N, E и S. Однако S G614 не связывал ACE2 более эффективно, чем S D614 , и псевдовирусы, содержащие эти S-белки, нейтрализовались с сопоставимой эффективностью плазмой выздоравливающих. Эти результаты показывают, что S G614 более стабилен, чем S D614 , что согласуется с эпидемиологическими данными, предполагающими, что вирусы с S G614 передаются более эффективно.До конца 2019 года было известно только шесть коронавирусов, инфицирующих людей: HCoV-229E, HCoV-OC43, SARS-CoV (SARS-CoV-1), HCoV-NL63, CoV-HKU1 и MERS-CoV.
 Седьмой, SARS-CoV-2, появился зимой 2019 года в Ухане, Китай. SARS-CoV-2 тесно связан с SARS-CoV-1, вирусом, который появился в провинции Гуандун, Китай в конце 2002 года.
Седьмой, SARS-CoV-2, появился зимой 2019 года в Ухане, Китай. SARS-CoV-2 тесно связан с SARS-CoV-1, вирусом, который появился в провинции Гуандун, Китай в конце 2002 года.Белок спайка коронавируса (S) опосредует связывание рецептора и слияние вирусной и клеточной мембран. Белок S простирается от вирусной мембраны и равномерно расположен в виде тримеров на поверхности вириона, создавая вид короны ( корона на латыни).Белок коронавируса S делится на два домена: S1 и S2. Домен S1 опосредует связывание рецептора, а S2 опосредует последующее слияние мембран 1,2 . Рецептором SARS-CoV-2 является ангиотензин-превращающий фермент 2 (ACE2) 3-7 , металлопротеаза, которая также служит рецептором для SARS-CoV-1 8 . Небольшой независимо сложенный субдомен S1, описываемый как рецептор-связывающий домен (RBD), напрямую связывает ACE2, когда вирус взаимодействует с клеткой-мишенью 9-12 .Соединение S1 / S2 SARS-CoV-2 обрабатывается фурин-подобной пропротеинконвертазой в клетке-продуценте вируса.
 Напротив, соединение S1 / S2 SARS-CoV-1 обрабатывается TMPRSS2 на поверхности клетки или лизосомными катепсинами в клетках-мишенях 13-18 . Оба S-белка далее процессируются в клетке-мишени в пределах домена S2 на сайте S2 ’, событие, которое также необходимо для продуктивного инфицирования 19,20 .
Напротив, соединение S1 / S2 SARS-CoV-1 обрабатывается TMPRSS2 на поверхности клетки или лизосомными катепсинами в клетках-мишенях 13-18 . Оба S-белка далее процессируются в клетке-мишени в пределах домена S2 на сайте S2 ’, событие, которое также необходимо для продуктивного инфицирования 19,20 .Недавний анализ мелкомасштабной изменчивости последовательностей изолятов SARS-CoV-2 выявил несколько участков генома с повышенной генетической изменчивостью 21-30 .Один из этих вариантов кодирует мутацию S-белка, D614G, в карбокси (C) -концевой области домена S1 21-23,26,30 . Эта область домена S1 напрямую ассоциируется с S2 (рис. 1а). Эта мутация с глицином в остатке 614 (G614), как было ранее обнаружено, увеличивалась с угрожающей скоростью 21,22 . Наш собственный анализ последовательностей S-белков, доступных в GenBank, показал аналогичный результат: генотип G614 не был обнаружен в феврале (среди 33 последовательностей) и наблюдался с низкой частотой в марте (26%), но быстро увеличился к апрелю (65 %) и май (70%) (рис.
 1b), что указывает на преимущество в передаче вирусов с D614. Корбер и др. отметили, что это изменение также коррелировало с увеличением вирусной нагрузки у пациентов с COVID-19 22 , но поскольку это изменение также связано с мутациями в вирусных белках nsp3 и RdRp, роль S-белка в этих наблюдениях оставалась неопределенной.
1b), что указывает на преимущество в передаче вирусов с D614. Корбер и др. отметили, что это изменение также коррелировало с увеличением вирусной нагрузки у пациентов с COVID-19 22 , но поскольку это изменение также связано с мутациями в вирусных белках nsp3 и RdRp, роль S-белка в этих наблюдениях оставалась неопределенной.Чтобы определить, изменяет ли мутация D614G свойства S-белка таким образом, чтобы это могло повлиять на передачу или репликацию, мы оценили ее роль в проникновении вируса.Псевдовирусы (PV) на основе вируса мышиного лейкоза Мэлони (MLV), экспрессирующие зеленый флуоресцентный белок (GFP) и псевдотипированные S-белком SARS-CoV-2 (SARS2), несущие генотип D614 или G614 (S D614 и S ). G614 соответственно) были получены из трансфицированных клеток HEK293T, как описано ранее 31 . Вариант S D614 , в котором фрагмент расщепления фурином между доменами S1 и S2 удален (S FKO ), также был включен для сравнения.
 Клетки HEK293T, трансдуцированные для экспрессии человеческого ACE2 (hACE2-293T) или клетки, трансдуцированные одним вектором (Mock-293T), были инфицированы теми же числами частиц, что и PV, псевдотипированные S D614 , S G614 или S FKO. (PV D614 , PV G614 или PV FKO соответственно), а уровень заражения оценивался днем позже. Мы наблюдали инфицированные PV G614 клетки hACE2-293T с примерно в 9 раз большей эффективностью, чем PV D614 (рис.1в, г). Эта повышенная инфекционность PV G614 не является артефактом нормализации титра PV, поскольку их титры очень похожи (расширенные данные, рис. 1).
Клетки HEK293T, трансдуцированные для экспрессии человеческого ACE2 (hACE2-293T) или клетки, трансдуцированные одним вектором (Mock-293T), были инфицированы теми же числами частиц, что и PV, псевдотипированные S D614 , S G614 или S FKO. (PV D614 , PV G614 или PV FKO соответственно), а уровень заражения оценивался днем позже. Мы наблюдали инфицированные PV G614 клетки hACE2-293T с примерно в 9 раз большей эффективностью, чем PV D614 (рис.1в, г). Эта повышенная инфекционность PV G614 не является артефактом нормализации титра PV, поскольку их титры очень похожи (расширенные данные, рис. 1).Затем мы исследовали механизм, с помощью которого S G614 увеличивает инфекционность вируса. Поскольку остаток 614 S1 расположен проксимальнее домена S2, мы сначала сравнили соотношение между доменами S1 и S2 в вирионе, которое может указывать на измененное высвобождение или отщепление домена S1 после расщепления в соединении S1 / S2.
 Для этого мы использовали конструкции S-белков, несущие метки Flag как на амино (N), так и на С-концах.Псевдотипы этих форм S D614 , S G614 и S FKO с этими двумя метками Flag были частично очищены и сконцентрированы путем гранулирования через 20% слой сахарозы 32 и оценены на их инфекционность. Титры ПВ были одинаковыми для PV G614 , PV D614 и PV FKO до и после очистки (рис. 2а). Кроме того, модификация с помощью Flag-тегов или гранулирование PV через слой сахарозы не изменяет относительную инфекционность между PV G614 и PV D614 (рис.2б). Затем мы определили их соотношение S1: S2 вестерн-блоттингом с использованием антитела против Flag M2. Как показано на рис. 2c, соотношение S1: S2 заметно больше в PV G614 по сравнению с PV D614 , что указывает на то, что глицин в остатке 614 S G614 стабилизирует взаимодействие между доменами S1 и S2, ограничивая S1.
Для этого мы использовали конструкции S-белков, несущие метки Flag как на амино (N), так и на С-концах.Псевдотипы этих форм S D614 , S G614 и S FKO с этими двумя метками Flag были частично очищены и сконцентрированы путем гранулирования через 20% слой сахарозы 32 и оценены на их инфекционность. Титры ПВ были одинаковыми для PV G614 , PV D614 и PV FKO до и после очистки (рис. 2а). Кроме того, модификация с помощью Flag-тегов или гранулирование PV через слой сахарозы не изменяет относительную инфекционность между PV G614 и PV D614 (рис.2б). Затем мы определили их соотношение S1: S2 вестерн-блоттингом с использованием антитела против Flag M2. Как показано на рис. 2c, соотношение S1: S2 заметно больше в PV G614 по сравнению с PV D614 , что указывает на то, что глицин в остатке 614 S G614 стабилизирует взаимодействие между доменами S1 и S2, ограничивая S1. линька. Кроме того, общее количество белка S в PV G614 также намного выше, чем в PV D614 , на что указывает более плотная полоса S2, даже несмотря на то, что было проанализировано такое же количество псевдовирионов, как определено количественной ПЦР. .Чтобы независимо подтвердить, что было проанализировано аналогичное количество вирионов, нижнюю часть той же мембраны подвергали блоттингу gag-антителом против p30 MLV (фиг. 2c). Сходные плотности полос p30 наблюдались для всех PV, что указывает на то, что различия во включении S-белка, наблюдаемые для PV G614 и PV D614 , были вызваны мутацией остатка 614, а не разным количеством проанализированных PV. Аналогичный эксперимент, проведенный с независимо произведенными ПВ, дал почти идентичный результат (расширенные данные, рис.2а). Денситометрический анализ показывает, что полоса S1 + S2 в PV G614 в 4,7 раза больше по сравнению с PV D614 (рис. 2d). Чтобы более точно оценить соотношение S1: S2, мы затем сравнили разное количество одних и тех же образцов, чтобы интенсивность полосы S2 в PV G614 и PV D614 была сопоставимой (рис.
линька. Кроме того, общее количество белка S в PV G614 также намного выше, чем в PV D614 , на что указывает более плотная полоса S2, даже несмотря на то, что было проанализировано такое же количество псевдовирионов, как определено количественной ПЦР. .Чтобы независимо подтвердить, что было проанализировано аналогичное количество вирионов, нижнюю часть той же мембраны подвергали блоттингу gag-антителом против p30 MLV (фиг. 2c). Сходные плотности полос p30 наблюдались для всех PV, что указывает на то, что различия во включении S-белка, наблюдаемые для PV G614 и PV D614 , были вызваны мутацией остатка 614, а не разным количеством проанализированных PV. Аналогичный эксперимент, проведенный с независимо произведенными ПВ, дал почти идентичный результат (расширенные данные, рис.2а). Денситометрический анализ показывает, что полоса S1 + S2 в PV G614 в 4,7 раза больше по сравнению с PV D614 (рис. 2d). Чтобы более точно оценить соотношение S1: S2, мы затем сравнили разное количество одних и тех же образцов, чтобы интенсивность полосы S2 в PV G614 и PV D614 была сопоставимой (рис. 2e). Средние значения нескольких количественных оценок показывают, что соотношение S1: S2 PV G614 в 3,5 раза выше, чем у PV D614 (рис. 2f). Антитело M2, используемое в этом эксперименте, связывает метку Flag, расположенную как на N-, так и на С-концах белка, но оно связывает N-концевую метку Flag более эффективно 33 .Поэтому мы непосредственно визуализировали полосы S-белка вириона путем окрашивания серебром (расширенные данные, рис. 2b). Хотя полосы S2 маскируются белком MLV того же размера, полосы S1 хорошо разделены. Опять же, интенсивность полосы S1 PV G614 намного выше, чем у PV D614 , в то время как полосы p30 сопоставимы, что соответствует результатам, наблюдаемым с использованием антитела против Flag M2.
2e). Средние значения нескольких количественных оценок показывают, что соотношение S1: S2 PV G614 в 3,5 раза выше, чем у PV D614 (рис. 2f). Антитело M2, используемое в этом эксперименте, связывает метку Flag, расположенную как на N-, так и на С-концах белка, но оно связывает N-концевую метку Flag более эффективно 33 .Поэтому мы непосредственно визуализировали полосы S-белка вириона путем окрашивания серебром (расширенные данные, рис. 2b). Хотя полосы S2 маскируются белком MLV того же размера, полосы S1 хорошо разделены. Опять же, интенсивность полосы S1 PV G614 намного выше, чем у PV D614 , в то время как полосы p30 сопоставимы, что соответствует результатам, наблюдаемым с использованием антитела против Flag M2.Затем мы подтвердили эти результаты, используя вирусоподобные частицы (VLP), состоящие только из нативных белков SARS-CoV-2, нуклеопротеина (N), мембранного белка (M), белка оболочки (E) и белка S 34 .
 VLP были частично очищены и проанализированы таким же образом, как и PV MLV. Полосы белка S были обнаружены с помощью антитела против Flag M2, а белок N — с объединенной плазмой выздоравливающей, полученной от пациентов с COVID-19. Отношение S1: S2 и общий белок S на вирионе снова были намного выше у VLP, несущих S G614 (VLP G614 ), по сравнению с VLP, несущих S D614 (VLP D614 ) (рис. 3a). Отношение S1: S2 в 3,4 раза выше, а общий белок S почти в пять раз обогащен VLP G614 по сравнению с VLP D614 (рис.3б, в). Таким образом, мутация D614G усиливает вирусную инфекцию за счет двух связанных механизмов: она снижает выделение S1 и увеличивает общий S-белок, включенный в вирион.
VLP были частично очищены и проанализированы таким же образом, как и PV MLV. Полосы белка S были обнаружены с помощью антитела против Flag M2, а белок N — с объединенной плазмой выздоравливающей, полученной от пациентов с COVID-19. Отношение S1: S2 и общий белок S на вирионе снова были намного выше у VLP, несущих S G614 (VLP G614 ), по сравнению с VLP, несущих S D614 (VLP D614 ) (рис. 3a). Отношение S1: S2 в 3,4 раза выше, а общий белок S почти в пять раз обогащен VLP G614 по сравнению с VLP D614 (рис.3б, в). Таким образом, мутация D614G усиливает вирусную инфекцию за счет двух связанных механизмов: она снижает выделение S1 и увеличивает общий S-белок, включенный в вирион.Ранее предполагалось, что мутация D614G способствует открытой конфигурации белка S, который более благоприятен для ассоциации ACE2 5,22,23,35 . Чтобы изучить эту возможность, мы исследовали, было ли связывание ACE2 с помощью S G614 более эффективным, чем связывание с S D614 .
 Клетки HEK293T, трансфицированные для экспрессии каждого S-белка, оценивали на их связывание с иммуноадгезином hACE2 с использованием hACE2-NN-Ig, ферментативная активность которого отменяется мутацией 31 .hACE2-NN-Ig связал SARS-CoV-1 RBD с эквивалентной аффинностью, как hACE2-Ig. Эти S-белки сливаются с C-концевой, но не с N-концевой меткой Flag, что позволяет измерять общую экспрессию S-белка в проницаемых клетках с помощью проточной цитометрии. Хотя общая экспрессия белка S была сопоставимой, связывание hACE2-NN-Ig с клетками, экспрессирующими S G614 , было значительно выше, чем его связывание с клетками, экспрессирующими S D614 (фиг. 4a). Этому наблюдению есть несколько объяснений.Во-первых, G614 может увеличивать ассоциацию hACE2, способствуя большему воздействию RBD, или, во-вторых, эта мутация может увеличивать количество сайтов связывания, ограничивая шеддинг S1-домена. Чтобы различить эти возможности, мы добавили Myc-tag к N-концу S-белка, который помечен Flag на его C-конце, и повторили исследование, на этот раз обнаружив домен S1 с помощью антитела против Myc.
Клетки HEK293T, трансфицированные для экспрессии каждого S-белка, оценивали на их связывание с иммуноадгезином hACE2 с использованием hACE2-NN-Ig, ферментативная активность которого отменяется мутацией 31 .hACE2-NN-Ig связал SARS-CoV-1 RBD с эквивалентной аффинностью, как hACE2-Ig. Эти S-белки сливаются с C-концевой, но не с N-концевой меткой Flag, что позволяет измерять общую экспрессию S-белка в проницаемых клетках с помощью проточной цитометрии. Хотя общая экспрессия белка S была сопоставимой, связывание hACE2-NN-Ig с клетками, экспрессирующими S G614 , было значительно выше, чем его связывание с клетками, экспрессирующими S D614 (фиг. 4a). Этому наблюдению есть несколько объяснений.Во-первых, G614 может увеличивать ассоциацию hACE2, способствуя большему воздействию RBD, или, во-вторых, эта мутация может увеличивать количество сайтов связывания, ограничивая шеддинг S1-домена. Чтобы различить эти возможности, мы добавили Myc-tag к N-концу S-белка, который помечен Flag на его C-конце, и повторили исследование, на этот раз обнаружив домен S1 с помощью антитела против Myc. Как показано на фиг. 4b, отношение Myc-tag к Flag-tag выше в клетках, экспрессирующих S G614 , чем в клетках, экспрессирующих S D614 .Однако соотношение Myc-tag / Flag-tag аналогично соотношению hACE2-NN-Ig / Flag-tag, что указывает на то, что повышенное связывание hACE2 с клетками, экспрессирующими S G614 , не является результатом повышения аффинности S G614. шипов к hACE2 или большему доступу к RBD. Вместо этого эти данные показывают, что в клетках, экспрессирующих S G614 , больше домена S1, что снова согласуется с наблюдением, что мутация D614G снижает шеддинг S1. Затем мы оценили, может ли различное количество S-белка влиять на чувствительность вируса к нейтрализации.Рис. 4c показывает, что PV D614 и PV G614 одинаково чувствительны к нейтрализующим антисывороткам, что указывает на то, что опосредованный антителами контроль вирусов, несущих S D614 и S G614 , будет аналогичным.
Как показано на фиг. 4b, отношение Myc-tag к Flag-tag выше в клетках, экспрессирующих S G614 , чем в клетках, экспрессирующих S D614 .Однако соотношение Myc-tag / Flag-tag аналогично соотношению hACE2-NN-Ig / Flag-tag, что указывает на то, что повышенное связывание hACE2 с клетками, экспрессирующими S G614 , не является результатом повышения аффинности S G614. шипов к hACE2 или большему доступу к RBD. Вместо этого эти данные показывают, что в клетках, экспрессирующих S G614 , больше домена S1, что снова согласуется с наблюдением, что мутация D614G снижает шеддинг S1. Затем мы оценили, может ли различное количество S-белка влиять на чувствительность вируса к нейтрализации.Рис. 4c показывает, что PV D614 и PV G614 одинаково чувствительны к нейтрализующим антисывороткам, что указывает на то, что опосредованный антителами контроль вирусов, несущих S D614 и S G614 , будет аналогичным.
Также предполагалось, что мутация D614G будет способствовать, а не ограничивать, отщепление домена S1, основываясь на гипотетической потере водородной связи между D614 в S1 и T859 в S2 22 . Альтернативное объяснение, более соответствующее представленным здесь данным, заключается в том, что Q613 образует водородную связь с T859, а большая гибкость основной цепи, обеспечиваемая введением глицина в соседнее положение 614, позволяет более благоприятную ориентацию Q613.Также возможно, что D614 может образовывать внутридоменный солевой мостик с R646, способствуя локальной конформации S1, неблагоприятной для его ассоциации с S2. В этой модели замена аспарагиновой кислоты глицином в положении 614 предотвратила бы отбор проб этой неблагоприятной конфигурации. Нестабильность S D614 также может объяснять наблюдаемый более низкий уровень включения функционального белка S в PV и VLP. В частности, тримеры S-белка с экспонированными доменами S2 в результате шеддинга S1 могут дестабилизировать мембрану транс-сети Гольджи, сайт процессинга границы S1 / S2, и такое нарушение может препятствовать включению S-белка в вирион.
 В случае VLPs это нарушение, по-видимому, д. Дальше мешать соответствующим ассоциациям M- и N-белков, изменяя конформацию и ориентацию S-белков проксимальных к мембране областей. Альтернативно, эти тримеры S-белка с экспонированными доменами S2 могут служить плохими субстратами для последующих посттрансляционных модификаций, включая пальмитоилирование, а те, которые не имеют надлежащих модификаций, могут быть неподходящими для включения вириона.
В случае VLPs это нарушение, по-видимому, д. Дальше мешать соответствующим ассоциациям M- и N-белков, изменяя конформацию и ориентацию S-белков проксимальных к мембране областей. Альтернативно, эти тримеры S-белка с экспонированными доменами S2 могут служить плохими субстратами для последующих посттрансляционных модификаций, включая пальмитоилирование, а те, которые не имеют надлежащих модификаций, могут быть неподходящими для включения вириона.Интересный вопрос заключается в том, почему вирусы, несущие более стабильный S G614 , кажутся более передаваемыми, не приводя к значительным наблюдаемым различиям в тяжести заболевания 22,27 .Возможно, что более высокие уровни функционального S-белка, наблюдаемые с S G614 , увеличивают вероятность передачи от хозяина к хозяину, но другие факторы ограничивают скорость и эффективность репликации внутри хозяина. Альтернативно, потеря ассоциированных с вирионом S-белков, наблюдаемая с S D614 , может быть компенсирована большей эффективностью слияния с дестабилизированным S-белком, когда следующая клетка-мишень находится рядом с тканью хозяина.
 Также возможно, что наша способность обнаруживать изменения последовательности на этой ранней стадии пандемии просто больше, чем наша способность обнаруживать небольшие различия в патогенезе.Сильная фенотипическая разница, которую мы наблюдаем здесь между D614 и G614, предполагает, что необходимы дополнительные исследования влияния мутации D614G на течение заболевания.
Также возможно, что наша способность обнаруживать изменения последовательности на этой ранней стадии пандемии просто больше, чем наша способность обнаруживать небольшие различия в патогенезе.Сильная фенотипическая разница, которую мы наблюдаем здесь между D614 и G614, предполагает, что необходимы дополнительные исследования влияния мутации D614G на течение заболевания.Наконец, наши данные поднимают интересные вопросы о естественной истории SARS-CoV-2, поскольку он предположительно перешел от подковообразных летучих мышей к людям. В какой-то момент этого процесса вирус приобрел сайт расщепления фурином, что позволило его границе S1 / S2 расщепляться в вирусопродуцирующих клетках. Напротив, граница S1 / S2 SARS-CoV-1, и действительно все SARS-подобные вирусы, выделенные от летучих мышей, лишены этого многоосновного сайта и расщепляются TMPRSS2 или эндосомными катепсинами в клетках-мишенях 13-20 .Таким образом, более высокая стабильность, которую мы наблюдаем с S G614 , не будет иметь отношения к вирусам, не имеющим этого сайта, но, по-видимому, она сильно предпочтительна, когда присутствует сайт расщепления фурином.
 Следовательно, мутация D614G могла возникнуть, чтобы компенсировать этот недавно приобретенный сайт фурина.
Следовательно, мутация D614G могла возникнуть, чтобы компенсировать этот недавно приобретенный сайт фурина.Таким образом, мы показываем, что мутация S-белка, которая приводит к более трансмиссивному SARS-CoV-2, также ограничивает отщепление домена S1 и увеличивает включение S-белка в вирион. Потребуются дальнейшие исследования, чтобы определить влияние этого изменения на характер и тяжесть COVID-19.
БлагодарностиЭта работа поддерживается административным приложением к NIH R01 AI129868 для исследования коронавируса (присуждено M.F. и H.C.)
Вклад авторовH.C. и М.Ф. задумал и руководил исследованием. L.Z., C.B.J., H.M., M.F. и H.C. разработанные эксперименты. L.Z., C.B.J., H.M. и A.O. проводил эксперименты. L.Z., C.B.J., H.M. и A.O. проанализированные данные. E.B.R. и Т. предоставил необходимые реагенты. М.Ф. и Х. написал рукопись. Все авторы просмотрели и отредактировали рукопись.
Конкурирующие интересыАвторы заявляют об отсутствии конкурирующих интересов.
Доступность данных
Данные, подтверждающие выводы этого исследования, могут быть получены у соответствующего автора по обоснованному запросу.
МетодыАнализ белковых последовательностей SARS-CoV-2 S. Для отслеживания вариации D614G среди изолятов SARS-CoV-2 последовательности белка S были загружены из GenBank и разделены по месяцам.Частоту генотипа по остатку 614 рассчитывали с использованием R (R Foundation for Statistical Computing) с пакетом Biostrings. Графики логотипа вариации D614G были созданы с помощью WebLogo после выравнивания последовательностей. Общее количество анализируемых последовательностей за каждый месяц указано в легенде на рис.
Производство, количественная оценка и заражение MLV PV. MLV PV получали путем трансфекции клеток HEK293T при ~ 60% конфлюэнтности в колбах T175 с использованием кальций-фосфатного метода с 70 мкг тотальной ДНК.Соотношение 5: 5: 1 по массе было использовано для ретровирусного вектора pQCXIX, кодирующего белок зеленой флуоресценции (GFP) или люциферазы светлячка (FLuc), плазмиды, экспрессирующей белки gag и pol MLV, и плазмиды, экспрессирующей белок S SARS- CoV-2 или белок VSV G.
Титры Ранее сообщалось о плазмиде, экспрессирующей белок G VSV 31 . Ген белка SARS-CoV-2 S, используемый в производстве PV MLV, был оптимизирован по кодонам и синтезирован Integrated DNA Technologies на основе последовательности белка (GenBank YP_009724390).Ген белка S слит с последовательностью метки Flag (DYKDDDDK) либо на его C-конце, либо на обоих N- и C-концах, как указано в каждом эксперименте. Содержащие PV культуральные супернатанты собирали через 43 часа после трансфекции, очищали через фильтры 0,45 мкм и либо очищали, либо разделяли на аликвоты и немедленно замораживали при -80 ° C.
Ранее сообщалось о плазмиде, экспрессирующей белок G VSV 31 . Ген белка SARS-CoV-2 S, используемый в производстве PV MLV, был оптимизирован по кодонам и синтезирован Integrated DNA Technologies на основе последовательности белка (GenBank YP_009724390).Ген белка S слит с последовательностью метки Flag (DYKDDDDK) либо на его C-конце, либо на обоих N- и C-концах, как указано в каждом эксперименте. Содержащие PV культуральные супернатанты собирали через 43 часа после трансфекции, очищали через фильтры 0,45 мкм и либо очищали, либо разделяли на аликвоты и немедленно замораживали при -80 ° C.PV были количественно определены с помощью RT-qPCR с использованием праймеров и зонда, нацеленного на промотор CMV. Смысловой праймер: 5’-TCACGGGGATTTCCAAGTCTC-3 ’, антисмысловой праймер: 5’-AATGGGGCGGAGTTGTTACGAC-3’, зонд: 5’-AAACAAACTCCCATTGACGTCA-3 ’.Вирусную РНК экстрагировали с помощью тризола (Life Technologies) и соосаждения GlycoBlue (Invitrogen) и подвергали обратной транскрипции с использованием набора для обратной транскрипции кДНК высокой емкости (Applied Biosystems).
 qPCR выполняли с использованием Luna Universal Probe qPCR Master Mix (New England Biolabs) с известным количеством вектора pQCXIX для создания стандартных кривых.
qPCR выполняли с использованием Luna Universal Probe qPCR Master Mix (New England Biolabs) с известным количеством вектора pQCXIX для создания стандартных кривых.Анализы на инфекцию выполняли путем спинокулирования (при 2100 x g в течение 30 минут при 10 ° C) PV на клетки Mock- и hACE2-293T, засеянные на многолуночные планшеты.Спинокулированные планшеты инкубировали в течение 2 ч в инкубаторе CO 2 и среду заменяли DMEM, содержащей 10% FBS. Уровни инфекции оценивали через 24 часа после заражения путем измерения экспрессии GFP с помощью проточного цитометра Accuri или активности люциферазы с использованием набора для анализа Luc-Pair Firefly Luciferase HS (GeneCopoeia).
Анализы белка S, включенного в PV MLV. Для анализа белка S в вирионе ЛВ были частично очищены. 9 мл очищенных культуральных супернатантов, содержащих PV (20 мл / T175), загружали в 2 мл 20% сахарозы в PBS и центрифугировали при 30 000 об / мин в роторе SW41 в течение 2 ч при 10 ° C 32 .
 Осадки PV ресуспендировали в 30-50 мкл NT-буфера (120 мМ NaCl, 20 мМ Трис, pH 8,0). Очищенные ПВ немедленно использовали или разделяли на аликвоты и замораживали при -80 ° C. Для вестерн-блоттинга 5-10 мкл очищенного PV, что эквивалентно 0,5-1,0 × 10 10 векторных геномов, загружали на дорожку 4-12% геля Бис-Трис (Life Technologies), переносили в PVDF-мембрану и блотировали 1 мкг / мл антитела против Flag M2 (Sigma-Aldrich, F1804) для обнаружения полос S-белка. 1 мкг / мл gag-антитела против p30 MLV (Abcam, ab130757) и разведение 1: 10000 козьих поликлональных антител против мышиного IgG-HRP (Jackson ImmunoResearch, 115-036-062) использовали для обнаружения белка gag MLV в качестве внутренний контроль.Интенсивность полос измеряли с использованием программного обеспечения Image Lab (Bio-Rad). Чтобы повысить точность этого измерения, одни и те же кляксы анализировали несколько раз при разных экспозициях. Для окрашивания серебром 30 мкл очищенных PV разделяли 4-12% гелем Bis-Tris и окрашивали Silver Stain Plus (Bio-Rad).
Осадки PV ресуспендировали в 30-50 мкл NT-буфера (120 мМ NaCl, 20 мМ Трис, pH 8,0). Очищенные ПВ немедленно использовали или разделяли на аликвоты и замораживали при -80 ° C. Для вестерн-блоттинга 5-10 мкл очищенного PV, что эквивалентно 0,5-1,0 × 10 10 векторных геномов, загружали на дорожку 4-12% геля Бис-Трис (Life Technologies), переносили в PVDF-мембрану и блотировали 1 мкг / мл антитела против Flag M2 (Sigma-Aldrich, F1804) для обнаружения полос S-белка. 1 мкг / мл gag-антитела против p30 MLV (Abcam, ab130757) и разведение 1: 10000 козьих поликлональных антител против мышиного IgG-HRP (Jackson ImmunoResearch, 115-036-062) использовали для обнаружения белка gag MLV в качестве внутренний контроль.Интенсивность полос измеряли с использованием программного обеспечения Image Lab (Bio-Rad). Чтобы повысить точность этого измерения, одни и те же кляксы анализировали несколько раз при разных экспозициях. Для окрашивания серебром 30 мкл очищенных PV разделяли 4-12% гелем Bis-Tris и окрашивали Silver Stain Plus (Bio-Rad).
Производство VLP и анализ S-белков. SARS-CoV-2 VLP были получены путем трансфекции клеток HEK293T при ~ 60% конфлюэнтности в колбах T75 25 мкг общей ДНК с использованием кальций-фосфатного метода, как описано ранее с модификацией 34 .Плазмиды, экспрессирующие белки M, N, E и S SARS-CoV-2, трансфицировали в соотношении 1: 5: 5: 1. Оптимизированные по кодонам гены белков M, N и E были синтезированы на основе последовательностей белков GenBank, YP_009724393, YP_009724397 и YP_009724392, соответственно. VLP собирали через 43 часа после трансфекции из культуральных супернатантов, очищали фильтрованием 0,45 мкм и частично очищали осаждением через слой 20% сахарозы, как и PV MLV. Осадки VLP ресуспендировали в 30 мкл NT-буфера, и все количество наносили на 4-12% гель Bis-Tris для анализа WB.Как и в случае MLV PV, полосы S-белка визуализировали с использованием антитела против Flag M2, а полосу N-белка детектировали с использованием объединенной плазмы выздоравливающей при разведении 1: 500 и 10 нг / мл козьего антитела против человеческого IgG.
 конъюгирован с полимеризованной HRP (Fitzgerald, 61R-I166AHRP40).
конъюгирован с полимеризованной HRP (Fitzgerald, 61R-I166AHRP40).Экспрессия на клеточной поверхности и анализ белка S. Клетки HEK293T, конфлюэнтные примерно на 80% в 6-луночных планшетах, трансфицировали 8 мкл PEI 40000 (Polysciences) и 2 мкг плазмиды, экспрессирующей указанный вариант белка S.Для экспериментов по связыванию ACE2-NN-Ig белок S конструируется с тегом Flag только на С-конце, а для измерения общего S1 — с N-концевым тегом Myc (EQKLISEEDL) и C-концевым тегом Flag (DYKDDDDK). ) используются. Все метки слиты с линкером из двух глицинов (GG). Для измерения способности связывания ACE2 или уровня S1 домена, присутствующего на поверхности клетки, клетки отделяли через два дня после трансфекции Accutase (Stemcell Technologies Inc.) и инкубировали либо с 1 мкг / мл очищенного hACE2-NN-Ig, либо с антигеном. -Myc-антитело (клон 9E10, Национальный центр культуры клеток, Миннеаполис, Миннесота), соответственно, на льду.hACE2-NN-Ig был ранее описан и очищен с использованием протеина A-сефарозы CL-4B (GE Healthcare) 31 .
 Для измерения общего уровня S-белка клетки пермеабилизировали PBS, включая 0,5% Triton X-100 (Sigma-Aldrich), при комнатной температуре в течение 10 минут и инкубировали с 1 мкг / мл антитела против Flag M2 (Sigma-Aldrich).
Для измерения общего уровня S-белка клетки пермеабилизировали PBS, включая 0,5% Triton X-100 (Sigma-Aldrich), при комнатной температуре в течение 10 минут и инкубировали с 1 мкг / мл антитела против Flag M2 (Sigma-Aldrich).Анализ нейтрализации иммунной плазмой человека. Деидентифицированные образцы крови были получены специалистами по аллергии, астме и иммунологии из Южной Флориды для серотипирования COVID-19 и освобождены от исследований на людях в соответствии с 45 CFR 45.101 (б) (4). MLV PV, кодирующие люциферазу светлячка и псевдотипированные указанным белком SARS-CoV-2 S, предварительно инкубировали в течение 1 ч при 37 ° C с или без выздоравливающей или здоровой плазмы, серийно разбавленной в DMEM, содержащей 10% FBS. Клетки mock- и hACE2-HEK293T на 96-луночных планшетах инфицировали смесями для предварительной инкубации, и уровни инфекции оценивали через 24 часа путем измерения активности люциферазы с использованием набора для анализа Luc-Pair Firefly Luciferase HS (GeneCopoeia).

Наличие реагента. Плазмиды и клеточные линии, использованные в этом исследовании, можно получить у соответствующего автора по запросу.
Статистический анализ . Все соответствующие данные анализировали с помощью GraphPad Prism 7 (GraphPad Software Inc.). Все проверки гипотез проводились как двусторонние тесты. Конкретные методы статистического анализа описаны в подписях к рисункам, где представлены результаты. Значения считались статистически значимыми для значений p ниже 0,05. Точные значения p приведены на соответствующих рисунках.
Молекула глицина —
Символ: Gly G
Молекулярный вес: 75,07
Изоэлектрическая точка (pH) 6,06
Молекулярная формула: C 2 H 5 NO 2Общие
Глицин — неполярная аминокислота. Это простейшая из 20 природных аминокислот; его боковая цепь представляет собой атом водорода.
 Поскольку у ± углерода есть второй атом водорода, глицин не является оптически активным.
Поскольку у ± углерода есть второй атом водорода, глицин не является оптически активным.Поскольку глицин имеет такую маленькую боковую цепь, он может поместиться во многих местах, где никакая другая аминокислота не может.Например, только глицин может быть внутренней аминокислотой спирали коллагена.
Глицин очень эволюционно стабилен в определенных положениях некоторых белков (например, в цитохроме с, миоглобине и гемоглобине), потому что мутации, которые превращают его в аминокислоту с большей боковой цепью, могут нарушить структуру белка.
Большинство белков содержат лишь небольшое количество глицина. Заметным исключением является коллаген, который составляет около одной трети глицина.
В 1994 году группа астрономов из Университета Иллинойса во главе с Льюисом Снайдером заявила, что они обнаружили молекулы глицина в космосе. Оказалось, что нет. Но восемь лет спустя, в 2002 году, Льюис Снайдер и Йи-Дженг Куан из Национального Тайваньского педагогического университета повторили открытие, на этот раз по-настоящему.
 Доказательства существования молекул глицина в межзвездном пространстве были обнаружены, когда с помощью радиотелескопа были идентифицированы 10 спектральных линий глицина.
Доказательства существования молекул глицина в межзвездном пространстве были обнаружены, когда с помощью радиотелескопа были идентифицированы 10 спектральных линий глицина.Согласно компьютерному моделированию и лабораторным экспериментам, глицин, вероятно, образовался при воздействии ультрафиолетового света на лед, содержащий простые органические молекулы.
До появления глицина в глубоком космосе было найдено более 130 более простых молекул, включая сахара и этанол. Но аминокислоты, которые иногда называют строительными блоками жизни, представляют собой гораздо более интересную находку.
Это не доказывает, что жизнь существует за пределами Земли, но, безусловно, делает эту возможность более вероятной, доказывая, что аминокислоты существуют в космическом пространстве. Это также косвенно поддерживает идею панспермии, согласно которой жизнь была принесена на Землю из космоса.
Физиологическая функция
Глицин является тормозным нейромедиатором в центральной нервной системе, особенно в спинном мозге.
 Когда рецепторы глицина активируются, ионы хлора попадают в нейрон, и клетка подвергается гиперполяризации. Таким образом, клетка имеет тенденцию находиться в заблокированном состоянии. Стрихнин, препарат, вызывающий судороги, блокирует эти рецепторы глицина.
Когда рецепторы глицина активируются, ионы хлора попадают в нейрон, и клетка подвергается гиперполяризации. Таким образом, клетка имеет тенденцию находиться в заблокированном состоянии. Стрихнин, препарат, вызывающий судороги, блокирует эти рецепторы глицина.Color h — PyMOLWiki
Этот скрипт окрашивает переданный выбор на основе шкалы гидрофобности, как определено:
# color_h # ------- # Команда PyMOL для окрашивания белковых молекул в соответствии со шкалой гидрофобности Айзенберга # # Источник: http: // us.expasy.org/tools/pscale/Hphob.Eisenberg.html # Шкала аминокислот: нормализованная консенсусная шкала гидрофобности. # Автор (ы): Айзенберг Д., Шварц Э., Комарони М., Уолл Р. № Ссылка: J. Mol. Биол. 179: 125–142 (1984). # # Значения шкалы аминокислот: # # Ala: 0,620 # Arg: -2,530 # Asn: -0,780 # Asp: -0.900 # Cys: 0,290 # Gln: -0,850 # Glu: -0,740 # Gly: 0,480 # Его: -0,400 # Ile: 1.380 # Leu: 1.060 # Lys: -1,500 # Мет: 0,640 # Phe: 1.190 # Pro: 0,120 # Ser: -0.
 180
# Thr: -0.050
# Trp: 0,810
# Тир: 0.260
# Val: 1.080
#
# Применение:
# color_h (выделение)
#
из pymol import cmd def color_h (selection = 'all'):
s = str (выбор)
печать (и)
cmd.set_color ('color_ile', [0.996,0.062,0.062])
cmd.set_color ('color_phe', [0.996,0.109,0.109])
cmd.set_color ('color_val', [0.992,0.156,0.156])
cmd.set_color ('color_leu', [0.992,0.207,0.207])
cmd.set_color ('color_trp', [0.992,0.254,0.254])
cmd.set_color ('color_met', [0.988,0.301,0.301])
cmd.set_color ('color_ala', [0.988,0,348,0,348])
cmd.set_color ('color_gly', [0,984,0,394,0,394])
cmd.set_color ('color_cys', [0.984,0.445,0.445])
cmd.set_color ('color_tyr', [0.984,0.492,0.492])
cmd.set_color ('color_pro', [0.980,0.539,0.539])
cmd.set_color ('color_thr', [0.980,0.586,0.586])
cmd.set_color ('color_ser', [0.980,0.637,0.637])
cmd.set_color ('color_his', [0.977,0.684,0.684])
cmd.set_color ('color_glu', [0.977,0.730,0.730])
cmd.set_color ('color_asn', [0,973,0.777,0.777])
cmd.set_color ('color_gln', [0.973,0.824,0.824])
cmd.set_color ('color_asp', [0,973,0,875,0,875])
cmd.set_color ('color_lys', [0.899,0.922,0.922])
cmd.set_color ('цвет_арг', [0.899,0.969,0.969])
cmd.color ("color_ile", "(" + s + "и resn ile)")
cmd.color ("color_phe", "(" + s + "и resn phe)")
cmd.color ("color_val", "(" + s + "и resn val)")
cmd.color ("color_leu", "(" + s + "и resn leu)")
cmd.color ("color_trp", "(" + s + "и resn trp)")
cmd.color ("color_met", "(" + s + "и resn встретились)")
cmd.color ("color_ala", "(" + s + "и resn ala)")
cmd.color ("color_gly", "(" + s + "и resn gly)")
cmd.color ("color_cys", "(" + s + "и resn cys)")
cmd.color ("color_tyr", "(" + s + "и resn tyr)")
cmd.color ("color_pro", "(" + s + "и resn pro)")
cmd.color ("color_thr", "(" + s + "и resn thr)")
cmd.color ("color_ser", "(" + s + "и resn ser)")
cmd.color ("color_his", "(" + s + "и повторно его)")
cmd.color ("color_glu", "(" + s + "и resn glu)")
cmd.color ("color_asn", "(" + s + "и resn asn)")
cmd.color ("color_gln", "(" + s + "и resn gln)")
cmd.color ("color_asp", "(" + s + "и resn asp)")
cmd.color ("color_lys", "(" + s + "и resn lys)")
cmd.color ("color_arg", "(" + s + "и resn arg)")
cmd.extend ('цвет_h', цвет_h) def color_h3 (selection = 'all'):
s = str (выбор)
печать (и)
cmd.set_color ("color_ile2", [0.938,1,0.938])
cmd.set_color ("color_phe2", [0.891,1,0.891])
cmd.set_color ("color_val2", [0.844,1,0,844])
cmd.set_color ("color_leu2", [0.793,1,0.793])
cmd.set_color ("color_trp2", [0.746,1,0.746])
cmd.set_color ("color_met2", [0,699,1,0,699])
cmd.set_color ("color_ala2", [0,652,1,0,652])
cmd.set_color ("color_gly2", [0.606,1,0.606])
cmd.set_color ("color_cys2", [0.555,1,0.555])
cmd.set_color ("color_tyr2", [0,508,1,0,508])
cmd.set_color ("color_pro2", [0.461,1,0.461])
cmd.set_color ("color_thr2", [0.414,1,0.414])
cmd.set_color ("color_ser2", [0.363,1,0,363])
cmd.set_color ("color_his2", [0.316,1,0.316])
cmd.set_color ("color_glu2", [0.27,1,0.27])
cmd.set_color ("color_asn2", [0.223,1,0.223])
cmd.set_color ("цвет_gln2", [0,176,1,0.176])
cmd.set_color ("color_asp2", [0,125,1,0,125])
cmd.set_color ("color_lys2", [0,078,1,0.078])
cmd.set_color ("цвет_арг2", [0,031,1,0.031])
cmd.color ("color_ile2", "(" + s + "и resn ile)")
cmd.color ("color_phe2", "(" + s + "и resn phe)")
cmd.color ("color_val2", "(" + s + "и resn val)")
cmd.цвет ("color_leu2", "(" + s + "и resn leu)")
cmd.color ("color_trp2", "(" + s + "и resn trp)")
cmd.color ("color_met2", "(" + s + "и resn встретились)")
cmd.color ("color_ala2", "(" + s + "и resn ala)")
cmd.
180
# Thr: -0.050
# Trp: 0,810
# Тир: 0.260
# Val: 1.080
#
# Применение:
# color_h (выделение)
#
из pymol import cmd def color_h (selection = 'all'):
s = str (выбор)
печать (и)
cmd.set_color ('color_ile', [0.996,0.062,0.062])
cmd.set_color ('color_phe', [0.996,0.109,0.109])
cmd.set_color ('color_val', [0.992,0.156,0.156])
cmd.set_color ('color_leu', [0.992,0.207,0.207])
cmd.set_color ('color_trp', [0.992,0.254,0.254])
cmd.set_color ('color_met', [0.988,0.301,0.301])
cmd.set_color ('color_ala', [0.988,0,348,0,348])
cmd.set_color ('color_gly', [0,984,0,394,0,394])
cmd.set_color ('color_cys', [0.984,0.445,0.445])
cmd.set_color ('color_tyr', [0.984,0.492,0.492])
cmd.set_color ('color_pro', [0.980,0.539,0.539])
cmd.set_color ('color_thr', [0.980,0.586,0.586])
cmd.set_color ('color_ser', [0.980,0.637,0.637])
cmd.set_color ('color_his', [0.977,0.684,0.684])
cmd.set_color ('color_glu', [0.977,0.730,0.730])
cmd.set_color ('color_asn', [0,973,0.777,0.777])
cmd.set_color ('color_gln', [0.973,0.824,0.824])
cmd.set_color ('color_asp', [0,973,0,875,0,875])
cmd.set_color ('color_lys', [0.899,0.922,0.922])
cmd.set_color ('цвет_арг', [0.899,0.969,0.969])
cmd.color ("color_ile", "(" + s + "и resn ile)")
cmd.color ("color_phe", "(" + s + "и resn phe)")
cmd.color ("color_val", "(" + s + "и resn val)")
cmd.color ("color_leu", "(" + s + "и resn leu)")
cmd.color ("color_trp", "(" + s + "и resn trp)")
cmd.color ("color_met", "(" + s + "и resn встретились)")
cmd.color ("color_ala", "(" + s + "и resn ala)")
cmd.color ("color_gly", "(" + s + "и resn gly)")
cmd.color ("color_cys", "(" + s + "и resn cys)")
cmd.color ("color_tyr", "(" + s + "и resn tyr)")
cmd.color ("color_pro", "(" + s + "и resn pro)")
cmd.color ("color_thr", "(" + s + "и resn thr)")
cmd.color ("color_ser", "(" + s + "и resn ser)")
cmd.color ("color_his", "(" + s + "и повторно его)")
cmd.color ("color_glu", "(" + s + "и resn glu)")
cmd.color ("color_asn", "(" + s + "и resn asn)")
cmd.color ("color_gln", "(" + s + "и resn gln)")
cmd.color ("color_asp", "(" + s + "и resn asp)")
cmd.color ("color_lys", "(" + s + "и resn lys)")
cmd.color ("color_arg", "(" + s + "и resn arg)")
cmd.extend ('цвет_h', цвет_h) def color_h3 (selection = 'all'):
s = str (выбор)
печать (и)
cmd.set_color ("color_ile2", [0.938,1,0.938])
cmd.set_color ("color_phe2", [0.891,1,0.891])
cmd.set_color ("color_val2", [0.844,1,0,844])
cmd.set_color ("color_leu2", [0.793,1,0.793])
cmd.set_color ("color_trp2", [0.746,1,0.746])
cmd.set_color ("color_met2", [0,699,1,0,699])
cmd.set_color ("color_ala2", [0,652,1,0,652])
cmd.set_color ("color_gly2", [0.606,1,0.606])
cmd.set_color ("color_cys2", [0.555,1,0.555])
cmd.set_color ("color_tyr2", [0,508,1,0,508])
cmd.set_color ("color_pro2", [0.461,1,0.461])
cmd.set_color ("color_thr2", [0.414,1,0.414])
cmd.set_color ("color_ser2", [0.363,1,0,363])
cmd.set_color ("color_his2", [0.316,1,0.316])
cmd.set_color ("color_glu2", [0.27,1,0.27])
cmd.set_color ("color_asn2", [0.223,1,0.223])
cmd.set_color ("цвет_gln2", [0,176,1,0.176])
cmd.set_color ("color_asp2", [0,125,1,0,125])
cmd.set_color ("color_lys2", [0,078,1,0.078])
cmd.set_color ("цвет_арг2", [0,031,1,0.031])
cmd.color ("color_ile2", "(" + s + "и resn ile)")
cmd.color ("color_phe2", "(" + s + "и resn phe)")
cmd.color ("color_val2", "(" + s + "и resn val)")
cmd.цвет ("color_leu2", "(" + s + "и resn leu)")
cmd.color ("color_trp2", "(" + s + "и resn trp)")
cmd.color ("color_met2", "(" + s + "и resn встретились)")
cmd.color ("color_ala2", "(" + s + "и resn ala)")
cmd.
- ↑ Horsford, E.N. (1847). «Гликоколл (желатиновый сахар) и некоторые продукты его разложения». Американский журнал науки и искусства .2-я серия 3 : 369–381. https://babel.hathitrust.org/cgi/pt?id=hvd.32044102
Глицин разлагается тремя путями.
 Преобладающий путь у животных и растений — обратный пути глицинсинтазы, упомянутому выше. В этом контексте задействованная ферментная система обычно называется системой расщепления глицина: [26]
Преобладающий путь у животных и растений — обратный пути глицинсинтазы, упомянутому выше. В этом контексте задействованная ферментная система обычно называется системой расщепления глицина: [26] На третьем пути деградации глицин превращается в глиоксилат оксидазой D-аминокислот. Затем глиоксилат окисляется лактатдегидрогеназой печени до оксалата в реакции, зависимой от NAD + . [26]
Период полувыведения глицина и его выведение из организма значительно варьируется в зависимости от дозы. [27] В одном исследовании период полувыведения варьировал от 0,5 до 4,0 часов.
 [27]
[27] Глицин чрезвычайно чувствителен к антибиотикам, нацеленным на фолиевую кислоту, и уровень глицина в крови резко падает в течение минуты после инъекции антибиотика. Некоторые антибиотики могут истощить более 90% глицина в течение нескольких минут после приема. [28]
Физиологическая функция
Основная функция глицина — это предшественник белков. Большинство белков содержат лишь небольшие количества глицина, заметным исключением является коллаген, который содержит около 35% глицина из-за его периодически повторяющейся роли в формировании спиральной структуры коллагена в сочетании с гидроксипролином. [26] [29] В генетическом коде глицин кодируется всеми кодонами, начинающимися с GG, а именно GGU, GGC, GGA и GGG.
В качестве промежуточного продукта биосинтеза
У высших эукариот δ-аминолевулиновая кислота, ключевой предшественник порфиринов, биосинтезируется из глицина и сукцинил-КоА ферментом АЛК-синтазой.
 Глицин обеспечивает центральную субъединицу C 2 N всех пуринов. [26]
Глицин обеспечивает центральную субъединицу C 2 N всех пуринов. [26] Как нейромедиатор
Глицин — тормозящий нейротрансмиттер в центральной нервной системе, особенно в спинном мозге, стволе мозга и сетчатке.Когда рецепторы глицина активируются, хлорид проникает в нейрон через ионотропные рецепторы, вызывая тормозящий постсинаптический потенциал (IPSP). Стрихнин является сильным антагонистом ионотропных рецепторов глицина, а бикукуллин — слабым. Глицин является необходимым коагонистом вместе с глутаматом для рецепторов NMDA. В отличие от ингибирующей роли глицина в спинном мозге, этому поведению способствуют (NMDA) глутаматергические рецепторы, которые являются возбуждающими. [30] LD 50 глицина составляет 7930 мг / кг у крыс (перорально), [31] и обычно вызывает смерть от гипервозбудимости.
использует
В США глицин обычно продается двух сортов: Фармакопея США (USP) и технический. Продажи класса USP составляют примерно от 80 до 85 процентов рынка глицина в США.
 Если требуется чистота выше, чем стандарт USP, например, для внутривенных инъекций, можно использовать более дорогой глицин фармацевтического качества. Глицин технической чистоты, который может соответствовать или не соответствовать стандартам качества USP, продается по более низкой цене для использования в промышленных приложениях, например.г., как средство комплексообразования и отделки металлов. [32]
Если требуется чистота выше, чем стандарт USP, например, для внутривенных инъекций, можно использовать более дорогой глицин фармацевтического качества. Глицин технической чистоты, который может соответствовать или не соответствовать стандартам качества USP, продается по более низкой цене для использования в промышленных приложениях, например.г., как средство комплексообразования и отделки металлов. [32] Продукты животного и человеческого происхождения
Структура цис -Cu (глицинат) 2 (H 2 O). [33]Глицин не широко используется в пищевых продуктах из-за его пищевой ценности, за исключением настоев. Вместо этого глицин играет роль ароматизатора в пищевой химии. Он умеренно сладкий и нейтрализует послевкусие сахарина. Он также обладает консервирующими свойствами, возможно, из-за его комплексообразования с ионами металлов.Глицинатные комплексы металлов, например Глицинат меди (II) используется в качестве добавок к корму для животных.
 [21]
[21] Сырье химическое
Глицин является промежуточным продуктом при синтезе различных химических продуктов. Он используется в производстве гербицидов глифосата, [34] ипродиона, глифозина, имипротрина и эглиназина. [21] Он используется в качестве промежуточного звена в лекарствах, таких как тиамфеникол. [ требуется ссылка ]
Лабораторные исследования
Глицин является важным компонентом некоторых растворов, используемых в методе анализа белков SDS-PAGE.Он служит буферным агентом, поддерживая pH и предотвращая повреждение образца во время электрофореза. Глицин также используется для удаления антител, меченных белками, с мембран вестерн-блоттинга, что позволяет исследовать многочисленные представляющие интерес белки из геля SDS-PAGE. Это позволяет получить больше данных из одного и того же образца, увеличивая надежность данных, уменьшая объем обработки образца и количество необходимых образцов.
 Этот процесс известен как зачистка.
Этот процесс известен как зачистка.Присутствие в космосе
Присутствие глицина вне Земли было подтверждено в 2009 году на основе анализа проб, взятых в 2004 году космическим кораблем НАСА Stardust с кометы Wild 2 и впоследствии возвращенных на Землю.Глицин ранее был обнаружен в метеорите Мерчисон в 1970 году. [35] Открытие кометного глицина поддержало теорию панспермии, которая утверждает, что «строительные блоки» жизни широко распространены во Вселенной. [36] В 2016 году было объявлено об обнаружении глицина в комете 67P / Чурюмова-Герасименко космическим кораблем Rosetta. [37]
Обнаружение глицина за пределами Солнечной системы в межзвездной среде было предметом споров. [38] В 2008 году Радиоастрономический институт Макса Планка обнаружил спектральные линии глициноподобной молекулы аминоацетонитрила в Большой молекуле Хеймат, гигантском газовом облаке недалеко от центра Галактики в созвездии Стрельца. [39]
Наличие в продуктах
Пищевые источники глицина [40] Еда г / 100г Снеки, шкуры свиные 11,04 Мука из семян кунжута (с низким содержанием жира) 3.  43 год
43 годНапитки, протеиновый порошок (на основе сои) 2,37 Семена, шрот сафлоровый, частично обезжиренный 2,22 Мясо, бизон, говядина и другие (разные части) 1,5–2,0 Десерты из желатина 1,96 Семена, ядра тыквы и кабачков 1,82 Индейка всех сортов, спина, мясо и кожа 1.79 Цыпленок, бройлеры или фритюрницы, мясо и кожа 1,74 Свинина, фарш, 96% постного мяса / 4% жира, вареная, в крошке 1,71 Бекон и говяжьи палочки 1,64 Арахис 1,63 Ракообразные, омары колючие 1,59 Специи, семена горчицы, молотые 1,59 Салями 1.55 Орехи, орехи сушеные 1,51 Рыба, лосось, горбуша, консервы, сушеные твердые вещества 1,42 Миндаль 1,42 Рыба, скумбрия 0,93 Злаки готовые к употреблению, мюсли домашние 0,81 Лук-порей (луковица и нижняя часть листа), лиофилизированный 0,7 Сыр, пармезан (и др.  ) Тертый
) Тертый0.56 Соевые бобы зеленые, вареные, вареные, сушеные, без соли 0,51 Хлеб белковый (включая глютен) 0,47 Яйцо, целое, вареное, жареное 0,47 Фасоль белая, зрелые семена, вареные, вареные, с солью 0,38 Чечевица, зрелые семена, вареные, вареные, с солью 0,37 См. Также
Список литературы

 123.
123. A Laboratory Manual. Ralph L. Shriner Professor of Organic Chemistry The State University of Iowa, Reynold C. Fuson Professor of Organic Chemistry The University of Illinois. Third Edition. 1948. New York / Перевод с английского М. Е. Манденова. Под редакцией М. С. Рождественского и Г. И. Чернова. — М.: Издательство иностранной литературы, 1950. — 374 с. Архивная копия от 6 марта 2016 на Wayback Machine
A Laboratory Manual. Ralph L. Shriner Professor of Organic Chemistry The State University of Iowa, Reynold C. Fuson Professor of Organic Chemistry The University of Illinois. Third Edition. 1948. New York / Перевод с английского М. Е. Манденова. Под редакцией М. С. Рождественского и Г. И. Чернова. — М.: Издательство иностранной литературы, 1950. — 374 с. Архивная копия от 6 марта 2016 на Wayback Machine Таблетки следует разжевать.
Таблетки следует разжевать.
 Филлипс и компания.
Филлипс и компания.
 Преобладающий путь у животных и растений — обратный пути глицинсинтазы, упомянутому выше. В этом контексте задействованная ферментная система обычно называется системой расщепления глицина: [26]
Преобладающий путь у животных и растений — обратный пути глицинсинтазы, упомянутому выше. В этом контексте задействованная ферментная система обычно называется системой расщепления глицина: [26]  [27]
[27]  Глицин обеспечивает центральную субъединицу C 2 N всех пуринов. [26]
Глицин обеспечивает центральную субъединицу C 2 N всех пуринов. [26]  Если требуется чистота выше, чем стандарт USP, например, для внутривенных инъекций, можно использовать более дорогой глицин фармацевтического качества. Глицин технической чистоты, который может соответствовать или не соответствовать стандартам качества USP, продается по более низкой цене для использования в промышленных приложениях, например.г., как средство комплексообразования и отделки металлов. [32]
Если требуется чистота выше, чем стандарт USP, например, для внутривенных инъекций, можно использовать более дорогой глицин фармацевтического качества. Глицин технической чистоты, который может соответствовать или не соответствовать стандартам качества USP, продается по более низкой цене для использования в промышленных приложениях, например.г., как средство комплексообразования и отделки металлов. [32]  [21]
[21]  Этот процесс известен как зачистка.
Этот процесс известен как зачистка. 43 год
43 год ) Тертый
) Тертый Совместная комиссия IUPAC-IUB по биохимической номенклатуре.1983. http://www.chem.qmul.ac.uk/iupac/AminoAcid/AA1n2.html.
Совместная комиссия IUPAC-IUB по биохимической номенклатуре.1983. http://www.chem.qmul.ac.uk/iupac/AminoAcid/AA1n2.html. Сэр Р. Филлипс и компания. п. 557. https://archive.org/details/onethousandexpe01mackgoog.
Сэр Р. Филлипс и компания. п. 557. https://archive.org/details/onethousandexpe01mackgoog.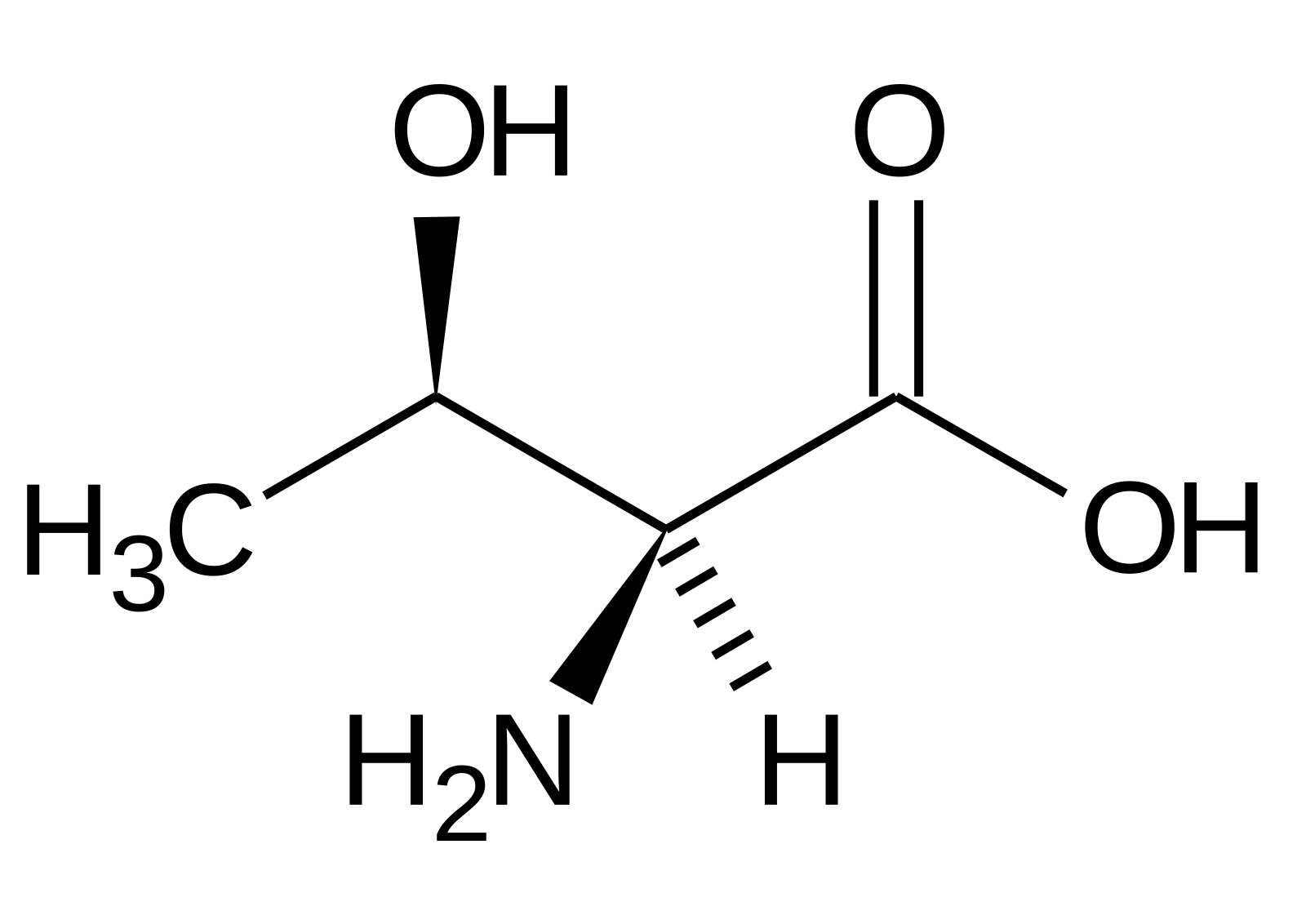 п. 654. https://books.google.com/?id=mDc4AQAAIAAJ&dq=%22glycin%22&pg=PA654#v=onepage. С п. 654: «Er hat dem Leimzucker als Basis den Namen Glycocoll gegeben.… Glycin genannt werden, und diesen Namen werde ich anwenden.» (Он [то есть, американский ученый Эбен Нортон Хорсфорд, в то время ученик немецкого химика Юстуса фон Либиха] дал название «гликоколл» основанию Leimzucker [сахар из желатина].Это название не благозвучно и, помимо недостатка, противоречит названиям остальных баз. Он состоит из γλυχυς (сладкого) и χολλα (животного клея). Поскольку эта органическая основа — единственная [одна], имеющая сладкий вкус, то ее можно гораздо короче назвать «глицин», и я буду использовать это название.)
п. 654. https://books.google.com/?id=mDc4AQAAIAAJ&dq=%22glycin%22&pg=PA654#v=onepage. С п. 654: «Er hat dem Leimzucker als Basis den Namen Glycocoll gegeben.… Glycin genannt werden, und diesen Namen werde ich anwenden.» (Он [то есть, американский ученый Эбен Нортон Хорсфорд, в то время ученик немецкого химика Юстуса фон Либиха] дал название «гликоколл» основанию Leimzucker [сахар из желатина].Это название не благозвучно и, помимо недостатка, противоречит названиям остальных баз. Он состоит из γλυχυς (сладкого) и χολλα (животного клея). Поскольку эта органическая основа — единственная [одна], имеющая сладкий вкус, то ее можно гораздо короче назвать «глицин», и я буду использовать это название.)
 http://www.usitc.gov/trade_remedy/731_ad_701_cvd/investigations/2007/glycine_from_india_japan_korea/preterior/DOC/Glycine%20Conference%20%28prelim%29.wpd.
http://www.usitc.gov/trade_remedy/731_ad_701_cvd/investigations/2007/glycine_from_india_japan_korea/preterior/DOC/Glycine%20Conference%20%28prelim%29.wpd.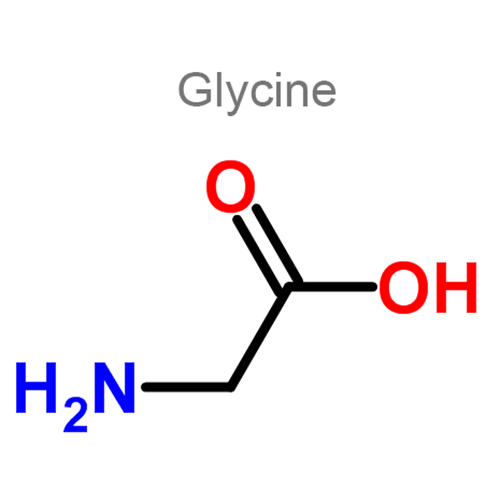 Л. (декабрь 2009 г.). «Слабое звено в метаболизме: метаболическая способность для биосинтеза глицина не удовлетворяет потребность в синтезе коллагена». Журнал биологических наук 34 (6): 853–72. DOI: 10.1007 / s12038-009-0100-9. PMID 20093739.
Л. (декабрь 2009 г.). «Слабое звено в метаболизме: метаболическая способность для биосинтеза глицина не удовлетворяет потребность в синтезе коллагена». Журнал биологических наук 34 (6): 853–72. DOI: 10.1007 / s12038-009-0100-9. PMID 20093739. DOI: 10.1016 / j.jas.2011.07.022. https://uwo.academia.edu/PaulSzpak/Papers/827788/Fish_Bone_Chemistry_and_Ultrastructure_Implications_for_Taphonomy_and_Stable_Isotope_Analysis.
DOI: 10.1016 / j.jas.2011.07.022. https://uwo.academia.edu/PaulSzpak/Papers/827788/Fish_Bone_Chemistry_and_Ultrastructure_Implications_for_Taphonomy_and_Stable_Isotope_Analysis. Жидкофазный аэробный окислительный катализ: промышленное применение и академические перспективы . Джон Вили и сыновья. ISBN 97835276
Жидкофазный аэробный окислительный катализ: промышленное применение и академические перспективы . Джон Вили и сыновья. ISBN 97835276 2005. DOI: 10.1086 / 426677. Бибкод: 2005ApJ … 619..914S.
2005. DOI: 10.1086 / 426677. Бибкод: 2005ApJ … 619..914S. , пентобарбитал, тиопентал натрия)
, пентобарбитал, тиопентал натрия) , 2-AG, анандамид (AEA))
, 2-AG, анандамид (AEA))
 wikipedia.org
wikipedia.org wikipedia.org
wikipedia.org Поэтому мы сравнили функциональные свойства белков S с аспарагиновой кислотой (S D614 ) и глицином (S G614 ) в остатке 614. Мы наблюдали, что ретровирусы, псевдотипированные S G614 , инфицировали клетки, экспрессирующие ACE2, заметно более эффективно, чем с S D614 .Эта большая инфекционность коррелировала с меньшим выделением S1 и большим включением S-белка в псевдовирион. Аналогичные результаты были получены с использованием вирусоподобных частиц, продуцируемых с помощью белков SARS-CoV-2 M, N, E и S. Однако S G614 не связывал ACE2 более эффективно, чем S D614 , и псевдовирусы, содержащие эти S-белки, нейтрализовались с сопоставимой эффективностью плазмой выздоравливающих. Эти результаты показывают, что S G614 более стабилен, чем S D614 , что согласуется с эпидемиологическими данными, предполагающими, что вирусы с S G614 передаются более эффективно.
Поэтому мы сравнили функциональные свойства белков S с аспарагиновой кислотой (S D614 ) и глицином (S G614 ) в остатке 614. Мы наблюдали, что ретровирусы, псевдотипированные S G614 , инфицировали клетки, экспрессирующие ACE2, заметно более эффективно, чем с S D614 .Эта большая инфекционность коррелировала с меньшим выделением S1 и большим включением S-белка в псевдовирион. Аналогичные результаты были получены с использованием вирусоподобных частиц, продуцируемых с помощью белков SARS-CoV-2 M, N, E и S. Однако S G614 не связывал ACE2 более эффективно, чем S D614 , и псевдовирусы, содержащие эти S-белки, нейтрализовались с сопоставимой эффективностью плазмой выздоравливающих. Эти результаты показывают, что S G614 более стабилен, чем S D614 , что согласуется с эпидемиологическими данными, предполагающими, что вирусы с S G614 передаются более эффективно. Седьмой, SARS-CoV-2, появился зимой 2019 года в Ухане, Китай. SARS-CoV-2 тесно связан с SARS-CoV-1, вирусом, который появился в провинции Гуандун, Китай в конце 2002 года.
Седьмой, SARS-CoV-2, появился зимой 2019 года в Ухане, Китай. SARS-CoV-2 тесно связан с SARS-CoV-1, вирусом, который появился в провинции Гуандун, Китай в конце 2002 года. Напротив, соединение S1 / S2 SARS-CoV-1 обрабатывается TMPRSS2 на поверхности клетки или лизосомными катепсинами в клетках-мишенях 13-18 . Оба S-белка далее процессируются в клетке-мишени в пределах домена S2 на сайте S2 ’, событие, которое также необходимо для продуктивного инфицирования 19,20 .
Напротив, соединение S1 / S2 SARS-CoV-1 обрабатывается TMPRSS2 на поверхности клетки или лизосомными катепсинами в клетках-мишенях 13-18 . Оба S-белка далее процессируются в клетке-мишени в пределах домена S2 на сайте S2 ’, событие, которое также необходимо для продуктивного инфицирования 19,20 . 1b), что указывает на преимущество в передаче вирусов с D614. Корбер и др. отметили, что это изменение также коррелировало с увеличением вирусной нагрузки у пациентов с COVID-19 22 , но поскольку это изменение также связано с мутациями в вирусных белках nsp3 и RdRp, роль S-белка в этих наблюдениях оставалась неопределенной.
1b), что указывает на преимущество в передаче вирусов с D614. Корбер и др. отметили, что это изменение также коррелировало с увеличением вирусной нагрузки у пациентов с COVID-19 22 , но поскольку это изменение также связано с мутациями в вирусных белках nsp3 и RdRp, роль S-белка в этих наблюдениях оставалась неопределенной. Клетки HEK293T, трансдуцированные для экспрессии человеческого ACE2 (hACE2-293T) или клетки, трансдуцированные одним вектором (Mock-293T), были инфицированы теми же числами частиц, что и PV, псевдотипированные S D614 , S G614 или S FKO. (PV D614 , PV G614 или PV FKO соответственно), а уровень заражения оценивался днем позже. Мы наблюдали инфицированные PV G614 клетки hACE2-293T с примерно в 9 раз большей эффективностью, чем PV D614 (рис.1в, г). Эта повышенная инфекционность PV G614 не является артефактом нормализации титра PV, поскольку их титры очень похожи (расширенные данные, рис. 1).
Клетки HEK293T, трансдуцированные для экспрессии человеческого ACE2 (hACE2-293T) или клетки, трансдуцированные одним вектором (Mock-293T), были инфицированы теми же числами частиц, что и PV, псевдотипированные S D614 , S G614 или S FKO. (PV D614 , PV G614 или PV FKO соответственно), а уровень заражения оценивался днем позже. Мы наблюдали инфицированные PV G614 клетки hACE2-293T с примерно в 9 раз большей эффективностью, чем PV D614 (рис.1в, г). Эта повышенная инфекционность PV G614 не является артефактом нормализации титра PV, поскольку их титры очень похожи (расширенные данные, рис. 1). Для этого мы использовали конструкции S-белков, несущие метки Flag как на амино (N), так и на С-концах.Псевдотипы этих форм S D614 , S G614 и S FKO с этими двумя метками Flag были частично очищены и сконцентрированы путем гранулирования через 20% слой сахарозы 32 и оценены на их инфекционность. Титры ПВ были одинаковыми для PV G614 , PV D614 и PV FKO до и после очистки (рис. 2а). Кроме того, модификация с помощью Flag-тегов или гранулирование PV через слой сахарозы не изменяет относительную инфекционность между PV G614 и PV D614 (рис.2б). Затем мы определили их соотношение S1: S2 вестерн-блоттингом с использованием антитела против Flag M2. Как показано на рис. 2c, соотношение S1: S2 заметно больше в PV G614 по сравнению с PV D614 , что указывает на то, что глицин в остатке 614 S G614 стабилизирует взаимодействие между доменами S1 и S2, ограничивая S1.
Для этого мы использовали конструкции S-белков, несущие метки Flag как на амино (N), так и на С-концах.Псевдотипы этих форм S D614 , S G614 и S FKO с этими двумя метками Flag были частично очищены и сконцентрированы путем гранулирования через 20% слой сахарозы 32 и оценены на их инфекционность. Титры ПВ были одинаковыми для PV G614 , PV D614 и PV FKO до и после очистки (рис. 2а). Кроме того, модификация с помощью Flag-тегов или гранулирование PV через слой сахарозы не изменяет относительную инфекционность между PV G614 и PV D614 (рис.2б). Затем мы определили их соотношение S1: S2 вестерн-блоттингом с использованием антитела против Flag M2. Как показано на рис. 2c, соотношение S1: S2 заметно больше в PV G614 по сравнению с PV D614 , что указывает на то, что глицин в остатке 614 S G614 стабилизирует взаимодействие между доменами S1 и S2, ограничивая S1. линька. Кроме того, общее количество белка S в PV G614 также намного выше, чем в PV D614 , на что указывает более плотная полоса S2, даже несмотря на то, что было проанализировано такое же количество псевдовирионов, как определено количественной ПЦР. .Чтобы независимо подтвердить, что было проанализировано аналогичное количество вирионов, нижнюю часть той же мембраны подвергали блоттингу gag-антителом против p30 MLV (фиг. 2c). Сходные плотности полос p30 наблюдались для всех PV, что указывает на то, что различия во включении S-белка, наблюдаемые для PV G614 и PV D614 , были вызваны мутацией остатка 614, а не разным количеством проанализированных PV. Аналогичный эксперимент, проведенный с независимо произведенными ПВ, дал почти идентичный результат (расширенные данные, рис.2а). Денситометрический анализ показывает, что полоса S1 + S2 в PV G614 в 4,7 раза больше по сравнению с PV D614 (рис. 2d). Чтобы более точно оценить соотношение S1: S2, мы затем сравнили разное количество одних и тех же образцов, чтобы интенсивность полосы S2 в PV G614 и PV D614 была сопоставимой (рис.
линька. Кроме того, общее количество белка S в PV G614 также намного выше, чем в PV D614 , на что указывает более плотная полоса S2, даже несмотря на то, что было проанализировано такое же количество псевдовирионов, как определено количественной ПЦР. .Чтобы независимо подтвердить, что было проанализировано аналогичное количество вирионов, нижнюю часть той же мембраны подвергали блоттингу gag-антителом против p30 MLV (фиг. 2c). Сходные плотности полос p30 наблюдались для всех PV, что указывает на то, что различия во включении S-белка, наблюдаемые для PV G614 и PV D614 , были вызваны мутацией остатка 614, а не разным количеством проанализированных PV. Аналогичный эксперимент, проведенный с независимо произведенными ПВ, дал почти идентичный результат (расширенные данные, рис.2а). Денситометрический анализ показывает, что полоса S1 + S2 в PV G614 в 4,7 раза больше по сравнению с PV D614 (рис. 2d). Чтобы более точно оценить соотношение S1: S2, мы затем сравнили разное количество одних и тех же образцов, чтобы интенсивность полосы S2 в PV G614 и PV D614 была сопоставимой (рис. 2e). Средние значения нескольких количественных оценок показывают, что соотношение S1: S2 PV G614 в 3,5 раза выше, чем у PV D614 (рис. 2f). Антитело M2, используемое в этом эксперименте, связывает метку Flag, расположенную как на N-, так и на С-концах белка, но оно связывает N-концевую метку Flag более эффективно 33 .Поэтому мы непосредственно визуализировали полосы S-белка вириона путем окрашивания серебром (расширенные данные, рис. 2b). Хотя полосы S2 маскируются белком MLV того же размера, полосы S1 хорошо разделены. Опять же, интенсивность полосы S1 PV G614 намного выше, чем у PV D614 , в то время как полосы p30 сопоставимы, что соответствует результатам, наблюдаемым с использованием антитела против Flag M2.
2e). Средние значения нескольких количественных оценок показывают, что соотношение S1: S2 PV G614 в 3,5 раза выше, чем у PV D614 (рис. 2f). Антитело M2, используемое в этом эксперименте, связывает метку Flag, расположенную как на N-, так и на С-концах белка, но оно связывает N-концевую метку Flag более эффективно 33 .Поэтому мы непосредственно визуализировали полосы S-белка вириона путем окрашивания серебром (расширенные данные, рис. 2b). Хотя полосы S2 маскируются белком MLV того же размера, полосы S1 хорошо разделены. Опять же, интенсивность полосы S1 PV G614 намного выше, чем у PV D614 , в то время как полосы p30 сопоставимы, что соответствует результатам, наблюдаемым с использованием антитела против Flag M2. VLP были частично очищены и проанализированы таким же образом, как и PV MLV. Полосы белка S были обнаружены с помощью антитела против Flag M2, а белок N — с объединенной плазмой выздоравливающей, полученной от пациентов с COVID-19. Отношение S1: S2 и общий белок S на вирионе снова были намного выше у VLP, несущих S G614 (VLP G614 ), по сравнению с VLP, несущих S D614 (VLP D614 ) (рис. 3a). Отношение S1: S2 в 3,4 раза выше, а общий белок S почти в пять раз обогащен VLP G614 по сравнению с VLP D614 (рис.3б, в). Таким образом, мутация D614G усиливает вирусную инфекцию за счет двух связанных механизмов: она снижает выделение S1 и увеличивает общий S-белок, включенный в вирион.
VLP были частично очищены и проанализированы таким же образом, как и PV MLV. Полосы белка S были обнаружены с помощью антитела против Flag M2, а белок N — с объединенной плазмой выздоравливающей, полученной от пациентов с COVID-19. Отношение S1: S2 и общий белок S на вирионе снова были намного выше у VLP, несущих S G614 (VLP G614 ), по сравнению с VLP, несущих S D614 (VLP D614 ) (рис. 3a). Отношение S1: S2 в 3,4 раза выше, а общий белок S почти в пять раз обогащен VLP G614 по сравнению с VLP D614 (рис.3б, в). Таким образом, мутация D614G усиливает вирусную инфекцию за счет двух связанных механизмов: она снижает выделение S1 и увеличивает общий S-белок, включенный в вирион.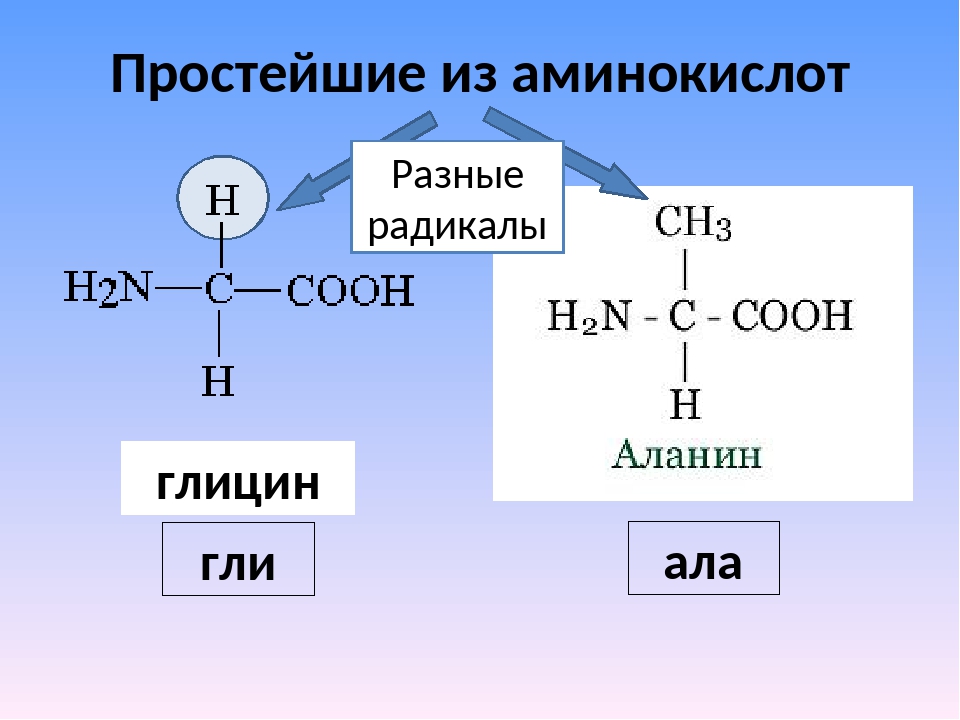 Клетки HEK293T, трансфицированные для экспрессии каждого S-белка, оценивали на их связывание с иммуноадгезином hACE2 с использованием hACE2-NN-Ig, ферментативная активность которого отменяется мутацией 31 .hACE2-NN-Ig связал SARS-CoV-1 RBD с эквивалентной аффинностью, как hACE2-Ig. Эти S-белки сливаются с C-концевой, но не с N-концевой меткой Flag, что позволяет измерять общую экспрессию S-белка в проницаемых клетках с помощью проточной цитометрии. Хотя общая экспрессия белка S была сопоставимой, связывание hACE2-NN-Ig с клетками, экспрессирующими S G614 , было значительно выше, чем его связывание с клетками, экспрессирующими S D614 (фиг. 4a). Этому наблюдению есть несколько объяснений.Во-первых, G614 может увеличивать ассоциацию hACE2, способствуя большему воздействию RBD, или, во-вторых, эта мутация может увеличивать количество сайтов связывания, ограничивая шеддинг S1-домена. Чтобы различить эти возможности, мы добавили Myc-tag к N-концу S-белка, который помечен Flag на его C-конце, и повторили исследование, на этот раз обнаружив домен S1 с помощью антитела против Myc.
Клетки HEK293T, трансфицированные для экспрессии каждого S-белка, оценивали на их связывание с иммуноадгезином hACE2 с использованием hACE2-NN-Ig, ферментативная активность которого отменяется мутацией 31 .hACE2-NN-Ig связал SARS-CoV-1 RBD с эквивалентной аффинностью, как hACE2-Ig. Эти S-белки сливаются с C-концевой, но не с N-концевой меткой Flag, что позволяет измерять общую экспрессию S-белка в проницаемых клетках с помощью проточной цитометрии. Хотя общая экспрессия белка S была сопоставимой, связывание hACE2-NN-Ig с клетками, экспрессирующими S G614 , было значительно выше, чем его связывание с клетками, экспрессирующими S D614 (фиг. 4a). Этому наблюдению есть несколько объяснений.Во-первых, G614 может увеличивать ассоциацию hACE2, способствуя большему воздействию RBD, или, во-вторых, эта мутация может увеличивать количество сайтов связывания, ограничивая шеддинг S1-домена. Чтобы различить эти возможности, мы добавили Myc-tag к N-концу S-белка, который помечен Flag на его C-конце, и повторили исследование, на этот раз обнаружив домен S1 с помощью антитела против Myc. Как показано на фиг. 4b, отношение Myc-tag к Flag-tag выше в клетках, экспрессирующих S G614 , чем в клетках, экспрессирующих S D614 .Однако соотношение Myc-tag / Flag-tag аналогично соотношению hACE2-NN-Ig / Flag-tag, что указывает на то, что повышенное связывание hACE2 с клетками, экспрессирующими S G614 , не является результатом повышения аффинности S G614. шипов к hACE2 или большему доступу к RBD. Вместо этого эти данные показывают, что в клетках, экспрессирующих S G614 , больше домена S1, что снова согласуется с наблюдением, что мутация D614G снижает шеддинг S1. Затем мы оценили, может ли различное количество S-белка влиять на чувствительность вируса к нейтрализации.Рис. 4c показывает, что PV D614 и PV G614 одинаково чувствительны к нейтрализующим антисывороткам, что указывает на то, что опосредованный антителами контроль вирусов, несущих S D614 и S G614 , будет аналогичным.
Как показано на фиг. 4b, отношение Myc-tag к Flag-tag выше в клетках, экспрессирующих S G614 , чем в клетках, экспрессирующих S D614 .Однако соотношение Myc-tag / Flag-tag аналогично соотношению hACE2-NN-Ig / Flag-tag, что указывает на то, что повышенное связывание hACE2 с клетками, экспрессирующими S G614 , не является результатом повышения аффинности S G614. шипов к hACE2 или большему доступу к RBD. Вместо этого эти данные показывают, что в клетках, экспрессирующих S G614 , больше домена S1, что снова согласуется с наблюдением, что мутация D614G снижает шеддинг S1. Затем мы оценили, может ли различное количество S-белка влиять на чувствительность вируса к нейтрализации.Рис. 4c показывает, что PV D614 и PV G614 одинаково чувствительны к нейтрализующим антисывороткам, что указывает на то, что опосредованный антителами контроль вирусов, несущих S D614 и S G614 , будет аналогичным.
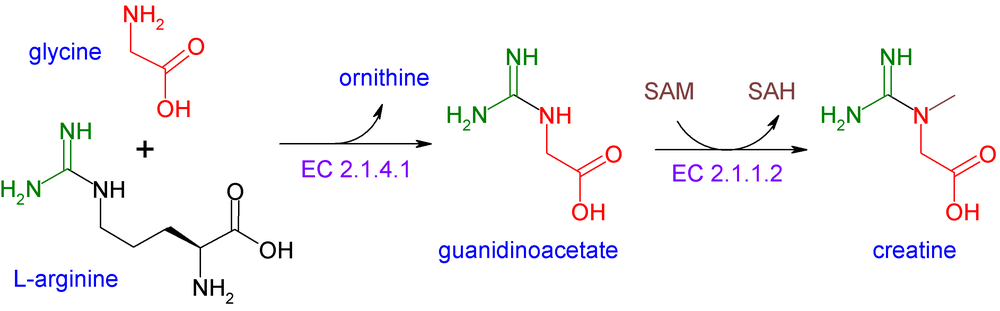 В случае VLPs это нарушение, по-видимому, д. Дальше мешать соответствующим ассоциациям M- и N-белков, изменяя конформацию и ориентацию S-белков проксимальных к мембране областей. Альтернативно, эти тримеры S-белка с экспонированными доменами S2 могут служить плохими субстратами для последующих посттрансляционных модификаций, включая пальмитоилирование, а те, которые не имеют надлежащих модификаций, могут быть неподходящими для включения вириона.
В случае VLPs это нарушение, по-видимому, д. Дальше мешать соответствующим ассоциациям M- и N-белков, изменяя конформацию и ориентацию S-белков проксимальных к мембране областей. Альтернативно, эти тримеры S-белка с экспонированными доменами S2 могут служить плохими субстратами для последующих посттрансляционных модификаций, включая пальмитоилирование, а те, которые не имеют надлежащих модификаций, могут быть неподходящими для включения вириона. Также возможно, что наша способность обнаруживать изменения последовательности на этой ранней стадии пандемии просто больше, чем наша способность обнаруживать небольшие различия в патогенезе.Сильная фенотипическая разница, которую мы наблюдаем здесь между D614 и G614, предполагает, что необходимы дополнительные исследования влияния мутации D614G на течение заболевания.
Также возможно, что наша способность обнаруживать изменения последовательности на этой ранней стадии пандемии просто больше, чем наша способность обнаруживать небольшие различия в патогенезе.Сильная фенотипическая разница, которую мы наблюдаем здесь между D614 и G614, предполагает, что необходимы дополнительные исследования влияния мутации D614G на течение заболевания. Следовательно, мутация D614G могла возникнуть, чтобы компенсировать этот недавно приобретенный сайт фурина.
Следовательно, мутация D614G могла возникнуть, чтобы компенсировать этот недавно приобретенный сайт фурина.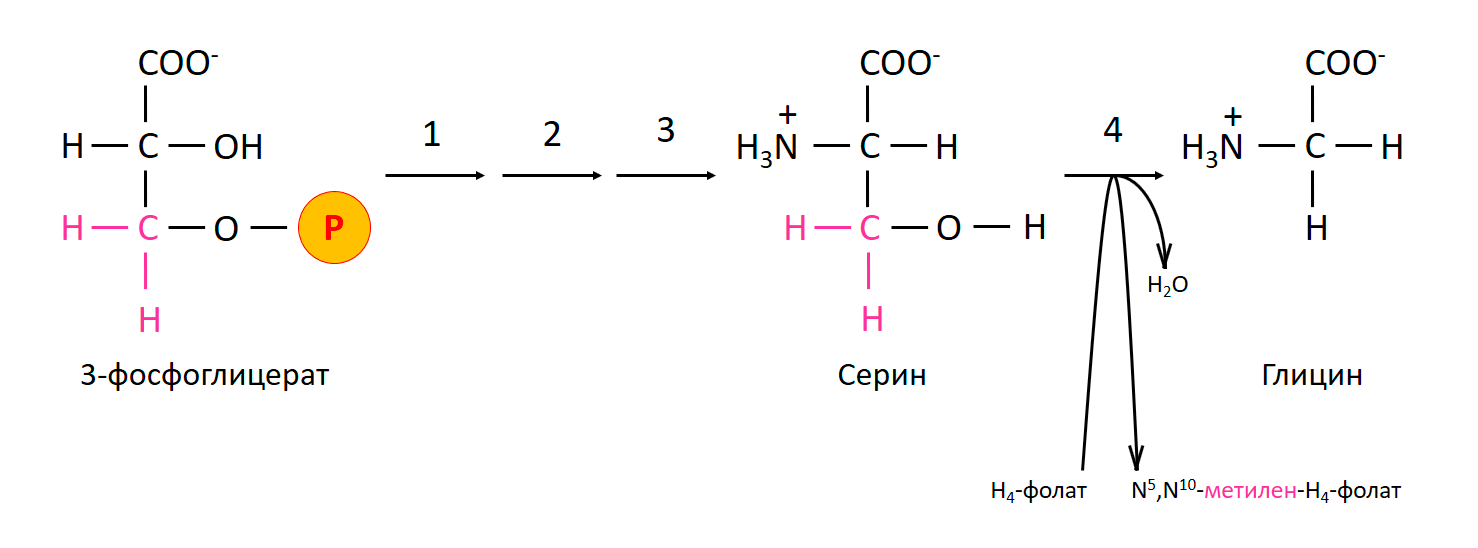
 Ранее сообщалось о плазмиде, экспрессирующей белок G VSV 31 . Ген белка SARS-CoV-2 S, используемый в производстве PV MLV, был оптимизирован по кодонам и синтезирован Integrated DNA Technologies на основе последовательности белка (GenBank YP_009724390).Ген белка S слит с последовательностью метки Flag (DYKDDDDK) либо на его C-конце, либо на обоих N- и C-концах, как указано в каждом эксперименте. Содержащие PV культуральные супернатанты собирали через 43 часа после трансфекции, очищали через фильтры 0,45 мкм и либо очищали, либо разделяли на аликвоты и немедленно замораживали при -80 ° C.
Ранее сообщалось о плазмиде, экспрессирующей белок G VSV 31 . Ген белка SARS-CoV-2 S, используемый в производстве PV MLV, был оптимизирован по кодонам и синтезирован Integrated DNA Technologies на основе последовательности белка (GenBank YP_009724390).Ген белка S слит с последовательностью метки Flag (DYKDDDDK) либо на его C-конце, либо на обоих N- и C-концах, как указано в каждом эксперименте. Содержащие PV культуральные супернатанты собирали через 43 часа после трансфекции, очищали через фильтры 0,45 мкм и либо очищали, либо разделяли на аликвоты и немедленно замораживали при -80 ° C.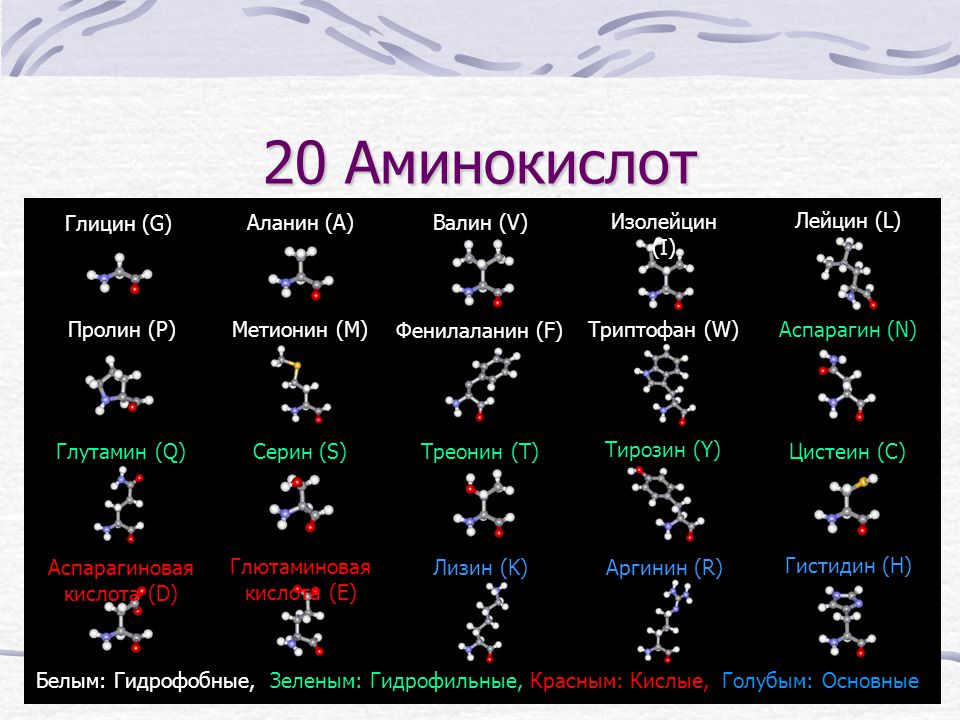 qPCR выполняли с использованием Luna Universal Probe qPCR Master Mix (New England Biolabs) с известным количеством вектора pQCXIX для создания стандартных кривых.
qPCR выполняли с использованием Luna Universal Probe qPCR Master Mix (New England Biolabs) с известным количеством вектора pQCXIX для создания стандартных кривых. Осадки PV ресуспендировали в 30-50 мкл NT-буфера (120 мМ NaCl, 20 мМ Трис, pH 8,0). Очищенные ПВ немедленно использовали или разделяли на аликвоты и замораживали при -80 ° C. Для вестерн-блоттинга 5-10 мкл очищенного PV, что эквивалентно 0,5-1,0 × 10 10 векторных геномов, загружали на дорожку 4-12% геля Бис-Трис (Life Technologies), переносили в PVDF-мембрану и блотировали 1 мкг / мл антитела против Flag M2 (Sigma-Aldrich, F1804) для обнаружения полос S-белка. 1 мкг / мл gag-антитела против p30 MLV (Abcam, ab130757) и разведение 1: 10000 козьих поликлональных антител против мышиного IgG-HRP (Jackson ImmunoResearch, 115-036-062) использовали для обнаружения белка gag MLV в качестве внутренний контроль.Интенсивность полос измеряли с использованием программного обеспечения Image Lab (Bio-Rad). Чтобы повысить точность этого измерения, одни и те же кляксы анализировали несколько раз при разных экспозициях. Для окрашивания серебром 30 мкл очищенных PV разделяли 4-12% гелем Bis-Tris и окрашивали Silver Stain Plus (Bio-Rad).
Осадки PV ресуспендировали в 30-50 мкл NT-буфера (120 мМ NaCl, 20 мМ Трис, pH 8,0). Очищенные ПВ немедленно использовали или разделяли на аликвоты и замораживали при -80 ° C. Для вестерн-блоттинга 5-10 мкл очищенного PV, что эквивалентно 0,5-1,0 × 10 10 векторных геномов, загружали на дорожку 4-12% геля Бис-Трис (Life Technologies), переносили в PVDF-мембрану и блотировали 1 мкг / мл антитела против Flag M2 (Sigma-Aldrich, F1804) для обнаружения полос S-белка. 1 мкг / мл gag-антитела против p30 MLV (Abcam, ab130757) и разведение 1: 10000 козьих поликлональных антител против мышиного IgG-HRP (Jackson ImmunoResearch, 115-036-062) использовали для обнаружения белка gag MLV в качестве внутренний контроль.Интенсивность полос измеряли с использованием программного обеспечения Image Lab (Bio-Rad). Чтобы повысить точность этого измерения, одни и те же кляксы анализировали несколько раз при разных экспозициях. Для окрашивания серебром 30 мкл очищенных PV разделяли 4-12% гелем Bis-Tris и окрашивали Silver Stain Plus (Bio-Rad).
 конъюгирован с полимеризованной HRP (Fitzgerald, 61R-I166AHRP40).
конъюгирован с полимеризованной HRP (Fitzgerald, 61R-I166AHRP40). Для измерения общего уровня S-белка клетки пермеабилизировали PBS, включая 0,5% Triton X-100 (Sigma-Aldrich), при комнатной температуре в течение 10 минут и инкубировали с 1 мкг / мл антитела против Flag M2 (Sigma-Aldrich).
Для измерения общего уровня S-белка клетки пермеабилизировали PBS, включая 0,5% Triton X-100 (Sigma-Aldrich), при комнатной температуре в течение 10 минут и инкубировали с 1 мкг / мл антитела против Flag M2 (Sigma-Aldrich).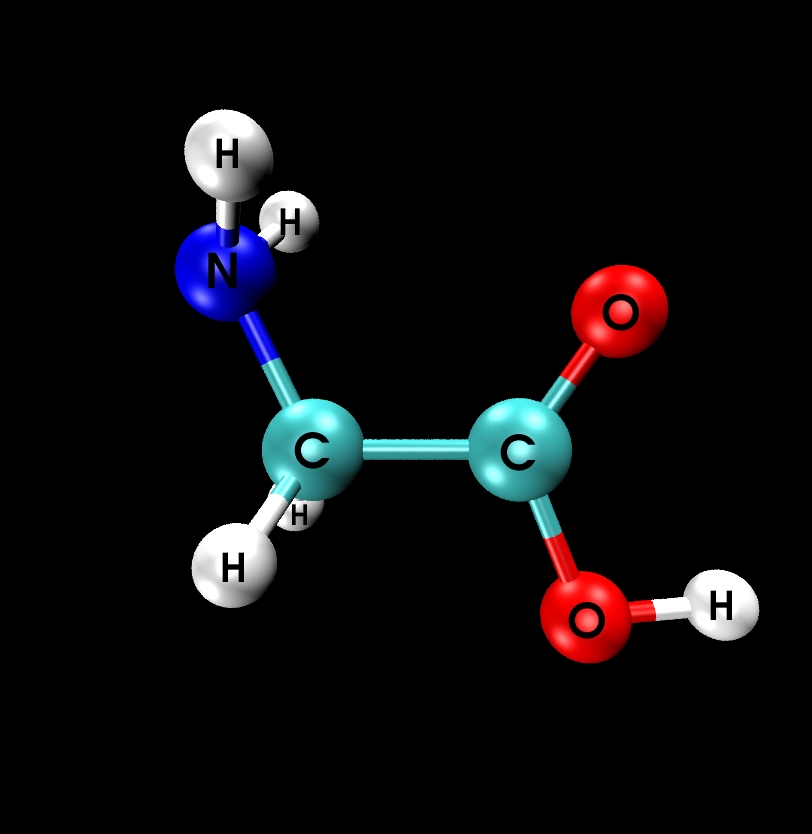
 Поскольку у ± углерода есть второй атом водорода, глицин не является оптически активным.
Поскольку у ± углерода есть второй атом водорода, глицин не является оптически активным. Доказательства существования молекул глицина в межзвездном пространстве были обнаружены, когда с помощью радиотелескопа были идентифицированы 10 спектральных линий глицина.
Доказательства существования молекул глицина в межзвездном пространстве были обнаружены, когда с помощью радиотелескопа были идентифицированы 10 спектральных линий глицина. Когда рецепторы глицина активируются, ионы хлора попадают в нейрон, и клетка подвергается гиперполяризации. Таким образом, клетка имеет тенденцию находиться в заблокированном состоянии. Стрихнин, препарат, вызывающий судороги, блокирует эти рецепторы глицина.
Когда рецепторы глицина активируются, ионы хлора попадают в нейрон, и клетка подвергается гиперполяризации. Таким образом, клетка имеет тенденцию находиться в заблокированном состоянии. Стрихнин, препарат, вызывающий судороги, блокирует эти рецепторы глицина. 180
# Thr: -0.050
# Trp: 0,810
# Тир: 0.260
# Val: 1.080
#
# Применение:
# color_h (выделение)
#
из pymol import cmd def color_h (selection = 'all'):
s = str (выбор)
печать (и)
cmd.set_color ('color_ile', [0.996,0.062,0.062])
cmd.set_color ('color_phe', [0.996,0.109,0.109])
cmd.set_color ('color_val', [0.992,0.156,0.156])
cmd.set_color ('color_leu', [0.992,0.207,0.207])
cmd.set_color ('color_trp', [0.992,0.254,0.254])
cmd.set_color ('color_met', [0.988,0.301,0.301])
cmd.set_color ('color_ala', [0.988,0,348,0,348])
cmd.set_color ('color_gly', [0,984,0,394,0,394])
cmd.set_color ('color_cys', [0.984,0.445,0.445])
cmd.set_color ('color_tyr', [0.984,0.492,0.492])
cmd.set_color ('color_pro', [0.980,0.539,0.539])
cmd.set_color ('color_thr', [0.980,0.586,0.586])
cmd.set_color ('color_ser', [0.980,0.637,0.637])
cmd.set_color ('color_his', [0.977,0.684,0.684])
cmd.set_color ('color_glu', [0.977,0.730,0.730])
cmd.set_color ('color_asn', [0,973,0.777,0.777])
cmd.set_color ('color_gln', [0.973,0.824,0.824])
cmd.set_color ('color_asp', [0,973,0,875,0,875])
cmd.set_color ('color_lys', [0.899,0.922,0.922])
cmd.set_color ('цвет_арг', [0.899,0.969,0.969])
cmd.color ("color_ile", "(" + s + "и resn ile)")
cmd.color ("color_phe", "(" + s + "и resn phe)")
cmd.color ("color_val", "(" + s + "и resn val)")
cmd.color ("color_leu", "(" + s + "и resn leu)")
cmd.color ("color_trp", "(" + s + "и resn trp)")
cmd.color ("color_met", "(" + s + "и resn встретились)")
cmd.color ("color_ala", "(" + s + "и resn ala)")
cmd.color ("color_gly", "(" + s + "и resn gly)")
cmd.color ("color_cys", "(" + s + "и resn cys)")
cmd.color ("color_tyr", "(" + s + "и resn tyr)")
cmd.color ("color_pro", "(" + s + "и resn pro)")
cmd.color ("color_thr", "(" + s + "и resn thr)")
cmd.color ("color_ser", "(" + s + "и resn ser)")
cmd.color ("color_his", "(" + s + "и повторно его)")
cmd.color ("color_glu", "(" + s + "и resn glu)")
cmd.color ("color_asn", "(" + s + "и resn asn)")
cmd.color ("color_gln", "(" + s + "и resn gln)")
cmd.color ("color_asp", "(" + s + "и resn asp)")
cmd.color ("color_lys", "(" + s + "и resn lys)")
cmd.color ("color_arg", "(" + s + "и resn arg)")
cmd.extend ('цвет_h', цвет_h) def color_h3 (selection = 'all'):
s = str (выбор)
печать (и)
cmd.set_color ("color_ile2", [0.938,1,0.938])
cmd.set_color ("color_phe2", [0.891,1,0.891])
cmd.set_color ("color_val2", [0.844,1,0,844])
cmd.set_color ("color_leu2", [0.793,1,0.793])
cmd.set_color ("color_trp2", [0.746,1,0.746])
cmd.set_color ("color_met2", [0,699,1,0,699])
cmd.set_color ("color_ala2", [0,652,1,0,652])
cmd.set_color ("color_gly2", [0.606,1,0.606])
cmd.set_color ("color_cys2", [0.555,1,0.555])
cmd.set_color ("color_tyr2", [0,508,1,0,508])
cmd.set_color ("color_pro2", [0.461,1,0.461])
cmd.set_color ("color_thr2", [0.414,1,0.414])
cmd.set_color ("color_ser2", [0.363,1,0,363])
cmd.set_color ("color_his2", [0.316,1,0.316])
cmd.set_color ("color_glu2", [0.27,1,0.27])
cmd.set_color ("color_asn2", [0.223,1,0.223])
cmd.set_color ("цвет_gln2", [0,176,1,0.176])
cmd.set_color ("color_asp2", [0,125,1,0,125])
cmd.set_color ("color_lys2", [0,078,1,0.078])
cmd.set_color ("цвет_арг2", [0,031,1,0.031])
cmd.color ("color_ile2", "(" + s + "и resn ile)")
cmd.color ("color_phe2", "(" + s + "и resn phe)")
cmd.color ("color_val2", "(" + s + "и resn val)")
cmd.цвет ("color_leu2", "(" + s + "и resn leu)")
cmd.color ("color_trp2", "(" + s + "и resn trp)")
cmd.color ("color_met2", "(" + s + "и resn встретились)")
cmd.color ("color_ala2", "(" + s + "и resn ala)")
cmd.
180
# Thr: -0.050
# Trp: 0,810
# Тир: 0.260
# Val: 1.080
#
# Применение:
# color_h (выделение)
#
из pymol import cmd def color_h (selection = 'all'):
s = str (выбор)
печать (и)
cmd.set_color ('color_ile', [0.996,0.062,0.062])
cmd.set_color ('color_phe', [0.996,0.109,0.109])
cmd.set_color ('color_val', [0.992,0.156,0.156])
cmd.set_color ('color_leu', [0.992,0.207,0.207])
cmd.set_color ('color_trp', [0.992,0.254,0.254])
cmd.set_color ('color_met', [0.988,0.301,0.301])
cmd.set_color ('color_ala', [0.988,0,348,0,348])
cmd.set_color ('color_gly', [0,984,0,394,0,394])
cmd.set_color ('color_cys', [0.984,0.445,0.445])
cmd.set_color ('color_tyr', [0.984,0.492,0.492])
cmd.set_color ('color_pro', [0.980,0.539,0.539])
cmd.set_color ('color_thr', [0.980,0.586,0.586])
cmd.set_color ('color_ser', [0.980,0.637,0.637])
cmd.set_color ('color_his', [0.977,0.684,0.684])
cmd.set_color ('color_glu', [0.977,0.730,0.730])
cmd.set_color ('color_asn', [0,973,0.777,0.777])
cmd.set_color ('color_gln', [0.973,0.824,0.824])
cmd.set_color ('color_asp', [0,973,0,875,0,875])
cmd.set_color ('color_lys', [0.899,0.922,0.922])
cmd.set_color ('цвет_арг', [0.899,0.969,0.969])
cmd.color ("color_ile", "(" + s + "и resn ile)")
cmd.color ("color_phe", "(" + s + "и resn phe)")
cmd.color ("color_val", "(" + s + "и resn val)")
cmd.color ("color_leu", "(" + s + "и resn leu)")
cmd.color ("color_trp", "(" + s + "и resn trp)")
cmd.color ("color_met", "(" + s + "и resn встретились)")
cmd.color ("color_ala", "(" + s + "и resn ala)")
cmd.color ("color_gly", "(" + s + "и resn gly)")
cmd.color ("color_cys", "(" + s + "и resn cys)")
cmd.color ("color_tyr", "(" + s + "и resn tyr)")
cmd.color ("color_pro", "(" + s + "и resn pro)")
cmd.color ("color_thr", "(" + s + "и resn thr)")
cmd.color ("color_ser", "(" + s + "и resn ser)")
cmd.color ("color_his", "(" + s + "и повторно его)")
cmd.color ("color_glu", "(" + s + "и resn glu)")
cmd.color ("color_asn", "(" + s + "и resn asn)")
cmd.color ("color_gln", "(" + s + "и resn gln)")
cmd.color ("color_asp", "(" + s + "и resn asp)")
cmd.color ("color_lys", "(" + s + "и resn lys)")
cmd.color ("color_arg", "(" + s + "и resn arg)")
cmd.extend ('цвет_h', цвет_h) def color_h3 (selection = 'all'):
s = str (выбор)
печать (и)
cmd.set_color ("color_ile2", [0.938,1,0.938])
cmd.set_color ("color_phe2", [0.891,1,0.891])
cmd.set_color ("color_val2", [0.844,1,0,844])
cmd.set_color ("color_leu2", [0.793,1,0.793])
cmd.set_color ("color_trp2", [0.746,1,0.746])
cmd.set_color ("color_met2", [0,699,1,0,699])
cmd.set_color ("color_ala2", [0,652,1,0,652])
cmd.set_color ("color_gly2", [0.606,1,0.606])
cmd.set_color ("color_cys2", [0.555,1,0.555])
cmd.set_color ("color_tyr2", [0,508,1,0,508])
cmd.set_color ("color_pro2", [0.461,1,0.461])
cmd.set_color ("color_thr2", [0.414,1,0.414])
cmd.set_color ("color_ser2", [0.363,1,0,363])
cmd.set_color ("color_his2", [0.316,1,0.316])
cmd.set_color ("color_glu2", [0.27,1,0.27])
cmd.set_color ("color_asn2", [0.223,1,0.223])
cmd.set_color ("цвет_gln2", [0,176,1,0.176])
cmd.set_color ("color_asp2", [0,125,1,0,125])
cmd.set_color ("color_lys2", [0,078,1,0.078])
cmd.set_color ("цвет_арг2", [0,031,1,0.031])
cmd.color ("color_ile2", "(" + s + "и resn ile)")
cmd.color ("color_phe2", "(" + s + "и resn phe)")
cmd.color ("color_val2", "(" + s + "и resn val)")
cmd.цвет ("color_leu2", "(" + s + "и resn leu)")
cmd.color ("color_trp2", "(" + s + "и resn trp)")
cmd.color ("color_met2", "(" + s + "и resn встретились)")
cmd.color ("color_ala2", "(" + s + "и resn ala)")
cmd.