Дисбактериоз кишечника у взрослых: симптомы, признаки, лечение
Что такое дисбактериоз
Вопреки распространенному заблуждению, дисбактериоз не является самостоятельным заболеванием. В Международной классификации болезней десятого пересмотра (МКБ-10) такой диагноз отсутствует. Правильнее будет сказать, что дисбактериоз, или дисбиоз — это состояние, сопровождающееся нарушением баланса микрофлоры кишечника, которое возникает как следствие других перенесенных болезней или в результате лечения антибиотиками.
В группу риска входят в первую очередь новорожденные и дети грудного возраста. Дело в том, что при рождении их пищеварительный тракт стерилен, а это означает, что микрофлоры как таковой в нем еще нет. Бифидо- и лактобактерии поступают в организм ребенка вместе с молоком матери. Однако если женщина в период беременности проходила лечение антибиотиками, то кормление грудью может усугубить ситуацию.
В эту же группу входят и пациенты, перенесшие тяжелые заболевания, сопровождающиеся истощением организма, инфекцией, нарушением кроветворения или злокачественными новообразованиями. В группе риска и те люди, кто подвержен частым стрессам и вредным привычкам.
Чем опасна патогенная микрофлора
Кишечник человека населяют не только облигатные, но и условно-патогенные бактерии. Если первые считаются «полезным» сегментом микрофлоры кишечника, обеспечивающим нормальное пищеварение и поддерживающим иммунитет, то с условно-патогенными микробами ситуация более сложная. В нормальных условиях такие бактерии никак себя не проявляют, но при сдвиге естественного баланса, когда их количество начинает преобладать, возникает комплекс симптомов, который называют дисбактериозом кишечника.
К представителям облигатной микрофлоры относят:
- бифидобактерии;
- лактобактерии;
- кишечные палочки (эшерихии неинвазивные).
Представители условно-патогенной флоры:
- стафилококки;
- стрептококки;
- бактероиды.

Существуют также патогенные бактерии (например, сальмонеллы, иерсинии, холерный вибрион), которые в кишечнике здорового человека отсутствуют. Однако они могут попасть туда при употреблении загрязненной воды или плохо вымытых продуктов.
Сдвиг здорового баланса микрофлоры кишечника и активность патогенных бактерий могут быть чреваты целым рядом неприятных последствий. Например, нарушение нормального биоценоза может способствовать выработке канцерогенных метаболитов и развитию злокачественных новообразований.
Хронические воспалительные процессы, сопровождающие дисбиоз, могут привести к развитию хронического колита и энтерита. Нельзя исключать и опасность распространения воспалительных процессов на суставы. Еще одним осложнением дисбактериоза является снижение иммунитета — человек становится в большей степени подверженным бактериально-вирусным заболеваниям.
Другие возможные осложнения:
- Нарушение гормонального баланса.
- Преждевременное старение.
- Заболевания сердечно-сосудистой системы.
- Сенсибилизация организма (склонность к аллергическим реакциям).
- Развитие атеросклероза.
- Нарушения работы нервной системы.
- Общая слабость и повышенная утомляемость.
Причины развития дисбактериоза
Факторов, провоцирующих развитие дисбактериоза, очень много — начиная от регулярных стрессов, заканчивая неблагоприятными экологическими условиями. Наиболее распространенные причины:
- Применение антибиотиков. Антибактериальные препараты (особенно широкого спектра действия) уничтожают не только патогенную, но и полезную микрофлору.
- Гормональная терапия. Сюда также можно отнести и заболевания, сопровождающиеся изменением гормонального фона. Например, при избытке тестостерона у женщин баланс микрофлоры кишечника нарушается.
- Химиотерапия. Этот радикальный метод борьбы с метастазами дает множество нежелательных осложнений, в число которых входит и нарушение здорового баланса микрофлоры.

- Частое использование клизм. При регулярном применении очистительных клизм из кишечника вымывается полезная микрофлора. Чем больше объем и частота использования клизм, тем более выраженными будут проявления дисбиоза.
- Стресс. Связь микробиоты с мозгом осуществляется через вагус (блуждающий нерв). Сами бифидо- и лактобактерии способны синтезировать ацетилхолин, норадреналин и серотонин. Эти нейромедиаторы отвечают за психоэмоциональное состояние человека. При этом наблюдается и обратная связь: регулярные стрессы подавляют рост этих бактерий.
- Вредные привычки. Алкоголь и никотин пагубно влияют на облигатную микрофлору.
- Неправильное питание. Этот вопрос вызывает разногласия среди специалистов. Одни склоняются к мнению, что роль неправильного питания в развитии дисбиоза переоценена. Другие же настаивают на том, что при отсутствии в рационе достаточного количества клетчатки и молочнокислых продуктов здоровый баланс микрофлоры нарушается. Причем ситуацию может усугубить сочетание с регулярным употреблением пищи, содержащей антибиотики, консерванты и другие ксенобиотики.
- Ослабление перистальтики кишечника. Этот фактор провоцирует рост патогенной микрофлоры.
- Травмы и воспаления. Любое нарушение целостности тканей и воспалительные процессы ослабляют иммунную систему, что отражается на биоценозе микрофлоры кишечника.
Виды
Разделение дисбактериоза на виды не вполне корректно. Это состояние классифицируется по степени тяжести согласно критериям, предложенным доктором биологических наук И.Б. Куваевой и доктором медицинских наук К.С. Ладодо.
1 стадия: титр содержания молочнокислой флоры снижен не более, чем на 20% от нормы. Количество бактероидов, а также лакто- и бифидобактерий снижается. В некоторых случаях отмечается рост различных представителей условно-патогенной флоры. Как правило, ощутимых нарушений со стороны работы ЖКТ не возникает, поэтому эту стадию также называют латентной.
2 стадия: так называемая пусковая фаза. Размножение условно-патогенной микрофлоры усиливается, растет число протеев и грибов Candida. При этом отмечается выраженная тенденция к снижению бифидобактерий и другой облигатной микрофлоры. Степень нарушений работы кишечника оценивается как легкая.
3 стадия: фаза агрессии. На фоне стремительного снижения количества лактобацилл и бифидобактерий прогрессирует рост патогенной газообразующей микрофлоры. Отмечается ускоренное размножение протеев, золотистого стафилококка, а также грибов рода Candida. Клинические проявления выражены более ярко.
4 стадия: фаза ассоциированного дисбактериоза. Бифидобактерии на этой стадии могут отсутствовать полностью, что приводит к тяжелым расстройствам пищеварения и невозможности нормального усвоения пищи.
Титр условно-патогенной микрофлоры достигает высокого уровня, настолько что это по-сути уже превращает ее в патогенную. Однако такая фаза встречается лишь в исключительных клинических ситуациях (например, на фоне приема антибиотиков в сочетании с гормональной и/или лучевой терапией).
Дисбактериоз кишечника — симптомы и лечение
Дисбактериоз кишечника – это заболевание, которое характеризуется нарушением соотношения и состава населяющих кишечник микроорганизмов.Без соответствующего лечения данное заболевание может привести к серьёзным нарушениям в работе желудочно-кишечного тракта.
Причины появления дисбактериоза
Существует многоженство факторов, способных изменить нормальную микрофлору кишечника. Но чаще всего своим появление дисбактериоза связано с:
- Прием некоторых лекарственных средств: антибиотиков, слабительных, гормональных, психотропных и т.д.;
- Неправильное питание и злоупотребление алкоголем;
- Инфекционные заболевания;
- Хронические заболевания желудочно-кишечного тракта;
- Аллергические заболевания
- Иммунодифициты.

Основные симптомы дисбактериоза
Симптомы дисбактериоза бывают идентичны симптомам других гастроэнтерологических заболеваний. При дисбактериозе могут беспокоить:
- Изменения стула: поносы, запоры или неустойчивый стул;
- Дискомфорт в животе, вздутие;
- Повышенное газообразование;
- Резкий запах стула;
- Тошнота;
- Боли в животе без четкой локализации;
- Аллергические реакции;
- Утомляемость, слабость.
Диагностика и лечение дисбактериоза
В первую очередь, для постановки диагноза необходимо провести анализ кала. Также врач может назначить: гастроскопию, ректороманоскопию, ирригоскопию, колоноскопию.
Лечение дисбактериоза кишечника проводится в комплексе и подразумевает: восстановление нормальной микрофлоры кишечника, улучшение пищеварения, восстановление моторики кишечника. Лекарственная терапия подразумевает прием антибактериальных препаратов и бактериальных, регуляторов пищеварения.
Лечение дисбактериоза у взрослых и детей
К какому специалисту следует обратиться, если у вас обнаружились симптомы Дисбактериоза?
Профилактика дисбактериоза
Профилактика дисбактериоза заключается в решении ряда проблем:
- Организация рационального питания;
- Контроль применяемых лекарственных препаратов;
- Улучшение экологической обстановки;
- Своевременное лечение заболеваний желудочно-кишечного тракта.
Лечение гастроэнтерологических заболеваний – одно из приоритетных направлений работы клиники «Семейная».
Запись на прием к врачу гастроэнтерологу
Обязательно пройдите консультацию квалифицированного специалиста в области гастроэнтерологии в клинике «Семейная».
Чтобы уточнить цены на прием врача гастроэнтеролога или другие вопросы пройдите по ссылке ниже
Лечение дисбактериоза кишечника
Дисбактериоз – это изменение состава микроорганизмов в кишечнике и развитие в нем патогенной микрофлоры. В результате в организме образуются опасные вещества, приводящие к его отравлению и возникновению процессов гниения.
В результате в организме образуются опасные вещества, приводящие к его отравлению и возникновению процессов гниения.За последние годы дисбактериоз кишечника стал таким же распространенным недугом как простудные заболевания и аллергия. Почему это происходит именно с Вами и как вылечить эту неприятную болезнь раз и навсегда?
Общие сведения
В человеческом организме живет масса бактерий, которые выполняют множество полезных функций. Они синтезируют витамины, расщепляют растительную клетчатку и не дают размножаться патогенным микроорганизмам. Полезные бактерии незаменимы для человеческого организма, они переваривают пищу и участвуют в процессе усвоения микроэлементов.
Около 400 видов микроорганизмов населяют кишечник, общая масса которых достигает 3 кг!
Нормальная кишечная флора, состоящая из бифидобактерий и молочнокислых бактерий, обеспечивает оптимальное переваривание пищи, а также перерабатывает ненужные «отходы».
Состояние кишечной микрофлоры связано не только с заболеваниями желудочно–кишечного тракта, но и с такими заболеваниями, как атеросклероз и артериальная гипертония, мочекаменная болезнь и пиелонефрит, желчнокаменная болезнь и гепатиты.
Возникновение дисбактериоза
Под действием внешних факторов количество полезных микроорганизмов уменьшается, а вредных становится больше. Из-за изменения состава бактерий в кишечнике возникает дисбактериоз. Симптомы этого недуга проявляются в виде легкого недомогания, боли в области пупка, метеоризма. Может возникнуть непереносимость определенных продуктов, особенно это касается острой и жареной пищи.
Человек с дисбактериозом чувствует постоянную усталость, боли в животе, слабость, появляются боли в суставах, температура тела повышается, возникает расстройство стула. Организм начинает получать меньше витаминов, а обмен веществ ухудшается.
Если Вам знакомы эти симптомы, стоит немедленно обратиться к опытным специалистам за помощью. Важно понимать, что легкие недомогания при дисбактериозе могут перерасти в тяжелые расстройства здоровья, при которых кишечная стенка начнет пропускать токсины и аллергены, тем самым снижая барьерную функцию печени.
Важно понимать, что легкие недомогания при дисбактериозе могут перерасти в тяжелые расстройства здоровья, при которых кишечная стенка начнет пропускать токсины и аллергены, тем самым снижая барьерную функцию печени.
Эффективное лечение дисбактериоза у взрослых и детей
Патогенные микроорганизмы в кишечнике развиваются потому, что его барьерная защита напрямую зависит от здоровья желчного пузыря, печени поджелудочной железы, желудка. Если в этих органах ( чаще всего с самого детства) у человека присутствует хронический воспалительный процесс (часто это бывает без болевых симптомов см. раздел Лечение), нарушается выработка ферментов, желчи, что приводит к бродильным процессам в кишечнике и соответственно снижается его барьерная функция.
Лечение в клинике при помощи современной гомеопатии, направлено не только на восстановление гомеостаза толстого и тонкого кишечника, но и на лечение воспалительных процессов других органов пищеварения, мочеполовой системы, которая находится рядом и тоже может влиять на кишечник.
Это приводит к тому, что восстанавливается гомеостаз толстого и тонкого кишечника, который начинает вырабатывать макрофаги и антитела на патогенные микроорганизмы (хеликобактер, стафилококк, палочки, гельминты и т. д). Освободившись таким образом от патогенных организмов, толстый кишечник дает возможность развиваться полезным бактериям и сохраняет эту способность долгое время.
Дисбактериоз: кишечные баталии
Фото носит иллюстративный характер. Из архива «МВ».
Едва ли найдется человек, у которого никогда не было изжоги, отрыжки, тошноты, боли в животе, метеоризма или нарушений стула. Однако за медпомощью люди обращаются только в том случае, если симптомы регулярно дают о себе знать или проявляются остро. Большинство до поры до времени лечатся самостоятельно, пользуясь распространенными «желудочными» средствами на свое усмотрение.
Цель — баланс
Пищеварительный тракт — гетерогенная бактериальная экосистема. Вследствие низкого значения pH желудок здорового человека можно считать стерильной средой.
Вследствие низкого значения pH желудок здорового человека можно считать стерильной средой.
В кишечнике условия для роста микроорганизмов лучше. В тонком бактерий немного — 104–106/мл (высокое значение pH и быстрый транзит не способствуют увеличению их количества), а в толстом — в 100 000 раз больше.
Кишечник является строго анаэробной системой, богатой питательными веществами, с кислотностью среды от нейтральной до слабощелочной. Его бактериальная экосистема включает от 400 до 500 типов микроорганизмов, которые взаимодействуют. Многие являются компенсалами, помогают расщеплять неперевариваемые соединения, содержащиеся в пище.
У практически здоровых людей около 96% микрофлоры кишечника составляют представители облигатной (т. е. постоянно встречающейся) микрофлоры: бифидо- и лактобактерии, бактероиды, непатогенная кишечная палочка и др.
Вторая группа, куда входят факультативная (непостоянная) и условно-патогенная микрофлора, занимает лишь 2–4% от общего количества микроорганизмов. При определенных условиях (снижение местного, а тем более общего иммунитета) вызывает внутрикишечные и общие нарушения. Факультативная группа представлена микрококками, протеем, стафилококками, клостридиями, цитробактерами и др.
Третью группу составляет транзиторная (случайная) патогенная микрофлора: клостридии, синегнойная палочка, грибы рода Candida. На ее долю приходится 0,001–0,01%.
В процессе постоянного взаимодействия макро- и микроорганизмов формируется уникальная экосистема, находящаяся в состоянии динамического баланса. Существенную роль играют облигатные и факультативные анаэробы: бифидо-, лакто- и энтеробактерии, а также энтерококки. Бифидобактерии создают кислую среду и тем самым препятствуют размножению вредной микрофлоры. Кроме того, обладают выраженным антагонизмом в отношении патогенов, улучшают процессы пищеварения, поддерживают витаминный баланс и иммунный статус, участвуют в синтезе незаменимых аминокислот.
Нарушение бактериоэкологического равновесия в ЖКТ приводит к формированию дисбактериоза (дисбиоза) кишечника.
Нехорошие перемены
Дисбактериоз кишечника — это клинико-лабораторный синдром, возникающий при разных патологических состояниях. Характерны изменения количественного и (или) качественного состава нормофлоры, метаболические и иммунологические нарушения; у некоторых пациентов добавляются симптомы поражения кишечника.
Кишечная микрофлора взрослого человека довольно устойчива к переменам в питании. Между тем стоит помнить, что еда, богатая углеводами, стимулирует бифидофлору и ведет к увеличению бактериальной массы толстого кишечника. Белковые блюда не влияют на спектр и количество кишечных бактерий, а жиры угнетают бифидобактерии и энтерококки, но стимулируют размножение бактероидов. «Пищевой» дисбиоз чаще носит временный характер и исчезает при переходе на здоровый сбалансированный рацион.
При заболеваниях местного и общего характера изменяется микробный пейзаж толстой кишки. Дисбактериоз регистрируется у большинства пациентов с поражением ЖКТ инфекционной и неинфекционной природы, после острых вирусных и бактериальных инфекций внекишечной локализации, при хронической воспалительной и аллергической патологии, у страдающих злокачественными заболеваниями и лейкозами, на фоне применения цитостатиков и особенно антибиотиков. Антибиотикозависимые дисбиозы стабильны и требуют активной терапии.
Сдвиги в микрофлоре кишечника вторичны — отражают воздействие факторов, изменяющих статус кишечника или внутренний баланс самого микробиоценоза. Нарушение микробного равновесия может осложнять многие патологические состояния, быть атерогенным явлением, связанным с антибактериальной, гормональной и другой терапией, несбалансированным питанием и т. д.
Один из частых вариантов (удельный вес порой достигает 31%) дисбактериоза кишечника — кандидозный, при котором имеет место избыточный рост грибов рода Candida. Он нередко ассоциируется с пищевой аллергией и аллергическими заболеваниями вообще, а также с курением.
Лабораторные поиски
Клиническая картина дисбактериоза кишечника вариабельна, а выраженность симптоматики не всегда напрямую зависит от степени дисбиотических нарушений. Ранними и наиболее специфическими симптомами можно считать повышенное газообразование, нарушение переваривания пищи (кишечная диспепсия), изменение характера стула; при развитии дисбактериоза на фоне колита — болевой синдром, патологические примеси в кале (слизь). В более тяжелых случаях добавляются интоксикация, диарея и обезвоживание, снижение массы тела.
Ранними и наиболее специфическими симптомами можно считать повышенное газообразование, нарушение переваривания пищи (кишечная диспепсия), изменение характера стула; при развитии дисбактериоза на фоне колита — болевой синдром, патологические примеси в кале (слизь). В более тяжелых случаях добавляются интоксикация, диарея и обезвоживание, снижение массы тела.
В диагностике и трактовке кишечного дисбактериоза большое значение имеет копрологическое исследование, дающее возможность охарактеризовать пищеварительную, ферментовыделительную, всасывательную и двигательную функции кишечника. В последнее время получили распространение методы, основанные на выявлении метаболитов микроорганизмов, — газожидкостная и ионная хроматография. В лабораториях проводят бактериологические исследования фекалий и посев на питательные среды соскобов со слизистых оболочек.
Золотым стандартом диагностики синдрома избыточного роста бактерий считается интестиноскопия с аспирацией содержимого тонкой кишки и посевом аспирата на питательную среду. Но эта методика сложна, требует общей анестезии и хорошей бактериологической базы с возможностью культивирования аэробов и анаэробов, а результат приходится ждать порядка 10 дней.
Синдром избыточного роста бактерий выявляется также по данным дыхательного теста с меченым Н2 — с лактулозой или галактозой. Бактерии разлагают лактулозу, в результате чего освобождается меченый Н2, концентрация которого затем может быть измерена в выдыхаемом воздухе. В норме лактулоза расщепляется лишь микрофлорой в толстом кишечнике. При дисбиозе и тонкая кишка заселяется микроорганизмами, расщепляющими лактулозу. При этом следует исключить ускоренное продвижение субстрата по тонкой кишке.
Посев дуоденального аспирата тоже подтверждает синдром избыточного роста бактерий: при патологии содержание микроорганизмов >106/мл (общее количество бактерий в просвете тощей кишки не превышает 104–106/мл).
Микрофлора различных отделов пищеварительного тракта значительно отличается количественно и качественно. +
+
Микробиологическое исследование фекалий лишь косвенно может свидетельствовать о микробном неблагополучии, т. к. состав фекальной микрофлоры отражает ситуацию только в толстой кишке, а точнее — в дистальном отделе.
Настрой на победу
Профилактика и особенно лечение дисбактериоза кишечника должны быть комплексными и предполагать:
- устранение избыточного бактериального обсеменения тонкой кишки;
- восстановление нормальной микробной флоры толстой кишки;
- улучшение кишечного пищеварения и всасывания;
- восстановление нормальной моторики кишечника;
- стимулирование реактивности организма.
Важнейшими нормальными обитателями толстого кишечника человека являются бифидобактерии (вид анаэробных палочковидных грамположительных бактерий) — 3–7% от общей фекальной микрофлоры взрослых. Нужны и лактобактерии.
Восстановлению качества и количества бифидобактерий способствует увеличение в рационе пектинов (растворимых пищевых волокон), а для лактобактерий лучшие продукты — кисломолочные. Антибиотическую активность последних повышают путем добавления никотиновой кислоты (на 1 л — 6–8 мг), тиамина (4–6 мг), токоферола (1–3 мг).
Для профилактики и лечения дисбактериоза широко используются пробиотики и пребиотики.
Пробиотики — это живые микроорганизмы (молочнокислые бактерии, чаще бифидо- или лактобактерии), нормальные обитатели кишечника здорового человека, улучшающие микробный баланс. Обладают антагонистическими свойствами по отношению к патогенам (третья группа): конкурируют за рецепторы на эпителиоцитах, питательные вещества; способны выделять ингредиенты (цитокины, масляную кислоту), ингибирующие рост патогенных бактерий. Монокультуру или комплекс живых микроорганизмов дополняют веществом, стимулирующим их колонизирующую способность и размножение.
Пробиотики содержатся в молочных продуктах со специальной закваской, кукурузных хлопьях, крупах, черном хлебе.
При наличии бродильных процессов в кишечнике надо ограничивать углеводы, пищевые волокна (клетчатку), при гнилостных — белки и жиры.
Каждому, у кого высок риск развития дисбиоза, следует избегать цельного молока, бобовых, а также продуктов, богатых эфирными маслами (чеснок, зеленый лук, репа, редька).
Для стабилизации микрофлоры кишечника в рацион включают морковный сок, сою, дрожжевой, тыквенный, картофельный и рисовый экстракты, молочную сыворотку и молозиво (обладают бифидогенным действием).
Используют растительные компоненты и при стафилококковом дисбактериозе. Полезны лесная земляника, рябина, малина, черника, шиповник, черная смородина. При протейном дисбактериозе нужны абрикосы и черная смородина; при наличии гнилостных бактерий — клюква и абрикосы. Если имеет место избыточный рост грибов рода Candida, стоит налегать на бруснику, стручковый перец, морковь.
При торпидно протекающем дисбактериозе рекомендуют дополнять лечение, подключая эффект от приема эвкалипта, календулы, аира, зверобоя. Когда подтвержден грибковый дисбактериоз с бродильной диспепсией, положительное влияние окажет цикорий растворимый.
Кроме пробиотиков, важное значение в профилактике и лечении дисбактериоза кишечника имеют пребиотики (к ним в основном относят растворимые пищевые волокна класса углеводов: фруктоолигосахариды, галактоолигосахариды). В желудке и тонкой кишке они избегают гидролиза пищеварительными ферментами и достигают толстой кишки в неизменном виде. Там подвергаются ферментации бифидо- и лактобактериями, что приводит к увеличению количества флоры и объема каловых масс. При этом важно подчеркнуть, что фруктоолигосахариды представляют собой энергетический субстрат для представителей нормальной микрофлоры кишечника (бифидо- и лактобактерий). В процессе ферментации образуются короткоцепочечные жирные кислоты (преимущественно уксусная, пропионовая, масляная), которые снижают рН в кишечнике, стимулируют перистальтику.
Укреплению защитного барьера толстой кишки при потреблении пребиотиков способствует и стимуляция выработки в ней слизи. Повышенное слизеобразование энтероцитами может быть следствием снижения рН при возросшем синтезе короткоцепочечных жирных кислот микрофлорой кишечника в ответ на введение пребиотиков. Свойствами пребиотиков в наибольшей степени обладают инулин, лактулоза, лактил, олигосахариды, лактоолигосахариды, хилак форте и др.
Повышенное слизеобразование энтероцитами может быть следствием снижения рН при возросшем синтезе короткоцепочечных жирных кислот микрофлорой кишечника в ответ на введение пребиотиков. Свойствами пребиотиков в наибольшей степени обладают инулин, лактулоза, лактил, олигосахариды, лактоолигосахариды, хилак форте и др.
Инулин присутствует в клетках цикория, артишока, корней одуванчика, клубней топинамбура, фасоли, петрушки. Наиболее хорошо изучен как бифидогенный фактор — избирательно ускоряет рост и метаболизм бифидобактерий. Прием 5 г/день олигофруктозы или ≤8 г/день инулина обеспечивает значительное изменение состава кишечной микрофлоры, увеличивая численность бифидобактерий и снижая количество патогенов.
Пробиотики и пребиотики могут применяться для профилактики и лечения дисбактериоза кишечника, в т. ч. при назначении эрадикационных схем лечения Helicobacter pylori при гастроэзофагеальной рефлюксной, язвенной болезни желудка и двенадцатиперстной кишки, эрозивных гастро- и дуоденопатиях.
Применение антибиотиков нежелательно, т. к. они могут усугублять дисбиоз кишечника. Целесообразно использовать препараты, минимально влияющие на симбиотическую флору и в тоже время подавляющие рост патогенных микроорганизмов. К таким относятся нитрофураны (нифуроксазид, интетрикс) — т. н. кишечные антисептики.
Пациентам с кишечной диспепсией показаны ферментные препараты. Чаще используют панкреатин (мезим форте, трифермент, креон). При стеаторее и гипомоторной дискинезии кишечника к панкреатину добавляют желчные кислоты (панзинорм), при бродильных расстройствах — гемицеллюлозу (фестал, энзистал, дигестал). Для улучшения процессов всасывания можно назначать мембраностабилизирующие препараты (карсил, эссенциале).
При дисбактериозе, особенно в период реабилитации, показаны иммуномодуляторы (натрия нуклеинат, витамины), растительные адаптогены (элеутерококк, женьшень, эхинацея). Когда отмечена тенденция к лейкопении и требуется усилить эпителизацию слизистой оболочки, можно использовать метилурацил и пентоксил (не более двух недель).
Иван Броновец, профессор кафедры кардиологии и внутренних болезней БГМУ, доктор мед. наук
Медицинский вестник, 12 сентября 2016
лечение и диагностика дисбактериоза кишечника
Дисбактериоз – заболевание, при котором наблюдается патологическое изменение состава нормальной флоры кишечника, когда количество полезных бактерий снижается, а патогенных – возрастает. Вследствие этого процесса нарушается работа кишечника.
Заболевание проявляется хорошо выраженными симптомами, которые доставляют немало дискомфорта:
- диарея, метеоризм, вздутие живота и урчание в кишечнике,
- могут возникать аллергические реакции на некоторые продукты,
- боль в животе,
- тошнота и рвота,
- жидкий стул нехарактерного цвета,
- снижение аппетита, потеря массы тела,
- снижение иммунитета, развитие грибковых заболеваний.
Симптомы не проявляются одновременно и резко, а степень их выраженности зависит от стадии болезни. При появлении признаков заболевания необходима срочная консультация гастроэнтеролога.
Если врач подтвердит диагноз, лечение дисбактериоза должно быть начато незамедлительно. Больным показана терапия лекарственными средствами по нескольким направлениям: для устранения причины заболевания, снятия острых симптомов и восстановления нормальной флоры кишечника и нормализации работы органа.
Лечение дисбактериоза кишечника неразрывно связано с соблюдением диеты. Питание больного должно быть сбалансированным, обогащенным витаминами и микроэлементами. Также нужно следить за потребляемым количеством жидкости: часто при дисбактериозе организм страдает от обезвоживания.
Дисбактериоз у взрослых может быть вызван приемом антибиотиков, неправильным питанием, другими заболеваниями печени и желудочно-кишечного тракта (гастрит, панкреатит), а также чрезмерным употреблением алкоголя.
Особого внимания требует дисбактериоз у детей, лечение которого крайне изматывает маленьких пациентов. Заболевание может быть вызвано самыми разными причинами: не вовремя введенный прикорм, частая смена детского рациона, раннее отлучение от груди.
Заболевание может быть вызвано самыми разными причинами: не вовремя введенный прикорм, частая смена детского рациона, раннее отлучение от груди.
Если вы ищете клинику в Минске, где могут правильно диагностировать и назначить корректное лечение дисбактериоза, Проктологический центр «МедКлиник» рад предложить вам свои услуги. У нас работают высококвалифицированные специалисты, имеющие колоссальный опыт лечения заболеваний желудочно-кишечного тракта.
Дисбактериоз влагалища: причины, профилактика и лечение
Дисбиоз (дисбактериоз) влагалища — это нарушение нормальной микрофлоры влагалища. Этим заболеванием в той или иной степени страдает большая часть женщин.
При нарушении микрофлоры изменяется равновесие между бактериями-нормальными обитателями влагалища. При этом снижается количество лакто- и бифидобактерий и увеличивается количество какого-то другого возбудителя. Этим другим возбудителем может быть одна из ключевых клеток (тогда развиваются гарднереллез, кандидоз и т.д.), может быть одна из половых инфекций (трихомониаз, хламидиоз), или же может быть любой сапрофитный возбудитель (кишечная палочка, протей, стрептококки, стафилококки и т.д.).
Дисбиоз влагалища и половые инфекции
Половые инфекции всегда связаны с нарушением микрофлоры влагалища. С одной стороны, нормальная микрофлора не допустит развития половой инфекции у женщины, и если обнаруживается половая инфекция, микрофлора не может быть не нарушена. С другой стороны, появление возбудителя какого-либо заболевания, передающегося половым путем (ЗППП) во влагалище смещает pH, вызывает воспалительную реакцию и еще больше способствует прогрессированию нарушения микрофлоры.
Ситуация, при которой во влагалище у женщины обитает только один лишь возбудитель ЗППП, почти никогда не возникает. Половая инфекция, одна или несколько, всегда находятся в ассоциации с условно-патогенной микрофлорой. И это всегда должно учитываться при лечении ЗППП. Иначе может возникнуть ситуация, при которой антибиотиками полностью убивается возбудитель ЗППП, а количество условно-патогенной инфекции лишь возрастает.
И это всегда должно учитываться при лечении ЗППП. Иначе может возникнуть ситуация, при которой антибиотиками полностью убивается возбудитель ЗППП, а количество условно-патогенной инфекции лишь возрастает.
Лечение ЗППП
у женщин обязательно должно завершаться восстановлением микрофлоры влагалища. Если речь идет о серьезных инфекциях (хламидия, трихомонада) или нескольких ЗППП, то сначала есть смысл провести антибактериальную терапию против них, а затем заняться восстановлением микрофлоры влагалища следующим курсом. В менее сложных ситуациях есть смысл проводить сначала комплексную диагностику всей урогенитальной микрофлоры, а затем ее восстановление с одновременным устранением половой инфекции.
Дисбиоз влагалища и заболевания кишечника
Многие заболевания желудочно-кишечного тракта ведут к нарушению нормальной микрофлоры кишечника и развитию дисбактериоза. При дисбактериозе кишечника происходит примерно тоже самое, что и при дисбактериозе влагалища — в кишечнике живет большое количество какой-нибудь бактерии.
Стенка прямой кишки плотно соприкасается со стенкой влагалища, бактерии легко проходят через нее. При выраженном дисбактериозе кишечника нарушение вагинальной микрофлоры всегда обусловлено именно этим, и как правило из влагалища высевается одна из кишечных инфекций — кишечная палочка, энтерококки и др.
Лечение дисбиоза влагалища
в такой ситуации крайне затруднено, вероятность рецидива заболевания очень высока. Восстановление нормальной микрофлоры влагалища в такой ситуации возможно лишь при одновременном лечении заболеваний кишечника.
Дисбиоз влагалища и половой партнер
Чаще всего нарушение микрофлоры влагалища у женщины не вызывает никаких проблем у ее полового партнера, даже при регулярной половой жизни без использования средств контрацепции. В отдельных случаях, когда имеет место выраженный дисбиоз влагалища, у мужчины могут развиваться явления баланопостита и неспецифического уретрита. Но это обычно бывает только в том случае, если у мужчины уже была предрасположенность к этим заболеваниям, в полностью здоровом организме они не разовьются.
Но это обычно бывает только в том случае, если у мужчины уже была предрасположенность к этим заболеваниям, в полностью здоровом организме они не разовьются.
Никакое заболевание полового партнера, за исключением венерических заболеваний, не оказывает влияния на микрофлору влагалища у женщины. Лечение дисбиоза влагалища у женщин не предполагает обязательного лечения полового партнера, если только хотя бы у одного из них не выявляется присутствие половой инфекции.
Дисбиоз влагалища и беременность
Беременность является одним из факторов, которые могут провоцировать обострение вагинального дисбиоза. На фоне беременности могут появляться или усиливаться выделения, зуд или жжение в половых органах, боль при половом акте и т.д. Это связано с тем, что во время беременности организм женщины подвергается серьезной гормональной перестройке, что не может не сказаться как на состоянии иммунитета, так и на вагинальной микрофлоре.
Спасибо за обращение.
Ваша заявка принята. Наш специалист свяжется с Вами в ближайшее время
Полноценное лечение дисбиоза влагалища во время беременности возможным не представляется. Даже если это лечение не связано с приемом антибиотиков, что крайне нежелательно во время беременности, оно всегда связано с иммунокоррекцией, а это во время беременности совершенно недопустимо. Поэтому задачей доктора при обострении дисбиоза влагалища у беременной женщины является лишь устранение симптомов и подготовка женщины к родам.
В нашей клинике с этой целью проводится курс процедур, которые если не нормализуют ситуацию, то делают ее более терпимой. Местное лечение, проводимое при этом, совершенно безвредно для плода. Если есть необходимость, это лечение на протяжении беременности можно проводить неоднократно.
Дисбиоз влагалища у девушек
Нарушение микрофлоры влагалища встречается у девушек, не начинавших половую жизнь, примерно с такой же частотой, как и у живущих активной половой жизнью женщин. Это связано несколько с другими факторами — нестабильность гормонального фона, становление цикла, а также с анатомическими особенностями строения девственной плевы.
Это связано несколько с другими факторами — нестабильность гормонального фона, становление цикла, а также с анатомическими особенностями строения девственной плевы.
Дисбиоз влагалища у девушек редко проявляется обильными выделениями, поскольку отверстия девственной плевы как правило не позволяют им выводиться из влагалища в том количестве, в каком они образуются. Поэтому развивается застой выделений во влагалище, и вероятность развития воспалительных заболеваний у девственниц выше. С другой стороны, при начале половой жизни с первыми половыми актами происходит заброс большого количества бактерий из влагалища в мочевой пузырь, и это может привести к возникновению так называемого «цистита медового месяца».
Лечение дисбиоза влагалища у девушек-девственниц несколько затруднительно из-за того, что строение девственной плевы не всегда позволяет проводить обработки влагалища лекарствами должным образом. В отдельных случаях даже приходится прибегать к искусственному нарушению целостности девственной плевы — гименэктомии.
В «СМ-Клиника» врачи-гинекологи после проведения обследования и анализов выявят точные причины дисбактериоза влагалища и назначат эффективное комплексное лечение, которое приведет к восстановлению нормальной микрофлоры влагалища.
ДИСБАКТЕРИОЗ КИШЕЧНИКА
ДИСБАКТЕРИОЗ КИШЕЧНИКА
СПИСОК ПРЕПАРАТОВ И ЛЕЧЕНИЕ НАРУШЕННОЙ МИКРОФЛОРЫ КИШЕЧНИКА
Состояние дисбактериоза в той или иной области организма знакомо практически каждому. Под этим понятием современная медицина чаще всего понимает не конкретное заболевание, а следствие какого-либо стороннего фактора, в том числе и болезни, в результате которого нарушается состав и свойства микрофлоры.
Определенный набор групп бактерий присутствует во всем человеческом организме. При этом для каждого конкретного места, будь то ротовая полость, кишечник, горло или влагалище, этот набор микроорганизмов свой. Более того, у каждого человека эти комбинации зачастую индивидуальны. Медики этот оптимальный набор бактерий называют эубиозом, реже биоценозом кишечника, а нарушение его состава, количества или свойств – дисбактериозом. Мы же разберемся в конкретной форме дисбактериоза – нарушении микрофлоры кишечника.
Более того, у каждого человека эти комбинации зачастую индивидуальны. Медики этот оптимальный набор бактерий называют эубиозом, реже биоценозом кишечника, а нарушение его состава, количества или свойств – дисбактериозом. Мы же разберемся в конкретной форме дисбактериоза – нарушении микрофлоры кишечника.
Это состояние или болезнь (дискуссионность последнего термина в отношении дисбактериоза не закрыта до сих пор) проявляется достаточно стандартным перечнем симптомов в зависимости от сложности протекания, но при этом причины возникновения дисбактериоза кишечника могут быть кардинально разные.
Банальные смена режима питания, переезд в другое место с изменением химического состава употребляемой воды, смена климата, стресс, диета могут привести к изменениям условно-патогенной микрофлоры кишечника и проявиться симптомами дисбактериоза. К этому же могут привести и более серьезные предпосылки: пищевое отравление, применение антибиотиков или болезни желудочно-кишечного тракта. И главное во всем этом то, что для избавления от симптомов нарушения микрофлоры кишечника, в первую очередь нужно избавиться от предпосылок возникновения такого состояния.
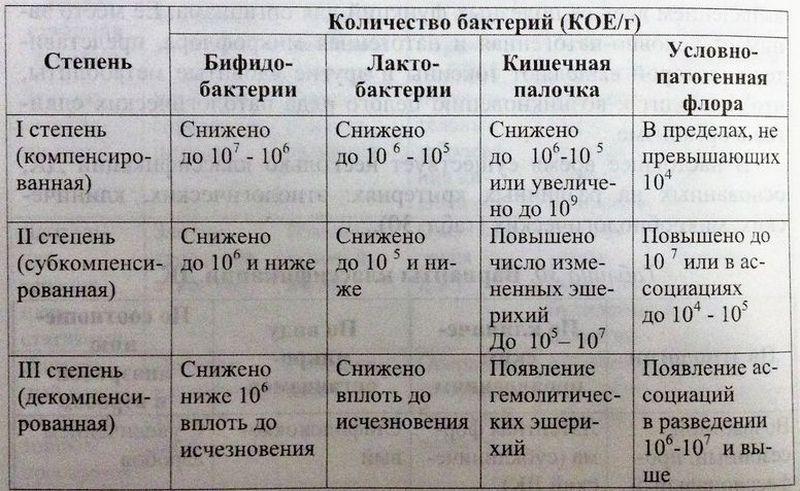
КЛАССИФИКАЦИЯ ДИСБАКТЕРИОЗА КИШЕЧНИКА ПО СИМПТОМАТИКЕ
Дисбактериоз по сложности изменений микрофлоры разделяют на четыре стадии, для каждой из которых характерны свои симптомы. Рассмотрим их для наглядности в форме таблицы:
| Стадия дисбактериоза | Симптомы | Способы устранения и возможные последствия |
| Первая стадия | Симптоматика практически не наблюдается. Возможно проявление несистемного урчания в животе. | Дисбактериоз первой стадии возникает сменой режима приема пищи или типа употребляемой воды. Устранение причины приводит к самостоятельной нормализации микрофлоры. |
| Вторая стадия | Наблюдаются запоры или диарея, снижение аппетита, неприятный привкус во рту, вероятны тошнота и рвота. | Такие симптомы возникают при значительном изменении состава микрофлоры, которое провоцируется приемом антибиотиков или легким пищевым отравлением. |
| Третья стадия | Возникают боли в кишечнике, непереваренная пища выходит в кале, усиливаются симптомы второй стадии. | Дисбактериоз на этой стадии приводит к развитию воспаления стенок кишечника, нарушению процесса пищеварения. Требует медикаментозного вмешательства для избегания серьезных последствий. |
| Четвертая стадия | Симптоматика предыдущих стадий усиливается бессонницей, апатией, депрессией. | При практически полном изменении состава микрофлоры кишечника, развиваются анемия и авитаминоз. Без квалифицированного лечения дисбактериоз четвертой стадии может привести к серьезным инфекционным заболеваниям. |
КЛАССИФИКАЦИЯ ДИСБАКТЕРИОЗА ПО СОДЕРЖАНИЮ МИКРООРГАНИЗМОВ В КАЛЕ
Помимо этого, существует и ещё одна классификация сложности дисбактериоза кишечника, основанная на показаниях лабораторных исследований кала при нарушении микрофлоры. Для взрослых она разделена на две группы. Для наглядности приведем её также в виде таблицы:
| Возраст | Стадия дисбактериоза | Лабораторные показатели |
| До 50 лет | 1 стадия | Заниженный до 105-106 либо завышенный до 109-1010 показатель типичных эшерихий, заниженный до 105-106 показатель лактобактерий и заниженный до 106-107 показатель бифидобактерий. |
| 2 стадия | Завышенный до 105-107 показатель условно-патогенных микроорганизмов, заниженный до 107 показатель бифидобактерий и до 105 лактобактерий. | |
| 3 стадия | Показатель условно-патогенных микроорганизмов превышает 107, показатель лактобактерий снижен до 105, бифидобактерий – до 107. | |
| После 50 лет | 1 стадия | Показатель типичных эшерихий вышел за пределы 105-1010, показатель лактобактерий снизился до 104 -105 , бифидобактерий – до 106-107 . |
| 2 стадия | Повышение показателя условно-патогенных микроорганизмов повышается до 105-107, показатель лактобактерий снижается до 104, бифидобактерий – до 106. | |
| 3 стадия | Показатель условно-патогенных микроорганизмов превышает 106-107, показатель лактобактерий снижен до 104, бифидобактерий – до 106. |
ВИЗУАЛЬНЫЙ АНАЛИЗ КАЛА ПРИ НАРУШЕНИИ МИКРОФЛОРЫ КИШЕЧНИКА
Также при дисбактериозе кишечника серьезное внимание обращается на характер кишечной патологии, которая достаточно просто определяется по типу и цвету кала, а также по состоянию стула.
Испражнения с желтоватым оттенком свидетельствуют о большом количестве непереваренной клетчатки в кале и об излишках крахмала. Для корректировки стула в таком случае рекомендуется белковая пища (отварное мясо, яйца, творог), которой нужно заместить сырые овощи, углеводы и молоко.
Очень темный кал с сильными зловониями демонстрирует наличие щелочной реакции в кишечнике, а также непереваренную волокнистую пищу. В этом случае из рациона нужно исключить мясо и жиры, возместив потребление калорий за счет отварных овощей и кисломолочных продуктов.
Дисбактериоз кишечника, который сопровождается поносом, устранять нужно диетой, основанной на «мягкой» пище. Блюда в рационе не должны быть ни горячими, ни холодными, пища по возможности должна быть отварная и протертая.
Если же нарушение микрофлоры кишечника проявляется запорами, то рацион нужно насытить продуктами с большим количеством клетчатки: яблоками, капустой, морковью, абрикосами.
ЛЕЧЕНИЕ ДИСБАКТЕРИОЗА У ВЗРОСЛЫХ
В начале мы уяснили, что, если обнаружен дисбактериоз кишечника лечение в первую очередь предполагает устранение причин его возникновения: лечение болезни, которая к нему привела, завершение курса приема антибиотиков или возвращение к исходному состоянию своего рациона. Но в большинстве случаев лечение требуется и для снятия симптомов нарушенной микрофлоры, и для ее восстановления. Для этих целей современная медицина рекомендует три типа терапии.
ДИЕТА ПРИ ДИСБАКТЕРИОЗЕ
Правильное питание при нарушении микрофлоры кишечника, особенно на начальных стадиях, способно полностью устранить проблему дисбактериоза. Выше мы уже рассмотрели варианты изменения рациона для нормализации стула, теперь же рассмотрим ряд других правил питания при этом состоянии.
Рацион человека при дисбактериозе должен быть максимально сбалансирован. В нем должны в достаточных количествах присутствовать белки, жиры и углеводы, а также жидкость. Врачи рекомендуют за полчаса до приема пищи выпивать стакан теплой воды.
Помимо этого, режим питания должен включать в себя пять приемов пищи, пусть и с меньшими порциями, а также с снижением нагрузок на кишечник перед сном.
Немаловажно, чтобы в употребляемых при дисбактериозе продуктах присутствовали следующие вещества:
- бифидо- и лактобактерии, которыми насыщены кисломолочные продукты и натуральное сливочное масло;
- пектины и пищевые волокна, содержащиеся в достаточных количествах в капусте, моркови, свекле и морских водорослях;
- аминокислоты глутамин и аргинин, источники которых – это курица, говядина, кисломолочные продукты, рыба, петрушка, шпинат, орехи, тыквенные семечки, пшеничная мука, горох.
Анализируя приведенный перечень продуктов можно прийти к выводу, что диета при дисбактериозе – это вовсе не перечень ограничений, а вкусное, полезное и сбалансированное питание. Главное, не переедать, не злоупотреблять «тяжелыми» продуктами, а также избегать в этот период употребления жаренного, острого и прочих, не самых полезных блюд.
ПРЕБИОТИКИ И ПРОБИОТИКИ ПРИ ДИСБАКТЕРИОЗЕ КИШЕЧНИКА
Для лечения дисбактериоза используются пребиотические и пробиотические препараты, которые, по заверениям, прекрасно справляются с нарушенной микрофлорой кишечника. Несмотря на схожесть названий, по своей сути пребиотики и пробиотики – кардинально разные препараты и стоит разобраться в их определении подробнее.
Пребиотики – это вещества, которые при попадании в кишечник оказывают положительное влияние на рост и активность имеющейся там полезной микрофлоры.
Пребиотики не всасываются органами желудочно-кишечного тракта и, если говорить совсем уж простым языком, являются кормом для нашей полезной микрофлоры. Среди фармацевтических форм пребиотиков чаще всего назначаются Лактулоза, Лактитол, Хилак Форте. Это лишь основные названия препаратов, так как их коммерческих наименований существуют десятки.
Помимо этого, есть и натуральные продукты, которые являются пребиотиками. Среди них молочные продукты, лук и чеснок, злаковые.
Теперь же о пробиотиках. Эти препараты являются набором необходимых организму человека микроорганизмов, которые при попадании в кишечник в достаточном количестве оказывают положительное влияние на состояние микрофлоры. При этом их применение является достаточно спорным вопросом.
Дело в том, что непосредственное введение микроорганизмов в виде пробиотиков имеет множество условностей. Одни микроорганизмы нужны в таких количествах, что получить их извне затруднительно, другие попросту ввести в живом виде нереально. Да и лабораторных доказательств реальной пользы от использования пробиотиков не так уж и много.
Из пробиотиков, положительное действие которых подтверждено исследованиями, в аптеках можно найти лактобактерии и бифидобактерии (Линекс, Бифиформ, Бифидумбактерин, Лактобактерин), сахаромицеты Буларди, энтерококки.
ЛЕЧЕНИЕ СЛОЖНЫХ ФОРМ ДИСБАКТЕРИОЗЕ
В тяжелых же формах дисбактериоз кишечника лечится более сложными фармацевтическими препаратами, которые делятся на три условных группы.
Первая из них – это антибактериальные средства. Они действуют на определенный тип условно-патогенной микрофлоры, останавливая ее рост и распространение. Назначаются антибактериальные препараты (кишечные антисептики) в зависимости от микроорганизма, который вызвал нарушение микрофлоры.
| Условно-патогенный микроорганизм | Применяемый антибактериальный препарат |
| Энтерококки | Эрсефурил, Фуразолидон, Энтерофурил, Левомицитин, макролиды. |
| Протеи | Невиграмон, Сульгин, Эрсефурил, Энтерофурил. |
| Стафилококки | Пиобактериофаг, Бактериофаг стафилококковый. |
| Кандиды и прочие грибковые агенты | Флуконазол, Микосист, Тербинафин, Амбизом. |
| Клостридии | Метронидазол, Ванкомицин. |
| Синегнойная палочка | Канамицин,Гентамицин. |
В том же направлении, что и антибактериальные средства, действуют и бактериофаги. В их составе содержатся специальные вирусы, которые подавляют определенный вид микроорганизмов. Как и антибактериальные препараты, бактериофаги делятся на группы по типу бактерий: синегнойные, стафилококковые и так далее.
Ну и напоследок нужно рассмотреть фармацевтические препараты, которые дополнительно назначают при дисбактериозе и которые устраняют его симптом и возможные последствия.
Иммуномодуляторы – средства для улучшения защитных свойств организма, прием которых при нарушении микрофлоры кишечник положительно влияет на процесс ее восстановления. Применение иммуномодуляторов должно проходить исключительно по назначению врача, а предпочтение стоит отдавать средствам на растительной основе: настойки эхинацеи и лимонника, Прополис, Дибазол.
Антигистаминные средства. Используются для избегания возникновения аллергических реакций, которые могут развиваться на фоне дисбактериоза кишечника. Самые простые из них – Цетрин, Зиртек и Кларитин, которые и назначаются в большинстве случаев.
Спазмолитики, применение которых зачастую необходимо при дисбактериозе, который сопровождается диареей. Самым популярным спазмолитическим средством является Но-Шпа, а конкретно от поноса рекомендуется Лоперамид. Если же нарушение микрофлоры кишечника сопровождается запорами, то для их устранения используются специальные свечи, вазелиновое масло, препарат Форлакс.
ДИСБАКТЕРИОЗ В СОВРЕМЕННОЙ МЕДИЦИНЕ
Мы уже отмечали вначале, что дисбактериоз отдельной болезнью классифицируется только на территории бывшего Советского Союза. Западная медицина обозначает его исключительно как состояние, спровоцированное определенными предпосылками. Дискуссии о правильности того или иного обозначения для простых людей вряд ли имеют смысл, но все же обозначим ряд интересных фактов, касающихся дисбактериоза:
- В Международной классификации болезней (официальном документе Всемирной организации охраны здоровья) диагноза «дисбактериоз» не существует. Максимально схожий с ним диагноз – СИБР (синдром избыточного бактериального роста). Ставится он при обнаружении более 105 микроорганизмов в миллилитре аспирата, взятого из тонкой кишки.
- Западная медицина достаточно скептически относится к анализу кала для изучения микрофлоры кишечника. По мнению врачей, такое исследование не позволяет сделать какие-либо выводы, так как понятие «нормальной микрофлоры кишечника» очень размыто и сугубо индивидуально для каждого человека.
- На территории бывшего СССР понятие дисбактериоза очень активно распространяется производителями лекарственных препаратов. Оправдано ли это или же под этим продвижением скрыта лишь коммерческая выгода, судить сложно.
- Многие медики очень скептически относятся к использованию при нарушенной микрофлоре кишечника пробиотиков и бактериофагов. По их мнению, полученные извне микроорганизмы практически не имеют шансов прижиться в кишечнике, а бактериофаги перевариваются в желудке и никакой приписываемой им пользы не приносят.
Так что единственный верный вывод о дисбактериозе – это самое спорное заболевание в современной медицине. Но симптомы, как и причины возникновения у него вполне конкретные и устранять их можно абсолютно эффективно.
https://med.vesti.ru/articles/zabolevaniya/disbakterioz-kishechnika-spisok-preparatov-i-lechenie-narushennoj-mikroflory-kishechnika/
Записаться на консультацию к специалистам медицинского центра «ВИТА» вы можете по телефонам:
8-909-557-47-57
8 (815 36) 740-10
или отправить заявку, воспользовавшись услугой сайта ЗАПИСЬ НА ПРИЕМ.
Текущее понимание дисбактериоза при заболевании на моделях человека и животных
Резюме
Воспалительное заболевание кишечника (ВЗК) — это воспалительное заболевание кишечника, которым страдают более двух миллионов человек в Соединенных Штатах. Хотя этиология и патогенез ВЗК все еще в значительной степени неизвестны, для развития ВЗК необходимы нерегулируемые взаимодействия хозяин / кишечные микроби. До сих пор многие исследователи пытались определить точную связь между ВЗК и дисбалансом кишечной микробиоты, называемым «дисбактериозом».Несмотря на прилагаемые усилия, до сих пор практически не известно о взаимодействии между микробами, их хозяевами и окружающей их средой, а также о том, является ли дисбактериоз причинным фактором или следствием ВЗК. Недавно глубокий анализ микробиоты у пациентов с ВЗК оказался полезным для характеристики сильной связи между дисбактериозом и развитием ВЗК, хотя в большинстве случаев он все еще не позволяет выявить специфически связанные изменения на уровне видов. Основываясь на многих недавних сообщениях, дисбиоз комменсальной микробиоты участвует в патогенезе нескольких заболеваний, включая ВЗК, ожирение и аллергические расстройства, как на моделях людей, так и на животных.
В этой обзорной статье мы сосредоточились на объяснении нескольких типов дисбактериоза, а также заболеваний, связанных с дисбактериозом, и возможных методов лечения, чтобы применить эти знания для понимания возможной причины и потенциально найти терапевтические стратегии для ВЗК, а также другие заболевания, связанные с дисбактериозом.
Ключевые слова: Дисбиоз, воспалительное заболевание кишечника, колоректальный рак, фекальная микробиота, гены восприимчивости к IBD
1. Что такое дисбиоз?
Кишечник взрослого человека содержит около 10 14 бактериальных клеток с более чем 1000 различными видами бактерий.В нормальной микрофлоре кишечника есть несколько основных подразделений бактерий, из которых наиболее доминирующими являются Bacteroidetes и Firmicutes. В кишечнике содержатся как защитные бактерии, так и некоторые бактерии, которые могут быть потенциально опасными для хозяина []. В нормальных условиях здоровых людей существуют перекрестные помехи и перекрестная регуляция между хозяином и микробиотой, находящейся в кишечнике, что создает гомеостатический баланс бактерий, так что желудочно-кишечный тракт остается здоровым и свободным от чрезмерного роста потенциально патогенных бактерий.Микробиота имеет комменсальные отношения с хозяином; бактерии процветают в богатой среде кишечника, в то время как хозяин извлекает выгоду из множества функций, обеспечиваемых бактериями.
Нормальная и дисбиотическая кишечная микробиотаA. Здоровый кишечник нормальных людей заселен широким спектром бактерий более 1000 видов. У здоровых людей эти бактерии находятся в гомеостатическом балансе между комменсальными и потенциально патогенными бактериями, и в кишечном тракте не наблюдается чрезмерного роста патогенных бактерий.Микрофлора обеспечивает хозяину защиту от чужеродных микробов, действуя как центральная линия устойчивости к колонизации этими экзогенными бактериями. Эта защита известна как «барьерный эффект» или устойчивость к колонизации [1]. Через слизистую оболочку кишечника микробиота взаимодействует с иммунной системой хозяина, обеспечивая хозяину иммунорегуляторные функции, такие как запуск иммунной системы слизистой оболочки [1,2]. Микробиота также обладает различными метаболическими функциями, такими как расщепление сложных углеводов и выработка короткоцепочечных жирных кислот, от которых хозяин получает пользу [1, 3].Удивительно, но микробиота кишечника также способна взаимодействовать с удаленными органами, такими как мозг, что привело к исследованиям влияния микробиоты кишечника на психические расстройства, такие как аутизм, и болезни, такие как болезнь Альцгеймера [2].
B. При нарушении бактериального гомеостаза кишечника возникает дисбактериоз. Дисбактериоз определяется дисбалансом бактериального состава, изменениями метаболической активности бактерий или изменениями распределения бактерий в кишечнике.Тремя типами дисбактериоза являются: 1) потеря полезных бактерий, 2) чрезмерный рост потенциально патогенных бактерий и 3) потеря общего бактериального разнообразия. В большинстве случаев эти типы дисбиоза возникают одновременно. Зеленые цвета, представляющие патогенные бактерии, и каждая бактерия разного цвета, представляющая разные комменсальные виды, демонстрируют разнообразие или отсутствие такового в каждом случае. Дисбиоз был связан с такими заболеваниями, как воспалительное заболевание кишечника (ВЗК), ожирение, диабет 1 и 2 типа, аутизм и некоторые виды рака желудочно-кишечного тракта.
Гомеостатический баланс кишечной микрофлоры чрезвычайно полезен для хозяина, однако, если есть изменение в микробном составе, которое вызывает резкий дисбаланс между полезными и потенциально патогенными бактериями, кишечник становится уязвимым для патогенного поражения с микробными изменениями кишечника. . Этот дисбаланс микробного равновесия называется «дисбиозом», который далее определяется как нарушение гомеостаза кишечной микробиоты из-за дисбаланса самой флоры, изменений их функционального состава и метаболической активности или изменений в их локальном распределении [1 , 4].В целом дисбактериоз можно разделить на три различных типа: 1) потеря полезных организмов, 2) чрезмерный рост потенциально вредных организмов и 3) потеря общего микробного разнообразия. Было обнаружено, что эти три типа не исключают друг друга и могут возникать одновременно, что чаще всего имеет место. Дисбиоз связан с широким спектром заболеваний, включая воспалительное заболевание кишечника (ВЗК), ожирение, аллергические расстройства, сахарный диабет 1 типа, аутизм, ожирение и колоректальный рак как на моделях человека, так и на животных.Этот обзор будет в основном сосредоточен на связи между дисбактериозом и воспалительными заболеваниями кишечника (ВЗК), такими как болезнь Крона (БК) и язвенный колит (ЯК), в дополнение к отдельным заболеваниям, связанным с дисбактериозом.
2. Заболевания, ассоциированные с дисбактериозом
IBD
В течение многих лет исследователи пытались обнаружить моно-ассоциированную причину IBD. В результате было обнаружено, что три основных патогена в наибольшей степени связаны с ВЗК. Эти патогены Mycobacterium avium paratuberculosis (MAP ), , которые когда-то считались потенциальным инфекционным агентом, связанным с патогенезом CD, Adherent-Invasive Escherichia coli (AIEC), который часто обнаруживался у пациентов с ВЗК. с острой / активной фазой и было предложено увеличить воспалительный ответ [2], и Clostridium difficile , который был обнаружен у пациентов с рецидивом ЯК, а также с ремиссией [5].В то время как некоторые исследования показали, что может наблюдаться увеличение сопутствующей патологии с этими бактериями и ВЗК, другие исследования показали, что эти результаты противоречивы [1,6,7]. До сих пор нет прямых доказательств того, что какие-либо из этих бактерий являются единственными причина ВЗК, и изменилось мнение, что ВЗК может быть вызвано дисбалансом комменсальной микрофлоры, связанной с более сложными взаимодействиями между хозяином и всей кишечной микробиотой [7], а не концепцией «один микроб — одно заболевание». Хотя дисбаланс микробиоты, так называемый дисбактериоз, по-видимому, является одной из основных причин патогенеза ВЗК, необходимы дальнейшие обширные исследования, чтобы подтвердить это утверждение, поскольку до сих пор неясно, является ли дисбактериоз, наблюдаемый у пациентов с ВЗК, фактором риска или эффект болезни.
Показано, что дисбактериоз кишечника у пациентов с ВЗК имеет характерную картину уменьшения разнообразия комменсальных бактерий, при этом в основном происходит уменьшение количества Firmicutes и Bacteroides в микрофлоре кишечника, которые являются двумя наиболее распространенными группами в нормальной флоре [ 8, 9, 10]. Согласно результатам некоторых исследований, дисбактериоз при ВЗК, в частности при БК, также был связан с относительным увеличением числа Enterobacteriaceae [1, 2, 6, 8, 9]. Сигнатура дисбактериоза при CD характеризуется пятью видами бактерий: увеличением Ruminococcus gnavus, и уменьшением Faecalibacterium prausnitzii, Bifidobacterium adolescentis, Dialister invisus, и неизвестным из кластера Clostridium XIVa [11].Также сообщалось, что здоровые родственники пациентов с БК также имели измененную микробиоту кишечника по сравнению со здоровыми людьми, а также имели повышенную деградацию муцина с повышенной проницаемостью эпителия [8, 11]. Поскольку барьер слизистой оболочки кишечника является первой линией защиты от микробиоты просвета, это разрушение может быть промежуточным этапом на пути к дисбактериозу и CD. Исходя из этого, дисбактериоз может быть предшественником БК. Изучено множество потенциальных механизмов, которые могут описать роль дисбактериоза в патогенезе ВЗК: один из этих механизмов включает уменьшение количества бутират-продуцирующих бактерий наряду с увеличением количества сульфатредуцирующих бактерий (SRB), что часто наблюдается при дисбактериоз больных ВЗК.У этих пациентов характерный дисбактериоз кишечника имеет серьезное снижение содержания F. prausnitzii [2, 6, 8, 9], которые являются основными продуцирующими бутират бактериями в кишечнике. Бутират является источником энергии для эпителиальных клеток кишечника и необходим для защиты кишечного эпителиального барьера от его уязвимости для потенциальных патогенов [2]. Некоторые исследования также обнаружили увеличение SRB [10]. SRB метаболизируют сульфат в сероводород, который является токсичной молекулой, которая может блокировать утилизацию бутирата и ингибировать фагоцитоз, а также убивать бактерии.Этот предполагаемый последовательный механизм ВЗК, ассоциированного с дисбиозом, предполагает, что дисбиоз, характеризующийся уменьшением количества бутират-продуцирующих бактерий и увеличением SRB, вызывает снижение уровня бутирата, что вызывает снижение экспрессии белков плотного соединения эпителия и, следовательно, увеличение проницаемости эпителия толстой кишки, что приводит к увеличению бактериальной транслокации через эпителиальные клетки кишечника и пропию пластинки. У генетически предрасположенных людей, которые несут мутации в генах восприимчивости к ВЗК, уничтожение бактерий, которые достигают пропиационной пластинки через проницаемый эпителиальный барьер, нарушается дефектным фагоцитозом, который затем приводит к чрезмерной стимуляции Toll-подобного рецептора (TLR). секреция провоспалительных цитокинов и активация приобретенных иммунных ответов, все это усиливает воспалительные реакции кишечника [12].Другой закономерностью, замеченной при изучении состава микробиоты у пациентов с ВЗК, является потеря облигатных анаэробов, таких как Bfidobacteria, и увеличение факультативных анаэробов, таких как E. coli [13]. Эта закономерность привела к гипотезе о том, что кислород может быть основным фактором, вызывающим дисбактериоз у пациентов с ВЗК. В здоровом кишечнике обычно низкий уровень кислорода и большая популяция облигатных анаэробов. Однако при дисбактериозе уменьшается количество Firmicutes, которые являются облигатными анаэробами, и увеличивается количество факультативных анаэробов, таких как Enterobacteriaceae.Это изменение кишечника от облигатных анаэробов к факультативным предполагает нарушение анаэробиоза в кишечнике, а это означает, что кислород, а также активные формы кислорода могут быть одним из причинных факторов дисбактериоза. Это открытие предполагает, что увеличение количества активных форм кислорода вызовет нарушение анаэробной среды кишечника, что создаст селективное преимущество для факультативных анаэробов или даже некоторых аэробов, что приведет к чрезмерному росту и возникновению дисбактериоза [13].
Исследуя роль дисбактериоза как причинного фактора ВЗК, было высказано предположение, что метаболизм желчных кислот также может играть важную роль в механизме ВЗК, ассоциированного с дисбактериозом. В просвете кишечника бактерии играют определенную роль в ферментативных реакциях, которые ответственны за преобразование желчных кислот (ЖК), водорастворимых амфипатических конечных продуктов метаболизма холестерина, включая процессы деконъюгации и дегидрирования. БА выполняют множество метаболических функций, таких как абсорбция липидов, поддержание гомеостаза холестерина, и действуют как противовоспалительные молекулы, которые способны снижать синтез провоспалительных цитокинов в моноцитах и макрофагах.Было обнаружено, что пациенты с ВЗК демонстрируют характерный дисбактериоз, а также нарушение метаболизма БА в кишечнике, особенно во время обострения ВЗК [14]. Было показано, что изменения микробиоты кишечника влияют на метаболизм БА, поскольку микробиота и связанные с ней метаболиты опосредуют некоторые изменения в метаболизме БА [15]. Дисбиоз, связанный с ВЗК, может изменить способность к модификации БА, что может нарушить регулируемый БА воспалительный процесс слизистой оболочки [16]. Firmicutes и Bacteroides, две основные группы, микробиота которых снижается у пациентов с ВЗК, являются наиболее мощными деконъюгированными бактериями для трансформации БА.Чем меньше этих бактерий в кишечнике во время дисбактериоза, тем меньше конъюгации БА, что приводит к усилению воспаления кишечника, что может сыграть решающую роль в обострении ВЗК. Следовательно, снижение конъюгации БА потенциально может быть надежным маркером дисбактериоза кишечника.
Ожирение
Ожирение — это болезнь, которая растет во многих странах мира. По данным Центров по контролю и профилактике заболеваний (CDC), в 2014 году около 78 миллионов взрослых и 12 миллионов детей в США страдали ожирением.Ожирение — это нарушение обмена веществ, связанное с накоплением избыточного количества жира в организме, которое, как считается, вызвано дисбалансом энергии, низким расходом энергии и увеличением количества потребляемых калорий. Однако недавние данные свидетельствуют о том, что ожирение является более сложным заболеванием, связанным с дисбактериозом кишечника как у мышей, так и у людей [17].
Подобно ВЗК, определенная характеристика микробиоты, по-видимому, связана с развитием ожирения. У лиц с ожирением наблюдается общее снижение бактериального разнообразия в кишечнике [17, 18].В большинстве исследований как на людях, так и на животных моделях ожирение, по-видимому, связано с изменением соотношения между Bacteroidetes и Firmicutes, которое показывает уменьшение Bacteroidetes, в то время как Firmicutes увеличивается [19–21]. Это соотношение коррелирует с массой тела и накоплением телесного жира, демонстрируя, что у более тучных людей более непропорционально соотношение этих бактерий. Количество Bacteroidetes, по-видимому, играет важную роль при ожирении, поскольку люди с ожирением, соблюдающие диету с ограничением калорий с потерей массы тела, показывают, что в микробиоте кишечника наблюдается повышенное соотношение видов Bacteroidetes [22, 23].Хотя дебаты о том, является ли дисбактериоз причинным элементом / фактором или просто следствием ожирения, все еще обсуждаются, многие эксперименты с участием мышей без зародышей (GF) предполагают, что дисбактериоз, вероятно, является причинным фактором ожирения. В этих экспериментах мышей GF и мышей дикого типа (WT) кормили одной и той же диетой с высоким содержанием жиров (HFD), однако только у мышей WT развилось ожирение. Когда тучная микробиота была трансплантирована мышам GF, затем индуцировалось ожирение [20, 24, 25]. Таким же образом было обнаружено, что ожирение человека может передаваться худым мышам GF через трансплантацию микробиоты [18].Трансплантация микробиоты также работает в противоположном направлении: было обнаружено, что микробиота тощих мышей, будучи перенесена на мышей с ожирением, может облегчить симптомы метаболического синдрома [26]. Эти многочисленные исследования показывают, что микробиота кишечника тесно связана с развитием ожирения.
Показано, чтоHFD изменяют состав микробиоты, что будет подробно обсуждаться в следующем разделе. Считается, что изменения в микробиоте, наблюдаемые при ожирении, вызывают различные эффекты, которые могут способствовать хроническому ожирению, связанному с воспалением.Сигнатура микробиоты с ожирением показывает измененное соотношение Bacteroidetes и Firmicutes, которые содержат элементы, вырабатывающие короткоцепочечные жирные кислоты (SCFA). У тучных людей уровни SCFA значительно ниже по сравнению с худыми людьми. Уменьшение SCFAs может быть связано с увеличением абсорбции SCFA, а также с измененным составом кишечной микробиоты, что свидетельствует о снижении количества бактерий, продуцирующих бутират [18], что может вызвать меньшую продукцию SCFA. Считается, что SCFAs ингибируют накопление жира в жировой ткани, поэтому считается, что их пониженный уровень способствует ожирению [18].
Предполагается, что наряду с измененной продукцией SCFA измененная микробиота ожирения влияет на баланс иммунной системы хозяина, что может привести к усилению транслокации бактериального антигена, что приводит к хроническому воспалению и нарушению метаболических функций, таких как резистентность к инсулину. Как на людях, так и на животных, ожирение связано с повышенной кишечной проницаемостью, что вызывает снижение барьерной функции кишечника [17]. Это снижение функции может вызвать прохождение молекул, таких как липополисахариды (ЛПС), которые представляют собой липогликаны, состоящие из липида и полисахарида, и обычно обнаруживаются во внешней мембране грамотрицательных бактерий.ЛПС действует как эндотоксин, защищая бактерии от солей желчных кислот, а также от липофильных антибиотиков. Кроме того, ЛПС может вызывать эндотоксемию, то есть присутствие эндотоксинов в крови, что может привести к септическому шоку и усилению хронического воспаления. Также считается, что ЛПС играет ключевую роль в патогенезе хронического воспалительного состояния, наблюдаемого у лиц с ожирением. Многие исследования подтверждают идею о том, что связанный с ожирением дисбиоз может вызывать повышение уровня ЛПС и проникновение через «протекающий» эпителиальный барьер в кровоток, вызывая эндотоксемию, которая приводит к хроническому воспалению, которое вызывает состояние ожирения [27].
Сахарный диабет
По данным Американской диабетической ассоциации, в 2012 году 9,3% или около 29,1 миллиона американцев страдали диабетом. Эта болезнь находится на подъеме в Соединенных Штатах, и ежегодно регистрируется около 1,7 миллиона новых диагнозов. Сахарный диабет — это нарушение углеводного обмена, которое характеризуется недостаточным производством или использованием инсулина, который необходим для преобразования сахаров и крахмалов в энергию для функционирования организма. Существует два основных типа диабета: тип 1 и тип 2.Сахарный диабет 1 типа или инсулинозависимый сахарный диабет (IDDM) — это аутоиммунное заболевание, обычно диагностируемое у детей или молодых людей, и вызываемое нарушением выработки инсулина бета-клетками поджелудочной железы. Сахарный диабет 2 типа или инсулиннезависимый сахарный диабет (NIDDM) обычно диагностируется у взрослых и характеризуется инсулинорезистентностью, то есть сниженной чувствительностью тканей к инсулину, в результате чего организм не реагирует на инсулин, который производится.NIDDM может усугубляться ожирением, а также является наиболее частой диагностируемой формой диабета. Несмотря на то, что IDDM и NIDDM вызываются разными механизмами в организме, исследования показали, что оба типа имеют дисбактериоз кишечной микробиоты, что может способствовать патогенезу заболевания [28].
IDDM-ассоциированный дисбиоз характеризуется уменьшением количества бактерий, разлагающих муцин, Bfidobacteria, Lactobacillus и Prevotella, с увеличением количества Bacteroidetes и Clostridium [29, 30].Напротив, дисбиоз, связанный с NIDDM, характеризуется уменьшением Clostridium, увеличением Lactobacillus и увеличением Bacteroidetes при NIDDM, не связанном с ожирением [31]. И IDDM, и NIDDM связаны с уменьшением общего микробного разнообразия, включая уменьшение количества бактерий, продуцирующих бутират, и Firmicutes, а также с нарушением целостности эпителиального барьера кишечника и повышенной проницаемостью кишечника [28, 31, 32, 33]. Повышенная транслокация LPS и эндотоксемия также наблюдаются при NIDDM, что, как и при ожирении, может способствовать слабому воспалению, которое способствует развитию инсулинорезистентности, связанной с NIDDM [27].
Как и при других заболеваниях, связанных с дисбактериозом кишечника, неясно, является ли несбалансированная микробиота причинным фактором или следствием диабета; однако различные исследования на людях и животных предполагают, что изменения в микробиоте могут предшествовать развитию IDDM. Было обнаружено, что у мышей с диабетом без ожирения (NOD) с диабетом уже в возрасте отъема состав микробиоты отличается от состава мышей NOD, у которых диабет не развивается [34]. Также было замечено, что распространенность IDDM зависит от общей бактериальной среды, в которой они содержатся.У мышей NOD в учреждениях GF развивается болезнь, в то время как у мышей в учреждениях, свободных от специфических патогенов (SPF), нет [29]. Когда кишечная микробиота мышей, содержащих SPF, переносится в мышей, размещенных в GF, диабет ослабляется [30]. Обоснование этих результатов связано с пониженной экспрессией MyD88 (первичный ответ миелоидной дифференцировки 88), универсального адапторного белка почти для всех Toll-подобных рецепторов (TLR). Было показано, что у мышей MyD88 — / — NOD в условиях SPF наблюдается изменение состава кишечной микробиоты и последующая потеря развития сахарного диабета по сравнению с таковыми в условиях GF.Это показывает, что развитие сахарного диабета зависит от состава комменсальных бактерий в кишечнике [30]. MyD88 также жизненно важен для бактериального восприятия и передачи сигналов о врожденном иммунном ответе, и предполагается, что подавление этого фактора может прервать развитие IDDM, предполагая, что микробные антигены и врожденная иммунная система связаны с патогенезом IDDM [30].
Расстройства аутистического спектра
Расстройства аутистического спектра (РАС) — это группа расстройств, которые включают аутизм и синдром Аспергера, которые характеризуются социальным и коммуникативным дефицитом, повторяющимся поведением и иногда когнитивными задержками [35].Точная причина РАС до сих пор в значительной степени неизвестна; однако есть серьезные основания полагать, что дисбактериоз кишечника может играть роль в патогенезе РАС, особенно при аутизме. Эта связь между РАС и дисбактериозом усиливается различными исследованиями, показывающими, что микробиота кишечника и ее метаболиты, по-видимому, влияют на центральную нервную систему (ЦНС) через ось кишечник-мозг (GBA), которая может сообщаться с ЦНС через нервную, эндокринную и нервную системы. и иммунные пути, влияющие на функции мозга и измененное поведение [36].Многочисленные эксперименты на моделях мышей показали, что измененная микробиота кишечника может вызывать синтез нейротоксинов, которые могут мешать развитию нервной системы, вызывая изменения в химии мозга, а также в поведении. Впоследствии эти связанные с дисбиозом нейрональные изменения приводят к таким поведенческим изменениям, как повышенная тревожность, депрессия и когнитивная дисфункция, которые являются характерными чертами РАС [35]. Эксперименты с использованием выбранных антибиотиков показали, что пробиотики, которые, как считается, помогают нормализовать микрофлору кишечника, также имеют тенденцию уменьшать беспокойство и улучшать когнитивные функции и поведение [37, 38], что показывает, что микробиота играет важную роль в развитии РАС.
У детей с аутизмом существует сильная корреляция между тяжестью заболевания и желудочно-кишечными расстройствами [39]. Общие желудочно-кишечные проблемы у аутичных детей включают боль в животе, диарею, вздутие живота, дисбактериоз кишечника и повышенную проницаемость кишечной мембраны [39]. Изучая ассоциированный с дисбиозом РАС, многочисленные исследования показали, что наблюдалось снижение количества Firmicutes и полезных бактерий, таких как Bfidobacteria и Prevotella, с увеличением количества Bacteroidetes и потенциально патогенных бактерий, таких как Proteobacteria и Clostridiales [38].Во многих исследованиях увеличение количества бактерий Clostridiales, предположительно некоторых избранных кластеров Clostridia, кажется, играет важную роль в развитии аутизма. Настоятельно предложенный механизм, в котором Clostridiales может способствовать распространению патогенеза аутизма, — это выработка пропионовой кислоты, одного из членов SCFA, которая может преодолевать физиологический барьер между кишечником и кровью и проникать через гематоэнцефалический барьер, где может изменяют функции в нескольких частях мозга, вызывая когнитивные нарушения и симптомы, обычно приписываемые аутизму [40].
Рак
Дисбактериоз кишечника также был связан с колоректальным раком (CRC), который является третьим по распространенности раком и второй по значимости причиной смерти от рака (для обоих полов вместе взятых) в Соединенных Штатах по данным Американского общества рака. CRC имеет несколько факторов риска, включая ВЗК, ожирение, диабет и диету с высоким содержанием жиров и белков, все из которых также связаны с дисбактериозом кишечника. Это предполагает, что дисбактериоз также может играть ключевую роль в патогенезе CRC.
У пациентов с CRC была обнаружена общая картина дисбиоза, которая включает уменьшение количества бактерий, продуцирующих бутират, наряду с увеличением доли некоторых потенциально патогенных бактерий.В различных литературных источниках было обнаружено уменьшение Proteobacteria, Bfidobacteria, Prevotella и снижение уровня продукции SCFA, в то время как наблюдается увеличение Firmicutes, Bacteroidetes, Enterobacteriaceae и Fusobacteria [41]. Различные исследования также показали, что два конкретных вида бактерий, Akkermansia muciniphila и Fusobacterium nucleatum , увеличиваются в тканях CRC [42]. Оба эти вида бактерий связаны с сильными местными воспалительными реакциями, которые могут быть связаны с заболеваниями, связанными с воспалением, и могут быть репрезентативными для высокого риска CRC. F. nucleatum также связан с повышенным количеством опухолей CRC, а также с метастазами в лимфатические узлы [42]. Также было обнаружено, что состав и количество в просвете доминирующих видов микробов, наблюдаемых при CRC-ассоциированном дисбиозе, различаются в зависимости от тяжести заболевания и стадии / статуса опухоли. Значительные различия наблюдались в микробном составе слизистой и фекалий между пациентами с CRC с полипами и пациентами с опухолями, причем наиболее значительным изменением было Enterobacteriaceae, которое было увеличено в слизистой оболочке пациентов с CRC с опухолями по сравнению с пациентами с полипами, и Bacteroidetes , который был увеличен в тканях CRC с опухолями, чем в тканях без опухолей [43].
Имеются убедительные доклинические экспериментальные данные, указывающие, что дисбиоз играет причинную роль в патогенезе CRC и онкогенезе у пациентов, чувствительных к CRC. Когда микробиота кишечника мышей с опухолями была трансплантирована мышам C57BL / 6 в установке GF, скорость онкогенеза в толстой кишке значительно увеличилась [44]. Манипуляции с кишечной микробиотой с помощью лечения антибиотиками также продемонстрировали важность микробиоты в статусе опухоли, показывая уменьшение количества и размера опухолей у чувствительных к CRC мышей при введении антибиотиков [41, 44].Эксперименты на мышах с дефицитом MyD88 показали снижение прогрессирования опухоли и неопластического развития [41] и предполагают, что MyD88 может передавать канцерогенный сигнал, который может быть одним из основных причинных факторов онкогенеза CRC.
Эксперименты с участием мышей GF, а также эксперименты с антибиотиками показывают, что изменения микробиоты кишечника во время дисбактериоза связаны с онкогенезом и, по-видимому, в значительной степени способствуют этому процессу. Различные исследования, изучающие роль дисбактериоза в развитии CRC, предложили несколько механизмов того, как это может происходить.Один из таких механизмов включает отсутствие SCFAs, количество которых значительно снижается в фекальной микробиоте в ходе развития CRC [41]. Когда бутират вводили в качестве добавки генетически восприимчивым мышам K-ras G12Dint , получавшим HFD, частота опухолей значительно снижалась [41], что позволяет предположить, что этот SCFA важен для защиты от онкогенеза. Другой предполагаемый механизм включает перепроизводство α-дефенсинов, которые представляют собой небольшие, богатые цистеином катионные белки, связанные с врожденным иммунитетом, которые важны для защиты от патогенов, включая многие грамотрицательные и грамположительные бактерии, грибы и вирусы в оболочке. а также участвует в передаче сигналов клеток и формировании кишечной микробиоты.У спорадических пациентов с CRC с аденоматозными полипами перепроизводство α-дефенсинов может вызывать дисбактериоз, поскольку существует корреляция, включающая уменьшение количества полезных бактерий, прикрепляющихся к слизистой оболочке, включая Bfidobacterium infantis , наряду с увеличением продукции α-дефенсина в этих пациенты [45]. Этот дисбиоз может привести к снижению регулирующей пролиферации эпителия толстой кишки, что является одним из преканцерогенных факторов, указывающих на потенциальную роль дисбактериоза в развитии CRC.Считается, что измененный метаболизм микробиоты, присутствующий при дисбактериозе, высвобождает токсичные метаболиты, что может быть связано с неопластическими изменениями в эпителиальных клетках кишечника. Считается, что дисбактериоз кишечника способствует обострению хронического воспаления, которое считается основной причиной развития колит-ассоциированного CRC [46]. Было высказано предположение, что усиленный иммунный ответ на антигены дисбиотической микробиоты кишечника может привести к этому хроническому, потенциально вызывающему CRC, воспалению [47].
3. Диета и микробиом
Диета является одним из наиболее важных факторов, влияющих на гомеостаз микробиоты кишечника, и играет важную роль с рождения, как показали исследования, показывающие различный микробный состав кишечника у младенцев, находящихся на грудном вскармливании и на искусственном вскармливании [ 48]. Определенные продукты питания и диетические компоненты были исследованы, чтобы определить тип воздействия, которое они оказывают на весь организм. В течение многих лет многие исследователи во всем мире находили влияние между диетой и заболеваниями, связанными с дисбактериозом, такими как ожирение, диабет и аллергические расстройства, однако недавние исследования показывают, что диета также может влиять на такие заболевания, как ВЗК, и определенные типы рака, такие как CRC.
При сравнении «западной» диеты, которая в основном состоит из животного белка с высоким содержанием сахара и насыщенных жиров, с аграрной диетой, которая в основном состоит из низкого животного белка и насыщенных жиров, а также высоких углеводов и простых сахаров, состав кишечника микробиота показала резкие различия: при анализе микробиоты людей, потребляющих западную диету, наблюдалось увеличение количества Firmicutes и Proteobacteria, а также некоторых Bacteroides, в то время как у людей, потребляющих аграрную диету, было повышенное количество актинобактерий, в основном Prevotella [49].У мышей было обнаружено, что диета с высоким содержанием жира / сахара приводит к дисбактериозу у мышей с измененной функцией барьера хозяина [2]. У людей, придерживающихся аграрной диеты, наблюдалось повышение уровней SCFA и снижение SCFAs у людей, придерживающихся западной диеты [49]. SCFA или летучие жирные кислоты синтезируются в толстой кишке в процессе ферментации пищевых волокон. Наиболее распространенные SCFAs включают уксусную, пропионовую и масляную кислоты. Считается, что SCFAs, в частности масляная кислота, защищают от появления потенциально патогенных кишечных бактерий, что указывает на то, что SCFAs могут быть регуляторным фактором возникновения дисбактериоза.Таким образом, показано, что диеты с высоким содержанием клетчатки имеют более высокое микробное разнообразие кишечника, в основном комменсальных бактерий, что ограничивает колонизацию потенциально патогенных бактерий, которые были связаны с различными заболеваниями, такими как ВЗК и CRC.
Недавние исследования показали, что витамин D является вероятным химиопротектором и снижает риск ВЗК и колита. Было показано, что у мышей с DSS-индуцированным колитом введение витамина D приводит к лучшему восстановлению веса, а также к уменьшению кровавой диареи [50].Витамин D способствует устойчивости эпителиальных клеток к травмам и подавляет воспалительные реакции, что важно для пациентов с ВЗК [50]. Витамин D также считается фактором регуляции бактериального гомеостаза кишечника. Исследования на мышах с дефицитом как витамина D, так и рецепторов витамина D (VDR) показали изменения состава кишечной микробиоты с уменьшением Lactobacilli и Firmicutes и увеличением Clostridium и Bacteroidetes в фекальном стуле по сравнению с мышами WT [51– 54].Лактобациллы — это грамположительные ферментативные бактерии, которые продуцируют молочную кислоту, которая оказывает противовоспалительное и противоопухолевое действие, балансируя гомеостаз кишечника [51]. Дефицит витамина D с уменьшением количества бактерий, продуцирующих молочную кислоту, и увеличением количества потенциально патогенных бактерий может увеличить риск хронического воспаления и последующего развития CRC, связанного с колитом. Витамин D также показал, что у мышей защищает от колонизации патогенными бактериями, поддерживая барьерную функцию кишечного эпителия [52, 53].У мышей с дефицитом витамина D возникает дисфункция кишечного эпителиального барьера, что позволяет патогенным бактериям, таким как AIEC, колонизировать кишечник, вызывая дисбактериоз и способствуя развитию воспаления, связанного с дисбактериозом, что увеличивает риск CD [52, 54].
Высокое потребление цельного зерна и пищевых волокон демонстрирует сильную обратную корреляцию с риском КРР, наряду с уменьшением воспаления и снижением риска других заболеваний, таких как сердечно-сосудистые заболевания (ССЗ), диабет, прогрессирующий КРР и заболевания, связанные с ожирением [55 ].В 2011 году Всемирный фонд исследований рака / Американский институт исследований рака (WCRF / AICR) пришел к выводу, что клетчатка «вероятно» уменьшит колоректальную неоплазию, при этом клетчатка обратно пропорциональна CRC [56]. Цельное зерно богато фенольными соединениями, наиболее распространенным из которых является феруловая кислота (ФК). Волокно в цельнозерновых продуктах доставляет ЖК в кишечник, где они медленно и непрерывно высвобождаются микробиотой кишечника, которая также превращает ЖК в циркулирующую дигидроферуловую кислоту (ДГФА) [55].Считается, что ЖК и ДГК защищают от неопластических изменений эпителиальных клеток толстой кишки [57], а также от повышения иммунного ответа, и было показано, что они, возможно, снижают риск заболеваний, связанных с ожирением, при длительном употреблении цельного зерна. . Повышенный уровень ЖК может иметь прямое противомикробное действие в отношении потенциально патогенных бактерий [55]. Наряду с этими кислотами, потребление цельного зерна снижает выработку TNFα вместе с увеличением количества Bacteroides и Lactobacillus, что помогает уменьшить субклиническое воспаление [55].
Уменьшение количества клетчатки связано с более высоким риском прогрессирующего CRC [58]. Было показано, что у пациентов с прогрессирующим CRC в микробиоте кишечника уменьшилось количество бактерий, продуцирующих бутират, что вызывает меньшую ферментацию SCFA в кишечнике, что может привести к образованию продвинутого CRC. Напротив, повышенное потребление клетчатки показало увеличение количества бактерий, продуцирующих бутират, и в целом сбалансированную микробиоту кишечника по сравнению с людьми с пониженным содержанием клетчатки, что указывает на важную роль клетчатки в снижении риска CRC, а также ее роль в поддержании микробного гомеостаза кишечника [ 56, 58].Было показано, что бутират, один из наиболее важных SCFAs, обладает противоопухолевым действием, ингибируя пролиферацию неопластических клеток, ограничивая ангиогенез опухоли и индуцируя апоптоз [59]. Рацион с высоким содержанием цельного зерна и клетчатки может влиять на микробиоту кишечника на уровне филума, в частности, вызывая снижение содержания Bacteroides при длительном потреблении и увеличение количества Bfidobacteria и Roseburia , оба из которых являются бактериями, продуцирующими бутират. влияют на иммунитет и воспалительные функции на животных моделях.В исследованиях, посвященных изучению роли диеты с высоким содержанием белка / низким содержанием углеводов (ВЭЖХ) по сравнению с диетами с высоким содержанием белка / умеренным содержанием углеводов (НРМС), присутствие клетчатки и неперевариваемых углеводов способствует предотвращению развития CRC [57]. Полагают, что это частично связано с повышенной ферментацией SCFA, которая может влиять на толстую кишку, способствуя секреции слизи и модулируя воспалительный иммунный ответ. Эти исследования также показали, что диета с ГПМЦ модулирует образование потенциально канцерогенного N-нитрозосоединения (NOC), на которое ранее считалось, что на него влияет только повышенное потребление мяса и белка, однако эти исследования показывают, что величина эффектов NOC зависит от количество съеденных углеводов; с повышенным потреблением углеводов происходит меньшее образование NOC и, следовательно, снижается риск образования CRC.Некоторые исследования показали, что влияние пищевых волокон на снижение риска колоректальной неоплазии может иметь половые различия, показывая, что мужчины могут получить больше пользы от воздействия клетчатки, чем женщины. Предполагается, что у женщин клетчатка снижает уровень эстрогена, что может защищать от неопластических изменений эпителиальных клеток [60]. Другая гипотеза относительно того, почему могут быть половые различия в влиянии клетчатки, заключается в том, что женщины более склонны к развитию чисто правосторонних (проксимальных) полипов, чем мужчины. Если волокно более эффективно предотвращает появление левосторонних (дистальных) полипов, это может объяснить, почему произошли эти различия [60, 61].
Было показано, что увеличение потребления клетчатки из фруктов и овощей обладает химиозащитным действием и связано с увеличением микробного разнообразия кишечника и снижением риска колоректального рака [56]. Было показано, что люди с диетой с высоким содержанием овощей имеют меньшую вероятность развития ВЗК, а также повышенного риска КРР [58, 59]. Большинство исследований показывают, что овощи обратно пропорциональны риску рака, однако некоторые исследования показывают, что только вареные листовые овощи имеют этот эффект, но не все овощи [62].Существует также различие между полами в потреблении фруктов и овощей, причем эти две группы продуктов обратно пропорциональны риску КРР у мужчин, но не у женщин [62]. Потребление красного вина также было изучено, чтобы показать, что его потребление может значительно изменить микробное разнообразие кишечника у людей, показывая увеличение количества пробиотических бактерий, таких как Prevotella, Proteobacteria и Bfidobacteria, и уменьшение количества потенциально патогенных бактерий, таких как Clostridium [63], которые являются наиболее распространенными. результат присутствия полифенолов в вине.Полифенолы присутствуют во многих продуктах питания, таких как вино, чай, фрукты, овощи и шоколад, и обычно попадают в толстую кишку неповрежденными, где они могут выполнять регулирующие функции и антимикробные свойства, которые изменяют микробиоту кишечника [63]. Помимо снижения риска рака, полифенолы также связаны со снижением артериального давления и уровня холестерина, а также со снижением риска сердечно-сосудистых заболеваний, включая сердечно-сосудистые заболевания, инсульт и аневризму аорты.
4. Генетика и дисбиоз
Наряду с факторами окружающей среды, такими как диета, генетические компоненты также сильно связаны с развитием дисбиоза.Это наиболее распространено при дисбактериозе, связанном с CD. Используя общегеномные исследования ассоциации (GWAS), в настоящее время существует более 160 локусов, связанных с ВЗК, однако в этом обзоре рассматриваются только варианты IL-10 / IL-10R, которые были связаны с ранним началом ВЗК, а также варианты. NOD2 и ATG16L1, двух наиболее изученных генов восприимчивости к IBD и связанных с ними белков, которые, как было обнаружено, увеличивают риск CD через измененное взаимодействие с микробиотой кишечника.
NOD2
Первый идентифицированный ген восприимчивости к CD, домен нуклеотидной олигомеризации 2 (NOD2), также известный как NOD2 / CARD15 (белок 15, содержащий домен рекрутирования CAspase), расположен на хромосоме человека 16q12 и синтезирует белок NOD2, который действует как тип белка. патоген-ассоциированный молекулярный паттерн (PAMP) и специфически распознает мурамилдипептид (MDP), который является компонентом клеточной стенки бактериального пептидогликана, присутствующего как в грамположительных, так и в грамотрицательных бактериях.NOD2 экспрессируется во многих типах клеток, включая дендритные клетки, макрофаги, клетки Панета, а также эпителиальные клетки кишечника и эпителиальные клетки в легких и полости рта [64]. Белок NOD2 важен для врожденного иммунитета и микробной регуляции, где он участвует в распознавании патогенов и защите от этих организмов [65]. MDP связывает и активирует NOD2, который затем локализуется на плазматической мембране и инициирует сигнальные каскады, рекрутируя рецептор-взаимодействующий белок 2 (RIP2), с последующей активацией митоген-активируемой протеинкиназы (MAPK) и ядерного фактора каппа B (NF-κB). каскады, приводящие к высвобождению провоспалительных молекул, которые помогают убить патогенные бактерии [66].NOD2 также необходим для экспрессии дефенсинов специализированными эпителиальными клетками, называемыми клетками Панета, которые расположены в криптах тонкого кишечника [65]. Более того, NOD2 важен для индукции аутофагии в эпителиальных клетках, направляя ATG16L1 (связанный с аутофагией 16-подобный 1) белок к плазматической мембране, чтобы индуцировать образование аутофагосом [66] []. Функционирование NOD2 важно как для грамположительной, так и для -отрицательной регуляции бактерий и помогает предотвратить колонизацию патогенными бактериями и дисбактериоз.
Нормальные и измененные функции NOD2A. Нормальные функции NOD2. Нормальный вариант NOD2 активируется мурамилдипептидом, который является компонентом стенок бактериальных клеток. Активированный NOD2 рекрутирует взаимодействующий с рецептором белок 2 (PIP2), который затем активирует каскады митоген-активированной протеинкиназы (MAPK) и ядерного фактора каппа B (NFκB). Это приводит к высвобождению провоспалительных молекул, которые помогают убить патогенные бактерии ( Left ). Активированный NOD2 также направляет связанный с аутофагией 16-подобный 1 (ATG16L1) белок из цитоплазмы к плазматической мембране, чтобы инициировать образование аутофагосом ( Right ).
B. Мутировавшие варианты NOD2 вызывают ухудшение восприятия и распознавания MDP. Без этой активации не происходит RIP2 и результирующее высвобождение цитокинов ( Left ). Без активного NOD2 ATG16L1 не направляется к плазматической мембране и остается в цитозоле, что нарушает образование аутофагосом и приводит к нарушению уничтожения вторгающихся бактерий ( Right ). Варианты NOD2 и их нарушение клеточных функций могут приводить к дисбактериозу кишечного эпителия и связаны с более ранним началом болезни Крона подвздошной кишки.
Существует три варианта гена NOD2, которые связаны с повышенным риском восприимчивости к CD: две миссенс-мутации (R702W и G908R) и одна мутация сдвига рамки считывания (L1007fsinsC) [66]. Эти вариации изменяют домен богатого лейцином повтора (LRR) или соседнюю область, что вызывает значительное снижение или полную потерю функции NOD2 [67]. NOD2 играет важную роль в регулировании кишечной микробиоты в кишечнике, регулируя колонизацию и подавляя условно-патогенные микроорганизмы. Было показано, что мыши NOD2 WT быстро очищают патогены, такие как Helicobacter hepaticus , однако у мышей NOD2 KO клиренс этого патогена был задержан и увеличилось количество H.hepaticus в терминальном отделе подвздошной кишки был значительно выше, чем у мышей WT [68]. Без NOD2 нарушается восприятие и распознавание бактериального MDP, и эти бактерии не могут быть нейтрализованы, поэтому они продолжают расти в кишечнике, вызывая дисбактериоз. Этот дисбактериоз изменяет микробные взаимодействия хозяина в слизистой оболочке подвздошной кишки, что приводит к усилению воспалительной реакции, которая может привести к БК. У людей мутации NOD2, в частности мутация NOD2 со сдвигом рамки считывания, тесно связаны со снижением экспрессии α-дефенсина в клетках Панета, что ухудшает его антибактериальную функцию, увеличивает риск инфекции и приводит к усилению воспаления, связанного с CD [ 64].Мутации NOD2 также могут нарушать аутофагию: вариант NOD2 со сдвигом рамки считывания (L1007fsinsC) и белок ATG16L1, его проводники, остаются в цитозоле и никогда не локализуются на плазматической мембране для инициации образования аутофагосом [66]. У людей, гомозиготных по одному из трех основных вариантов NOD2 (R702W, G908R и L1007fsinsC), риск БК увеличивается в 20 раз, однако менее двадцати процентов пациентов с БК гомозиготны по варианту NOD2 [69], что показывает, что Варианты NOD2 не являются единственными причинными факторами CD.Однако эти три варианта NOD2 связаны с возникновением фибростенотической CD тонкой кишки [70].
NOD2 и комменсальные бактерии регулируют друг друга. У мышей без микробов (GF) экспрессия NOD2 в терминальном отделе подвздошной кишки была ниже по сравнению с мышами SPF [71]. После того, как мышей GF восстановили комменсальными бактериями, уровни экспрессии NOD2 в подвздошной кишке значительно увеличились, что указывает на то, что комменсальные бактерии положительно регулируют NOD2, в то время как функция NOD2 отрицательно регулирует комменсальную флору [71].Без этих отношений нарушается гомеостаз кишечника или дисбактериоз. У мышей с нокаутом NOD2 (- / -) обнаружен дисбактериоз в терминальном отделе подвздошной кишки с увеличением количества комменсальных бактерий наряду с повышением восприимчивости к патогенным бактериям. Это связано с неспособностью регулировать комменсальные бактерии и предотвращать колонизацию патогенных бактерий. У мышей NOD2 — / — измененная микробиота кишечника наблюдалась в слизистой оболочке терминальной части подвздошной кишки, в основном состоящая из увеличения Bacteroides и Firmicutes по сравнению с мышами NOD2 WT, у которых было едва обнаруживаемое количество этих родов бактерий [68, 72].Эти данные также коррелируют с тем, что наблюдалось у людей с дефицитом NOD2 [60]. Было также показано, что у мышей с CD-ассоциированными вариантами NOD2 увеличилось количество Enterobacteriaceae [73]. Существует также эффект дозировки аллелей, который наблюдается при дефиците NOD2, со значительной корреляцией между количеством аллелей риска NOD2 и повышенным количеством присутствующих Enterobacteriaceae [73]. Пациенты с CD, у которых есть мутации NOD2, показали неэффективное распознавание Mycobacterium avium paratuberculosis (MAP), патогенной бактерии, которая обнаружена у значительного меньшинства пациентов и может быть связана с образованием гранулемы [74].
ATG16L1
Ген ATG16L1 кодирует белок ATG16L1, который важен для аутофагии и образования аутофагосом [66]. ATG16L1 экспрессируется в кишечном эпителии, антигенпрезентирующих клетках, Т-клетках и В-клетках [65]. Обычно он обнаруживается в цитозоле до тех пор, пока он не рекрутируется NOD2 и не направляется к плазматической мембране, где он рекрутирует 1A / 1B-легкую цепь 3 (LC3) для инициации образования аутофагосом [66]. Также было показано, что ATG16L1 играет роль как у мышей, так и у людей, регулируя секрецию гранул в клетках Панета, что может влиять на состав микробиоты кишечника [75].
Однонуклеотидный полиморфизм (SNP) в гене ATG16L1, который изменяет треонин на аланин (T300A), вызывает снижение или отсутствие экспрессии белка ATG16L1 [66]. Как у людей, так и у мышей, гомозиготных по аллелю риска, не было аномалий морфологии подвздошной кишки, но были выявлены аномалии секреции гранул клеток Панета [75]. С истощением ATG16L1 в клетках Панета значительно уменьшилось количество антибактериальных гранул, которые он обычно секретирует, что вызывает нарушение регуляции микробиоты в кишечнике и может привести к CD-ассоциированному дисбиозу.Уменьшение или отсутствие ATG16L1 также вызывает нарушение роли NOD2 в формировании аутофагосом, которая является ATG16L1-зависимой для этого процесса. Без ATG16L1 происходит отсутствие инфицированной бактериями цитоплазматической аутофагии, что дает вторгшимся бактериям возможность чрезмерно колонизировать и приводить к дисбактериозу эпителия кишечника, что может привести к воспалению и повышенному риску развития БК.
Подобно полиморфизму NOD2, варианты ATG16L1 связаны с нарушением бактериального клиренса посредством аутофагии против внутриклеточных бактерий, а также имеют эффект дозировки аллелей на кишечную микробиоту [76].Было показано, что дефицит ATG16L1 связан с увеличением восприимчивости к штамму Helicobacter pylori s1m1, что приводит к хроническому воспалению, которое может создавать проканцерогенную среду [77]. Также было замечено, что в клетках с дефицитом ATG16L1 наблюдалось значительное увеличение адгезивно-инвазивного штамма LF82 E. coli (AIEC), который был выделен из илеоцекальных поражений пациентов с БК с активным воспалением [78]. Другая работа показала, что снижение аутофагии подвздошных бактерий в ATG16L1-дефицитных клетках не является патоген-специфичным [76, 78].Следует отметить, что дефицит ATG16L1 связан с повышенной инвазией условно-патогенных микроорганизмов, некоторые из которых были протестированы: Mycobacterium tuberculosis и Streptococcus pyrogenes [78]. Повышенное количество внутриклеточных патогенных бактерий вызывает дисбаланс в микробиоте кишечника, этот дисбактериоз затем может привести к хроническому воспалению, которое увеличивает риск развития таких заболеваний, как ВЗК, и может стать канцерогенной средой.
IL-10 / IL-10R
IL-10 (интерлейкин-10) представляет собой противовоспалительный цитокин, который секретируется в основном моноцитами / макрофагами, но также может продуцироваться лимфоцитами, такими как клетки Th3 и некоторые регуляторные Т-клетки. / В-клетки.Экспрессия IL-10 важна для иммунного гомеостаза слизистых оболочек в желудочно-кишечном тракте как мышей, так и людей, где он инициирует каскад, чтобы в конечном итоге ограничить чрезмерные иммунные ответы и воспаление кишечника. Этот каскад инициируется, когда IL-10 связывается с IL-10R (рецептор IL-10), который представляет собой белок, состоящий из двух альфа (IL-10RA) и двух бета (IL-10RB) субъединиц. Когда IL-10 связывается с этими рецепторами, активация JAK1 и TYK2 приводит к фосфорилированию STAT3, который затем перемещается в ядро и подавляет экспрессию провоспалительных генов [79].Этот каскад важен для ограничения избыточного количества клеток Th27 (Т-хелперов 17) в слизистой оболочке, чрезмерное размножение которых связано с CD [79, 80]. IL-10 также ограничивает секрецию провоспалительных цитокинов, таких как TNFα и IL-12, которые способствуют вредному воспалению в кишечнике [81].
Генетические мутации в генах IL-10 и IL-10R приводят к потере функциональных мутаций в белках IL-10 и IL-10R, соответственно, и были связаны с ранним началом IBD (EO-IBD), которые может поражать детей в возрасте от нескольких месяцев до восемнадцати лет.Наряду с ВЗК и воспалением толстой кишки у пациентов с ЭО-ВЗК могут также развиться перианальные заболевания, респираторные заболевания, артрит, а также могут быть абсцессы, свищи и язвы слизистой оболочки кишечника [82, 83]. Сообщалось о большом количестве мутаций белковых субъединиц IL-10R, начиная от аминокислотных замен, делеций, точечных мутаций и мутаций сдвига рамки считывания, приводящих к преждевременному стоп-кодону [79, 83]. Эти мутации вызывают дефект IL-10-опосредованного противовоспалительного сигнального каскада как у мышей IL-10R — / -, так и у людей, что приводит к тяжелому воспалению кишечника и увеличению провоспалительных цитокинов, особенно к увеличению TNFα, из периферической крови мононуклеарные клетки [81, 84].Отсутствие противовоспалительного ответа и последующее увеличение провоспалительных цитокинов особенно сильно проявляется в кишечнике, где присутствие комменсальных бактерий приводит к сильному нерегулируемому иммунному ответу, который вызывает гипервоспалительное состояние и приводит к развитию ранней инфекции. начало ВЗК [79–81, 83]. Потеря сигнального каскада IL-10 на врожденных клетках также может нарушать перекрестные помехи с Т-клетками, что приводит к дальнейшему нарушению иммунного баланса слизистой оболочки и в большей степени способствует воспалению кишечника [80].
Пациенты с ЭО-ВЗК обычно не отвечают на иммуносупрессивные терапии, такие как кортикостероиды и талидомид [81, 82], однако, поскольку дефекты у пациентов с метаболическим путем IL-10 / IL-10R связаны с клетками гемопоэтического происхождения, аллогенными гемопоэтическими стволовыми клетками Трансплантация (ТГСК) была предпочтительным вариантом лечения. Как от семейных, так и от неродственных доноров, ТГСК до сих пор показала себя успешной, у пациентов с ЭО-ВЗК наступала ремиссия [81, 82]. Этот вариант лечения кажется многообещающим, однако один обзор показал, что частота отторжения первичного трансплантата была высокой, и предполагает, что пациенты с EO-IBD имеют режим трансплантации гаплоидентичного костного мозга с Т-клетками и посттрансплантационным циклофосфамидом для снижения частоты отказа [83].
5. Симбиотическое вмешательство
Значительный прогресс, достигнутый за последние годы в понимании перекрестных помех между хозяином и микробами, профилей / сигнатур микробиома и молекулярных методов исследования кишечной микробиоты, облегчил разработку и проведение мероприятий по обращению вспять побочных эффектов, опосредованных микробиотой. во время болезненного состояния. Классические вмешательства включают такие соединения, как диета (как описано в разделе выше) и антибиотики, которые оказывают прямое воздействие на гомеостаз микробиома кишечника.В качестве альтернативы, можно также прямо или косвенно ввести экзогенные бактерии для воздействия на эндогенную кишечную бактериальную флору хозяина и ее изменения. Они могут проявляться в форме пробиотиков, трансплантации фекальной микробиоты и изменений окружающей среды в бактериальной флоре, которые создают симбиотическое вмешательство со своими преимуществами и недостатками []. Они могут оказывать сильное воздействие на хозяина и микробное сообщество кишечника, такое как 1) облегчение образования биопленки за счет усиления микробной коагрегации, 2) выработка бактериоцинов, обладающих избирательным антимикробным действием, 3) стимуляция иммунитета хозяина и 4) усиление барьерной функции кишечника через эпителиальные клетки хозяина.
Преимущества и недостатки различных симбиотических вмешательств микробной флоры кишечникаЭкзогенные бактерии могут влиять на дисбиотический кишечник для восстановления здоровой флоры. Эти экзогенные бактерии могут быть введены в виде пробиотиков или трансплантации фекальной микробиоты, что имеет свои преимущества и недостатки. Микробы, присутствующие в окружающей среде, также могут изменять состав эндогенного микробиома кишечника и обеспечивать восприимчивость к болезням или защиту.
Пробиотики
Пробиотики — это живые, в основном грамположительные бактерии (например, Bifidobacteriaum spp ., Lactobacillus spp ., Lactococcus spp ., Pediococcus spp . И другие непатогенные штаммы E и другие непатогенные штаммы E. coli ). Обычно они способствуют целостности кишечного барьера, предотвращают бактериальную транслокацию в кишечнике и уменьшают воспалительную реакцию. Однако было высказано предположение, что эффекты пробиотиков могут быть временными, поскольку было показано, что введение Lactobacillus plantarum может привести к увеличению количества Lactobacillus в кале с течением времени, но не в биопсии кишечника [ 85].Тем не менее, хотя и преходящий, ответ in vivo человека показал, что эффекты L. plantarum могут быть драматичными для хозяина, чтобы установить иммунную толерантность путем изменения профиля экспрессии гена слизистой оболочки кишечника, в основном с участием NF-kB-зависимого пути [ 86]. Помимо изменений в транскриптоме гена-хозяина, пиросеквенирование фекалий здоровых людей, получавших пробиотики (три пробиотических штамма: Lactobacillus rhamnosus CNCM I-4036, Lactobacillus paracasei CNCM I-4034 и Bifidobacterium breve CNCM I-4035). сообщалось об изменении общей численности кишечной флоры в здоровых условиях [87].
В контексте болезни пробиотики в форме ферментированного молока могут вызывать увеличение веса у людей с тяжелым острым недоеданием, модулируя эндогенную микробиоту кишечника [88]. Это будет полезно для развивающихся стран с высоким риском недоедания, особенно у детей. Однако введение других определенных штаммов пробиотиков может иметь эффект против ожирения. Например, потребление L. plantarum и L. gasseri приведет к потере веса за счет подавления нескольких гормональных путей [88].Это означает, что разные штаммы пробиотиков могут оказывать разные эффекты, и, следовательно, тип бактерий, которые нужно добавлять, необходимо тщательно охарактеризовать и выбрать для достижения желаемого эффекта. Этим Шен и др. Недавно продемонстрировали доказательную концепцию, в которой определенный консорциум из 8 бактерий (измененная флора Шадлера; АЧС) может снизить нейротоксичность и энцефалопатию, связанные с гипераммонемией [89]. Эти АЧС обладают минимальным эффектом уреазы, и заселение этого консорциума способствовало созданию нового сообщества бактерий, которое способствует долгосрочному снижению активности уреазы и выработке аммиака.Это приводит к снижению выработки аммиака и диоксида углерода в результате метаболизма мочевины, полученной из организма хозяина, с помощью уреазы бактериального происхождения. Аналогично, при воспалении кишечника, молочный продукт с пятью бактериальными штаммами, как сообщается, улучшает степень колита у мышей T-bet — / — × Rag2 — / — за счет изменения состава эндогенных бактерий кишечника [90]. Недавние последующие исследования той же группы впоследствии идентифицировали Lactococcus lactis I-1631 одного достаточно для облегчения колита, что было проверено на трех доклинических моделях колита на мышах [91].Колонизация L. lactis в кишечнике не является необходимой для лечения колита, скорее, опосредованный лизоцимом лизис хозяина во время колита приводит к высвобождению супероксиддисмутазы L. lactis , что снижает окислительный стресс во время воспаления. Это говорит о том, что бактерии могут приносить пользу хозяину, но для проявления этих полезных эффектов потребуются определенные производные от хозяина факторы.
Недостаток пробиотиков более количественный. Пероральные дозы пробиотиков значительно меньше (обычно в 3-4 раза), чем те, которые присутствуют в толстой кишке, и количество, которое в конечном итоге достигнет толстой кишки, будет еще больше уменьшаться при прохождении через тяжелые условия желудка и тонкой кишки.Кроме того, большинство используемых штаммов пробиотиков происходит из кишечника (например, Lactobacilli , Bifidobacteria и Escherichia ). Эти штаммы могли потерять свою адаптацию к кишечной среде во время культивирования ex vivo .
Трансплантация фекальной микробиоты
Трансплантация фекальной микробиоты (FMT; также известна как фекальная бактериотерапия или фекальная инфузия) — новый метод лечения пациентов с дисбактериозом. В этом методе используется принцип прививки микробиоты от здоровых доноров пациенту-реципиенту для повторного введения или восстановления стабильной среды, которая влияет как на эндогенные микробы, так и на хозяина.Отношения между донором и пациентом, по-видимому, не влияют на результат [92,93]. Первоначально FMT проводился с помощью фекальных клизм, впоследствии также с помощью назодуоденальных трубок (1991 г.) и колоноскопии (2000 г.). Недавние сообщения продемонстрировали разработку капсулированного замороженного инокулята, который можно вводить перорально без явных побочных эффектов и, таким образом, избежать ненужных инвазивных желудочно-кишечных процедур (2012) [94].
Примечательно, что лучший пример того, как FMT может облегчить течение болезни, — это инфекция Clostridium difficile (CDI), показатель излечения которого превышает 90–95% во всем мире [95].Пациенты с ИКД обычно продолжают принимать противомикробные препараты до 2–3 дней до FMT. Донорский стул, который обычно обрабатывают и используют в течение 8 часов после пассажа, суспендируют в небактериостатическом солевом растворе и фильтруют для удаления крупных твердых частиц. Пост-FMT приводит к размножению и восстановлению бактерий, полученных от донора, у пациента в течение от 2 недель до 1 месяца [96]. В настоящее время FMT рассматривается при других заболеваниях, таких как инсулинорезистентность, а также IBD [26, 97]. У пациентов с ВЗК, получающих FMT, может развиться лихорадка и временное снижение уровня С-реактивного белка [98].Временная характеристика FMT у пациентов с ВЗК показала сдвиг в сторону донорских филотипов реципиента, включая Faecalibacterium prausnitzii , Rosebura faecis и Bacteroides ovatus , которые продуцируют противовоспалительные и / или короткоцепочечные жирные кислоты. Этот эффект может проявиться через 3 дня после трансплантации и сохраняться до 12 недель [98]. Таким образом, такой анализ микробного профиля после FMT с временным разрешением может быть использован для определения эффективности колонизации и мониторинга успешности FMT.
Однако вероятность успеха FMT при ВЗК намного ниже, чем при сравнении с ИКД: 62–71% пациентов с ВЗК достигают разрешения или уменьшения симптомов [97]. Данные, собранные для FMT при ВЗК, обычно выполняются на небольших когортах и, следовательно, также не имеют стандартизированных процедур, включая отбор доноров и подготовку образцов. Другой проблемой для FMT при ВЗК является способ введения, который будет зависеть от типа дисбактериоза. Например, Bacteroidetes может быть разрушен желудочной кислотой, и, таким образом, использование более низкого пути введения будет предпочтительным при выполнении FMT.Напротив, переход через верхние отделы желудочно-кишечного тракта необходим для того, чтобы определенные спорообразующие Firmicutes были эффективны функционально [99]. Другие общие проблемы, связанные с FMT, включают безопасность, стоимость, этическое принятие и риски, включая возможную передачу инфекционных агентов.
Экологические вмешательства
Окружающая среда оказывает глубокое влияние на микробиоту кишечника, обеспечивая общий гомеостаз, который начинается сразу после рождения. Состав / профиль микробиома детей, родившихся с помощью кесарева сечения, отличался от тех, которые родились естественным путем; первые сначала подвергаются воздействию бактерий из больничной среды, тогда как вторые сначала колонизируются материнскими фекальными и вагинальными бактериями [100].Было показано, что у детей, рожденных после кесарева сечения, отсутствует видов бифидобактерий, видов, которые важны для развития постнатального иммунитета, по сравнению с младенцами, родившимися через естественные родовые пути, у которых наблюдается преобладание этих видов [101].
Постнатально «гипотеза гигиены» впоследствии определяет развитие и изменения гомеостаза кишечника. Он основан на необходимости для развивающихся младенцев подвергаться воздействию большого количества как патогенных, так и комменсальных микроорганизмов, чтобы их иммунная система развивалась и функционировала должным образом.Это, очевидно, подтверждается многими исследованиями с использованием моделей на животных, демонстрирующих, как отсутствие воздействия микробов в раннем возрасте влияет не только на развитие иммунитета, но также контролирует созревание и функцию других органов, включая центральную нервную систему. Воздействие микробов в раннем возрасте оказывает стойкое влияние на инвариантные естественные Т-клетки-киллеры (iNKT) и реакцию на такие заболевания, как ВЗК и астма [102]. У поросят микробное разнообразие окружающей среды влияет на количество CD4 + , CD4 + CD25 + эффекторных Т-клеток и CD4 + CD25 + Foxp3 + регуляторных Т-клеток, а также сыворотки. Ответ антител IgG [103].Вклад микробов окружающей среды в развитие болезни также очевиден во многих спонтанных моделях ВЗК, например, в α-цепи Т-клеточного рецептора (TCR-α) — / — мышей, у которых заболевание развивается не в условиях GF, а, скорее, в SPF и CV среды [102]. Помимо контроля иммунного ответа, микробы окружающей среды также влияют на развитие и функцию клеток-хозяев. Недавно Erny et al. Сообщили, что мыши GF обнаруживают глобальные дефекты в микроглии, а также в морфологии и нарушают клеточные сети [104].Они определили, что микробная продукция SCFA и продукты ферментации микробиоты присутствуют у мышей SPF, но не GF, и являются ключевыми детерминантами этой причины, поскольку повторное введение этих компонентов в мыши GF может спасти фенотип.
В более позднем возрасте такой образ жизни также может способствовать развитию дисбактериоза, связанного с окружающей средой. Например, кишечная микробиота людей и мышей демонстрирует суточные колебания, на которые могут влиять ритмы кормления или индукция смены часовых поясов.Смена часовых поясов вызывает дисбактериоз как у человека, так и у мышей и приводит к непереносимости глюкозы и ожирению [105]. Перенос аберрантной флоры через FMT мышам GF приведет к такому же фенотипу. В совокупности все эти примеры показывают, что изменение микробного статуса окружающей среды может либо способствовать развитию болезни, либо обеспечивать защиту. Улучшение нашего понимания всех этих факторов, а также создание основных исследовательских групп микробиома, таких как Проект человеческого микробиома, поддерживаемый Национальными институтами здравоохранения (NIH) в США, и проект MetaHIT (Метагеномика кишечного тракта человека), учрежденный Международный консорциум микробиома человека (IHMC) в Европе поможет лучше облегчить разработку плана вмешательства против дисбактериоза.
Дисбактериоз — обзор | Темы ScienceDirect
36.5.2 Дисбиоз
Дисбиоз часто определяют как «дисбаланс» микробного сообщества кишечника, связанный с заболеванием. Этот дисбаланс может быть вызван приростом или потерей членов сообщества или изменениями в относительной численности микробов. Эта теория в первую очередь фокусируется на изменениях в таксономическом составе микробного сообщества и функциях, связанных с отдельными членами или подмножествами членов сообщества. 126 Характеристика дисбиоза традиционно основывалась на таксономических каталогах кишечных микробов, созданных у разных людей в отдельные моменты времени с использованием секвенирования 16S или 18S рРНК. 127 Более поздние попытки были попытаться каталогизировать не виды микробов, а скорее микробные гены в кишечнике с использованием метагеномики дробовика. 128,129 Таксономическая характеристика или генетический состав сообщества затем используется для вывода его функций на основе литературных данных исследований с использованием эталонных штаммов микробов.Обычно эти модельные микробы изучаются как отдельные организмы и часто in vitro, чтобы получить эти функциональные данные.
Огромное количество исследований выявило значительные различия в таксономическом составе кишечных микробных сообществ между пациентами с ВЗК и здоровыми людьми из контрольной группы. 130 Эти различия были выявлены в бактериальном, грибковом и вирусном компонентах сообщества. 131,132 Однако конкретные таксономические различия микробов широко варьируются в зависимости от исследований, и окончательная структура сообщества, связанного с заболеванием, не установлена.Это может быть связано с большими различиями в составе микробного сообщества кишечника среди людей и / или с техническими различиями между исследованиями. Поэтому пока неясно, как определить дисбактериоз и диагностировать «дисбиотическое сообщество». Также неясно, является ли дисбактериоз причиной, следствием или одновременно причиной и следствием заболевания, поскольку воспаление само по себе может приводить к изменениям в составе микробного сообщества в кишечнике. 133
Дисбиоз может вызывать или способствовать развитию ВЗК несколькими способами.Это может привести к появлению одного или нескольких микробов с функциями, вредными для хозяина, или потере одного или нескольких микробов с функциями, полезными для хозяина. Поскольку многие микробы в кишечном сообществе имеют важные функциональные отношения друг с другом, изменения в небольшом количестве микробов и / или их функциях могут иметь широкое влияние на сообщество. Конкретные функции, которые могут представлять интерес, включают изменения доступности ниш или характеристик, которые влияют на принятие или устойчивость к колонизации, изменения микробных продуктов или физических характеристик, которые изменяют взаимодействия между бактериями или с хозяином, и изменения в сообществе, которые активируют механизмы вирулентности в в противном случае комменсальные микробы.Наиболее устойчивой характеристикой микробных сообществ больных пациентов является потеря таксономического разнообразия. 134 Однако снова неясно, является ли потеря биоразнообразия в кишечнике причиной или следствием заболевания. Также в настоящее время неясно, как такая потеря разнообразия сама по себе может привести к заболеванию, тем более что животные-гнотобиоты, колонизированные одним или небольшим количеством микробов, не проявляют болезни, связанной с колонизацией только ограниченным сообществом. Это говорит о том, что конкретные микробы в сообществе и их функции имеют первостепенное значение.
Состав и поведение микробного сообщества чрезвычайно чувствительны к окружающей среде. 9 Среда кишечного микробного сообщества состоит как из компонентов, полученных из организма хозяина, так и из проглоченных веществ. Каждый из этих факторов может иметь огромное влияние на состав и поведение кишечного микробного сообщества. Компоненты, производные от хозяина, определяются генетикой хозяина и, возможно, воздействием диеты или других проглоченных веществ непосредственно на хозяина. Наиболее хорошо охарактеризованными детерминантами состава и поведения микробного сообщества-хозяина являются системы противомикробной защиты хозяина.Когда эти системы нарушаются из-за генетического нокаута отдельных компонентов у модельных животных, возникает дисбиоз. 135 Проглоченное содержимое просвета кишечника в основном происходит с пищей. Вклад диеты в микробный дисбактериоз представляет особый интерес для многих исследователей, поскольку ВЗК распространяется вместе с распространением западного образа жизни по всему миру, а западная диета сильно отличается от традиционных диет в незападнических обществах. 136 Пищевые компоненты состоят из макроэлементов, таких как жиры и сахар, микроэлементов, таких как витамины и минералы, и непитательных компонентов, таких как диетические эмульгаторы.Западная диета, как правило, сильно переработана и содержит большое количество насыщенных жиров и простых сахаров. Было показано, что этот тип диеты способствует выработке метаболитов, вредных для тканей хозяина. 137 И наоборот, диеты с низким содержанием субстратов, необходимых микробам для производства метаболитов, которые способствуют здоровью тканей хозяина, также могут способствовать развитию болезней. Например, неперевариваемые пищевые волокна используются микробами для производства короткоцепочечных жирных кислот, а пищевой триптофан используется для производства лигандов арилуглеводородных рецепторов, которые способствуют здоровью кишечника. 95,138 Наконец, диетические эмульгаторы часто добавляют в обработанные пищевые продукты для улучшения их текстуры или стабильности. In vitro эти соединения активируют образование фибр в E. coli , что приводит к прилипанию и повреждению тканей этими обычно комменсальными бактериями. 139 Было показано, что потребление диетических эмульгаторов in vivo вызывает дисбактериоз и обострение колита у мышей IL-10 — / — . 140 Другие типы экологического стресса, такие как введение антибиотиков, также могут привести к изменениям в микробном сообществе посредством прямого уничтожения микробов или горизонтального переноса генов. 141,142 Экологический стресс также может определять, ведут ли бактериофаги лизогенный или литический образ жизни. 143 Фаг-индуцированный лизис не только убивает бактерии, но и потенциально приводит к инфицированию новых бактериальных мишеней с изменением поведения этих бактерий.
Открытым вопросом в области дисбактериоза является важность того, когда происходят дисбиотические изменения в микробном сообществе. Кесарево сечение приводит к изменениям в ранних стадиях колонизации, а раннее введение антибиотиков может значительно нарушить развивающиеся сообщества. 144 Оба эти фактора были связаны с рядом иммуноопосредованных заболеваний в более позднем возрасте, но окончательных доказательств причинно-следственной связи или понимания механизмов все еще нет. 145 Кроме того, у многих пациентов развивается ВЗК без событий в раннем возрасте, которые могли бы вызвать дисбактериоз. Таким образом, дополнительные неизвестные события могут способствовать раннему, давнему дисбактериозу на момент постановки диагноза ВЗК, или более острые дисбиотические события также могут способствовать развитию ВЗК. Также ожидается, что тип дисбиотического события будет ключевым фактором в том, как дисбактериоз способствует развитию ВЗК.Остается определить, являются ли это широкими изменениями в сообществе или небольшими кардинальными изменениями в конкретных микробах. Эта неопределенность, по крайней мере частично, связана с техническими проблемами, которые могут переоценить значимость очень распространенных микробов и недооценить функциональную важность менее многочисленных членов сообщества. Технические ограничения доступных в настоящее время методов и данных также могут переоценить важность известных микробов с установленными функциональными данными по сравнению с неизвестными микробами, которые могут быть столь же важны для болезни.Наконец, до сих пор неизвестно, как дисбактериоз вызывает или способствует развитию ВЗК. Есть некоторые свидетельства того, что определенные дисбиотические микробные сообщества могут вызывать заболевание у нормальных хозяев. 146 Однако есть гораздо более убедительные доказательства того, что дисбактериоз работает в сочетании с дополнительными факторами, такими как лежащая в основе генетическая предрасположенность или повреждение кишечника, вызывающее заболевание. Например, перенос микробных сообществ от пациентов с ВЗК стерильным мышам не вызывает спонтанного колита. 69,70,146 Однако он, по-видимому, способствует развитию заболевания на моделях мышей, предрасположенных к заболеванию, таких как мыши IL-10 — / — или с химической индукцией колита. 69,70,146 Кроме того, дисбактериоз, связанный с диетами западного типа, по-видимому, допускает колонизацию организмами, ассоциированными с ВЗК. Свободные от зародышей мыши, колонизированные микробами от мышей, получавших диету с высоким содержанием жиров и сахара, имеют повышенную восприимчивость к колонизации AIEC. 147 Следовательно, дисбактериоз может по-разному влиять на разных хозяев в зависимости от природы дисбиотического сообщества и лежащих в основе генетической предрасположенности к заболеванию у хозяина.Независимо от того, возникает ли дисбактериоз первым и вызывает заболевание, или он является результатом болезни, однажды возникнув, он почти наверняка способствует сохранению болезни.
Архив Дисбактериоза — Елена Клименко, д.м.н.
Синдром протекающей кишки (LGS), также называемый повышенной проницаемостью кишечника, представляет собой состояние, при котором соединение между клетками слизистой оболочки кишечника становится рыхлым. Это позволяет веществам из пищеварительного тракта проникать через стенку кишечника в кровь, минуя нормальный путь, который проходит через клетку.Это не будет проблемой, за исключением того, что вещества, попадающие в кровоток, такие как микробы, непереваренные частицы пищи и даже токсины, там никогда не должны быть. В результате стенка кишечника воспаляется и не может выполнять свою важную функцию — всасывание питательных веществ. Следовательно, можно начать страдать от мальабсорбции и недоедания . Мы часто видим это как низкий уровень общих витаминов и минералов в анализе крови.
Чаще всего LGS может проявляться симптомами вздутия живота, газов, болей в животе, пищевой непереносимости или чувствительности.Вещества, которые попадают в кровь, также могут вызывать начало аутоиммунных заболеваний, таких как целиакия, ревматоидный артрит, заболевания щитовидной железы, такие как болезнь Хашимото или болезнь Грейвса, рассеянный склероз и многие другие. Существует установленная связь между LGS и некоторыми психическими заболеваниями. симптомы (затуманенность мозга, плохая память, интеллектуальная вялость) и даже психические заболевания (синдром дефицита внимания, депрессия, беспокойство). Мы часто называем это «дырявый кишечник = дырявый мозг».
Интересно, что синдром дырявого кишечника (LGS) не является диагнозом, которому обязательно учат в программах традиционных медицинских школ, поэтому строго традиционные врачи могут не признавать существование этого состояния.Поэтому они не всегда подозревают это у своих пациентов или не знают, как его лечить. Однако все больше и больше данных исследований подтверждают связь между этим состоянием и развитием множества хронических заболеваний, особенно связанных с желудочно-кишечными заболеваниями, такими как Синдром раздраженного кишечника (СРК) и воспалительное заболевание кишечника (ВЗК), такое как язвенный колит или болезнь Крона.
Я продолжил учебу после традиционного медицинского образования, в медицинской практике, основанной на альтернативных науках, и недавняя сертификация по функциональной медицине научила меня огромным последствиям протекающего кишечника для общего здоровья людей.
Факторы, способствующие развитию LGS: стресс, алкоголь, токсины, некоторые лекарственные препараты, неправильное питание, бактериальный дисбаланс кишечника (дисбактериоз).
Три способа выздоровления от синдрома дырявого кишечника:
Узнайте, действительно ли у вас LGS
Измените способ питания
Научитесь справляться со стрессом
Узнайте, действительно ли у вас синдром протекающей кишки
Во-первых, определите, действительно ли у вас есть LGS.Найдите в своем районе врача функциональной медицины, который может вам помочь (посетите www.functionalmedicine.org). В результате обширного обучения альтернативной и функциональной медицине я выхожу за рамки традиционных методов и собираю полный медицинский анамнез. Я использую специальные лабораторные исследования, чтобы добраться до самой сути медицинских проблем, а не просто составлять график симптомов и выписывать рецепты для их подавления.
Измените способ питания
В процессе исследования вашей болезни я могу помочь вам составить новую индивидуальную диету, которая, вероятно, улучшит ваше здоровье, независимо от окончательного диагноза.В этом смысле диета не ограничивает потребление калорий, а относится к типам продуктов, которые вы едите. Натуральные и необработанные продукты следует употреблять в разнообразном виде с большим количеством зеленых листовых овощей и нежирным белком в качестве основных частей вашего рациона. Могут быть рекомендованы определенные добавки, которые помогут вылечить слизистую оболочку кишечника и снова сделают соединения клеток плотными.
Научитесь справляться со стрессом
Стрессовый образ жизни повышает риск развития хронических заболеваний, и LGS является одним из них.Изучение того, как справляться со стрессом и определение факторов стресса в вашей жизни, станет частью любого плана лечения, который восстановит баланс и излечит ваше тело в долгосрочной перспективе.
Дисбактериоз кишечника, связанный с симптомами СРК-D
Ссылки: 1. Rezaie A, Heimanson Z, McCallum R, Pimentel M. Дыхательный тест на лактулозу как прогностический фактор ответа на рифаксимин у пациентов с синдромом раздраженного кишечника с диареей. Am J Gastroenterol. 2019; 114 (12): 1886-1893. 2. Кэрролл И.М., Рингель-Кулька Т., Сиддл Дж. П., Рингель Ю. Изменения в составе и разнообразии кишечной микробиоты у пациентов с синдромом раздраженного кишечника с преобладанием диареи. Neurogastroenterol Motil. 2012; 24 (6): 521-530. 3. Чжун В., Лу Х, Ши Х и др. Определенные микробные популяции существуют в микробиоте слизистой оболочки, связанной с преобладанием диареи, синдрома раздраженного кишечника и язвенного колита. J Clin Gastroenterol. 2019; 53 (9): 660-672. 4. Кассинен А., Крогиус-Курикка Л., Мякивуокко Х. и др. Микробиота кала пациентов с синдромом раздраженного кишечника значительно отличается от таковой здоровых людей. Гастроэнтерология. 2007; 133 (1): 24-33. 5. Casén C, Vebø HC, Sekelja M, et al. Отклонения в микробиоте кишечника человека: новый диагностический тест для определения дисбактериоза у пациентов с СРК или ВЗК. Aliment Pharmacol Ther. 2015; 42 (1): 71-83. 6. Пиментел М., Лембо А., Чей В.Д. и др. Терапия рифаксимином у пациентов с синдромом раздраженного кишечника без запоров. N Engl J Med. 2011; 364 (1): 22-32. 7. Рингель Ю. Микробиом кишечника при синдроме раздраженного кишечника и других функциональных расстройствах кишечника. Gastroenterol Clin North Am. 2017; 46 (1): 91-101. 8. Рингель-Кулька Т., Чой Ч., Темас Д. и др. Измененная бактериальная ферментация толстой кишки как потенциальный патофизиологический фактор синдрома раздраженного кишечника. Am J Gastroenterol. 2015; 110 (9): 1339-1346. 9. Кинг Т.С., Элия М., Хантер Дж. Аномальное брожение толстой кишки при синдроме раздраженного кишечника. Ланцет. 1998; 352 (9135): 1187-1189. 10. Онг Д.К., Митчелл С.Б., Барретт Дж. С. и др. Манипуляции с пищей с короткоцепочечными углеводами изменяют характер газообразования и генезис симптомов синдрома раздраженного кишечника. J Gastroenterol Hepatol. 2010; 25 (8): 1366-1373. 11. Serra J, Azpiroz F, Malagelada JR. Нарушение транзита и толерантности кишечных газов при синдроме раздраженного кишечника. Gut. 2001; 48 (1): 14-19. 12. Houghton LA, Lea R, Agrawal A, Reilly B, Whorwell PJ.Связь вздутия живота с вздутием живота при синдроме раздраженного кишечника и влияние привычки кишечника. Гастроэнтерология. , 2006; 131 (4): 1003-1010. 13. Данлоп С.П., Хебден Дж., Кэмпбелл Э. и др. Аномальная кишечная проницаемость в подгруппах синдромов раздраженного кишечника с преобладанием диареи. Am J Gastroenterol. , 2006; 101 (6): 1288-1294. 14. Аткинсон В., Локхарт С., Уорвелл П.Дж., Кивил Б., Хоутон Л.А. Нарушение передачи сигналов 5-гидрокситриптамина у пациентов с синдромом раздраженного кишечника с преобладанием запора и диареи. Гастроэнтерология. , 2006; 130 (1): 34-43. 15. Гаргари Г., Тавернити В, Гардана С. и др. Распределение фекальных Clostridiales и короткоцепочечных жирных кислот отражает привычки кишечника при синдроме раздраженного кишечника. Environ Microbiol. 2018; 20 (9): 3201-3213. 16. Tack J, Broekaert D, Corsetti M, Fischler B, Janssens J. Влияние острого ингибирования обратного захвата серотонина на сенсомоторную функцию толстой кишки у человека. Aliment Pharmacol Ther. , 2006; 23 (2): 265-274. 17. Chey WY, Jin HO, Lee MH, Sun SW, Lee KY. Нарушение моторики толстой кишки у пациентов с синдромом раздраженного кишечника с болью в животе и диареей. Am J Gastroenterol. , 2001; 96 (5): 1499-1506. 18. Хаутон Л.А., Аткинсон В., Локхарт С., Уорвелл П.Дж., Кивил Б. Сигмовидно-толстая кишка в состоянии здоровья и синдром раздраженного кишечника: роль 5-гидрокситриптамина. Neurogastroenterol Motil. 2007; 19 (9): 724-731. 19. Торнблом Х., Ван Ауденхове Л., Садик Р., Абрахамссон Х., Тэк Дж., Симрен М.Время прохождения через толстую кишку и симптомы СРК: какая связь? Am J Gastroenterol. 2012; 107 (5): 754-760. 20. Cremon C, Gargano L, Morselli-Labate AM, et al. Иммунная активация слизистой оболочки при синдроме раздраженного кишечника: гендерная зависимость и связь с пищеварительными симптомами. Am J Gastroenterol. 2009; 104 (2): 392-400. 21. Либрегтс Т., Адам Б., Бредак С. и др. Иммунная активация у пациентов с синдромом раздраженного кишечника. Гастроэнтерология. 2007; 132 (3): 913-920. 22. Гиларте М., Сантос Дж., Де Торрес И. и др. У пациентов с СРК с преобладанием диареи наблюдается активация тучных клеток и гиперплазия тощей кишки. Gut. 2007; 56 (2): 203-209. 23. Zhou Q, Zhang B, Verne GN. Проницаемость кишечной мембраны и гиперчувствительность при синдроме раздраженного кишечника. Боль. 2009; 146 (1-2): 41-46. 24. Piche T., Barbara G, Aubert P, et al. Нарушение целостности кишечного барьера в толстой кишке у пациентов с синдромом раздраженного кишечника: участие растворимых медиаторов. Gut. 2009; 58 (2): 196-201. 25. Shulman RJ, Jarrett ME, Cain KC, Broussard EK, Heitkemper MM. Связь между проницаемостью кишечника, маркерами воспаления и симптомами у пациентов с синдромом раздраженного кишечника. J Гастроэнтерол. 2014; 49 (11): 1467-1476. 26. Мерин Ф, Лейси Б. Е., Чанг Л. и др. Расстройства кишечника. Гастроэнтерология. 2016; 150 (6): 1393-1407.
Современные взгляды на дисбиоз и депрессию кишечного микробиома
Кишечная микробиота и депрессия
Kelly et al.исследовали изменения в составе кишечной микробиоты у людей, связанные с депрессией, и дополнительно изучили ее влияние на нейроповедение крыс [26]. Образцы фекалий, слюны и плазмы были взяты у 34 пациентов с депрессией и 33 здоровых пациентов, чтобы оценить состав микробиоты, функцию оси гипоталамус-гипофиз-надпочечники (HPA), активацию иммунной системы, метаболизм триптофана, функциональные последствия и проницаемость кишечника. Образцы фекалий трех пациентов мужского пола с наиболее тяжелой депрессией были объединены и трансплантированы 13 взрослым крысам-самцам, которых ранее лечили антибиотиками.Поведение, состав микробиоты, функция оси HPA, активация иммунной системы, метаболизм триптофана, время прохождения через кишечник, функциональные последствия и проницаемость кишечника были оценены и сравнены с образцами от 15 взрослых самцов крыс в контрольной группе.
В исследованиях пациентов авторы обнаружили значительно повышенные уровни интерлейкина-6 (IL-6), интерлейкина-8 (IL-8), фактора некроза опухоли альфа (TNFα) и С-реактивного белка (CRP) ( p <0,02), а также более высокое соотношение кинуренин / триптофан ( p = 0.049) у пациентов в депрессивной группе. Общий выброс кортизола также был увеличен ( p = 0,05), хотя не было ни разницы в ответе дельта-кортизола, ни исходных уровнях кортизола после пробуждения в обеих группах. Образцы фекалий из депрессивной группы показали пониженное богатство микробиоты ( p = 0,005), общее количество наблюдаемых видов ( p = 0,002) и филогенетическое разнообразие ( p = 0,001). Наиболее выраженная разница наблюдалась в редукции семейства Prevotellaceae и рода Prevotella .Не было значительных различий в уровнях липополисахаридсвязывающего белка в плазме или короткоцепочечных жирных кислот, хотя депрессивные симптомы отрицательно коррелировали с ежедневным потреблением клетчатки.
Крысы в группе с депрессией демонстрировали поведение, подобное ангедонии и тревоге, по сравнению с контрольной группой. Уровни кинуренина в плазме ( p = 0,029) и соотношение кинуренин / триптофан ( p = 0,008) были значительно увеличены в группе с депрессией, а уровни CRP в плазме показали тенденцию к увеличению, хотя не было никаких значительных различий между различными цитокинами или уровень кортикостерона.Крысы в группе с депрессией также продемонстрировали значительное увеличение времени прохождения через кишечник ( p = 0,013). Образцы фекалий в депрессивной группе выявили пониженное богатство микробиоты ( p = 0,004), наблюдаемые виды ( p = 0,006) и филогенетическое разнообразие ( p = 0,006). Не было значительных различий в уровнях липополисахаридсвязывающего белка или короткоцепочечных жирных кислот.
Путем трансплантации фекалий пациентов с депрессией крысам с истощенной микробиотой авторы смогли вызвать определенные поведенческие и физиологические особенности депрессивного фенотипа, в частности те, которые относятся к богатству и разнообразию кишечной микробиоты, метаболизму триптофана и иммунной функции.На основании этих результатов авторы пришли к выводу, что изменения в микробиоте кишечника могут играть причинную роль в патогенезе депрессии. Потенциально сбивает с толку то, что многим пациентам в депрессивной группе были прописаны антидепрессанты, что указывает на потенциальное изменение микробиоты кишечника, вызванное серотонином. Необходимы дальнейшие исследования, чтобы полностью выяснить роль микробиоты кишечника в развитии депрессивного фенотипа, особенно при изучении влияния дисбиоза кишечника на нейроэндокринные и нейроиммунные сигнальные пути в оси кишечник – мозг – микробиота.
Истощение кишечной микробиоты у взрослых крыс
Примечательным открытием в исследованиях микробиома является то, что большее видовое разнообразие бактерий, колонизирующих кишечник, защищает от различных заболеваний. Чтобы оценить последствия нарушения предположительно здорового микробиома, Hoban et al. исследовали поведенческие и нейрохимические последствия хронического истощения кишечной микробиоты во взрослом возрасте у крыс [27]. Шестинедельный курс антибиотиков вводился с питьевой водой десяти взрослым самцам крыс для истощения кишечной микробиоты, в то время как десять взрослых самцов крыс в контрольной группе получали воду в автоклаве без каких-либо антибиотиков.Через 6 недель все крысы прошли тестирование для оценки тревожного поведения, депрессивного поведения, пространственного обучения, распознавания новых объектов, соматической болевой чувствительности, растяжения толстой кишки, уровней моноаминов в головном мозге, уровней кортикостерона, состава микробиоты и экспрессии генов в ЦНС.
Авторы обнаружили, что лечение антибиотиками привело к значительному депрессивному поведению ( p <0,04), но не продемонстрировало никакого влияния на поведение, подобное тревоге. Хроническое лечение антибиотиками также было связано с нарушением пространственного обучения ( p = 0.037) и пониженной висцеральной гиперчувствительности ( p = 0,015). Что касается моноаминов, крысы, получавшие антибиотики, демонстрировали снижение уровня 5-гидрокситриптамина (5-HT) и увеличение обмена 5-гидроксииндолеуксусной кислоты (5-HIAA) / 5-HT в гиппокампе ( p = 0,0004). Уровни триптофана также увеличивались у крыс, получавших антибиотики ( p = 0,032). Кроме того, увеличение норадреналина в полосатом теле ( p <0,003) и повышение уровня леводопы (l-ДОФА) в префронтальной коре и гиппокампе ( p <0.0001) были отмечены. Уровни гомованиловой кислоты (HVA) предшественника дофамина также были увеличены в префронтальной коре и гиппокампе ( p <0,05). Не было отмечено значительных различий в уровнях кортикостерона в плазме у контрольных крыс по сравнению с крысами, получавшими антибиотики. Анализ экспрессии генов показал снижение уровней глюкокортикоидного рецептора Nr3c1 ( p <0,05) и рецептора 1 кортикотропин-рилизинг-гормона ( p <0,01) в гиппокампе и миндалине крыс, получавших антибиотики, в то время как Bdn были увеличены в миндалине ( p <0.01). Снижение уровней Crch2 было также отмечено в гиппокампе и миндалине ( p <0,01). Наконец, крысы, получавшие антибиотики, демонстрировали измененное микробное разнообразие со значительным уменьшением Firmicutes и Bacteroidetes и увеличением Proteobacteria и Cyanobacteria.
На основании этих результатов авторы смогли идентифицировать отдельный фенотип, который включал депрессивное поведение и нарушение познавательной способности, который был связан с вызванным антибиотиками истощением микробиоты у крыс во взрослом возрасте.Кроме того, исследование подтвердило существующую литературу о важности микробиоты кишечника для доступности триптофана и серотонинергической системы ЦНС. Хроническое воздействие антибиотиков уменьшило разнообразие и богатство кишечной микробиоты, что совпало с проявлением депрессивного поведения. Сниженные уровни обмена 5-HT и 5-HT / 5HIAA в гиппокампе и измененные уровни l-DOPA и HVA отражают нарушение регуляции синтеза и деградации моноаминов, указывая на то, что дисбиоз может серьезно влиять на системы нейротрансмиттеров.
Подростковые стрессовые когнитивные изменения и изменения микробиома в зависимости от диеты
Provensi et al. исследовали профилактическое влияние диеты, обогащенной ω-3 полиненасыщенными жирными кислотами (ω-3 ПНЖК) и витамином А, на когнитивное поведение, вызванное стрессом, и микробиом кишечника [28]. Самцы крыс были разделены на три экспериментальные группы: крысы, не подвергавшиеся стрессу, с контрольной диетой (NSCD), крысы, подвергшиеся протоколу социальной нестабильности с контрольной диетой (SCD), и крысы, подвергшиеся протоколу социальной нестабильности с ω-3 ПНЖК. / обогащенная витамином А диета (СЭД).Крысы, подверженные социальной нестабильности, претерпевали различные изменения в жилищных условиях в течение 15 дней, в то время как крыс, не подвергавшихся стрессу, не беспокоили. После этого периода крыс из всех трех экспериментальных групп наблюдали от подросткового до взрослого возраста с помощью поведенческих, нейрохимических и кишечных оценок микробиоты.
Авторы обнаружили, что крысы SCD набирали и сохраняли меньший вес от подросткового до взрослого возраста по сравнению с крысами NSCD ( p <0,01). Этому эффекту противодействовала диета, обогащенная ω-3 ПНЖК / витамином А ( p <0.01). Что касается долговременной памяти, подростковые крысы SCD не могли различать два объекта, и этот эффект сохранялся и во взрослом возрасте. Обогащенная диета предотвратила этот эффект, поскольку у крыс SED не наблюдалось вызванного стрессом нарушения различения объектов в подростковом или взрослом возрасте ( p <0,001). Точно так же крысы SCD также испытали длительные нарушения контекстной памяти о страхе по сравнению с крысами SED ( p <0,001). Двигательная активность, поведение, подобное ангедонии, и поведение, связанное с тревогой, были сопоставимы во всех трех когортах.
Учитывая пластичность мозга, экспрессия мозгового нейротрофического фактора (BDNF) была снижена в гиппокампе подростков и взрослых крыс SCD по сравнению с крысами NSCD и SED ( p <0,01). Повышенные уровни BDNF были также обнаружены в лобной коре головного мозга крыс-подростков и взрослых крыс SED ( p <0,05). В гиппокампе и лобной коре головного мозга крыс SED также было отмечено значительное увеличение экспрессии синаптофизина ( p <0.05). Анализ кишечной микробиоты крыс-подростков SED продемонстрировал повышенное альфа-разнообразие по сравнению с крысами SCD и NSCD ( p <0,05), хотя этот эффект не сохранялся в течение взрослого возраста. Наблюдался сдвиг в составе микробиома и бета-разнообразии у крыс-подростков SCD по сравнению с крысами-подростками NSCD ( p <0,05). Анализ кишечной микробиоты выявил снижение относительной численности семейств Lachnospiraceae и Ruminococcaceae и повышение относительной численности представителей рода Eubacterium и семейства Coriobacteriaceae.Этот сдвиг был почти полностью предотвращен, когда крысы-подростки, подвергшиеся стрессу, получали обогащенную диету ( p <0,1) и сохранялись на протяжении всей взрослой жизни. Кроме того, стресс социальной нестабильности снижает концентрацию короткоцепочечных жирных кислот ( p <0,05) у крыс-подростков SCD. Напротив, крысы-подростки SED показали общее увеличение разветвленных короткоцепочечных жирных кислот ( p <0,001).
Изучая влияние диеты, обогащенной ω-3 ПНЖК / витамином А, у подростков и взрослых крыс, авторы подчеркнули фундаментальную роль питания и диетического вмешательства на нейроповеденческое развитие и микробиом кишечника.Введение диеты, обогащенной ω-3 ПНЖК / витамином А, предотвращало снижение памяти и BDNF, связанное со стрессом социальной нестабильности, вызванным у крыс в подростковом возрасте. BDNF в гиппокампе играет значительную роль в инициации консолидации памяти о страхе — способности, которой не хватало у стрессированных крыс, получавших контролируемую диету.
Кроме того, у стрессированных крыс наблюдались изменения в составе микробиома кишечника. Подростковый стресс привел к уменьшению количества Lachnospiraceae и Ruminococcaceae, которое также было отмечено у пациентов с депрессивными расстройствами [29].Кроме того, увеличение количества Coriobacteriaceae и Eubacteriaceae связано с экспериментальным колитом у крыс [30]. Хотя эти негативные изменения не сохраняются в зрелом возрасте, введение диеты, обогащенной ω-3 ПНЖК / витамином А, предотвратило эти изменения в подростковом возрасте и, кроме того, привело к длительному изменению бета-разнообразия. Обогащенная диета также увеличила выработку разветвленных короткоцепочечных жирных кислот, которые сильно коррелируют с улучшением тревожного и депрессивного поведения.Хотя эти результаты предполагают, что оптимизация диеты может играть ключевую роль в улучшении поведения, связанного со стрессом, необходимы дальнейшие исследования, чтобы определить, существует ли причинно-следственная связь между диетой, обогащенной ω-3 ПНЖК / витамином A, и микробиомом кишечника и поведение.
Истощение кишечной микробиоты в раннем подростковом возрасте
Desbonnet et al. исследовали влияние истощения кишечной микробиоты в раннем подростковом возрасте у мышей на развитие мозга и поведение [31]. На 21-й день постнатального развития мышей-подростков были разделены на две группы: контрольную группу ( n = 14), получавшую питьевую воду в автоклаве, или группу лечения ( n = 15), которая получала коктейль антибиотиков с питьевой водой.Начиная с 55-го дня после рождения, у мышей оценивали поведение, реакцию кортикостерона на острый стресс, состав кишечной микробиоты, уровни экспрессии BDNF и нейропептидов гипоталамуса, моноамины в головном мозге и метаболизм триптофана, а также посмертный вес селезенки и надпочечников.
Уменьшение посмертного отношения селезенки к массе тела наблюдалось у мышей, получавших антибиотики, по сравнению с контрольными мышами ( p <0,0005), хотя не было отмечено значительных различий в посмертном соотношении веса надпочечников / массы тела.Поведенческое тестирование выявило сниженную способность распознавать новые объекты, меньшее предпочтение кормовой еде и повышенную экскрецию фекалий у мышей, получавших антибиотики, по сравнению с контрольными мышами ( p <0,05). Мыши, получавшие антибиотики, также проводили значительно больше времени в светлой камере в тесте «свет / темнота» ( p <0,05). В то время как исходные уровни кортикостерона между контрольными мышами и мышами, получавшими антибиотики, не различались, опыт острого сдерживающего стресса вызывал повышение уровней кортикостерона у мышей, получавших антибиотики ( p <0.05).
Что касается состава кишечной микробиоты, лечение антибиотиками уменьшило количество наблюдаемых видов бактерий, филогенное разнообразие и видовое богатство ( p <0,0001). На уровне филума наблюдалось снижение относительной численности Firmicutes ( p <0,005) и Bacteroides ( p <0,0001), при этом отмечалось увеличение относительной численности Proteobacteria и Cyanobacteria ( p <0,0001). На уровне семейства сокращение относительной численности Prevotellaceae ( p <0.0001), Rikenellaceae ( p <0,0001) и Incertae Sedis XI ( p <0,0005). Кроме того, острый стресс еще больше изменил микробиоту кишечника как у контрольных мышей, так и у мышей, получавших антибиотики. В то время как у контрольных мышей наблюдалось увеличение количества наблюдаемых видов бактерий и филогенетического разнообразия, у мышей, получавших антибиотики, наблюдалось снижение количества наблюдаемых видов бактерий, филогенетического разнообразия и видового богатства ( p <0,02). В частности, острый стресс увеличивал количество рикенеллезных у контрольных мышей ( p <0.05), в то время как у мышей, получавших антибиотики, никаких изменений не наблюдалось.
Лечение антибиотиками увеличивало уровни триптофана ( p <0,0005) и снижало уровни кинуренина ( p <0,0001) по сравнению с контролем. Лечение антибиотиками также значительно снижало уровни экспрессии BDNF в гиппокампе ( p <0,05), а также гипоталамического окситоцина ( p <0,02) и вазопрессина ( p <0,0001). Кроме того, повышенные уровни моноаминов мозга, норадреналина и 5-HIAA в гиппокампе ( p <0.0001) были отмечены у мышей, получавших антибиотики, хотя повышение 5-HIAA наблюдалось только у мышей, не подвергавшихся стрессу, леченных антибиотиками. Увеличение l-ДОФА ( p <0,0001) и HVA ( p <0,005) в миндалине было также отмечено у мышей, получавших антибиотики.
Кроме того, острый стресс, по-видимому, также влияет на метаболизм триптофана и концентрацию моноаминов. Снижение уровней триптофана ( p <0,0005) и увеличение соотношения кинуренин / триптофан ( p <0.01) наблюдались как у контрольных мышей, так и у мышей, получавших антибиотики. Хотя между двумя группами не наблюдалось различий в BDNF гиппокампа или нейропептидах гипоталамуса, вызванное острым стрессом повышение уровня 5-HIAA ( p <0,0001) и соотношения 5-HIAA / серотонин ( p <0,002) в гиппокампе, а также в префронтальной коре ( p <0,005). Кроме того, острый стресс увеличивал уровни HVA в миндалине, особенно в группе, получавшей антибиотики ( p <0.05).
В свете этих результатов авторы пришли к выводу, что бактериальное истощение и реструктуризация кишечной микробиоты в раннем подростковом возрасте могут значительно изменить развитие мозга и поведение. Дисбактериоз кишечника после лечения антибиотиками сопровождался изменениями концентраций нейромодулирующих веществ и нейропептидов, а также уровней фактора роста BDNF. Это также коррелировало с изменением познания и поведения, включая снижение способности распознавать новые объекты, снижение тревожности, дефицит непространственной памяти и снижение производительности в тесте социальной передачи предпочтений в еде.Хотя данные свидетельствуют о том, что нарушение микробиоты кишечника в подростковом возрасте может иметь глубокое влияние на ось микробиота-кишечник-мозг и, следовательно, на познание и поведение, будущие исследования должны выяснить роль бактериального истощения в более определенные периоды развития мозга. как механизмы, с помощью которых кишечные микробы модулируют уровни и активность нейромодулирующих веществ, нейропептидов и факторов роста.
Bifidobacterium и 5-гидрокситриптофан РегламентTian et al.исследовали влияние введения Bifidobacterium на регуляцию синтеза 5-гидрокситриптофана (5-HTP), депрессивное поведение и состав микробиома кишечника [32]. Взрослых мышей случайным образом распределяли по массе тела в контрольную или экспериментальную группы, состоящие из группы депрессии, группы флуоксетина (положительный контроль) и группы пробиотиков. Экспериментальные группы прошли протокол хронического непредсказуемого умеренного стресса в течение 5 недель, после чего все мыши прошли поведенческое, нейробиологическое, иммунологическое и фекальное тестирование.Кроме того, клетки RIN14B использовали в качестве предполагаемой модели энтерохромаффинных клеток для оценки влияния штаммов E41 и M2CF22M7 Bifidobacterium на синтез 5-HTP.
Что касается депрессивного поведения, введение штаммов E41, M2CF22M7, F45BB, GM59 и S60 значительно увеличило время плавания в группе пробиотиков по сравнению с группой депрессии ( p <0,05). Введение E41, M2CF22M7, C9, h38L1, Hh260497 и MSPC591 также значительно изменило индуцированную стрессом ангедонию в группе пробиотиков ( p <0.05). Группа депрессии продемонстрировала снижение бутирата короткоцепочечной жирной кислоты слепой кишки (SCFA) ( p <0,001), эффект, который был отменен введением E41, F45BBm и S60 в группе пробиотиков ( p <0,05) . Повышенный уровень бутирата положительно коррелировал с улучшением результатов в тесте в открытом поле, который использовался для оценки тревожного поведения.
Что касается нейробиологического и иммунологического тестирования, введение штаммов E41, S60 и h38L1 обратило вспять дефицит 5-HT и 5-HTP в гиппокампе, наблюдаемый в группе депрессии ( p <0.05). Введение E41, M2CF22M7 и F45BB также увеличивало уровни BDNF в префронтальной коре ( p <0,05). Анализ клеток RIN14B выявил значительное увеличение мРНК Tph2, ( p <0,0001) и 5-HTP ( p <0,01) при введении E41 и M2CF22M7. Кроме того, снижение уровня кортикостерона в сыворотке коррелировало с введением M2CF22M7, S60 и h38L1 ( p <0,05). Штамм F45BB также был связан со снижением значимости клеток T reg ( p <0.01).
Оценка дисбактериоза микробиоты выявила резкое изменение микробной структуры кишечника при сравнении мышей, находящихся в условиях хронического стресса, с мышами контрольной группы, с уменьшением количества Bacteroidetes и увеличением количества актинобактерий, наблюдаемых в группе депрессии ( p <0,05). Относительная численность Rikenellaceae и Lachnospiraceae также снизилась, в то время как относительная численность Veillonellaceae, Desulfovibrio и Lactobacillus увеличилась.Обработка E41 и M2CF22M7 значительно снизила численность Veillonellaceae, а обработка E41 дополнительно снизила численность Desulfovibrio . В целом, введение пробиотиков увеличивало альфа-разнообразие микробиома, измеряемое индексом Chao 1 ( p <0,01). Кроме того, оценка функциональных путей микробиоты выявила 20 различных функциональных категорий, влияющих на метаболизм и обработку генной информации между контрольной и депрессивной группами.В частности, обработка Bifidobacterium привела к значительной активации глутаматергических синапсов и биосинтеза фенилаланина / тирозина / триптофана ( p <0,05).
В свете этих открытий авторы пришли к выводу, что введение определенных штаммов Bifidobacterium может оказывать антидепрессивное действие за счет регуляции синтеза 5-HTP в кишечнике. В этом исследовании у мышей в группе депрессии обнаружен дефицит 5-HT и 5-HTP в гиппокампе и BDNF префронтальной коры.Кроме того, в исследованиях на людях у пациентов с депрессией был обнаружен повышенный уровень кортизола в результате длительного стресса и устойчивой активации HPA, что еще больше усугубляет дефицит 5-HT и BDNF [33, 34].
Лечение Bifidobacterium смогло не только устранить дефицит 5-HT и BDNF, но также снизить уровень кортикостерона в сыворотке. Кроме того, введение E41 и M2CF22M7 в клетки RIN14B усиливало синтез 5-HTP, не влияя на конечную продукцию 5-HT.Кроме того, лечение пробиотиками активировало биосинтез триптофана и глутаматергические синапсы. Глутамат является основным возбуждающим нейротрансмиттером в ЦНС, и ранее сообщалось, что он проявляет антидепрессивный эффект при употреблении кетамина [35]. Следовательно, мыши, получавшие пробиотики в этом исследовании, показали улучшенные поведенческие и неврологические характеристики по сравнению с мышами в группе депрессии. Хотя эти результаты предполагают, что пробиотики могут улучшить синаптический сигнальный путь и нейронные связи, которые участвуют в патофизиологии депрессии, необходимы дальнейшие исследования, чтобы полностью понять точный механизм, с помощью которого пробиотики могут модулировать микробиом кишечника и ось кишечник-мозг.
Фруктоолигосахариды, галактоолигосахариды и хронический стресс
Burokas et al. исследовали влияние пребиотических фруктоолигосахаридов (ФОС) и галактоолигосахаридов (ГОС) на поведение, эндокринную и иммунную системы, а также микробиоту кишечника [36]. Взрослые мыши были отнесены к контрольной группе или к одной из трех групп лечения: FOS, GOS или комбинации FOS и GOS. После 3 недель лечения мышей подвергали поведенческому и когнитивному тестированию с последующей оценкой эндокринной, иммунной и нейробиологической функции.Отдельная когорта мышей также прошла протокол хронического непредсказуемого социального стресса для оценки поведенческих и физиологических изменений при хроническом стрессе. Кроме того, микробиом кишечника был проанализирован на предмет изменений в составе и концентрации SCFA.
Что касается тестирования поведения, связанного с депрессией, мыши в группе FOS / GOS показали значительно меньшее время неподвижности в тестах подвешивания за хвост и принудительного плавания по сравнению с мышами в контрольной группе ( p <0.01). Мыши в группах FOS и GOS также показали уменьшенное время неподвижности в тесте принудительного плавания, хотя это различие не было таким резким, как наблюдаемое в группе FOS / GOS ( p <0,05). Что касается тестирования поведения, связанного с тревогой, введение FOS / GOS значительно увеличивало время пребывания в центре теста «открытое поле» ( p <0,05). При тестировании социального поведения мыши в группах GOS и FOS / GOS также демонстрировали усиление приступов просоциального поведения в тесте резидент-злоумышленник ( p <0.05). Никаких существенных различий в когнитивных или ноцицептивных оценках между контрольной и пробиотической группами не наблюдалось.
Что касается эндокринного тестирования, у мышей, получавших GOS или FOS / GOS, наблюдались сниженные вызванные стрессом уровни кортикостерона и дефекация ( p <0,05). Мыши в группе FOS / GOS также продемонстрировали значительное снижение гипертермии, вызванной стрессом ( p <0,01). Что касается экспрессии генов гиппокампа и гипоталамуса, экспрессия BDNF (нейротрофического фактора мозга), гена рецептора гамма-аминомасляной кислоты (GABA B1 ) и гена рецептора GABA B2 в группе FOS / GOS оказалась равной увеличилось ( p <0.05), тогда как экспрессия Crhr1 (рецептор 1 кортикотропин-рилизинг гормона) была снижена в группах GOS и FOS / GOS ( p <0,05). Кроме того, введение FOS, по-видимому, увеличивало экспрессию субъединицы 2A рецептора N -метил-d-аспартата, тогда как введение FOS / GOS снижало ее экспрессию ( p <0,05). В гипоталамусе введение FOS / GOS, по-видимому, снижает уровни мРНК глюкокортикоидного рецептора ( p <0.01).
Лечение пребиотиками выявило ряд изменений в относительном количестве в составе микробиома кишечника. Все три группы пребиотиков показали значительно более высокие пропорции Bacteroides и Parabacteroides ( p <0,05). В группе FOS / GOS было отмечено увеличение Verrucomicrobiaceae и Akkermansia по сравнению с контрольной группой ( p, <0,01) и двумя другими группами пребиотиков ( p <0.05). Группа FOS также показала значительное увеличение Oscillibacter ( p <0,05). Снижение содержания Desulfovibrio, Ruminococcus, Allobaculum, Turicibacter, Lactobacillus, и Bifidobacterium также было обнаружено в группах пребиотиков ( p <0,05). Кроме того, на концентрации SCFA значительное влияние оказала обработка пребиотиками: увеличение ацетата наблюдалось при обработке FOS и FOS / GOS ( p <0,05), увеличение пропионата наблюдалось при обработке GOS и FOS / GOS ( p <0.01), и снижение i -бутирата наблюдалось во всех трех группах лечения ( p <0,05).
Хронический социальный стресс оказал значительное негативное влияние на социальное взаимодействие, долговременную память, поведение, подобное ангедонии, и поведение, подобное депрессии. Эти эффекты были в значительной степени ослаблены введением FOS / GOS. Кроме того, введение FOS / GOS мышам в условиях хронического социального стресса привело к значительному снижению вызванной стрессом гипертермии и уровней кортикостерона по сравнению с стрессированными мышами, которые не получали лечения ( p <0.05). Анализ иммунологической активности выявил более высокие концентрации IL-6 и TNFα у необработанных мышей, подвергшихся стрессу, в то время как введение пребиотиков выявило уровни, аналогичные таковым у контрольных мышей ( p <0,05). Наконец, вызванные стрессом изменения в микробиоме слепой кишки, включая снижение относительной численности Bifidobacterium ( p <0,001) и отношения Actinobacteria к Proteobacteria , также были устранены лечением антибиотиками.
На основании этих результатов авторы пришли к выводу, что введение пребиотиков FOS, GOS или комбинации FOS и GOS приводит к заметным изменениям в поведении и химии мозга, связанных с тревогой и депрессией у мышей, а также к изменениям в кишечнике. микробное сообщество. Мыши, получавшие как FOS, так и GOS, продемонстрировали наибольшее снижение уровней тревожности и депрессивного поведения, что предполагает аддитивные эффекты комбинированного введения пребиотиков. Изменения в поведении после лечения пребиотиками также коррелировали с изменениями экспрессии генов и уровней моноаминов.Авторы предполагают, что эти эффекты могут быть частично опосредованы изменениями в SCFAs, которые могут модулировать функции микроглии в ЦНС и способствовать развитию депрессии и тревоги, связанных со стрессом [37, 38]. Кроме того, в условиях хронического психосоциального стресса введение комбинации FOS и GOS оказывало защитное действие на поведение, эндокринные и иммунологические реакции, а также на микробиом кишечника. Хотя потенциал пребиотиков в качестве пищевых терапевтических агентов при тревоге и депрессии кажется многообещающим, механизмы, с помощью которых FOS и GOS модулируют поведение и физиологические процессы, еще полностью не изучены, и потребуются дальнейшие исследования для выяснения процесса, с помощью которого пребиотики изменяют кишечник. –Ось мозга при нервно-психических расстройствах.
Дисбиоз микробиома кишечника и легких играет роль в развитии астмы
Бокулич Н.А., Чанг Дж., Батталья Т., Хендерсон Н., Джей М., Ли Х, Д. Либер А., Ву Ф, Перес-Перес Г. И., Чен Y, Schweizer W, Zheng X, Contreras M, Dominguez-Bello MG, Blaser MJ (2016) Антибиотики, способ рождения и диета формируют созревание микробиома в молодом возрасте. Sci Transl Med 8: 343ra82
Статья CAS PubMed PubMed Central Google ученый
Эге MJ (2017) Гипотеза гигиены в эпоху микробиома. Ann Am Thorac Soc 14: S348 – SS53
Статья PubMed PubMed Central Google ученый
Генсоллен Т., Айер С.С., Каспер Д.Л., Блумберг Р.С. (2016) Как колонизация микробиотой в раннем возрасте формирует иммунную систему. Science 352: 539–544
Статья CAS PubMed PubMed Central Google ученый
Morgan XC, Huttenhower C (2012) Глава 12: анализ микробиома человека. PLoS Comput Biol 8: e1002808
Статья CAS PubMed PubMed Central Google ученый
Sokolowska M, Frei R, Lunjani N, Akdis CA, O’Mahony L (2018) Микробиом и астма. Asthma Res Pract 4: 1
Статья PubMed PubMed Central Google ученый
Huffnagle GB, Dickson RP, Lukacs NW (2017) Микробиом дыхательных путей и воспаление легких: улица с двусторонним движением.Mucosal Immunol 10: 299–306
Статья CAS PubMed PubMed Central Google ученый
Диксон Р.П., Эрб-Даунворд Дж. Р., Мартинес Ф. Дж., Хаффнагл, Великобритания (2016) Микробиом и дыхательные пути. Annu Rev Physiol 78: 481–504
Статья CAS PubMed PubMed Central Google ученый
Legatzki A, Rosler B, von Mutius E (2014) Разнообразие микробиома и риск астмы и аллергии.Curr Allergy Asthma Rep 14: 466
Статья CAS PubMed PubMed Central Google ученый
Weiss ST, Litonjua AA (2015) Витамин D, микробиом кишечника и гипотеза гигиены. Как начинается астма? Am J Respir Crit Care Med 191: 492–493
Статья PubMed PubMed Central Google ученый
Mathieu E, Escribano-Vazquez U, Descamps D, Cherbuy C, Langella P, Riffault S, Remot A, Thomas M (2018) Парадигмы функций микробиоты легких в отношении здоровья и болезней, в частности, при астме.Front Physiol 9: 1168
Артикул PubMed PubMed Central Google ученый
Проект микробиома человека, C (2012) Структура, функции и разнообразие микробиома здорового человека. Nature 486: 207–214
Статья CAS Google ученый
Деуренберг Р.Х., Батхорн Э, Хлебович М.А., Коуто Н., Фердоус М., Гарсия-Кобос С., Коистра-Смид А.М., Раангс ЕС, Розема С., Вело А.С., Чжоу К., Фридрих А.В., Россен Дж. У. (2017 г. ) Применение секвенирования нового поколения в клинической микробиологии и профилактике инфекций.J Biotechnol 243: 16–24
Статья CAS PubMed PubMed Central Google ученый
Kozik AJ, Huang YJ (2019) Микробиом при астме: роль в патогенезе, фенотипе и ответе на лечение. Ann Allergy Asthma Immunol 122: 270–275
Статья PubMed PubMed Central Google ученый
Hilty M, Burke C, Pedro H, Cardenas P, Bush A, Bossley C, Davies J, Ervine A, Poulter L, Pachter L, Moffatt MF, Cookson WO (2010) Беспорядочные микробные сообщества в астматических дыхательных путях .PLoS One 5: e8578
Артикул CAS PubMed PubMed Central Google ученый
Bassis CM, Erb-Downward JR, Dickson RP, Freeman CM, Schmidt TM, Young VB, Beck JM, Curtis JL, Huffnagle GB (2015) Анализ микробиоты верхних дыхательных путей как источника легких и желудочные микробиоты у здоровых людей. MBio 6: e00037
Статья CAS PubMed PubMed Central Google ученый
Сегал Л.Н., Алексеенко А.В., Клементе Дж.К., Кулькарни Р., Ву Б., Гао З., Чен Х., Бергер К.И., Голдринг Р.М., Ром В.Н., Блазер М.Дж., Вайден М.Д. (2013) Обогащение микробиома легких надгортанными таксонами связано с увеличением легочное воспаление. Микробиом 1:19
Статья PubMed PubMed Central Google ученый
Венкатараман А., Бассис С.М., Бек Дж. М., Янг В. Б., Кертис Дж. Л., Хаффнагл Г. Б., Шмидт Т. М. (2015) Применение модели нейтрального сообщества для оценки структурирования микробиома легких человека.MBio 6
Dickson RP, Martinez FJ, Huffnagle GB (2014) Роль микробиома в обострениях хронических заболеваний легких. Ланцет 384: 691–702
Артикул CAS PubMed PubMed Central Google ученый
Jensen-Jarolim E (2014) Сравнительная медицина — анатомия и физиология. Springer, Вена
Google ученый
Хан С., Маллампалли Р.К. (2015) Роль сурфактанта в заболевании легких и защите организма от легочных инфекций. Ann Am Thorac Soc 12: 765–774
Статья PubMed PubMed Central Google ученый
Marsh RL, Kaestli M, Chang AB, Binks MJ, Pope CE, Hoffman LR, Smith-Vaughan HC (2016) Микробиота бронхоальвеолярного лаважа у маленьких детей с хроническим заболеванием легких включает таксоны, присутствующие в ротоглотке. и носоглотка.Microbiome 4:37
Статья CAS PubMed PubMed Central Google ученый
Lal CV, Travers C, Aghai ZH, Eipers P, Jilling T, Halloran B, Carlo WA, Keeley J, Rezonzew G, Kumar R, Morrow C, Bhandari V, Ambalavanan N (2016) Микробиом дыхательных путей при рождении. Sci Rep 6: 31023
Статья CAS PubMed PubMed Central Google ученый
Arrieta MC, Stiemsma LT, Dimitriu PA, Thorson L, Russell S, Yurist-Doutsch S, Kuzeljevic B, Gold MJ, Britton HM, Lefebvre DL, Subbarao P, Mandhane P, Becker A, McNagny KM, Sears MR, Kollmann T. , Investigators CS, Mohn WW, Turvey SE, Finlay BB (2015) Микробные и метаболические изменения в раннем младенчестве влияют на риск детской астмы. Sci Transl Med 7: 307ra152
Статья CAS PubMed PubMed Central Google ученый
Biesbroek G, Tsivtsivadze E, Sanders EA, Montijn R, Veenhoven RH, Keijser BJ, Bogaert D (2014) Ранний состав респираторной микробиоты определяет паттерны бактериальной сукцессии и здоровье органов дыхания у детей. Am J Respir Crit Care Med 190: 1283–1292
Статья PubMed PubMed Central Google ученый
Teo SM, Mok D, Pham K, Kusel M, Serralha M, Troy N, Holt BJ, Hales BJ, Walker ML, Hollams E, Bochkov YA, Grindle K, Johnston SL, Gern JE, Sly PD , Holt PG, Holt KE, Inouye M (2015) Микробиом носоглотки младенца влияет на тяжесть инфекции нижних дыхательных путей и риск развития астмы.Клеточный микроб-хозяин 17: 704–715
Статья CAS PubMed PubMed Central Google ученый
Korten I, Mika M, Klenja S, Kieninger E, Mack I, Barbani MT, Gorgievski M, Frey U, Hilty M, Latzin P (2016) Взаимодействие респираторных вирусов и носовой микробиоты в течение первого года жизни здоровых младенцев. mSphere 1: e00312 – e00316
Статья PubMed PubMed Central Google ученый
Рот-Вальтер Ф., Адкок И.М., Бенито-Виллалвилла С., Бьянкини Р., Бьермер Л., Карамори Дж., Кари Л., Чунг К.Ф., Диамант З., Эгуилуз-Грасиа I, Кнол Е.Ф., Колиос АГА, Леви-Шаффер Ф., Ночентини Г. , Palomares O, Puzzovio PG, Redegeld FA, van Esch B, Stellato C (2019) Сравнение биологических препаратов и низкомолекулярных препаратов для лечения хронических респираторных заболеваний: рабочая группа EAACI по позиционному документу по иммунофармакологии. Аллергия 74: 432–448
Статья PubMed PubMed Central Google ученый
Groves HT, Cuthbertson L, James P, Moffatt MF, Cox MJ, Tregoning JS (2018) Респираторное заболевание, вызванное вирусной инфекцией легких, изменяет микробиоту кишечника мышей. Фронт Иммунол 9: 182
Статья CAS PubMed PubMed Central Google ученый
Pulvirenti G, Parisi GF, Giallongo A, Papale M, Manti S, Savasta S, Licari A, Marseglia GL, Leonardi S (2019) Микробиота нижних дыхательных путей. Front Pediatr 7: 393
Артикул PubMed PubMed Central Google ученый
МакКоли, К., Дурак, Дж., Валладарес, Р., Фадрош, Д.У., Лин, Д.Л., Калатрони, А, Лебо, П.К., Тран, Х.Т., Фуджимура, К.Э., Ламере, Б., Мерана, Г., Линч, К., Коэн , RT, Pongracic, J, Khurana Hershey, GK, Kercsmar, CM, Gill, M, Liu, AH, Kim, H, Kattan, M, Teach, SJ, Togias, A, Boushey, HA, Gern, JE, Jackson, DJ, Lynch, SV, Национальный институт, A, Inner-City Asthma, спонсируемая инфекционными заболеваниями, C (2019) Определенные бактериальные микробиоты носовых дыхательных путей по-разному связаны с обострением у педиатрических пациентов с астмой.J Allergy Clin Immunol 144: 1187–1197
Teo SM, Tang HHF, Mok D, Judd LM, Watts SC, Pham K, Holt BJ, Kusel M, Serralha M, Troy N, Bochkov YA, Grindle K , Lemanske RF Jr, Johnston SL, Gern JE, Sly PD, Holt PG, Holt KE, Inouye M (2018) Динамика микробиоты дыхательных путей открывает критическое окно для взаимодействия патогенных бактерий и аллергии при респираторных заболеваниях у детей. Клеточный микроб-хозяин 24 (341–52): e5
Google ученый
Robinson PFM, Pattaroni C, Cook J, Gregory L, Alonso AM, Fleming LJ, Lloyd CM, Bush A, Marsland BJ, Saglani S (2019) Микробиота нижних дыхательных путей ассоциируется с воспалительным фенотипом при тяжелом хрипе дошкольного возраста. J Allergy Clin Immunol 143 (1607–10): e3
Google ученый
Хуанг YJ, Boushey HA (2015) Микробиом при астме. J Allergy Clin Immunol 135: 25–30
Статья PubMed PubMed Central Google ученый
Goleva E, Jackson LP, Harris JK, Robertson CE, Sutherland ER, Hall CF, Good JT Jr, Gelfand EW, Martin RJ, Leung DY (2013) Влияние микробиома дыхательных путей на реакцию кортикостероидов при астме. Am J Respir Crit Care Med 188: 1193–1201
Статья CAS PubMed PubMed Central Google ученый
Хуанг Ю.Дж., Нельсон К.Э., Броди Э.Л., Десантис Т.З., Бэк М.С., Лю Дж., Войке Т., Аллгайер М., Бристоу Дж., Винер-Крониш Дж. П., Сазерленд Э. Р., Кинг Т. С., Ичитович Н., Мартин Р. Дж., Calhoun WJ, Castro M, Denlinger LC, Dimango E, Kraft M, Peters SP, Wasserman SI, Wechsler ME, Boushey HA, Lynch SV, National Heart L, Клинические исследования астмы Института крови, N (2011) Микробиота дыхательных путей и гиперчувствительность бронхов в пациенты с плохо контролируемой астмой.J Allergy Clin Immunol 127 (372–81): e1 – e3
Google ученый
van Nimwegen FA, Penders J, Stobberingh EE, Postma DS, Koppelman GH, Kerkhof M, Reijmerink NE, Dompeling E, van den Brandt PA, Ferreira I, Mommers M, Thijs C (2011) Режим и место родоразрешения, микробиоты желудочно-кишечного тракта и их влияние на астму и атопию. J Allergy Clin Immunol 128 (948–55): e1 – e3
Google ученый
Stiemsma LT, Arrieta MC, Dimitriu PA, Cheng J, Thorson L, Lefebvre DL, Azad MB, Subbarao P, Mandhane P, Becker A, Sears MR, Kollmann TR, Canadian Healthy Infant Longitudinal Development Study, I, Mohn WW, Finlay BB, Turvey SE (2016) Сдвиги у Lachnospira и Clostridium sp. В 3-месячном стуле микробиом ассоциируется с астмой дошкольного возраста. Clin Sci (Lond) 130: 2199–2207
Статья CAS Google ученый
Chiu CY, Cheng ML, Chiang MH, Kuo YL, Tsai MH, Chiu CC, Lin G (2019) Бутират кишечного микробного происхождения обратно связан с реакциями IgE на аллергены при детской астме.Pediatr Allergy Immunol 30: 689–697
Статья PubMed PubMed Central Google ученый
Durack J, Kimes NE, Lin DL, Rauch M, McKean M, McCauley K, Panzer AR, Mar JS, Cabana MD, Lynch SV (2018) Задержка развития микробиоты кишечника у младенцев с высоким риском астмы — это временно модифицируется добавлением Lactobacillus. Nat Commun 9: 707
Статья CAS PubMed PubMed Central Google ученый
Перес А.С., Панг Б., Кинг Л. естественным образом. Pathog Dis 70: 280–288
Статья CAS PubMed PubMed Central Google ученый
Bisgaard H, Hermansen MN, Buchvald F, Loland L, Halkjaer LB, Bonnelykke K, Brasholt M, Heltberg A, Vissing NH, Thorsen SV, Stage M, Pipper CB (2007) Детская астма после бактериальной колонизации дыхательные пути у новорожденных.N Engl J Med 357: 1487–1495
Статья CAS PubMed PubMed Central Google ученый
Bosch A, de Steenhuijsen Piters WAA, van Houten MA, Chu M, Biesbroek G, Kool J, Pernet P, de Groot PCM, Eijkemans MJC, Keijser BJF, Sanders EAM, Bogaert D (2017) Созревание респираторная микробиота младенцев, факторы окружающей среды и последствия для здоровья. Проспективное когортное исследование. Am J Respir Crit Care Med 196: 1582–1590
Статья PubMed PubMed Central Google ученый
Toivonen L, Hasegawa K, Waris M, Ajami NJ, Petrosino JF, Camargo CA Jr, Peltola V (2019) Ранняя назальная микробиота и острые респираторные инфекции в первые годы жизни. Thorax 74: 592–599
Статья Google ученый
Depner M, Ege MJ, Cox MJ, Dwyer S, Walker AW, Birzele LT, Genuneit J, Horak E, Braun-Fahrlander C, Danielewicz H, Maier RM, Moffatt MF, Cookson WO, Heederik D, von Mutius E, Legatzki A (2017) Бактериальная микробиота верхних дыхательных путей и детская астма.J Allergy Clin Immunol 139 (826–34): e13
Google ученый
von Mutius E (2018) Интимные перекрестные помехи в нижних дыхательных путях в начале жизни. Клеточный микроб-хозяин 24: 758–759
Статья CAS Google ученый
Карр Т.Ф., Алкатиб Р., Крафт М. (2019) Микробиом в механизмах астмы. Clin Chest Med 40: 87–96
Артикул PubMed PubMed Central Google ученый
Marri PR, Stern DA, Wright AL, Billheimer D, Martinez FD (2013) Связанные с астмой различия в микробном составе индуцированной мокроты. J Allergy Clin Immunol 131 (346–52): e1 – e3
Google ученый
Taylor SL, Leong LEX, Choo JM, Wesselingh S, Yang IA, Upham JW, Reynolds PN, Hodge S, James AL, Jenkins C, Peters MJ, Baraket M, Marks GB, Gibson PG, Simpson JL , Rogers GB (2018) Воспалительные фенотипы у пациентов с тяжелой астмой связаны с особой микробиологией дыхательных путей.J Allergy Clin Immunol 141 (94–103): e15
Google ученый
Green B, Wiriyachaiporn S, Grainge C, Rogers GB, Kehagis V, Lau L, Carroll MP, Bruce KD, Howarth PH (2014) Потенциально патогенные бактерии дыхательных путей и нейтрофильное воспаление при устойчивой к лечению тяжелой астме. PLoS One 9: e100645
Артикул CAS PubMed PubMed Central Google ученый
Durack J, Lynch SV, Nariya S, Bhakta NR, Beigelman A, Castro M, Dyer AM, Israel E, Kraft M, Martin RJ, Mauger DT, Rosenberg SR, Sharp-King T, White SR, Woodruff PG, Avila PC , Denlinger LC, Holguin F, Lazarus SC, Lugogo N, Moore WC, Peters SP, Que L, Smith LJ, Sorkness CA, Wechsler ME, Wenzel SE, Boushey HA, Huang YJ, National Heart L, Институт крови, A (2017 ) Особенности бактериального микробиома бронхов, связанные с атопией, астмой и чувствительностью к лечению ингаляционными кортикостероидами.J Allergy Clin Immunol 140: 63–75
Статья CAS PubMed PubMed Central Google ученый
Abrahamsson TR, Jakobsson HE, Andersson AF, Bjorksten B, Engstrand L, Jenmalm MC (2014) Низкое разнообразие кишечной микробиоты в раннем младенчестве предшествует астме в школьном возрасте. Clin Exp Allergy 44: 842–850
Статья CAS PubMed PubMed Central Google ученый
Dang AT, Marsland BJ (2019) Микробы, метаболиты и ось кишечник-легкие. Mucosal Immunol 12: 843–850
Статья CAS PubMed PubMed Central Google ученый
Tulic MK, Piche T, Verhasselt V (2016) Перекрестный разговор легких и кишечника: доказательства, механизмы и последствия для воспалительных заболеваний слизистых оболочек. Clin Exp Allergy 46: 519–528
Статья CAS PubMed PubMed Central Google ученый
Stokholm J, Blaser MJ, Thorsen J, Rasmussen MA, Waage J, Vinding RK, Schoos AM, Kunoe A, Fink NR, Chawes BL, Bonnelykke K, Brejnrod AD, Mortensen MS, Al-Soud WA, Sorensen SJ, Bisgaard H (2018) Созревание микробиома кишечника и риск астмы в детстве. Nat Commun 9: 141
Статья CAS PubMed PubMed Central Google ученый
Wang H, Liu JS, Peng SH, Deng XY, Zhu DM, Javidiparsijani S, Wang GR, Li DQ, Li LX, Wang YC, Luo JM (2013) Перекрестные помехи между кишечником и легкими при поражении легких с воспалительным процессом заболевания кишечника.World J Gastroenterol 19: 6794–6804
Статья PubMed PubMed Central Google ученый
Braun-Fahrlander C, Gassner M, Grize L, Neu U, Sennhauser FH, Varonier HS, Vuille JC, Wuthrich B (1999) Распространенность сенной лихорадки и аллергической сенсибилизации у детей фермеров и их сверстников, живущих в та же сельская община. Команда SCARPOL Швейцарское исследование детской аллергии и респираторных симптомов в отношении загрязнения воздуха Clin Exp Allergy 29: 28–34
CAS Google ученый
Douwes J, Travier N, Huang K, Cheng S, McKenzie J, Le Gros G, von Mutius E, Pearce N (2007) Пожизненное воздействие на ферму может значительно снизить риск астмы у взрослых. Аллергия 62: 1158–1165
Статья CAS PubMed PubMed Central Google ученый
Loss G, Apprich S, Waser M, Kneifel W, Genuneit J, Buchele G, Weber J, Sozanska B, Danielewicz H, Horak E, van Neerven RJ, Heederik D, Lorenzen PC, von Mutius E, Braun-Fahrlander C, group, GS (2011) Защитный эффект потребления молока на ферме на астму и атопию у детей: исследование GABRIELA.J Allergy Clin Immunol 128 (766–73): e4
Google ученый
Waser, M, Michels, KB, Bieli, C, Floistrup, H, Pershagen, G, von Mutius, E, Ege, M, Riedler, J, Schram-Bijkerk, D, Brunekreef, B, van Hage, M, Lauener, R, Braun-Fahrlander, C, team, PS (2007) Обратная связь потребления молока на ферме с астмой и аллергией среди сельского и пригородного населения по всей Европе. Clin Exp Allergy 37: 661–670
Ege MJ, Frei R, Bieli C, Schram-Bijkerk D, Waser M, Benz MR, Weiss G, Nyberg F, van Hage M, Pershagen G, Brunekreef B, Riedler J, Lauener R, Braun-Fahrlander C, von Mutius E, team, PS (2007) Не все фермерские хозяйства защищают от развития астмы и хрипов у детей.J Allergy Clin Immunol 119: 1140–1147
Статья PubMed PubMed Central Google ученый
Stein MM, Hrusch CL, Gozdz J, Igartua C, Pivniouk V, Murray SE, Ledford JG, Marques Dos Santos M, Anderson RL, Metwali N, Neilson JW, Maier RM, Gilbert JA, Holbreich M, Thorne PS, Martinez FD, von Mutius E, Vercelli D, Ober C, Sperling AI (2016) Врожденный иммунитет и риск астмы у фермерских детей амишей и гуттеритов. N Engl J Med 375: 411–421
Статья CAS PubMed PubMed Central Google ученый
Muller-Rompa, SEK, Markevych, I, Hose, AJ, Loss, G, Wouters, IM, Genuneit, J, Braun-Fahrlander, C, Horak, E, Boznanski, A, Heederik, D, von Mutius, E, Heinrich, J, Ege, MJ, Group, GS (2018) Подход к защитному эффекту фермы от астмы путем геокодирования: хорошие фермы и лучшие фермы. Pediatr Allergy Immunol 29: 275–282
Статья Google ученый
Обер С., Сперлинг А.И., фон Мутиус Э., Верчелли Д. (2017) Иммунное развитие и окружающая среда: уроки от детей амишей и гуттеритов.Curr Opin Immunol 48: 51–60
Статья CAS PubMed PubMed Central Google ученый
Tantoco JC, Elliott Bontrager J, Zhao Q, DeLine J, Seroogy CM (2018) У амишей снизилось количество астмы и аллергических заболеваний по сравнению с меннонитами старого порядка. Ann Allergy Asthma Immunol 121 (252–3): e1
Google ученый
Тимм С., Фриденберг М., Абрамсон М.Дж., Бертельсен Р.Дж., Брабак Л., Бенедиктсдоттир Б., Гисласон Т., Холм М., Янсон С., Джоги Р., Йоханнесен А., Ким Д.Л., Малиновски А., Мишра Дж., Мораталл Дж. , Sigsgaard T, Svanes C, Schlunssen V (2019) Астма и выборочная миграция из сельскохозяйственных угодий в когортном исследовании трех поколений.Eur J Epidemiol 34: 601–609
Статья PubMed PubMed Central Google ученый
Кирьявайнен П.В., Карвонен А.М., Адамс Р.И., Таубель М., Ропонен М., Туоресмаки П., Потеря Г., Джаяпракаш Б., Депнер М., Эге М.Дж., Ренц Х., Пфефферле П.И., Шауб Б., Лауенер Р., Хиваринен А. , Knight R, Heederik DJJ, von Mutius E, Pekkanen J (2019) Домашняя микробиота, подобная ферме, в несельскохозяйственных домах защищает детей от развития астмы. Nat Med 25: 1089–1095
Статья CAS Google ученый
Hesselmar B, Hicke-Roberts A, Lundell AC, Adlerberth I, Rudin A, Saalman R, Wennergren G, Wold AE (2018) Содержание домашних животных в раннем возрасте снижает риск аллергии в зависимости от дозы. PLoS One 13: e0208472
Статья CAS PubMed PubMed Central Google ученый
Барберан А., Данн Р.Р., Райх Б.Дж., Пасифици К., Лабер Э.Б., Меннингер Х.Л., Мортон Дж. М., Хенли Дж. Б., Лефф Дж. В., Миллер С. Л., Фирер Н. (2015) Экология микроскопической жизни в домашней пыли.Proc Biol Sci 282
Middelbos IS, Vester Boler BM, Qu A, White BA, Swanson KS, Fahey GC Jr (2010) Филогенетическая характеристика фекальных микробных сообществ собак, которых кормили диетами с добавлением пищевых волокон или без них, с использованием 454 пиросеквенирование. PLoS One 5: e9768
Артикул CAS PubMed PubMed Central Google ученый
Song SJ, Lauber C, Costello EK, Lozupone CA, Humphrey G, Berg-Lyons D, Caporaso JG, Knights D, Clemente JC, Nakielny S, Gordon JI, Fierer N, Knight R (2013) Cohabiting члены семьи делятся микробиотой друг с другом и со своими собаками.Elife 2: e00458
Статья PubMed PubMed Central Google ученый
Tun HM, Konya T, Takaro TK, Brook JR, Chari R, Field CJ, Guttman DS, Becker AB, Mandhane PJ, Turvey SE, Subbarao P, Sears MR, Scott JA, Kozyrskyj AL, Investigators CS (2017) Воздействие домашних пушистых домашних животных влияет на микробиоту кишечника младенца в возрасте 3-4 месяцев после различных сценариев рождения. Microbiome 5:40
Статья PubMed PubMed Central Google ученый
фон Мутиус Э., Верчелли Д. (2010) Жизнь на ферме: влияние на детскую астму и аллергию. Nat Rev Immunol 10: 861–868
Статья CAS Google ученый
Debarry J, Hanuszkiewicz A, Stein K, Holst O, Heine H (2010) Аллергозащитные свойства Acinetobacter lwoffii F78 придает его липополисахарид. Аллергия 65: 690–697
Статья CAS PubMed PubMed Central Google ученый
Froidure A, Pilette C (2016) От гипотезы гигиены до A20: защитный эффект эндотоксинов против развития астмы. Clin Exp Allergy 46: 192–193
Статья CAS PubMed PubMed Central Google ученый
Schuijs MJ, Willart MA, Vergote K, Gras D, Deswarte K, Ege MJ, Madeira FB, Beyaert R, van Loo G, Bracher F, von Mutius E, Chanez P, Lambrecht BN, Hammad H ( 2015) Фермерская пыль и эндотоксин защищают от аллергии за счет индукции A20 в эпителиальных клетках легких.Science 349: 1106–1110
Статья CAS PubMed PubMed Central Google ученый
Frei R, Ferstl R, Roduit C, Ziegler M, Schiavi E, Barcik W, Rodriguez-Perez N, Wirz, OF, Wawrzyniak M, Pugin B, Nehrbass D, Jutel M, Smolinska S, Konieczna P , Bieli C, Loeliger S, Waser M, Pershagen G, Riedler J, Depner M, Schaub B, Genuneit J, Renz H, Pekkanen J, Karvonen AM, Dalphin JC, van Hage M, Doekes G, Akdis M, Braun-Fahrlander C, Akdis CA, von Mutius E, O’Mahony L, Lauener RP, Предотвращение факторов риска аллергии для сенсибилизации у детей, связанных с, F, Исследование антропософского образа жизни, g, Исследование защиты от аллергии в сельской местности / Механизмы раннего защитного воздействия по исследованию развития аллергии, g (2018) Воздействие немикробной N-гликолилнейраминовой кислоты защищает детей фермеров от воспаления дыхательных путей и колита.J Allergy Clin Immunol 141 (382–90): e7
Google ученый
Roth-Walter F, Pacios LF, Bianchini R, Jensen-Jarolim E (2017) Связь дефицита железа с аллергией: роль молекулярных аллергенов и микробиома. Металломика 9: 1676–1692
Статья CAS PubMed PubMed Central Google ученый
Roth-Walter F, Pacios LF, Gomez-Casado C, Hofstetter G, Roth GA, Singer J, Diaz-Perales A, Jensen-Jarolim E (2014) Главный аллерген коровьего молока, Bos d 5, манипулирует T — клетки-помощники в зависимости от их нагрузки железом, связанным с сидерофором.PLoS One 9: e104803
Статья CAS PubMed PubMed Central Google ученый
Hufnagl K, Ghosh D, Wagner S, Fiocchi A, Dahdah L, Bianchini R, Braun N, Steinborn R, Hofer M, Blaschitz M, Roth GA, Hofstetter G, Roth-Walter F, Pacios LF, Jensen-Jarolim E (2018) Ретиноевая кислота предотвращает иммуногенность липокалина Bos d 5 молока за счет связывания с его иммунодоминантным Т-клеточным эпитопом. Sci Rep 8: 1598
Статья CAS PubMed PubMed Central Google ученый
Singh V, Yeoh BS, Chassaing B, Zhang B, Saha P, Xiao X, Awasthi D, Shashidharamurthy R, Dikshit M, Gewirtz A, Vijay-Kumar M (2016) Индуцируемый микробиотой врожденный иммунный, связывающий сидерофор белок липокалин 2 — это критически важен для гомеостаза кишечника. Cell Mol Gastroenterol Hepatol 2 (482–98): e6
Google ученый
Pawlowski M, Jerzynska J, Podlecka D, Stelmach W, Majak P, Stelmach I (2017) Эффективность иммунотерапии у детей зависит от места проживания — пилотное исследование.Allergol Immunopathol (Madr) 45: 272–275
Статья CAS Google ученый
Ege MJ, Bieli C, Frei R, van Strien RT, Riedler J, Ublagger E, Schram-Bijkerk D, Brunekreef B, van Hage M, Scheynius A, Pershagen G, Benz MR, Lauener R, von Mutius E, Braun-Fahrlander C, Parsifal Study, t (2006) Пренатальное воздействие на ферму связано с экспрессией рецепторов врожденного иммунитета и с атопической сенсибилизацией у детей школьного возраста.J Allergy Clin Immunol 117: 817–823
Статья PubMed PubMed Central Google ученый
Финкина Е.И., Мельникова Д.Н., Богданов И.В., Овчинникова Т.В. (2017) Белки патогенеза растений PR-10 и PR-14 как компоненты системы врожденного иммунитета и повсеместные аллергены. Curr Med Chem 24: 1772–1787
Статья CAS PubMed PubMed Central Google ученый
Roth-Walter F, Gomez-Casado C, Pacios LF, Mothes-Luksch N, Roth GA, Singer J, Diaz-Perales A, Jensen-Jarolim E (2014) Bet v 1 из пыльцы березы представляет собой липокалин-подобный белок, действующий как аллерген, только если он лишен железа, способствуя развитию лимфоцитов Th3. J Biol Chem 289: 17416–17421
Статья CAS PubMed PubMed Central Google ученый
Bulgarelli D, Schlaeppi K, Spaepen S, Ver Loren van Themaat E, Schulze-Lefert P (2013) Структура и функции бактериальной микробиоты растений.Анну Рев Завод Биол 64: 807–838
Артикул CAS PubMed PubMed Central Google ученый
Manirajan B, Ratering S, Rusch V, Schwiertz A, Geissler-Plaum R, Cardinale M, Schnell S (2016) Бактериальная микробиота, связанная с цветочной пыльцой, зависит от типа опыления и демонстрирует высокую степень разнообразия и видовая специфика. Environ Microbiol 18: 5161–5174
Статья Google ученый
Obersteiner A, Gilles S, Frank U, Beck I, Haring F, Ernst D, Rothballer M, Hartmann A, Traidl-Hoffmann C, Schmid M (2016) Микробиом, связанный с пыльцой, коррелирует с параметрами загрязнения и аллергенностью пыльцы. PLoS One 11: e0149545
Артикул CAS PubMed PubMed Central Google ученый
Oteros J, Bartusel E, Alessandrini F, Nunez A, Moreno DA, Behrendt H, Schmidt-Weber C, Traidl-Hoffmann C, Buters J (2019) Пыльца артемизии является основным переносчиком эндотоксина в воздухе.J Allergy Clin Immunol 143 (369–77): e5
Google ученый
Tripathy S, Tunno BJ, Michanowicz DR, Kinnee E, Shmool JLC, Gillooly S, Clougherty JE (2019) Гибридное регрессионное моделирование землепользования для оценки пространственно-временного воздействия PM2,5, BC и металлических компонентов через мегаполис со сложным рельефом и промышленными источниками. Sci Total Environ 673: 54–63
Статья CAS PubMed PubMed Central Google ученый
Li X, Sun Y, An Y, Wang R, Lin H, Liu M, Li S, Ma M, Xiao C (2019) Загрязнение воздуха в зимний период и микробный дисбаланс дыхательных путей у здорового молодого населения на северо-востоке Китая. Environ Pollut 246: 972–979
Статья CAS PubMed PubMed Central Google ученый
Chotirmall SH, Gellatly SL, Budden KF, Mac Aogain M, Shukla SD, Wood DL, Hugenholtz P, Pethe K, Hansbro PM (2017) Микробиомы в респираторном здоровье и болезнях: азиатско-тихоокеанский взгляд.Респирология 22: 240–250
Статья PubMed PubMed Central Google ученый
Budden KF, Shukla SD, Rehman SF, Bowerman KL, Keely S, Hugenholtz P, Armstrong-James DPH, Adcock IM, Chotirmall SH, Chung KF, Hansbro PM (2019) Функциональные эффекты микробиоты в хроническом респираторная инфекция. Lancet Respir Med
Gao H, Shu Q, Chen J, Fan K, Xu P, Zhou Q, Li C, Zheng H (2019) Воздействие антибиотиков оказывает полозависимое воздействие на микробиоту кишечника и метаболизм коротких -цепочечные жирные кислоты и аминокислоты у мышей.mSystems 4: e00048 – e00019
Артикул PubMed PubMed Central Google ученый
Werbner M, Barsheshet Y, Werbner N, Zigdon M, Averbuch I, Ziv O, Brant B, Elliott E, Gelberg S, Titelbaum M, Koren O, Avni O (2019) Микробиота, чувствительная к социальному стрессу индуцирует стимуляцию аутореактивных эффекторных Т-хелперных клеток. mSystems: 4
Le Bastard Q, Al-Ghalith GA, Gregoire M, Chapelet G, Javaudin F, Dailly E, Batard E, Knights D, Montassier E (2018) Систематический обзор: дисбактериоз кишечника человека, вызванный не — рецептурные антибиотики.Aliment Pharmacol Ther 47: 332–345
Статья PubMed PubMed Central Google ученый
Scholl I, Untersmayr E, Bakos N, Roth-Walter F, Gleiss A, Boltz-Nitulescu G, Scheiner O, Jensen-Jarolim E (2005) Противоязвенные препараты способствуют оральной сенсибилизации и гиперчувствительности к аллергенам фундука в BALB / c мышей и человека. Am J Clin Nutr 81: 154–160
Артикул PubMed PubMed Central Google ученый
Жернакова А., Курилщиков А., Бондер М.Дж., Тигчелаар Е.Ф., Ширмер М., Ватанен Т., Муджагич З., Вила А.В., Фалони Г., Виейра-Силва С., Ван Дж., Имханн Ф., Брандсма Э, Янкиперсадсинг С.А., Джоосенс М., Сенит М.С. , Deelen P, Swertz MA, LifeLines cohort, s, Weersma RK, Feskens EJ, Netea MG, Gevers D, Jonkers D, Franke L, Aulchenko YS, Huttenhower C, Raes J, Hofker MH, Xavier RJ, Wijmenga C, Fu J (2016) Популяционный метагеномический анализ выявляет маркеры состава и разнообразия кишечного микробиома. Science 352: 565–569
Статья CAS PubMed PubMed Central Google ученый
Russell SL, Gold MJ, Reynolds LA, Willing BP, Dimitriu P, Thorson L, Redpath SA, Perona-Wright G, Blanchet MR, Mohn WW, Finlay BB, McNagny KM (2015) Перинатальные изменения микробиоты кишечника, вызванные антибиотиками, имеют дифференциальное воздействие на воспалительные заболевания легких. J Allergy Clin Immunol 135: 100–109
Статья CAS PubMed PubMed Central Google ученый
Oldenburg CE, Sie A, Coulibaly B, Ouermi L, Dah C, Tapsoba C, Barnighausen T, Ray KJ, Zhong L, Cummings S, Lebas E, Lietman TM, Keenan JD, Doan T (2018) Влияние обычно используемых детских антибиотиков на микробное разнообразие кишечника у детей дошкольного возраста в Буркина-фасо: рандомизированное клиническое исследование.Открытый форум Infect Dis 5: ofy289
Статья CAS PubMed PubMed Central Google ученый
Adami AJ, Bracken SJ, Guernsey LA, Rafti E, Maas KR, Graf J, Matson AP, Thrall RS, Schramm CM (2018) Антибиотики в раннем возрасте ослабляют образование регуляторных Т-клеток и увеличивают серьезность мышей астма, вызванная клещами домашней пыли. Pediatr Res 84: 426–434
Статья CAS PubMed PubMed Central Google ученый
Jackson MA, Goodrich JK, Maxan ME, Freedberg DE, Abrams JA, Poole AC, Sutter JL, Welter D, Ley RE, Bell JT, Spector TD, Steves CJ (2016) Ингибиторы протонной помпы изменяют состав микробиоты кишечника. Gut 65: 749–756
Статья CAS PubMed PubMed Central Google ученый
Mishiro T, Oka K, Kuroki Y, Takahashi M, Tatsumi K, Saitoh T, Tobita H, Ishimura N, Sato S, Ishihara S, Sekine J, Wada K, Kinoshita Y (2018) Изменения микробиома полости рта здоровых добровольцев с ингибитором протонной помпы.J Gastroenterol Hepatol 33: 1059–1066
Статья CAS PubMed PubMed Central Google ученый
Naito Y, Kashiwagi K, Takagi T, Andoh A, Inoue R (2018) Дисбиоз кишечника, вторичный по отношению к использованию ингибиторов протонной помпы. Пищеварение 97: 195–204
Статья CAS PubMed PubMed Central Google ученый
Takagi T, Naito Y, Inoue R, Kashiwagi S, Uchiyama K, Mizushima K, Tsuchiya S, Okayama T, Dohi O, Yoshida N, Kamada K, Ishikawa T., Handa O, Konishi H, Okuda K , Tsujimoto Y, Ohnogi H, Itoh Y (2018) Влияние длительного использования ингибиторов протонной помпы на микробиоту кишечника: исследование случай-контроль с учетом возраста и пола.J Clin Biochem Nutr 62: 100–105
Артикул CAS PubMed PubMed Central Google ученый
Ходзё М., Асахара Т., Нагахара А., Такеда Т., Мацумото К., Уэяма Х, Мацумото К., Асаока Д., Такахаси Т., Номото К., Ямасиро Ю., Ватанабе С. (2018) Состав микробиоты кишечника до и после использование ингибиторов протонной помпы. Dig Dis Sci 63: 2940–2949
Статья CAS PubMed PubMed Central Google ученый
Миналян А., Габриелян Л., Скотт Д., Джейкобс Дж., Писенья Дж. Р. (2017) Микробиом желудка и кишечника: роль ингибиторов протонной помпы. Curr Gastroenterol Rep 19:42
Артикул PubMed PubMed Central Google ученый
Castellani C, Singer G, Kashofer K, Huber-Zeyringer A, Flucher C, Kaiser M, Till H (2017) Влияние ингибиторов протонной помпы на фекальный микробиом младенцев с гастроэзофагеальным рефлюксом — проспективный продольный интервенционное исследование.Front Cell Infect Microbiol 7: 444
Статья CAS PubMed PubMed Central Google ученый
Clooney AG, Bernstein CN, Leslie WD, Vagianos K, Sargent M, Laserna-Mendieta EJ, Claesson MJ, Targownik LE (2016) Сравнение микробиома кишечника между постоянными пользователями и непользователями ингибиторы протонной помпы. Aliment Pharmacol Ther 43: 974–984
Статья CAS PubMed PubMed Central Google ученый
Diesner SC, Bergmayr C, Pfitzner B, Assmann V, Krishnamurthy D, Starkl P, Endesfelder D, Rothballer M, Welzl G, Rattei T., Eiwegger T, Szepfalusi Z, Fehrenbach H, Jensen-Jarolim, A Pal, Hart Scholl I, Untersmayr E (2016) Особый состав микробиоты связан с защитой от пищевой аллергии в модели оральной иммунизации мышей. Clin Immunol 173: 10–18
Статья CAS PubMed PubMed Central Google ученый
McAleer JP, Kolls JK (2018) Вклад кишечного микробиома в иммунитет легких. Eur J Immunol 48: 39–49
Статья CAS Google ученый
Черникова Д., Юань И., Шейкер М. (2019) Профилактика аллергии с разнообразной и здоровой микробиотой: обновленная информация. Curr Opin Pediatr 31: 418–425
Статья PubMed PubMed Central Google ученый
Obiakor CV, Tun HM, Bridgman SL, Arrieta MC, Kozyrskyj AL (2018) Связь между использованием антибиотиков в раннем возрасте и аллергическими заболеваниями у маленьких детей: последние выводы и их значение. Эксперт Рев Клин Иммунол 14: 841–855
Статья CAS PubMed PubMed Central Google ученый
Милликен С., Аллен Р.М., Ламонт РФ (2019) Роль антимикробного лечения во время беременности на микробиом кишечника новорожденных и развитие атопии, астмы, аллергии и ожирения в детстве.Мнение эксперта Drug Saf 18: 173–185
Статья CAS PubMed PubMed Central Google ученый
Loewen K, Monchka B, Mahmud SM, t Jong G, Azad MB (2018) Пренатальное воздействие антибиотиков и детская астма: популяционная. исследование Eur Respir J 52: 1702070
Статья CAS PubMed PubMed Central Google ученый
Mulder B, Pouwels KB, Schuiling-Veninga CC, Bos HJ, de Vries TW, Jick SS, Hak E (2016) Использование антибиотиков во время беременности и астмы у детей дошкольного возраста: влияние смешения.Clin Exp Allergy 46: 1214–1226
Статья CAS PubMed PubMed Central Google ученый
Домингес-Белло М.Г., Костелло Е.К., Контрерас М., Магрис М., Идальго Г., Фирер Н., Найт Р. (2010) Режим доставки формирует приобретение и структуру исходной микробиоты в различных средах обитания новорожденных. Proc Natl Acad Sci U S A 107: 11971–11975
Статья PubMed PubMed Central Google ученый
Alm B, Goksor E, Pettersson R, Mollborg P, Erdes L, Loid P, Aberg N, Wennergren G (2014) Антибиотики в первую неделю жизни являются фактором риска аллергического ринита в школьном возрасте. Pediatr Allergy Immunol 25: 468–472
Статья PubMed PubMed Central Google ученый
Taylor SL, Leong LEX, Mobegi FM, Choo JM, Wesselingh S, Yang IA, Upham JW, Reynolds PN, Hodge S, James AL, Jenkins C, Peters MJ, Baraket M, Marks GB, Gibson PG , Роджерс Г.Б., Симпсон Дж.Л. (2019) Азитромицин в течение длительного времени снижает уровень Haemophilus influenzae и повышает устойчивость к антибиотикам при тяжелой астме.Am J Respir Crit Care Med
Segal LN, Clemente JC, Wu BG, Wikoff WR, Gao Z, Li Y, Ko JP, Rom WN, Blaser MJ, Weiden MD (2017) Рандомизированный, двойной слепой, плацебо-контролируемое испытание с азитромицином отбирает противовоспалительные микробные метаболиты в эмфизематозном легком. Thorax 72: 13–22
Статья PubMed PubMed Central Google ученый
Donovan BM, Abreo A, Ding T, Gebretsadik T, Turi KN, Yu C, Ding J, Dupont WD, Stone CA, Hartert TV, Wu P (2019) Доза, время и тип детского антибиотика использование и риск детской астмы.Clin Infect Dis
Lu J, Xiong L, Zhang X, Liu Z, Wang S, Zhang C, Zheng J, Wang G, Zheng R, Simpson JL, Wang F (2017) Роль дисбактериоза нижних дыхательных путей при астме: дисбактериоз и астма. Mediat Inflamm 2017: 38
Google ученый
Mitre E, Susi A, Kropp LE, Schwartz DJ, Gorman GH, Nylund CM (2018) Связь между использованием кислотоподавляющих препаратов и антибиотиков в младенчестве и аллергическими заболеваниями в раннем детстве.JAMA Pediatr 172: e180315
Артикул PubMed PubMed Central Google ученый
(2019) Глобальная инициатива по астме, отчет GINA: глобальная стратегия управления и профилактики астмы. https://ginasthma.org/wp-content/uploads/2019/06/GINA-2019-main-report-June-2019-wms.pdf По состоянию на 2 февраля 2020 г.
Ganti L, Rosario J (2019 ) Улучшают ли антибиотики исходы у пациентов с обострениями астмы? Энн Эмерг Мед
Denner DR, Sangwan N, Becker JB, Hogarth DK, Oldham J, Castillo J, Sperling AI, Solway J, Naureckas ET, Gilbert JA, White SR (2016) Кортикостероидная терапия и обструкция воздушного потока влияют на микробиом бронхов, который отличается от бронхоальвеолярный лаваж дыхательных путей при астме. J Allergy Clin Immunol 137 (1398–405): e3
Google ученый
Untersmayr E, Poulsen LK, Platzer MH, Pedersen MH, Boltz-Nitulescu G, Skov PS, Jensen-Jarolim E (2005) Влияние пищеварения желудка на аллергенность трески.J Allergy Clin Immunol 115: 377–382
Статья CAS PubMed PubMed Central Google ученый
Zhang H, DiBaise JK, Zuccolo A, Kudrna D, Braidotti M, Yu Y, Parameswaran P, Crowell MD, Wing R, Rittmann BE, Krajmalnik-Brown R (2009) Микробиота кишечника человека при ожирении и после обходной желудочный анастомоз. Proc Natl Acad Sci U S A 106: 2365–2370
Статья PubMed PubMed Central Google ученый
Shakeri-Leidenmuhler S, Lukschal A, Schultz C, Bohdjalian A, Langer F, Birsan T, Diesner SC, Greisenegger EK, Scheiner O, Kopp T, Jensen-Jarolim E, Prager G, Untersmayr E (2015) Хирургическое устранение Переваривание желудка с помощью обходного желудочного анастомоза по Ру влияет на пищевую сенсибилизацию — экспериментальное исследование. Obes Surg 25: 2268–2275
Артикул PubMed PubMed Central Google ученый
Джордакиева Г., Кунди М., Унтерсмайр Э., Пали-Шолль И., Райхардт Б., Йенсен-Яролим Э. (2019) Медицинские записи по всей стране указывают на повышенный риск аллергии из-за ингибирования кислоты желудочного сока.Nat Commun 10: 3298
Статья CAS PubMed PubMed Central Google ученый
Hong SW, Eunju O, Lee JY, Lee M, Han D, Ko HJ, Sprent J, Surh CD, Kim KS (2019) Пищевые антигены вызывают спонтанное повышение уровня IgE в отсутствие комменсальной микробиоты. Sci Adv 5: eaaw1507
Статья PubMed PubMed Central Google ученый
Feehley T, Plunkett CH, Bao R, Choi Hong SM, Culleen E, Belda-Ferre P, Campbell E, Aitoro R, Nocerino R, Paparo L, Andrade J, Antonopoulos DA, Berni Canani R, Nagler CR (2019) У здоровых младенцев есть кишечные бактерии, защищающие от пищевой аллергии.Nat Med 25: 448–453
Статья CAS PubMed PubMed Central Google ученый
Fiocchi A, Pawankar R, Cuello-Garcia C, Ahn K, Al-Hammadi S, Agarwal A, Beyer K, Burks W, Canonica GW, Ebisawa M, Gandhi S, Kamenwa R, Lee BW, Li H, Prescott S, Riva JJ, Rosenwasser L, Sampson H, Spigler M, Terracciano L, Vereda-Ortiz A, Waserman S, Yepes-Nunez JJ, Brozek JL, Schunemann HJ (2015) Рекомендации Всемирной аллергологической организации и Университета Макмастера для аллергиков профилактика заболеваний (GLAD-P): пробиотики.World Allergy Organ J 8: 4
Статья PubMed PubMed Central Google ученый
Reddel S, Del Chierico F, Quagliariello A, Giancristoforo S, Vernocchi P, Russo A, Fiocchi A, Rossi P, Putignani L, El Hachem M (2019) Профиль микробиоты кишечника у детей, страдающих атопическим дерматитом и оценка устойчивости пробиотической смеси в кишечнике. Sci Rep 9: 4996
Статья CAS PubMed PubMed Central Google ученый
Dunwoody R, Steel A, Landy J, Simmonds N (2018) Clostridium difficile и муковисцидоз: стратегии управления и роль трансплантации фекалий. Педиатр Респир Ред. 26: 16–18
PubMed PubMed Central Google ученый
Herfarth H, Barnes EL, Long MD, Isaacs KL, Leith T, Silverstein M, Gerardin Y, Kassam Z (2019) Комбинированная эндоскопическая и оральная трансплантация фекальной микробиоты у пациентов с антибиотико-зависимым паучитом: низкая клиническая эффективность из-за низкого приживления донорских микробов.Воспаление кишечника Dis 4: 1–6
Статья PubMed PubMed Central Google ученый
Korpela K, Salonen A, Vepsalainen O, Suomalainen M, Kolmeder C, Varjosalo M, Miettinen S, Kukkonen K, Savilahti E, Kuitunen M, de Vos WM (2018) Пробиотические добавки восстанавливают нормальный состав и функцию микробиоты у младенцев, получавших лечение антибиотиками, и у младенцев, рожденных после кесарева сечения. Microbiome 6: 182
Статья PubMed PubMed Central Google ученый
ВОЗ / ФАО (2006) Пробиотики в пищевых продуктах: полезные и питательные свойства и рекомендации по оценке. FAO Food Nutr Pap
Du X, Wang L, Wu S, Yuan L, Tang S, Xiang Y, Qu X, Liu H, Qin X, Liu C (2019) Эффективность дополнительной пробиотической терапии астмы, аллергический ринит и хрипы: метаанализ рандомизированных контролируемых исследований. Allergy Asthma Proc 40: 250–260
Статья PubMed PubMed Central Google ученый
Dargahi N, Johnson J, Donkor O, Vasiljevic T, Apostolopoulos V (2019) Иммуномодулирующие эффекты пробиотиков: можно ли их использовать для лечения аллергии и аутоиммунных заболеваний? Maturitas 119: 25–38
Статья CAS PubMed PubMed Central Google ученый
Оздемир О. (2010) Различные эффекты различных пробиотических штаммов при аллергических расстройствах: обновленные лабораторные и клинические данные. Clin Exp Immunol 160: 295–304
Статья CAS PubMed PubMed Central Google ученый
Sharma G, Im SH (2018) Пробиотики как потенциальные иммуномодулирующие фармабиотики при аллергических заболеваниях: текущее состояние и перспективы на будущее. Allergy Asthma Immunol Res 10: 575–590
Статья CAS PubMed PubMed Central Google ученый
Arpaia N, Campbell C, Fan X, Dikiy S, van der Veeken J, deRoos P, Liu H, Cross JR, Pfeffer K, Coffer PJ, Rudensky AY (2013) Метаболиты, продуцируемые комменсальными бактериями, способствуют развитию периферических генерация регуляторных Т-клеток.Nature 504: 451–455
Статья CAS PubMed PubMed Central Google ученый
Wu CT, Chen PJ, Lee YT, Ko JL, Lue KH (2016) Влияние иммуномодулирующих добавок с Lactobacillus rhamnosus на воспаление дыхательных путей на модели астмы у мышей. J Microbiol Immunol Infect 49: 625–635
Статья PubMed PubMed Central Google ученый
Russell SL, Gold MJ, Willing BP, Thorson L, McNagny KM, Finlay BB (2013) Перинатальное лечение антибиотиками влияет на микробиоту мышей, иммунные реакции и аллергическую астму. Кишечные микробы 4: 158–164
Статья PubMed PubMed Central Google ученый
Forsythe P, Inman MD, Bienenstock J (2007) Пероральное лечение живыми Lactobacillus reuteri подавляет аллергическую реакцию дыхательных путей у мышей. Am J Respir Crit Care Med 175: 561–569
Статья PubMed PubMed Central Google ученый
Blumer N, Sel S, Virna S, Patrascan CC, Zimmermann S, Herz U, Renz H, Garn H (2007) Применение Lactobacillus rhamnosus GG для беременных в перинатальном периоде подавляет аллергическое воспаление дыхательных путей у потомства мышей. Clin Exp Allergy 37: 348–357
Статья CAS PubMed PubMed Central Google ученый
Nunes CF, Nogueira JS, Vianna PHO, Ciambarella BT, Rodrigues PM, Miranda KR, Lobo LA, Domingues R, Busch M, Atella GC, Vale AM, Bellio M, Nobrega A, Canto FB, Fucs R (2018) Лечение пробиотиками в неонатальном возрасте обеспечивает оптимальную защиту от экспериментальной астмы за счет модуляции микробиоты и Т-клеток.Int Immunol 30: 155–169
Статья CAS PubMed PubMed Central Google ученый
Feleszko W, Jaworska J, Rha RD, Steinhausen S, Avagyan A, Jaudszus A, Ahrens B, Groneberg DA, Wahn U, Hamelmann E (2007) Связано подавление аллергической сенсибилизации и воспаления дыхательных путей, вызванное пробиотиками. с увеличением Т-регуляторных механизмов на мышиной модели астмы. Clin Exp Allergy 37: 498–505
Статья CAS PubMed PubMed Central Google ученый
Cabana MD, McKean M, Caughey AB, Fong L, Lynch S, Wong A, Leong R, Boushey HA, Hilton JF (2017) Раннее добавление пробиотиков для профилактики экземы и астмы: рандомизированное контролируемое исследование. Педиатрия 140: e20163000
Статья PubMed PubMed Central Google ученый
Gutkowski P, Madalinski K, Grek M, Dmenska H, Syczewska M, Michalkiewicz J (2010) Эффект перорально вводимых пробиотических штаммов «Lactobacillus» и «Bifidobacterium» у детей с атопической астмой.Central-Eur J Immunol: выходящий раз в два месяца Польское общество иммунологии под совместной редакцией одиннадцати других центральных европейских иммунологических обществ 35: 233–238
CAS Google ученый
Huang CF, Chie WC, Wang IJ (2018) Эффективность введения Lactobacillus детям школьного возраста с астмой: рандомизированное плацебо-контролируемое исследование. Питательные вещества 10: E1678
Артикул CAS PubMed PubMed Central Google ученый
Chen Y, Jan RL, Lin YL, Chen HH, Wang JY (2010) Рандомизированное плацебо-контролируемое испытание лактобацилл у детей-астматиков с аллергическими ринитами. Педитр Пульмонол 45: 1111–1120
Артикул Google ученый
Elazab N, Mendy A, Gasana J, Vieira ER, Quizon A, Forno E (2013) Введение пробиотиков в раннем возрасте, атопии и астме: метаанализ клинических испытаний. Педиатрия 132: e666 – e676
Статья PubMed PubMed Central Google ученый
Azad MB, Coneys JG, Kozyrskyj AL, Field CJ, Ramsey CD, Becker AB, Friesen C, Abou-Setta AM, Zarychanski R (2013) Пробиотические добавки во время беременности или младенчества для профилактики астмы и хрипов: систематический обзор и мета -анализ. BMJ 347: f6471
Артикул PubMed PubMed Central Google ученый
Mennini M, Dahdah L, Artesani MC, Fiocchi A, Martelli A (2017) Пробиотики в профилактике астмы и аллергии.Front Pediatr 5: 165
Артикул PubMed PubMed Central Google ученый
Wang HT, Anvari S, Anagnostou K (2019) Роль пробиотиков в предотвращении аллергических заболеваний. Дети (Базель) 6: E24
Google ученый
Cuello-Garcia CA, Brozek JL, Fiocchi A, Pawankar R, Yepes-Nunez JJ, Terracciano L, Gandhi S, Agarwal A, Zhang Y, Schunemann HJ (2015) Пробиотики для профилактики аллергии: a систематический обзор и метаанализ рандомизированных контролируемых исследований.J Allergy Clin Immunol 136: 952–961
Статья PubMed PubMed Central Google ученый
Эдвардс М.Р., Уолтон Р.П., Джексон Д.Д., Фелешко В., Скеваки С., Джартти Т., Макриноти Х., Никонова А., Шиловский И.П., Шварце Дж., Джонстон С.Л., Хаитов М.Р., Астма, EA-ii, Обострения астмы Task, F (2018) Потенциал противоинфекционных средств и иммуномодуляторов в качестве терапии астмы и обострений астмы. Аллергия 73: 50–63
Статья CAS PubMed PubMed Central Google ученый
Esposito S, Soto-Martinez ME, Feleszko W, Jones MH, Shen KL, Schaad UB (2018) Неспецифические иммуномодуляторы для рецидивирующих инфекций дыхательных путей, хрипов и астмы у детей: систематический обзор механистических и клинических данных. Curr Opin Allergy Clin Immunol 18: 198–209
Статья CAS PubMed PubMed Central Google ученый
Esposito S, Bianchini S, Polinori I, Principi N (2019) Влияние OM-85 на детей с рецидивирующими инфекциями дыхательных путей в течение двух лет подряд: ретроспективное исследование.Int J Environ Res Public Health 16: E1065
Статья CAS Google ученый
Navarro S, Cossalter G, Chiavaroli C, Kanda A, Fleury S, Lazzari A, Cazareth J, Sparwasser T, Dombrowicz D, Glaichenhaus N, Julia V (2011) Пероральное введение бактериальных экстрактов предотвращает астму с помощью рекрутирование регуляторных Т-клеток в дыхательные пути. Mucosal Immunol 4: 53–65
Статья CAS Google ученый
Lu Y, Li Y, Xu L, Xia M, Cao L (2015) Бактериальный лизат увеличивает процент естественных Т-клеток-киллеров в периферической крови и облегчает астму у детей. Фармакология 95: 139–144
Статья CAS PubMed PubMed Central Google ученый
Razi CH, Harmanci K, Abaci A, Ozdemir O, Hizli S, Renda R, Keskin F (2010) Иммуностимулятор OM-85 BV предотвращает приступы хрипов у детей дошкольного возраста. J Allergy Clin Immunol 126: 763–769
Статья CAS PubMed PubMed Central Google ученый
Emeryk A, Bartkowiak-Emeryk M, Raus Z, Braido F, Ferlazzo G, Melioli G (2018) Механическое введение бактериального лизата предотвращает обострение у детей с аллергической астмой — исследование EOLIA. Pediatr Allergy Immunol 29: 394–401
Статья PubMed PubMed Central Google ученый
Beigelman A, Rosas-Salazar C, Hartert TV (2018) Детская астма: все дело в бактериях, а не в вирусах? Дискуссия за / против.J Allergy Clin Immunol Pract 6: 719–725
Статья PubMed PubMed Central Google ученый
Новые рубежи лечения метаболических заболеваний
Поддержание здорового метаболизма человека зависит от симбиотического консорциума между бактериями, архей, вирусами, грибами и эукариотическими клетками-хозяевами во всем желудочно-кишечном тракте человека. Сообщества микробов обеспечивают ферментативный механизм и метаболические пути, которые способствуют перевариванию пищи, метаболизму ксенобиотиков и производству различных биоактивных молекул.К ним относятся витамины, аминокислоты, короткоцепочечные жирные кислоты (SCFA) и метаболиты, которые необходимы для взаимосвязанных путей гликолиза, цикла трикарбоновых кислот / Кребса, окислительного фосфорилирования (OXPHOS) и метаболизма аминокислот и жирных кислот. Недавние исследования выяснили, как питательные вещества, питающие метаболические процессы, влияют на то, как иммунные клетки, в частности, макрофаги, реагируют на различные стимулы в физиологических и патологических условиях, активируются и приобретают особую функцию.Два основных воспалительных фенотипа макрофагов контролируются за счет различного потребления глюкозы, глутамина и кислорода. Фенотип M1 запускается сигналом поляризации от бактериального липополисахарида (LPS) и провоспалительных цитокинов Th2, таких как интерферон- γ , TNF- α и IL-1 β или оба, тогда как фенотип M2 запускается цитокинами Th3 такие как интерлейкин-4 и интерлейкин-13, а также противовоспалительные цитокины, IL-10 и TGF β или глюкокортикоиды.Утилизация глюкозы и производство химических медиаторов, включая АТФ, активные формы кислорода (АФК), оксид азота (NO) и НАДФН, поддерживают эффекторную активность макрофагов M1. Дисбиоз — это дисбаланс комменсальных и патогенных бактерий, а также выработка микробных антигенов и метаболитов. Теперь известно, что продукты, полученные из микробиоты кишечника, вызывают низкую воспалительную активацию тканевых макрофагов и способствуют метаболическим и дегенеративным заболеваниям, включая диабет, ожирение, метаболический синдром и рак.Здесь мы обновляем возможное взаимодействие дисбактериоза микробиома кишечника хозяина и метаболических заболеваний. Мы также обобщаем достижения в области фекальной терапии, пробиотиков, пребиотиков, симбиотиков, а также питательных веществ и низкомолекулярных ингибиторов ферментов метаболического пути в качестве профилактических и терапевтических средств при метаболических заболеваниях.
1. Введение
Микробиомы человека относятся к коллективным геномам бактерий, архей, вирусов, простейших и грибов, которые совместно обитают в нескольких экосистемах человеческого тела (Bäckhed et al.[1], Белизарио и Наполитано [2]). Взрослый мужчина весом 70 кг может содержать до 3,8 × 10 13 бактерий, что равно количеству клеток в организме взрослого человека (Sender et al. [3]). Бактерии классифицируются морфологически и биохимически на основе различных свойств, включая тип стенки, форму, потребность в кислороде (анаэробный или аэробный), продукцию эндоспор, подвижность и их метаболизм. Бактерии также классифицируются по филогенетическому разнообразию вариабельных нуклеотидных последовательностей малых субъединичных оперонов рибосомной РНК или генов 16S и 18S рРНК [1, 2].
В рамках проекта «Микробиом человека» (HMP) были определены критерии высококачественного и всестороннего метагеномного анализа генетического материала, извлеченного непосредственно из различных участков человеческого тела, для определения относительной численности микробов множества штаммов и видов разных типов в физиологических условиях [4–6]. Достижения в области вычислительной техники позволили изучить общедоступные человеческие метагеномы на основе филогенетической кластеризации и сборки бактериальных геномов в таксономический домен, царство, тип, класс, порядок, семейство, род и виды [4–8].Анализ различных наборов данных микробиома человека выявил огромное разнообразие как популяций, так и отдельных людей на протяжении эволюции и жизни [7–9]. Микробиота кишечника здоровых людей состоит из постоянных и преходящих видов и подвидов микробов-кандидатов более чем 17 бактериальных типов, принадлежащих Firmicutes (> 70%), Bacteroidetes (> 30%), Proteobacteria (<5%), Actinobacteria (<2%). ), Fusobacteria и Verrucomicrobia (<1%) и другие типы. Новая сборка бактериального генома и таксономическое профилирование на основе 1550 геномов, собранных из метагенома (MAG), выявили около 70 000 геномов бактерий и архей, а также новые виды, которые находятся в стадии глубокого исследования [6–8].Обычный набор преобладающих видов микробов, обнаруживаемых в нормальном стуле человека, включает видов Clostridiales , таких как Coprococcus , Ruminococcus , Eubacterium , Bacteroides dorei и fragilis 3 [7, 8]. Полностью широкое таксономическое распределение, микробная эволюция и метаболизм видов бактерий в отношении калорийной нагрузки и усвоения питательных веществ послужили объединению филотипов на уровне видов в основные энтеротипы человека [9–12].Преобладающий тип 1 энтеротипа человека характеризуется высокими уровнями Bacteroides , а тип 2 — небольшим количеством Bacteroides , но высокими уровнями Prevotella . Они, соответственно, связаны с людьми, потребляющими либо большое количество животного белка (тип 1), либо углеводов (тип 2).
Желудочно-кишечный тракт обладает собственной нервной системой, известной как кишечная нервная система. Эта система взаимодействует с центральной нервной системой через нервы, такие как блуждающий нерв, нейромодуляторы и нейротрансмиттеры симпатических и парасимпатических ветвей вегетативной нервной системы [1].Бактериальное богатство и разнообразие микробиоты ЖКТ играют центральную роль в нормальных метаболических и иммунологических функциях тканей и органов [1, 2]. Здесь мы расскажем о различных исследованиях, изучающих роль микробиомов, питательных веществ и метаболитов в функции иммунных клеток, этиологии воспалительных и метаболических заболеваний, включая широкий спектр их механизмов. Мы также описываем, почему и как новые диетические и фармакологические стратегии, включая трансплантацию фекалий, пробиотики, пребиотики и малые молекулы, могут помочь лечить и модулировать типы типов на уровне видов и способствовать восстановлению микробиомов, вызывающих метаболические синдромы.
2. Микробиота кишечника контролирует метаболические физиологические состояния хозяина
Микроорганизмы в кишечнике выполняют свои функции в основном через ферментные пути, чтобы переваривать сложные пищевые углеводы и белки [13, 14]. Микробиота кишечника обеспечивает аминокислоты с разветвленной цепью лейцин, изолейцин и валин, и особенно глицин, который необходим для синтеза глутатиона — основного внутриклеточного антиоксиданта и детоксифицирующего агента, необходимого для многих биологических функций организма-хозяина.Бактерии кишечника синтезируют большое количество сигнальных молекул с низким молекулярным весом, включая метан, сероводород и неосновные метаболиты [13, 14]. Эти продукты могут включать или выключать как гены хозяина, так и гены вирулентности и метаболизма микробов. Микроорганизмы также воспринимают различные сигналы окружающей среды, включая гормоны хозяина и питательные вещества, и реагируют на них посредством дифференциальной регуляции генов и адаптации к нише [13, 14].
Поддержание стабильной ферментативной микробиоты кишечника требует диеты, богатой цельными растительными продуктами, особенно богатыми клетчаткой [13, 14].Эти субстраты обрабатываются ферментами кишечной микробиоты, такими как гликозидгидролазы и полисахаридные лиазы, с образованием полиаминов, полифенолов и витаминов B и K. В анаэробных условиях виды, принадлежащие к роду Bacteroides и к Clostridiaceae и Семейства Lactobacillaceae , в частности штаммы Citrobacter и Serratia , продуцируют короткоцепочечные жирные кислоты (SCFA), которые представляют собой летучие жирные кислоты, способные преодолевать гематоэнцефалический барьер через переносчики монокарбоксилатов.SCFAs, продуцируемые кишечными бактериями, представляют собой ацетат (2 атома углерода), пропионат (3 атома углерода) и бутират (4 атома углерода), и их молярные отношения варьируются от 3: 1: 1 до 10: 2: 1 соответственно. Большинство SCFAs метаболизируются до CO 2 . Бутират действует на колоноциты, бокаловидные клетки и клетки Панета и обеспечивает энергию для клеточного метаболизма и регулирует апоптоз, клеточную дифференцировку и химическую модификацию ядерных белков и нуклеиновой кислоты. Ацетат и пропионат попадают в кровоток и поглощаются печенью и периферическими органами, где они могут действовать как субстраты для глюконеогенеза и липогенеза [14, 15].Рецепторы, связанные с G-белком (GPR), GPR41 и GPR43, также называемые рецепторами свободных жирных кислот 2 и 3 (FFARs 2/3), присутствующие во многих тканях, включая жировую ткань, энтероэндокринные клетки кишечника и воспалительные клетки, действуют как основные рецепторы SCFAs [14, 15]. При определенных физиологических условиях SCFAs могут индуцировать секрецию глюкагоноподобных пептидов (GLP-1 и GLP-2) и пептида YY (PYY). GLP1 стимулирует β клеток поджелудочной железы к выработке инсулина, тогда как PYY ингибирует всасывание питательных веществ в просвете кишечника, а также контролирует аппетит.Микробиота кишечника способствует отложению жира посредством регуляции ядерного рецептора фарнезоида X (FXR), рецептора желчных кислот, который отвечает за регуляцию синтеза желчных кислот и накопление триглицеридов в печени [16]. Желчные кислоты, например дезоксихолевая кислота, обладают противомикробным действием на микробы кишечника, а также индуцируют синтез антимикробных пептидов эпителиальной тканью кишечника [17]. Более того, микробиота превращает карнитин и холин в триметиламин и, таким образом, напрямую регулирует биодоступность холина и косвенно накопление триглицеридов в печени.Микробиота кишечника также способствует усвоению кальция, магния и железа. Высокая или низкая продукция SCFAs, метаболитов триптофана, ГАМК, норадреналина, дофамина, ацетилхолина и 5-гидрокситриптамина (серотонина) связана с различными воспалительными и метаболическими заболеваниями и нервно-психическими расстройствами [18]. Некоторые из этих факторов действуют как основные нейротрансмиттеры и модуляторы оси мозг-кишечник, а серотонин играет центральную роль в сексуальности, наркозависимости, аппетите, эмоциях и реакции на стресс [18].
Тысячи производных микробиоты метаболитов с известными и неизвестными функциями были идентифицированы как компоненты метаболома человека [19–21]. Микробиота ЖКТ производит большое количество эпигенетически активных метаболитов, таких как фолат и витамины A и B (включая рибофлавин (B 2 ), ниацин (B 3 ), пантотеновую кислоту (B 5 ), пиридоксин (B 6). ), фолиевой кислоты (B 9 ) и кобаламина (B 12 )), которые регулируют активность ферментов, модулирующих хроматин хозяина, и генетические ответы на сигналы окружающей среды [22].Ацетил-КоА, продуцируемый рядом метаболических процессов, является донором ацетила для модификации гистонов (ацетилирования и деацетилирования), катализируемой ацетилтрансферазами гистонов. Глицин, серин и метионин являются субстратами для ферментов метилирования и деметилирования ДНК. Следовательно, изменения микробиоты кишечника могут приводить к эпигеномным изменениям не только непосредственно в соседних клетках кишечника, но и в отдаленных клеточных клонах, таких как гепатоциты и адипоциты [22]. Наконец, бактерии могут подавлять рост своих конкурентов с помощью микробной коммуникации на большие расстояния, посредством высвобождения метаболитов и пептидов, чувствительных к кворуму, что считается биологической стратегией для поддержания плотности комменсальных видов и устранения патогенных бактерий [23, 24].
3. Микробиота кишечника управляет иммунологическими функциями хозяина
Коллекция из 100-400 × 10 12 бактерий обитает и живет в мутуалистических отношениях в желудочно-кишечном тракте человека [3]. Двойной слизистый слой GI образован сильно O-гликозилированными белками муцина, кодируемыми геном MUC2 из семейства белков муцина. Большинство бактерий толстой кишки плотно прикреплены к внешнему слою слизи, а внутренний слой образует физический барьер, ограничивающий контакт бактерий с эпителием.Большинство видов микробов в желудочно-кишечном тракте передаются младенцам в раннем возрасте через материнское молоко, которое содержит преимущественно видов Bifidobacteria и Lactobacillus [25, 26]. По мере перехода от младенчества к взрослой жизни увеличение источников пищи приводит к усложнению и разнообразию бактериальных сообществ родов Bacteroides , Parabacteroides (Bacteroidetes) и Clostridium (Firmicutes) [1, 2, 25, 26 ]. Плотность бактерий в тощей кишке / подвздошной кишке (<10 5 ) и в толстой кишке прогрессивно увеличивается по сравнению с желудком и двенадцатиперстной кишкой, а самые высокие таксоны и плотность клеток присутствуют в толстой кишке, которая содержит 10 9 -10 12 колониеобразующих единиц на мл (99% от общей популяции GI).Это анаэробы, такие как Bacteroides , Porphyromonas , Bifidobacterium , Lactobacillus и Clostridium . Анаэробные бактерии и чувствительные к кислороду микробы способны продуцировать короткоцепочечные жирные кислоты, чем факультативные аэробные бактерии, такие как E. coli , в 1000 раз. Нарушение динамической взаимосвязи между хозяином и микробными сообществами вызывает дисбиоз, что представляет собой бактериальный дисбаланс между соотношениями аэробных и факультативно-анаэробных бактерий [1, 2].Гипоксия предотвращает рост патогенных факультативных анаэробов, таких как E. coli и Salmonella . Разрыв кишечного барьера, спровоцированный дисбактериозом, приводит к локальному и системному воспалению [1, 2, 27]. Исследование Byndloss et al. однозначно продемонстрировано, что дисбактериоз может быть вызван высоким уровнем кислорода и нитратов, которые являются соединениями, которые способствуют росту Escherichia и видов Salmonella [28]. Многие заболевания, включая воспалительные заболевания кишечника (ВЗК), синдром раздраженного кишечника (СРК), диабет, ожирение и рак, связаны со специфическим бактериальным дисбиозом [29–31].Возможные временные изменения видов микробиоты, например, за счет уменьшения количества противовоспалительных видов, таких как Faecalibacterium prausnitzii и Akkermansia muciniphila , которые преобладают у здоровых людей, или за счет размножения потенциально провоспалительных бактерий, таких как Bacteroides и Ruminococcus gnavus могут способствовать прогрессированию и хронизации заболевания [29–32]. Сравнительные исследования на моделях худых и страдающих ожирением животных показали, что низкое соотношение Bacteroidetes / Firmicutes является признаком ожирения [33].Firmicutes в значительной степени зависят от пищевых углеводов, тогда как Proteobacteria полагаются на белки как на источник углерода. Например, Akkermansia muciniphila — это бактерия, разлагающая муцин, в типе Verrucomicrobia , которая присутствует в большом количестве у здоровых людей, но присутствует в меньшем количестве у пациентов с воспалительными и желудочно-кишечными заболеваниями, ожирением и диабетом 2 типа. (T2D) [34]. Фактически, различные микробные сообщества и механизмы могут определять восприимчивость хозяина к заболеваниям и влиять на клинические исходы [35].
Микробиота кишечника играет важную роль в иммунной системе, контролируя развитие и функционирование лимфоидных тканей, ассоциированных с кишечником (GALT), включая пейеровы бляшки, изолированные лимфоидные фолликулы и мезентериальные лимфатические узлы [30, 31, 36, 37] . Микробы и их продукты необходимы иммунной системе, чтобы отличать себя от чужого (захватчиков) на раннем этапе жизни, а также для активации и поддержания врожденных гемолимфоидных клеток (ILC1, 2 и 3), естественных киллеров (NK), цитотоксических и нецитотоксических и лимфоидные клетки-помощники [36–39].NK-клетки и ILC1 продуцируют большое количество IFN- γ , антимикробных пептидов (AMP), гранулизина, дефенсинов, лизоцима и Reg III γ , которые вместе играют критические функции в регуляции микробной экологии и иммунного надзора [24, 31, 39, 40]. Например, полисахарид A, α -галактозилцерамид и метаболиты триптофана, продуцируемые микробными сообществами, стимулируют иммунные клетки к выработке интерлейкина-22, Reg3 γ , IgA и интерлейкина-17 [37].IgA — один из важных компонентов врожденного ответа, предотвращающего вторжение микроорганизмов в кровообращение [30]. Т-хелперные (Th) 17-клетки и регуляторные Т-клетки (Treg) представляют собой антиген-специфические популяции, которые реагируют на трансформирующий фактор роста β и ретиноевую кислоту и контролируют иммунную толерантность [38, 39]. Этот контроль иммунной системы всего организма кишечными бактериями, по-видимому, является сложной структурой, поскольку потеря определенного вида может привести к чрезмерной реакции или подавлению врожденного иммунного ответа [27, 35, 36].
Различные мембранные и внутриклеточные рецепторы, называемые «рецепторами распознавания образов» или PRR, экспрессируемые на эпителиальных и иммунных клетках, действуют как сенсоры бактериальных и клеточных продуктов, которые называются патоген-ассоциированными молекулярными структурами (PAMP) и связанными с повреждениями молекулярными структурами. паттерны (DAMPs) [41, 42]. PAMP и DAMP, такие как липополисахариды (LPS), липид A, пептидогликаны, флагеллин, микробная РНК / ДНК, а также компоненты клетки-хозяина, такие как мочевая кислота, HMGB1 (белок группы 1 с высокой подвижностью), двухцепочечная ДНК, и митохондриальные, распознаются членами семейства Toll-подобных рецепторов (TLR) и ядерными доменами олигомеризации рецепторов семейства NOD / NLR [41, 42].Внеклеточные и внутриклеточные комплексы, образованные DAMP, PAMP и рецепторами NOD / NLR, составляют инфламмасомы [43]. Эти цитозольные комплексы связываются с адаптерным белком ASC (ассоциированный с апоптозом пятнышкообразный белок) и провоспалительными протеазами семейства каспаз: каспаза 1, каспаза 11, каспаза 4 и каспаза 5 [43]. После активации инфламмасом происходит выработка интерлейкинов IL-1 , β и IL-18. Эти цитокины увеличивают синтез других цитокинов, таких как TNF-, α , IL-6, IL-17, IL-22 и IL-23, а также некоторых активных химических медиаторов воспаления [43].
Различные исследования с использованием генно-дефицитных моделей мышей определили прямое и сложное взаимодействие бактериального дисбиоза, генетических факторов и факторов окружающей среды [35, 36, 44]. Многие воспалительные заболевания вызваны мутациями или утратой некоторых генов врожденного ответа в лимфоидных тканях и более мелких пейеровских бляшках и мезентериальных лимфатических узлах [38, 39]. Компоненты инфламмасом, такие как MyD88, TLR, NOD, NLrp3 / 6, ASC, а также каспаза 1 и каспаза 11, как известно, контролируют дисбактериоз кишечника [29, 38, 39, 45, 46].Например, трансгенные мыши NOD1 — / — и NOD2 — / — обладают повышенной восприимчивостью не только к воспалительному заболеванию кишечника, но также к диабету 1 типа и раку [38, 39, 45, 46]. Условия содержания животных и состав микробиоты, вызванный диетой, являются некоторыми примерами, которые могут быть ответственны за фенотипические различия штаммов у трансгенных животных [47, 48]. У мышей без зародышей (GF) наблюдаются недоразвитые лимфоидные ткани, нарушение функции Т- и В-клеток и снижение выработки Т-клеток CD4 + и антител.Их клетки Th27 и Treg менее эффективны в борьбе с инфекцией. Колонизация мышей GF с ограниченным числом видов бактерий (модели мышей-гнотобиотов) может восстановить иммунологические функции [47, 48]. Фенотипы, наблюдаемые на этих моделях мышей, не всегда наблюдаются в исследованиях на людях. Важно отметить, что 85% видов микробиома мышей не были обнаружены в микробиомах человека [49, 50]. Более того, гуманизация мышиных моделей клетками человека или человеческой микробиотой не может адекватно отображать весь спектр соответствующих фенотипов болезней человека [47, 48].
На рисунке 1 показаны основные классы молекул, метаболитов и питательных веществ, продуцируемых видами бактерий, иммунными клетками, тканями и органами, которые регулируют динамическое взаимодействие между клетками-хозяевами и микробиомом кишечника, а также терапевтические стратегии для контроля дисбактериоза и заболеваний.
4. Иммунометаболизм и пути перепрограммирования митохондрий
Митохондрии служат двигателем клетки, производя и высвобождая критические сигналы в окружающую среду и синтезируя АТФ, энергию тела, необходимую для метаболических процессов [51].Биоэнергетические пути гликолиза, цикл трикарбоновой кислоты (TCA) (также известный как цикл Кребса и цикл лимонной кислоты), метаболизм жирных кислот и аминокислот являются центральными метаболическими процессами для полного окисления всех питательных веществ в митохондриях [51, 52 ]. Клетки используют аэробный гликолиз для производства пирувата, производного от глюкозы, который превращается в ацетилкофермент А (ацетил-КоА). Молекулы ацетил-КоА, полученные из метаболизма глюкозы, глутамина или жирных кислот, входят в цикл TCA и превращаются в CO 2 , NADH и FADH 2 во время окислительного фосфорилирования (OXPHOS). молекулы-носители, называемые цепью переноса электронов, с помощью переносчиков электронов, таких как NAD (P) H и FADH 2 , которые служат субстратом для генерации аденозинтрифосфата (АТФ) в митохондриальном матриксе [51, 52].Электроны передаются от НАДН к О 2 через три белковых комплекса: НАДН-дегидрогеназа, цитохромредуктаза и цитохромоксидаза. Электронный транспорт между комплексами происходит через другие мобильные переносчики электронов, убихинон и цитохром c. Вновь синтезированный АТФ переносится в цитозоль транслоказой аденин-нуклеотида в обмен на АДФ. Ацетил-КоА является предшественником синтеза холестерина и жирных кислот, которые включены в клеточные плазматические мембраны.
Иммунометаболизм включает в себя центр биохимической активности, осуществляемой иммунными клетками, чтобы модулировать профиль экспрессии генов и переключать метаболические пути и их ключевые ферменты [53]. После стимулирующего сигнала различные иммунные клетки, в частности, макрофаги, DC и Т-клетки, демонстрируют различные метаболические пути перепрограммирования, способствующие их активации, выживанию и образованию клонов [53]. Это перепрограммирование метаболических путей лучше всего охарактеризовано в макрофагах и показано на рисунке 2.Основополагающее исследование Newsholme et al. привело к открытию того, что скорость потребления глюкозы, глутамина и жирных кислот и ферментативная активность глюкозо-6-фосфатдегидрогеназы, 6-фосфоглюконатдегидрогеназы, цитратсинтазы, оксоглутаратдегидрогеназы и глутаминазы различаются в покоящихся и вызванных (воспалительных) макрофагах. [54]. Их исследование показало, что вся глюкоза, используемая воспалительными макрофагами, превращалась в лактат и очень мало ее окислялось [54, 55]. С тех пор переход от окислительного фосфорилирования (OXPHOS) к гликолизу и глутаминолизу рассматривается как путь метаболического репрограммирования воспалительных клеток.Примечательно, что макрофаги, Т-клетки и другие иммунные клетки используют гликолиз для быстрого производства радикальных форм кислорода (АФК), используемых для ограничения инфекции. Гликолиз также обеспечивает быстрое производство АТФ и промежуточных продуктов метаболизма для синтеза рибозы для нуклеотидов и аминокислот для биосинтеза РНК и ДНК белков макрофагами. Гликолиз — предпочтительный путь активации дендритных клеток, CD4 + T-хелперов 1 (Th2), Th3 и Th27 клеток, NK-клеток и цитотоксических клеток CD8 + [51, 52].Интересно, что эта метаболическая адаптация к аэробному гликолизу (в присутствии кислорода) была впервые описана как отличительный признак опухолевых клеток Warburg et al. в основополагающем отчете, опубликованном 60 лет назад [56].
Нестимулированные макрофаги, проявляющие фенотип M0 и маркеры поверхности дифференцировки CD68 + / CD80 / низкий / CD206 высокий приобретают и демонстрируют фенотип M1 (CD68 + / CD80 / низкий / CD206 низкий ) или фенотип M2 (CD68 + / CD80 высокий / CD206 / низкий ) после переключения их метаболизма и функции в ответ на стимулы или сигналы поляризации, которые инициируют про- или противовоспалительный ответ [57].Клетки M1 проявляют Th2-ориентированные провоспалительные эффекторные свойства и способствуют повреждению тканей и противомикробной и противоопухолевой устойчивости, тогда как клетки M2 проявляют функции ремоделирования и восстановления тканей, способствуют заживлению ран, ангиогенезу и устойчивости к паразитам, а также способствуют росту опухолей. Перепрограммирующие метаболические пути в макрофагах M1 / M2 изменяют их функции, включая продукцию цитокинов, фагоцитоз и презентацию антигена [58–60]. Классический путь активации или путь репрограммирования в макрофагах M1 способствует накоплению цитрата и высокой продукции NO, ROS, цитокинов и простагландинов [60, 61].Макрофаги M1 высвобождают АФК и NO в фагосомах, где они способствуют уничтожению патогенов. Цитокины Th3, такие как IL-4 и IL-13, регулируют альтернативный путь макрофагов или путь репрограммирования M2. Основная особенность путей репрограммирования M2 состоит в том, что цикл TCA связан с окислительным фосфорилированием, β -окислением жирных кислот и митохондриальным биогенезом. Кроме того, макрофаги M2 не производят NO. Важно учитывать, что макрофаги M2 проявляют различные различные формы (M2a, b и c) в зависимости от местной тканевой среды и воздействия раздражителей [57].
Образование промежуточных продуктов UDP-GlcNAc способствует гликозилированию M2-ассоциированных рецепторов, таких как рецептор маннозы [60]. Таким образом, фенотипы макрофагов M1 и M2 могут контролироваться либо кислородом и питательными веществами, либо цитокинами и сигналами, опосредованными повреждениями и патогенами молекулярных паттернов (DAMP- и PAMP-) [60]. Эти события контролируются сигнальными и транскрипционными путями, индуцируемыми каноническими регуляторами клеточного метаболизма, такими как фактор транскрипции C-myc, коактиваторные белки, такие как PPAR γ и PGC-1 β (рецептор, активируемый пролиферацией пероксисом γ ). , коактиватор 1 β ) и сигнальные пути, управляемые AMPK (5-аденозинмонофосфат-активируемая протеинкиназа), mTORC1 / 2 (мишень рапамициновых комплексов млекопитающих) и STAT6 (преобразователь сигналов и активатор транскрипции) [51, 52 ].Подробный обзор метаболических путей макрофагов, фенотипических и функциональных исходов описан в другом месте [62].
В 2013 году Tannahil et al. сообщили, что экспрессия мРНК IL-1 β в макрофагах M1, стимулированных LPS, приводит к активации фактора транскрипции, индуцированного гипоксией, фактора 1 α (HIF1 α ) зависимым от гликолиза образом [63]. HIF1 α взаимодействует с изоферментом пируваткиназы M2 (PKM2) и способствует экспрессии индуцированных HIF1 α генов, необходимых для гликолиза [64].Активация эффекта Варбурга (гликолиза) в LPS-стимулированных макрофагах вызывает накопление промежуточных продуктов цикла TCA, в частности, сукцината, малата и фумарата, из-за отклонения потока или «точки разрыва» пути цикла Кребса ( см. рисунок 2). Сукцинат выполняет множество иммунологических функций [52, 53, 63]. Окисление сукцината ферментом сукцинатдегидрогеназой (SHD), который превращает сукцинат в фумарат, стимулирует производство ROS из комплекса II в митохондриях, процесс, называемый обратным электронным транспортом (RET).Макрофаги отвечают на активацию HIF-1 α через АФК и повышают экспрессию IL-1 β [58]. Ингибирование SDH диметилмалонатом подавляет экспрессию IL-1 β , одновременно увеличивая продукцию иммуносупрессивного цитокина IL-10 [52, 63].
Итаконат — один важный метаболит, образующийся при втором отклонении потока или «точке разрыва» пути цикла Кребса во время перехода макрофагов из неактивного в провоспалительное состояние [65]. Итаконат представляет собой ненасыщенную дикарбоновую кислоту, продуцируемую экстрамитохондриальным ферментом цис-аконитат-декарбоксилазой, кодируемым иммунно-чувствительным геном 1 ( Irg1 ).Этот фермент превращает цис-аконитат (полученный из цитрата) в итаконовую кислоту. Одним из замечательных эффектов, наблюдаемых после лечения итаконатом, является снижение экспрессии цитокинов IL-1 β , IL-6 и iNOS [65]. Исследования с использованием макрофагов, полученных из костного мозга мыши (BMDM) и клеток RAW-264.7, стимулированных LPS и цитокинами, показали, что отсутствие (нокдаун) гена Irg приводит к нарушению субстратного фосфорилирования (SLP) митохондрий [66 ]. SLP — это метаболическая реакция, которая приводит к образованию ATP или GTP путем прямого переноса фосфатной группы на ADP или GDP от другого фосфорилированного соединения.Введение итаконата (0,5–2 мМ) обращает эту реакцию вспять [66]. Исследования с использованием трансгенных мышей и иммунных клеток, дефицитных по гену Irg 1, продемонстрировали, что итаконат действует как эндогенный ингибитор сукцинатдегидрогеназы и что такое ингибирование вызывает накопление сукцината [67]. В совокупности эти исследования подтвердили, что итаконат регулирует уровни сукцината, митохондриальное дыхание и выработку воспалительных цитокинов и, следовательно, действует как важный регулятор активации макрофагов.Кроме того, итаконовая кислота обладает антимикробной активностью и убивает непосредственно внутриклеточные Salmonella typhimurium , Legionella pneumophila и Mycobacterium tuberculosis ; таким образом, он защищает от заражения. Цитотоксический эффект связан с ингибированием фермента изоцитратлиазы [68]. Изоцитратлиаза регулирует специфический для бактерий метаболический путь, известный как глиоксилатный шунт, в котором ацетил-КоА превращается в сукцинат для синтеза углеводов.По этому пути изоцитрат расщепляется ферментом ICL (кодируемым aceA) с образованием глиоксилата и сукцината, которые повторно входят в цикл TCA после стадий окислительного декарбоксилирования. Таким образом, глиоксилатный шунт действует как путь выживания микробов [66–68].
5. Дисбиоз кишечника, связанный с метаболическими заболеваниями
Исследования взаимосвязи кишечных микробов, ожирения, инсулинорезистентности и метаболического синдрома показали сложное взаимодействие между диетой хозяина, генетикой и динамикой состава микробиома [49, 69, 70] .Серия экспериментов показала, что хронический воспалительный процесс, связанный с перемещением ЛПС кишечных бактерий в кровоток, вызывает «тихую» метаболическую эндотоксемию и, в конечном итоге, расстройства, связанные с ожирением [71–73]. Признаки клинических проявлений метаболического синдрома включают центральное ожирение, высокое кровяное давление и высокий уровень сахара в крови и триглицеридов сыворотки, которые являются наиболее значительными факторами развития инсулинорезистентности, диабета 2 типа, гипертонии и жировой болезни печени.Лица, устойчиво колонизированные бактериями и архей родами Faecalibacterium , Bifidobacterium , Lactobacillus , Coprococcus и Methanobrevibacter , имеют значительно меньшую склонность к развитию метаболизма, воспалений и нарушений метаболизма 2 типа сердечно-сосудистые нарушения [49, 73]. Эти виды являются более высокими продуцентами SCFAs и перекиси водорода, которые, как известно, ингибируют образование биопленок патогенными видами, включая Staphylococcus aureus и E.coli [73].
Ожирение связано с поведенческими факторами и факторами окружающей среды, такими как чрезмерное потребление высококалорийной пищи и малоподвижный образ жизни [49, 73–75]. Первые ключи к разгадке роли микроорганизмов в энергетическом гомеостазе и ожирении появились в исследованиях на стерильных животных [76]. Остается ответить на несколько важных вопросов о сложном взаимодействии между хозяином и микробами в патофизиологии ожирения [49, 74, 75]. Исследования на генетических и индуцированных диетой моделях ожирения на мышах подтвердили, что соотношение Firmicutes и Bacteroidetes увеличивается у тучных животных по сравнению с контрольными животными, не страдающими ожирением [33, 49, 77].Более высокое соотношение Firmicutes к Bacteroidetes было также обнаружено в клинических исследованиях, в которых оценивали здоровых добровольцев с избыточной массой тела и ожирением [33], при этом было обнаружено высокое общее количество SCFAs в кале [78]. Мышиные и человеческие модели продемонстрировали обратную связь между колонизацией A. muciniphila и воспалительными состояниями. Фактически А . muciniphila присутствует в низких количествах у людей, страдающих ожирением, диабетом и кардиометаболическими заболеваниями, что подтверждает их роль в качестве штамма против ожирения [79].
Вклад оси ГИ гипоталам-гипофиз-надпочечники в предрасположенность к ожирению до сих пор не полностью изучен [18, 70]. Недавно в одном исследовании описывалась взаимосвязь диеты с высоким содержанием жиров и уровней ацетата, продуцируемого кишечной микробиотой, на модели крыс [80]. Авторы пришли к выводу, что хронический обмен ацетата активирует парасимпатическую нервную систему, которая координирует секрецию стимулированного глюкозой инсулина, грелина и гиперфагии. Они пришли к выводу, что вместе эти факторы способствуют развитию ожирения [80].Ожирение, вызванное диетой с высоким содержанием жиров, также приводит к хроническому воспалению гипоталамуса низкой степени и активации как микроглии, так и астроцитов [81]. Исследование на мышиной модели предполагает, что ацетат накапливается в гипоталамусе. Это соединение играет центральную роль в предотвращении набора веса за счет аноректического эффекта [82]. Нейро-иммуно-эндокринный путь имеет решающее значение для гомеостаза глюкозы и контроля ожирения у людей с ожирением, восстанавливающихся после бариатрической хирургии [80]. После бариатрической хирургии с помощью методов обходного желудочного анастомоза по Ру (RYGB) модели людей и животных меняют пищевые предпочтения [83, 84].Обычно производное жирной кислоты под названием олеоилэтаноламид (OEA) образуется после приема жирной пищи. OEA может напрямую активировать рецепторы PPAR- α , которые отвечают за обеспечение насыщения через блуждающий нерв и высвобождение дофамина в головном мозге [84]. Животные с ожирением с подавлением дофамина демонстрируют низкий уровень OEA в головном мозге. После операции RYGB у этих животных повышается уровень экспрессии OEA и рецептора дофамина 1 (D1R), что способствует сдвигу в передаче сигналов по оси GI-мозг. Это приводит к резкому изменению пищевого поведения животных, в том числе к предпочтению нежирной пищи [84].Известно также, что RYGB глубоко влияет на секрецию многих желудочно-кишечных гормонов, включая грелин и GLP-1 [83]. Введение экзогенного GLP-1 или аналога GLP-1 способствует снижению веса и регуляции глюкозы у пациентов с СД2. Примечательно, что метформин, лекарство, используемое для лечения СД2, может увеличивать количество бактерий, продуцирующих бутират, и тем самым способствовать восстановлению здорового микробиома [85]. Вместе эти открытия открыли новые перспективы для будущих методов лечения, направленных на улучшение здоровья за счет воздействия на основные клетки-хозяева, микробы и метаболиты, полученные из микробиома.
6. Нацеленность на дисбактериоз кишечной микробиоты и метаболические пути
6.1. Пробиотики и пребиотики
Иммунолог Эли Мечников был первым, кто заявил, что употребление ферментированного молока (т.е. йогурта), приготовленного из Bacillus bulgaricus , улучшает здоровье и продлевает продолжительность жизни. Он предвидел рациональное использование пробиотиков из живых микроорганизмов с пользой для здоровья за счет изменения микробиома кишечника [86]. Lactobacillus plantaram и Bifidobacterium — это пробиотические бактерии, способные модулировать негативные эффекты диеты с высоким содержанием жиров и даже управлять иммунологическими реакциями, опосредованными воспалительными заболеваниями [25, 38, 45]. Bifidobacterium и Lactobacillus являются продуцентами фолиевой кислоты в кишечнике. Lactobacillus rhamnosus в сочетании с Lactobacillus gasseri и Bifidobacterium lactis может снизить прибавку в весе, в частности ожирение жировой ткани, у людей [87]. Исследования эффектов A. muciniphila , живого или пастеризованного, на мышах, получавших диету с высоким содержанием жиров, показали, что небольшой белок Amuc_1100 30 кДа активирует TLR2, что способствует развитию иммунного ответа на здоровье кишечника [79].
Известно, что диетические пребиотики обеспечивают иммунную и метаболическую пользу хозяину [14, 86]. Плохо усваиваемые углеводы, такие как некрахмальные полисахариды, резистентный крахмал, неперевариваемые олигосахариды (NDO) и полифенолы, являются источником различных сахаров, включая глюкозу, галактозу, рамнозу и рутинозу. Ферменты микробиоты толстой кишки, гидролизующие углеводы, способствуют ферментации пребиотиков, которые производят водород, метан, диоксид углерода и SCFA. Когда они связаны, пробиотик и пребиотик могут избирательно стимулировать рост и активность полезных для здоровья бактерий [14, 86].Таким образом, пробиотики и пребиотики могут модулировать метаболические процессы, связанные с СД2 и расстройствами, связанными с ожирением [14, 86]. Прием инулина или олигофруктозы улучшает метаболические нарушения, связанные с ожирением, включая инсулинорезистентность и метаболическую эндотоксемию [34, 71, 79]. Эти эффекты могут быть связаны с восстановлением целостности кишечного барьера и снижением высвобождения ЛПС грамотрицательными бактериями [25, 88].
6.2. Фекальный микробный трансплантат (FMT)
Использование антибиотиков навсегда изменяет микробное сообщество кишечника [89].Высокие дозы и частота приема антибиотиков, особенно против анаэробов, таких как ванкомицин, могут нарушить и дестабилизировать нормальный микробиом кишечника. Антибиотик расширенного спектра действия вызывает чрезмерный рост Clostridium difficile () и хронический рецидивирующий колит [89]. Фекальная бактериотерапия — это клиническая процедура, при которой жидкая суспензия стула от человеческого донора (члена семьи или здорового донора) инокулируется пациентам кишечника для восстановления кишечной микробиоты в рефрактерных случаях колоректальной инфекции Clostridium difficile после антибактериальная терапия [90, 91].Эти фекальные препараты могут содержать от 3,0% до 10% жизнеспособных мертвых бактерий и клеток толстой кишки и других компонентов, которые влияют на результаты трансплантации, усиливая или подавляя иммунную функцию врожденных лимфоидных клеток (ВЛК) [92]. Сегодня проводится более 150 клинических испытаний с участием FMT, в основном в США, для лечения большого количества метаболических, инфекционных и иммунологических заболеваний и осложнений, включая пациентов с трансплантированными почками и печенью, особенно с бактериальной колонизацией, устойчивой к антибиотикам или инфекция (ClinicalTrials.gov).
Исследования показали, что около 90% пациентов, получавших FMT от инфекции Clostridium difficile , были излечены, по сравнению с 31% пациентов, получавших только ванкомицин (van Nood et al. [93]). Известно, что Lactobacillus , Enterococcus , Bifidobacterium и Bacteroides обладают ингибирующей активностью против роста C. difficile . Например, вместе с FMT переносятся различные вирусы, археи, грибы, паразитические виды и метаболиты [92].Таким образом, необходимы дальнейшие исследования, чтобы подтвердить их способность потенциально способствовать развитию кишечного иммунитета хозяина при оптимизации разнообразия микробиома.
Серия исследований на животных моделях показала, что микробиом кишечника играет решающую роль в увеличении веса и ожирении [49, 50, 70]. Исследования на мышах и крысах с худым и генетическим ожирением (ob / ob) выявили большие различия в их кишечной абсорбции и составе микробиома, которые связаны с 50% сокращением Bacteroidetes и пропорциональным увеличением видов Firmicutes и Archaea [74, 75].Перенос микробиоты от толстых мышей к свободным от микробов мышам-хозяевам вызывает больший набор веса, чем у тех, кто получает микробиоту от худых доноров [49, 50]. Потребление большого количества жиров увеличивает проницаемость кишечника и распространение ЛПС, связанное с ожирением. Напротив, введение Bifidobaterium infantis мышам снижает выработку провоспалительных цитокинов, одновременно способствуя приросту белой жировой ткани [68, 71]. Результаты лечения FMT людей с различными метаболическими нарушениями неубедительны.Перенос кишечной микробиоты от худых доноров слегка повысил чувствительность к инсулину у пациентов с метаболическим синдромом [94]. Кратковременное воздействие антибиотиков может улучшить периферическую чувствительность к инсулину у небольшого числа лиц с ожирением [94]. Кроме того, в исследовании с 75 добровольцами с ожирением и предиабетом, которые прошли 8-дневную терапию антибиотиками (амоксициллин и ванкомицин), дисбиоз, вызванный антибиотиками, не повлиял на проницаемость кишечника, что подтверждается вариациями уровней ЛПС и экспрессии липидных метаболических ферментов [ 95].Такая неоднородность может отражать сложные взаимодействия между генетическими факторами, образом жизни и факторами окружающей среды, полученными из различных модельных систем.
6.3. Small Molecules
Ацетат, пропионат и бутират являются наиболее важными SCFAs, которые в конечном итоге вводятся в виде пероральных пищевых добавок. SCFAs, действующие как сигнальные молекулы, вызывают у человека различные физиологические эффекты [96]. Они связываются с рецепторами GPR41 и GPR43 (рецепторы свободных жирных кислот 2 и 3, FFARs 2/3) в L-клетках кишечника, сигнализируя о высвобождении GLP-1 и пептида YY [78].Примечательно, что инъекция пептидов GLP-1 стимулирует передачу сигналов инсулина в белых жировых тканях, тем самым уменьшая ожирение. SCFAs также увеличивают секрецию лептина и адипогенез, ингибируя липолиз жировой ткани. В печени пропионат действует как глюконеогенный фактор, а ацетат и бутират действуют как липогенные факторы [96]. SCFAs, в частности, пропионовая и масляная кислоты, могут напрямую предотвращать низкую воспалительную реакцию при ожирении, контролируя микробиоту кишечника [88]. Бутират, действующий на человеческие моноциты, ДК костного мозга и макрофаги, подавляет продукцию IL-12, снижает экспрессию костимулирующих молекул и блокирует транслокацию NF- κ B [37].Добавка бутирата, структурного аналога и кетонового тела β -гидроксибутирата (также известного как 3-гидроксибутират) может подавлять активность гистондеацетилаз (HDAC). HDACS способствует специфическим модификациям гистонов для регулирования транскрипции, репликации и репарации ДНК. Он также проявляет противовоспалительную активность, подавляя активацию NF- κ B и STAT1 [22–95]. Сукцинат является хорошо известным ингибитором гистоновых деметилаз (DNMT) и одиннадцати транслокационных (TET) метилцитозиндиоксигеназ, которые окисляют 5-метилцитозины, способствуя деметилированию ДНК [22].
Несколько низкомолекулярных ингибиторов метаболических путей, таких как 2-дезоксиглюкоза, дихроацетат, BPTES (бис-2- (5-фенилацетамидо-1,3,4-тиадиазол-2-ил) этилсульфид), диметилмалонат (DMM) , ротенон и метформин считаются многообещающими терапевтическими средствами [51, 52, 60]. Метформин — препарат первой линии для лечения СД2, который значительно улучшает метаболические параметры, такие как масса тела, уровень инсулина, глюкозы, лептина и С-реактивного белка в плазме [96]. Ингибируя комплекс I в дыхательной цепи митохондрий, метформин повышает уровень лактата в плазме.Лактоацидоз — актуальная проблема в клинической практике. Метформин вызывает переключение с OXPHOS на аэробный гликолиз [97]. Таким образом, у лиц, принимающих метформин, выше риск развития метформин-ассоциированного лактоацидоза. Лечение метформином значительно увеличивает относительное количество A. muciniphila в фекальной микробиоте мышей с ожирением [34]. А . muciniphila является продуцентом ацетата и пропионата посредством деградации муцина, и у пациентов с СД2, получавших метформин, увеличивается количество бактерий, продуцирующих бутират и пропионат, что, в свою очередь, может способствовать положительному эффекту метформина [85].Интересно спросить, связаны ли эффекты метформина также с путями метаболического репрограммирования макрофагов M1 / M2.
Сукцинат — сильный провоспалительный медиатор [51, 63]. DMM подавляет выработку митохондриальных АФК за счет ингибирования сукцинатдегидрогеназы (SDA), которая превращает сукцинат в фумарат. Это метаболическое изменение ограничивает продукцию IL-1 β , одновременно увеличивая синтез иммунодепрессивного IL-10 [67]. TEPP-46 и DASA-58, два низкомолекулярных ингибитора PKM2 (изофермент пируваткиназы 2), ингибируют LPS-индуцированный HIF-1 α и IL-1 β , тем самым способствуя репрограммированию макрофагов M1 в M2 [63 , 98].Таким образом, необходимы дальнейшие исследования для подтверждения этих фармакологических целей и подходов к контролю метаболических нарушений.
7. Выводы и перспективы
За последнее десятилетие секвенирование и анализ большого количества человеческих микробиомов и сборка их метаболических путей расширили наше понимание того, как бактериальные метаболиты участвуют во взаимодействиях микробов и хозяев при здоровье и болезнях. . Функциональные вариации микробиомов кишечника у разных людей показали, что анаболические и катаболические пути имеют важное значение для поддержания основных структур сообщества для гомеостаза всего тела.Появляющиеся новые биомаркеры обещают специфическое различение типов и видов, чтобы подтвердить доказательства прямого участия микробов в диабете типа II, ожирении, метаболических нарушениях, воспалительных заболеваниях кишечника и даже некоторых видах рака.